文章信息
- 唐大刚,王淼,张艳亮,王孝林,李贵强,罗小辑
- TANG Da-gang,WANG Miao,ZHANG Yan-liang,WANG Xiao-lin,LI Gui-qiang,LUO Xiao-ji
- Hey1 基因参与调控BMP9诱导的C3H10T1/2细胞成骨分化
- Hey1 Gene Is Involved in Regulating BMP9-induced Osteogenic Differentiation of C3H10T1/2 Cells
- 中国生物工程杂志,2015,35(6): 14-20
- China Biotechnology,2015,35(6): 14-20
- http://dx.doi.org/10.13523/j.cb.20150603
-
文章历史
- 收稿日期:2015-02-26
- 修回日期:2015-03-14
伴有骨缺损的骨不连一直是骨科临床工作的一项难题,每年有数百万病例寻求临床治疗。传统治疗以自体骨移植最优,但该方法存在不足。目前,以间充质干细胞(mesenchymal stem cells,MSCs)为细胞源的骨组织再生工程在修复骨缺损、骨不连,促进脊柱融合,治疗股骨头缺血性坏死等疾病的治疗中有着愈来愈广的应用前景[1]。
MSCs是多潜能干细胞的一种,具有强大的增殖能力及多向分化潜能,在不同条件下可诱导分化为骨细胞、软骨细胞、心肌细胞和神经细胞等多种细胞[2]。大量研究表明,骨形态发生蛋白(bone morphogenetic proteins,BMPs)家族可诱导MSCs骨向分化,临床上可用于骨组织的再生和重建[3]。
BMPs是转化生长因子β(transforming growth factor-β,TGF-β)超家族中的一类多功能分泌型信号分子,在体内通过级联信号传导发挥多种重要的生物学效应[4, 5]。目前共分离和鉴定出20余种,已有研究证实BMP2和BMP7具有很强的诱导成骨分化的能力[6]。本实验前期系统性研究了多种BMPs亚型的成骨诱导活性,发现除BMP2和BMP7外,BMP4、BMP6和BMP9也具有诱导MSCs成骨分化的作用,其中BMP9的作用最强[7]。然而,近年来对BMP9诱导MSCs成骨分化的研究才刚刚起步,获得的有价值的成果较少,严重阻碍了BMP9在临床骨组织工程中的应用[8,9]。因此,阐明BMP9诱导MSCs成骨分化的作用具有重要的临床应用价值。
发状分裂相关增强子Hey1(也被称为Hesr1,HRT1,CHF2,HERP2) 属螺旋-环-螺旋 (helix-loop-helix,HERP) 蛋白家族成员,是Notch 信号通路的重要靶基因。已有研究发现,Hey1基因和Notch信号通路在进化中高度保守,在细胞的生长、分化及生存中起重要作用,与软骨分化、成肌分化以及心脏畸形等密切相关[10, 11, 12]。有研究报道Hey1基因与细胞的增殖和分化有关,可通过螺旋-环-螺旋(basic helix-loop-helix,bHLH)依赖性途径以及bHLH非依赖性途径发挥作用[13, 14]。也有研究报道Hey1基因可与BMPs共同作用调控成骨分化[15]。然而,目前对Hey1基因如何调节BMP9诱导的MSCs成骨分化,以及是否是MSCs骨向分化途径上的“路标”,尚不明确。因此本实验以鼠成纤维母细胞C3H10T1/2为模型,主要探讨Hey1基因是否在BMP9诱导的MSCs成骨分化过程中发挥着一定的作用,为BMP9促进骨形成和骨组织修复重建提供理论依据和实验基础。
1 材料与方法 1.1 材 料C3H10T1/2和293T细胞购于美国典型菌种保藏中心(ATCC);慢病毒LV5-HEY1、LV5-BMP9和LV5-GFP由本实验室构建和保存;小鼠碱性磷酸酶ALP、ELISA 检测试剂盒购于上海生工公司;维生素C、β-磷酸甘油、茜素红S和MTT检测试剂盒购于Sigma 公司;Trizol购于Invitrogen公司;M-MLV逆转录酶购于Promega公司;RT-PCR试剂盒购于TaKaRa公司;RT-PCR引物由上海生工合成;DMEM高糖培养基购于Hyclone公司,胎牛血清购于Gibco公司;一抗GFP(sc-5385)和β-actin(sc-47778)购于Santa Cruz公司;一抗BMP9 (ab35088)和Hey1(ab22614)购于Abcam公司;其它试剂均为进口分装或国产分析纯。
1.2 方 法 1.2.1 细胞培养C3H10T1/2和293T细胞用含10%胎牛血清和100 mmol/L青霉素以及100 g/L链霉素的DMEM高糖培养基培养于37℃,含5%CO2的细胞培养箱。
1.2.2 Hey1、BMP9以及GFP慢病毒的构建参考Hey1、BMP9以及GFP的基因,分别设计PCR引物扩增相应的基因序列;酶切过表达载体LV5,纯化酶切产物后进行定向连接;再将产物转化细菌感受态细胞,对长出的克隆进行PCR鉴定和酶切鉴定,鉴定出阳性的克隆,证明目的基因已经定向连入目的载体。将阳性克隆进行测序并比对分析测序结果,筛选出构建成功的LV5-Hey1、LV5- BMP9与LV5-GFP慢病毒载体。制备慢病毒穿梭质粒及其辅助包装原件载体质粒,四种质粒载体分别进行高纯度无内毒素抽提,共转染293T细胞,转染后8 h更换为完全培养基,继续培养48 h后,收集富含慢病毒颗粒的细胞上清液,对浓缩后得到的高滴度慢病毒浓缩液,采用倍比稀释法检测病毒滴度。
1.2.3 ALP浓度测定本实验采用双抗体一步夹心法测定小鼠C3H10T1/2细胞中碱性磷酸酶(ALP)的水平。往预先包被ALP抗体的包被微孔中,依次加入标本、标准品、HRP标记的检测抗体,经过温育并彻底洗涤。用底物TMB显色,TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品中的ALP浓度呈正相关。用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品浓度。
1.2.4 钙盐沉积实验将C3H10T1/2细胞接种于24孔板中,待细胞汇合至30%~40%时加入相应处理因素,以及终浓度为50 mg/L的维生素C和10 mmol/L的β-磷酸甘油。14 d后进行钙盐染色,弃去培养基,用PBS清洗两次,每孔加入0.4%的戊二醛固定10 min后,用双蒸水(ddH2O)终止固定,每孔加入0.4%茜素红S染液200 μl,待出现红色钙盐物质沉积时,弃去染液,用ddH2O终止反应并洗涤,最后在显微镜下观察并成像。
1.2.5 细胞增殖检测(MTT方法)将C3H10T1/2细胞接种于96孔板中,每孔细胞个数为2×103个,待细胞贴壁后加入相应处理因素,分别培养24、48和72 h后,每孔加入 0.5 mg/ml MTT 试剂10 μl,4 h后,弃培养基,每孔加入DMSO100 μl,15 min后检测490 nm处吸光度OD值,可间接反映活细胞数量。
1.2.6 细胞周期分析(流式细胞术)C3H10T1/2细胞经不同因素处理,在相应时间点收集细胞,用75% 冰乙醇于4℃冰箱固定过夜。然后弃去冰乙醇,用遇冷的PBS充分混匀洗涤两次,用0.01%的Rnase和0.5%的碘化丙啶(PI)处理细胞,并在4℃避光孵育15 min。然后到流式细胞仪上进行检测,在488 nm波长下测定DNA的含量,PI所发的红光通过630 nm的滤光片进行收集,采用CELLQest软件进行分析,得出细胞周期各个时期的百分比。
1.2.7 RT-PCRC3H10T1/2细胞接种于60 mm的细胞培养皿中,待细胞汇合至50%时,加入相应处理因素,在所需时间点提取细胞RNA,经逆转录反应制备成cDNA,采用小鼠GAPDH基因作为内参照,RT-PCR检测相关基因的表达。相应引物序列见表 1。
| Gene | Forward primer | Reversed primer |
| GAPDH | GGCTGCCCAGAACATCAT | CGGACACATTGGGGGTAG |
| BMP9 | CTACGCCTGCCTCCAACA | GTCCTCCAGAACATCATAAACG |
| GFP | TTGGTACCATGGCTAGCAAAGGAGAAG | TAGGGCCCTTATTTGTAGAGCTCATCC |
| Hey1 | CTGAGCAAAGCGTTGACAAA | TTCCTTTCCACCAACACTCC |
将C3H10T1/2细胞接种于60 mm的细胞培养皿中,加入相应处理因素后在所需时间点用无血清无双抗的DMEM高糖培养基饥饿处理过夜后提取细胞总蛋白,按步骤进行Western blot检测[9]。
1.3 统计分析计量资料以均数±标准差(x±s)表示,组间比较采用单因素方差分析,统计学分析用SSPS17.0软件包处理。
2 结 果 2.1 Hey1、BMP9以及GFP的过表达慢病毒包装按1.2.2 节中方法分别包装出GFP、BMP9以及Hey1的过表达慢病毒LV5-GFP、LV5-BMP9与LV5-Hey1,分别感染C3H10T1/2细胞,24 h后倒置荧光显微镜下观察显示,慢病毒LV5-GFP、LV5- BMP9与LV5-Hey1可成功感染C3H10T1/2细胞(图 1a)。分别在感染2和3 d后提取细胞RNA及总蛋白,RT-PCR以及Western blot结果均显示慢病毒包装成功(P<0.05)(图 1b、c)。
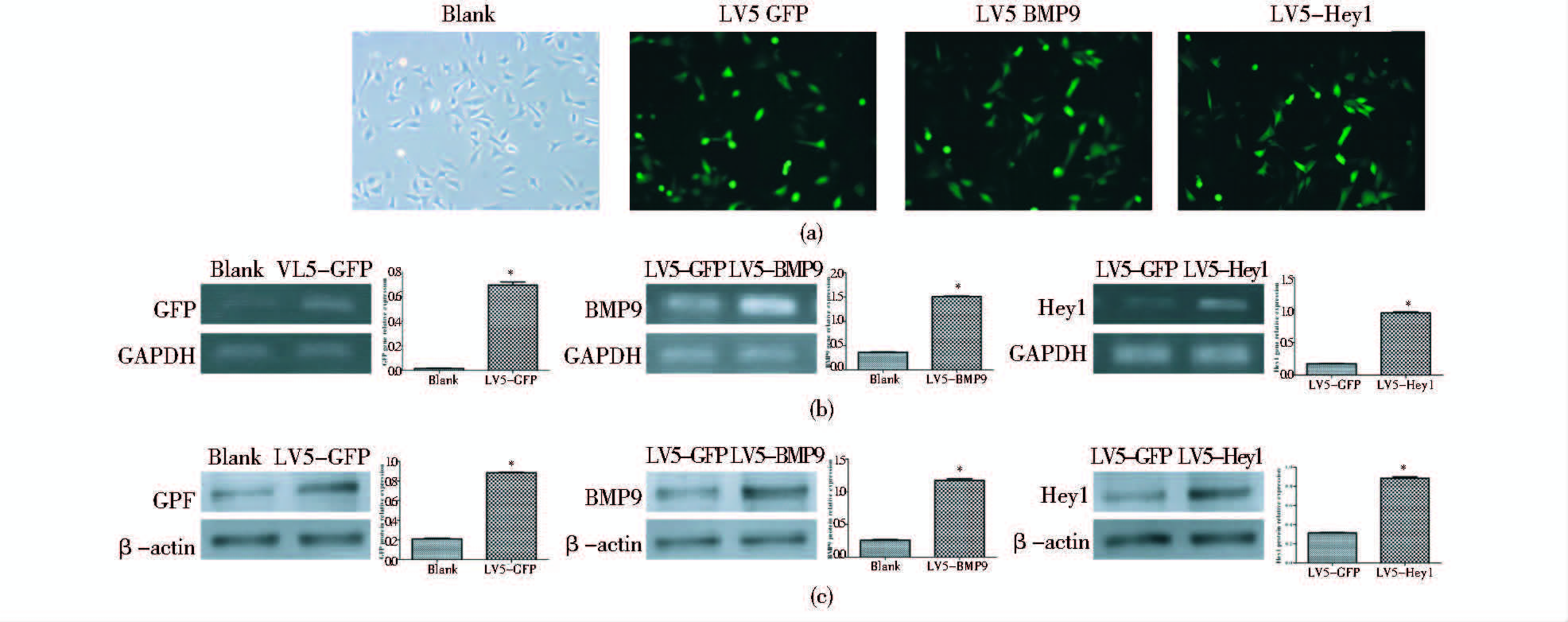
|
| 图 1 Hey1、BMP9以及GFP的过表达慢病毒包装成功 Fig. 1 The expression of GFP,BMP9 and Hey1 |
为了探讨Hey1基因对BMP9诱导的小鼠C3H10T1/2细胞早期成骨分化的影响,用 LV5-Hey1和LV5-GFP感染C3H10T1/2细胞24 h后,加入适当滴度的LV5-BMP9,5 d时检测早期成骨指标ALP浓度,结果显示,单独BMP9组可明显诱导ALP的表达,而LV5-Hey1促进了BMP9诱导的ALP表达(P<0.05)(图 2)。以上结果表明,Hey1可促进BMP9诱导的小鼠C3H10T1/2细胞早期成骨分化。
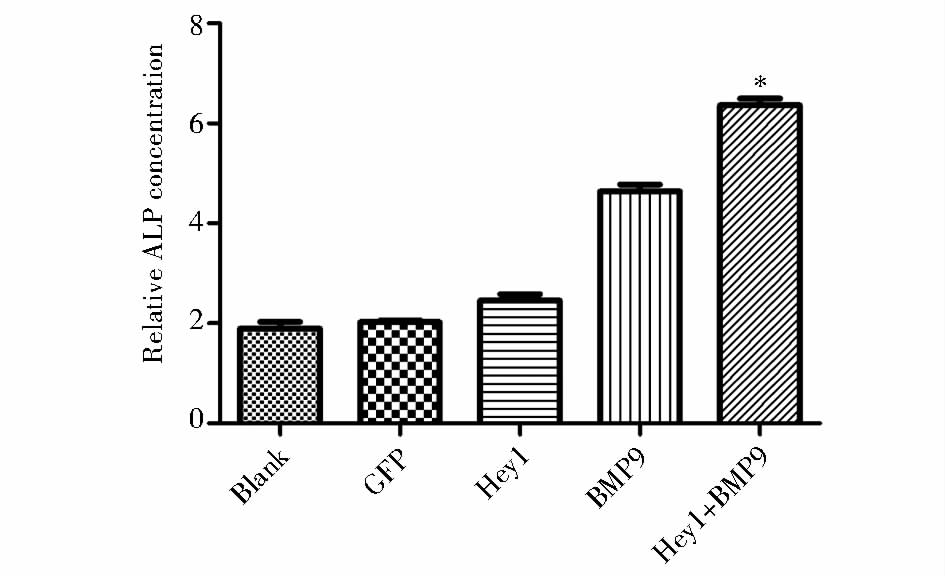
|
| 图 2 Hey1基因影响BMP9诱导的C3H10T1/2细胞早期成骨分化 Fig. 2 Effect of Hey1 gene on BMP9-induced early osteogenic differentiation of C3H10T1/2 cells |
在早期成骨分化的基础上进一步探讨Hey1基因对BMP9诱导的小鼠C3H10T1/2细胞晚期成骨分化的影响,用 LV5-Hey1和LV5-GFP感染C3H10T1/2细胞24 h后,加入适当滴度的LV5-BMP9,14 d后检测晚期成骨指标钙盐沉积。结果显示,单独BMP9组可明显诱导钙盐沉积,而LV5-Hey1促进了BMP9诱导的C3H10T1/2细胞晚期成骨分化(图 3)。综上所述,Hey1基因可促进BMP9诱导的小鼠C3H10T1/2细胞早晚期成骨分化。
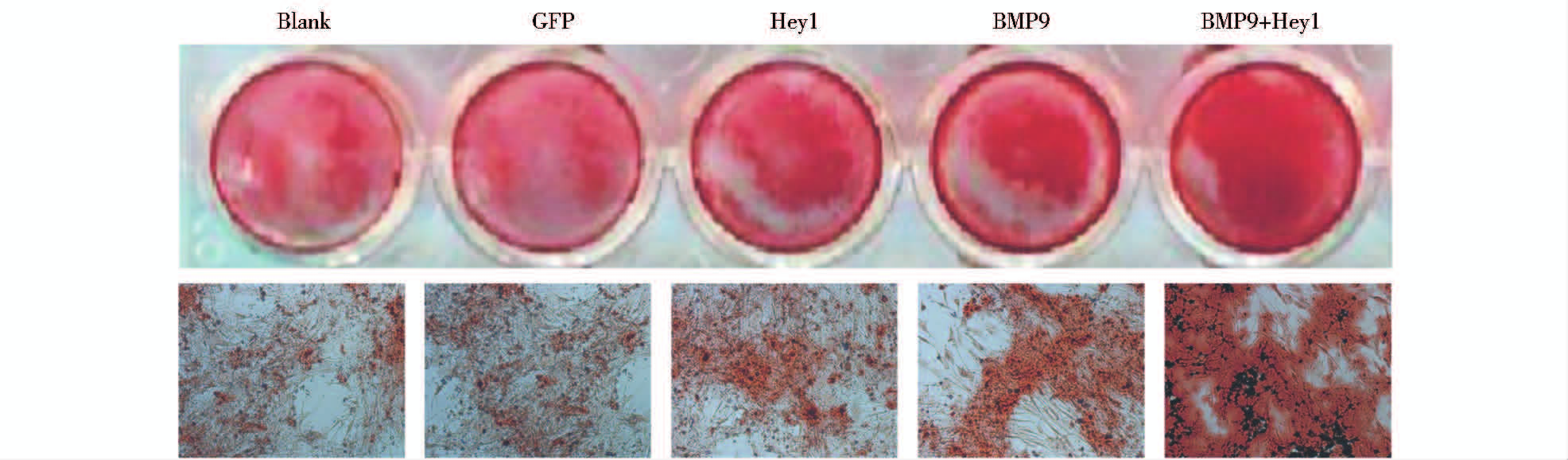
|
| 图 3 Hey1基因影响BMP9诱导的C3H10T1/2细胞晚期成骨分化 Fig. 3 Effect of Hey1 gene on BMP9-induced later osteogenic differentiation of C3H10T1/2 cells |
有研究报道,Hey1基因可影响细胞的增殖[13, 14]。在Hey1基因影响BMP9诱导的小鼠C3H10T1/2细胞早晚期成骨分化的基础上进一步探讨Hey1基因对BMP9参与调控的细胞增殖的影响,用LV5-Hey1和LV5-GFP感染C3H10T1/2细胞24 h后,加入适当滴度(30%)的LV5-BMP9,分别在处理后24、48和72 h用MTT方法检测细胞的增值,结果显示,单独BMP9组对细胞的增殖有部分抑制作用,而LV5-Hey1促进了BMP9调控的C3H10T1/2细胞的增殖(P<0.05)(图 4)。
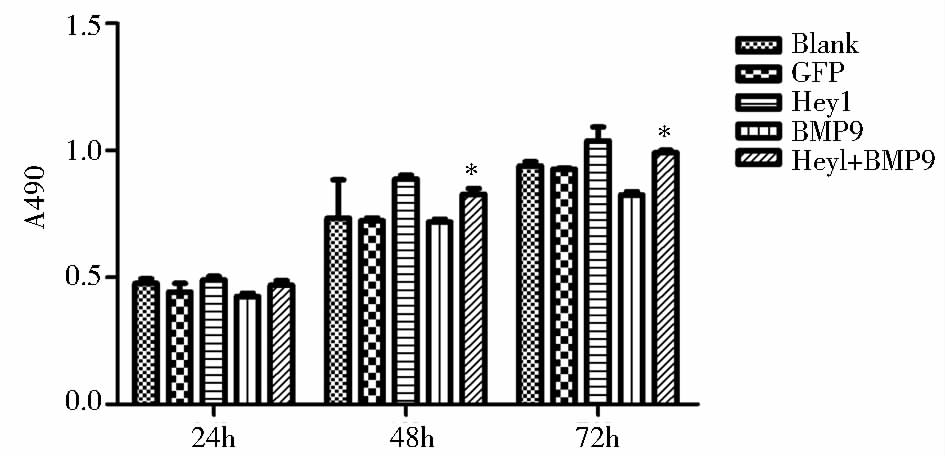
|
| 图 4 Hey1基因影响BMP9调控的C3H10T1/2细胞的增殖 Fig. 4 Effect of Hey1 gene on BMP9-regulated proliferation of C3H10T1/2 cells |
在上述探讨Hey1基因对BMP9调控的C3H10T1/2细胞增值的影响的基础上,进一步探讨Hey1基因对BMP9调控的C3H10T1/2细胞周期的作用。用LV5-Hey1和LV5-GFP感染C3H10T1/2细胞24 h后,加入适当滴度的LV5-BMP9,分别在处理后4、5、6和7 d通过流式细胞术检测细胞周期的变化,结果显示,在晚期,单独BMP9组可缩短细胞的G1期从而促进细胞的增殖,而LV5-Hey1使BMP9调控的C3H10T1/2细胞的周期阻滞在G1期(P<0.05)(图 5)。

|
| 图 5 Hey1基因影响BMP9调控的C3H10T1/2细胞的周期 Fig. 5 Effect of Hey1 gene on BMP9-regulated cycles of C3H10T1/2 cells |
在BMPs家族成员中BMP2和BMP7因被证实具有明确的诱导成骨分化的作用而应用于临床,课题组前期研究发现在BMP2~BMP15这14种BMPs中BMP9诱导MSCs体内外成骨分化的能力最强[7]。然而,对于BMP9诱导的MSCs成骨分化的作用机制目前还缺乏详细了解。课题组前期已经陆续证实BMP9诱导的MSCs成骨分化的过程受多种细胞因子及信号途径的调控,如:胰岛素样生长因子2(IGF2)、成纤维样生长因子(FGF2)、核受体PPARγ、经典的BMP/Smad信号通路、Wnt/β-catenin信号通路、Notch以及TGF-β信号通路等[16, 17, 18]。有研究报道Notch信号通路可调控成骨分化,而Hey1基因作为Notch信号通路的重要靶基因参与这一过程,也有研究显示Hey1基因作为BMPs下游的一个重要基因而参与成骨分化的调控[15, 19]。然而,对于Hey1基因是否参与调控BMP9诱导的MSCs成骨分化的过程并不是很清楚。因此本实验主要探究Hey1基因是否参与调控BMP9诱导的MSCs成骨分化。
带着以上问题,本实验分别包装了GFP、BMP9和Hey1的过表达慢病毒,以C3H10T1/2细胞为模型,在激活Hey1的情况下检测其对BMP9诱导的MSCs成骨分化的影响。结果显示,过表达Hey1基因可促进BMP9诱导的C3H10T1/2细胞早期成骨分化指标ALP表达,以及晚期成骨分化指标钙盐沉积,并且,在早期可促进BMP9调控的C3H10T1/2细胞的增殖,晚期通过将细胞周期阻滞在G1期而抑制细胞增殖。以上结果表明,Hey1基因可促进BMP9诱导的C3H10T1/2细胞早晚期成骨分化,并且在早期可促进细胞的增殖,晚期抑制细胞的增殖。
在以上体外实验的基础上,本实验接下来将通过裸鼠皮下异位成骨以及颅盖骨组织培养等技术在体内检测Hey1基因是否参与调控BMP9诱导的MSCs成骨分化的过程。实验室前期研究证实BMP9诱导MSCs成骨分化的过程可通过经典的Smad以及非经典的MAPK信号通路来调控[16, 18, 20],因此本实验接下来将通过荧光素酶报告基因实验、Western blot以及Chip等实验进一步探讨Hey1基因参与调控BMP9诱导的MSCs成骨分化的作用机制。另外,还将构建Hey1基因的干扰慢病毒,在抑制Hey1基因的基础上,通过Western blot、RT-PCR以及裸鼠皮下成骨等实验从反面研究Hey1基因对BMP9诱导MSCs成骨分化的影响。
| [1] | Ripamonti U. Soluble osteogenic molecular signals and the induction of bone formation. Biomaterials, 2006, 27(6): 807-822. |
| [2] | Caplan A I, Bruder S P. Mesenchymal stem cells: building blocks for molecular medicine in the 21st century. Trends Mol Med, 2001, 7(6): 259-264. |
| [3] | Luu H H, Song W X, Luo X, et al. Distinct roles of bone morphogenetic proteins in osteogenic differentiation of mesenchymal stem cells. J Orthop Res, 2007, 25(5): 665-677. |
| [4] | Varga A C,Wrana J L. The desparate role of BMP in stem cell biology. Oncogene, 2005, 24(37): 5713-5721. |
| [5] | Wang R N, Green J, Wang Z, et al. Bone Morphogenetic Protein (BMP) signaling in development and human diseases. Genes Dis, 2014, 1(1): 87-105. |
| [6] | Chen D, Zhao M, Mundy G R. Bone morphogenetic proteins. Growth factors, 2004, 22(4): 233-241. |
| [7] | Kang Q, Sun M H, Cheng H, et al. Characterization of the distinct orthotopic bone-forming activity of 14 BMPs using recombinant adenovirus-mediated gene delivery. Gene Ther, 2004, 11(17): 1312-1320. |
| [8] | Lamplot J D, Qin J, Nan G, et al. BMP9 signaling in stem cell differentiation and osteogenesis. Am J Stem Cells, 2013, 2(1): 1. |
| [9] | 赵艳芳, 宋涛, 刘跃亮, 等. RUNX2 对 BMP9 诱导的间充质干细胞 C3H10T1/2 成骨分化的影响. 中国生物工程杂志, 2013, 33(2): 21-26. Zhao Y F, Song T, Liu Y L, et al. Effects of RUNX2 on BMP9 induced osteogenic differentiation of C3H10T1/2 mesenchymal stem cells. China Biotechnology, 2013, 33(2): 21-26. |
| [10] | Hulleman E, Quarto M, Vernell R, et al. A role for the transcription factor HEY1 in glioblastoma. J Cell Mol Med, 2009, 13(1): 136-146. |
| [11] | Fischer A, Steidl C, Wagner T U, et al. Combined loss of Hey1 and HeyL causes congenital heart defects because of impaired epithelial to mesenchymal transition. Circ Res, 2007, 100(6): 856-863. |
| [12] | Sun H, Kawashima N, Xu J, et al. Expression of Notch signalling-related genes in normal and differentiating rat dental pulp cells. Aust Endod J, 2010, 36(2): 54-58. |
| [13] | Bennani-Baiti I M, Aryee D N, Ban J, et al. Notch signalling is off and is uncoupled from HES1 expression in Ewing's sarcoma. J Pathol, 2011, 225(3): 353-363. |
| [14] | Fukada S. Molecular regulation of muscle stem cells by 'quiescence genes'. Yakugaku Zasshi, 2011, 131(9): 1329-1332. |
| [15] | Sharff K A, Song W X, Luo X, et al. Hey1 basic helix-loop-helix protein plays an important role in mediating BMP9-induced osteogenic differentiation of mesenchymal progenitor cells. J Biol Chem, 2009, 284(1): 649-659. |
| [16] | Chen L, Jiang W, Huang J, et al. Insulin-like growth factor 2 (IGF-2) potentiates BMP-9-induced osteogenic differentiation and bone formation. J Bone Miner Res, 2010, 25(11): 2447-2459. |
| [17] | Deng Z L, Sharff K A, Tang N, et al. Regulation of osteogenic differentiation during skeletal development. Front Biosci, 2008, 13: 2001-2021. |
| [18] | Liu X, Qin J, Luo Q, et al. Cross-talk between EGF and BMP9 signalling pathways regulates the osteogenic differentiation of mesenchymal stem cells. J Cell Mol Med, 2013, 17(9): 1160-1172. |
| [19] | Panagopoulos I, Gorunova L, Bjerkehagen B, et al. Chromosome aberrations and HEY1-NCOA2 fusion gene in a mesenchymal chondrosarcoma. Oncol Rep, 2014, 32(1): 40-44. |
| [20] | 徐道晶, 王锦, 何娟文, 等. p38 蛋白激酶参与 BMP9 诱导的 C3H10T1/2 细胞成骨分化. 中国生物工程杂志, 2011, 31(5): 15-21. Xu D J, Wang J, He J W, et al. p38 kinase participated in BMP9-induced osteogenic differentiation of C3H10T1/2 mesenchymal stem cells. China Biotechnology, 2011, 31(5): 15-21. |
 2015,Vol. 35
2015,Vol. 35




