文章信息
- 晏丽, 王康, 李瑞建, 白义, 白先宏, 周海平
- YAN Li, WANG Kang, LI Rui-jian, BAI Yi, BAI Xian-hong, ZHOU Hai-ping
- 一种新型高糖基化免疫融合蛋白NESP-Fc的研制
- Manufaction of a New High-glycosylated Fusion Protein NESP-Fc
- 中国生物工程杂志, 2015, 35(4): 80-85
- China Biotechnology, 2015, 35(4): 80-85
- http://dx.doi.org/10.13523/j.cb.20150412
-
文章历史
- 收稿日期:2014-11-26
- 修回日期:2015-03-02
据世界卫生组织统计:全球约有30亿人患有不同程度的贫血,每年因贫血引致各类疾病而死亡的人数高达上千万[1]。中国患贫血的人口概率远高于西方国家,在患贫血的人群中,女性明显高于男性,老年人和儿童高于中青年。促红细胞生成素(Erythropoietin,EPO)是由人体肾脏和肝脏分泌的一种糖蛋白激素,90%由肾脏的间质或近端小管的特殊细胞生成,10%在肝脏的Kuper氏细胞产生[2]。EPO前体由193个氨基酸组成;成熟EPO切除信号肽后含有166个氨基酸,分子量约34.4kDa,含蛋白60%,碳水化合物40%[3]。根据碳水化合物含量的不同可以把天然存在的EPO分成两种类型:α型(34%)和β型(26%)。两种类型的EPO在生物学特性,抗原性及临床应用效果上均相同。
目前,促红细胞生成素(Erythropoietin,EPO)已广泛应用于临床上各种贫血的治疗,包括由慢性肾衰、多发性骨髓瘤、骨髓异常增殖综合症和艾滋病引起的贫血,其中对肾衰、尿毒症所伴随贫血的治疗最有效[4]。此外,EPO对肿瘤相关性贫血、早产儿和孕产妇贫血、围手术期减少异源性输血等方面也有良好的疗效。多年来的研究发现EPO除了具备作为激素的基本功能外,它还有其他多种生理功能,例如:促进造血细胞前体增生分化、代谢应激时保护神经元和促进肠粘膜发育等。随着研究的不断深入和临床试验的开展,EPO必将在更多领域发挥更大的作用。由于EPO在体内的半衰期比较短,病人可能每周需要2~3次用药,这样可能给病人带来诸多不便[5],因此不少公司在研制长效EPO,其中最成功的是美国Amgen公司研制的长效贫血治疗药新红细胞生成刺激蛋白(New Erythropoietin Stimulating Protein,NESP),它是一种高糖基化的rhEPO类似物,具有与rhEPO相似的作用机制[5]。NESP含5个N端糖链和比rhEPO高2倍的唾液酸残基,从而达到较好的代谢稳定性和3倍于rhEP的半衰期,因此可减少给药次数[6]。
本研究在现有技术的基础上,采用新红细胞生成刺激蛋白(NESP)的策略,突变了天然EPO的5个氨基酸残基,分别是Ala30Asn,His32Thr,Pro87Val,Trp88Asn,Pro90Thr。与天然EPO相比,增加了30和88位的N糖基化位点。另一方面,通过NESP和IgG2的铰链区、CH2和CH3基因的连接,并突变部分位点,从而形成了一种融合蛋白。我们命名该融合蛋白为New Erythropoietin Stimulating Protein Fc fragment from IgG2,简称NESP-Fc。实验表明,该融合蛋白具有与天然EPO同样的生物活性,体内外实验也表明,与对照EPO相比,该融合蛋白的生物半衰期显著延长,因此它具有长效的能力。NESP-Fc在细胞和动物模型中效果显著,有可能用于临床。本文中的NESP-Fc具有原创性,已经申请了国家专利,并获得了授权,专利公开号是CN101870735 B[7]。
1 材料与方法 1.1 材 料内切酶HindIII、EcoRI和T4 DNA连接酶购自英国NEB公司,蛋氨酸亚氨基代砜(MSX)和丙酸钠 (Valproic acid)购自美国Sigma公司,脂质体LipofectamineTM2000、PRMI 1640培养基、无血清培养基CD CHO medium、CD EfficientFeedTM C (Feed C)、HT、蛋白胨 (peptone)和谷氨酰胺(Gln)购自Life Technologies公司,HiTrap MabSelectSuRe 1ml纯化柱为GE公司产品,人原巨核细胞型白血病细胞(UT-7)购自中国医学科学院基础医学研究所基础医学细胞中心,CHO-K1细胞购自ATCC,对照重组人的EPO购自沈阳三生制药股份有限公司,CCK-8试剂盒购自日本株式会社同仁化学研究所,抗EPO的抗体来自美国Abcam公司。实验动物BALB/c小鼠和SD大鼠均购自北京维通利华实验动物技术有限公司。
1.2 NESP-Fc融合蛋白表达基因的优化为了提高蛋白的表达产量,根据CHO表达的偏性密码子表,对新红细胞生成刺激蛋白(NESP)和IgG2编码的DNA序列进行优化,减少稀有密码子含量,并保证所编码的蛋白氨基酸残基保持不变[8]。同时,为了保证蛋白的高效分泌表达,选择适于抗体类蛋白表达的轻链κ信号肽,序列为“METDTLLLWVLLLWVPGSTG”,作为融合蛋白的信号肽序列,并在起始密码子“ATG”前加入有利于蛋白表达的Kozak序列“CGCCACC”,并将IgG2中的Val234和Gly237突变为Ala。因涉及多个碱基的突变,故采用人工合成全序列,委托北京奥科生物技术有限责任公司对表达蛋白的cDNA进行全合成(序列略)。
1.3 NESP-Fc融合蛋白表达载体的构建上游引物:5′-CCCAAGCTTCCGCCACCATGGAGAC-3′,下划线部分为HindIII酶切位点下游引物:5′-CCGGAATTCTTACTTTCCAGGAGACAGGGACAGG-3′,下划线部分为EcoRI酶切位点,由北京奥科生物技术有限责任公司合成。采用PCR的方法对NESP-Fc的cDNA进行扩增,扩增条件为:95℃预变性5min,以94℃变性45s,56℃退火45s,72℃延伸2min,扩增30个循环,再以72℃延伸10min,PCR扩增产物经1%琼脂糖凝胶电泳,将目的条带切下,用DNA回收试剂盒(北京天根生化科技有限公司产品)回收扩增产物。纯化的PCR产物和载体pH用HindIII和EcoRI双酶切后,分别用DNA试剂盒回收纯化酶切产物,在T4 DNA连接酶作用下16℃连接过夜,将连接产物转化DH5α感受态细胞,在LB(氨苄青霉素抗性)培养基中筛选培养,HindIII和EcoRI双酶切鉴定阳性克隆,提取正确克隆的质粒送上海英杰生物技术有限公司测序。
1.4 高表达细胞株的构建及细胞培养条件的初步优化利用脂质体LipofectamineTM2000,将含有NESP-Fc的质粒转染CHO-K1细胞,利用MSX进行系列筛选,扩增,ELISA筛选高表达克隆,然后挑取表达量高的单克隆进行无血清驯化和悬浮培养驯化。
选择驯化后的高表达细胞株,在250ml细胞培养瓶中进行培养条件的初步优化,基础培养基为Invitrogen公司CD CHO medium。在批培养过程适时补料,包括CD EfficientFeedTM C (Feed C),HT、谷氨酰胺(Gln)、丙戊酸钠(valproic acid)、蛋白胨(peptone)等。分别于第6d,8d,10d和12d收集上清,用液相色谱法测定融合蛋白表达量。
1.5 NESP-Fc融合蛋白的纯化用10个床体积pH7.4的PBS溶液平衡HiTrap MabSelectSuRe 1ml柱,流速为0.5ml/min;将60ml上述上清液用0.45μm滤膜过滤后上样,流速为0.5ml/min;用pH7.4的PBS溶液洗5~10个床体积,流速为0.5ml/min;用100mmol/L柠檬酸缓冲液(pH4.0)洗脱,流速为0.5ml/min,收集洗脱峰。透析置换纯化样品中的洗脱液,透析3h,中间需要更换缓冲液一次,透析实验缓冲液为pH7的磷酸缓冲液,冻存备用。
1.6 SDS-PAGE和免疫印迹法SDS-PAGE和免疫印迹方法参考文献[9],还原电泳和非还原电泳的区别是还原电泳的加样液中含有1%的巯基乙醇,而非还原的加样液中则没有。
1.7 CCK-8方法检测NESP-Fc融合蛋白体外药效学研究UT-7细胞悬浮培养于含10%胎牛血清PRMI 1640培养基中,37℃,5% CO2中培养,于96孔培养板中加入UT-7细胞1×104/孔。分别转染不同浓度的EPO和NESP-Fc融合蛋白,每个稀释度做3个复孔,37℃,5% CO2中培养。对照组培养基为不含EPO的10% FBS的PRMI 1640。直至对照组(不含EPO)细胞全部死亡(凋亡)结束培养。每孔加入10μl CCK-8,37℃培养2.5h后测450nm处吸光度,参比波长630nm,将浓度对数与吸光值(OD)作图。
1.8 NESP-Fc融合蛋白体内药效学研究近交系雌性BALB/c小鼠,按体重分组,每组4只,静脉给药。EPO给药组:40IU/鼠,给药前及给药后分别于1~7d,每日取血;NESP-Fc融合蛋白组:低剂量,40IU/鼠;中剂量,200IU/鼠;高剂量,400IU/鼠。给药后分别于1~12d,每日取血。计算网织红细胞数对红细胞总数的比值(Ret%)。药品稀释液为含0.1%牛血清白蛋白的生理盐水,过滤除菌。
1.9 NESP-Fc融合蛋白在大鼠体内半衰期研究SD大鼠,3只/组,分2组,EPO组和NESP-Fc融合蛋白组,分别给药750IU/kg。给药前采空白阴性血,给药后分别于5min、30min、1h、4h、6h、8h、12h、24h、48h、96h、168h、240h和288h取血,分离血清,用Elisa方法检测血清中的残留NESP-Fc的含量。
2 结 果 2.1 NESP-Fc融合蛋白载体的构建NESP-Fc融合蛋白载体的构建见图 1a。以北京奥科生物技术有限责任公司合成的NESP-Fc融合蛋白cDNA为模板,PCR扩增获得NESP-Fc融合蛋白基因序列,其大小约为1 250bp(图 1b)。片段回收后,经HindIII和EcoRI双酶切与同样酶切处理的载体PHL连接。转化大肠杆菌DH5α,经菌落PCR筛选出阳性克隆。提取质粒DNA,HindIII和EcoRI双酶切后,可从重组质粒中切出分子量约1 250bp的片段(图 1c),表明目的片段已成功克隆至表达载体pHL上。测序结果与设计的序列完全一致。
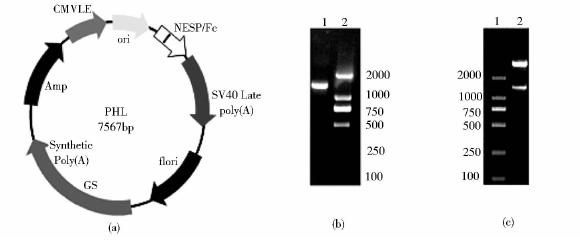
|
| 图 1 NESP-Fc表达载体的构建 Fig. 1 Construction of NESP-Fc vector (a) A schematic of the vector construction (b) PCR production of NESP-Fc 1: NESP-Fc gene; 2:DL2000 DNA marker (c) Analysis of recombinant vector 1: DL2000 DNA marker; 2: Vector digested with HindIII-EcoRI |
将含NESP-Fc融合蛋白编码基因的表达质粒(pHL)转染CHO-K1细胞后,首先用25μmol/L的MSX筛选阳性克隆,然后对混合克隆用400μmol/L的MSX进行加压扩增,用有限稀释法分离单克隆,并利用夹心ELISA对单克隆的表达水平进行鉴定,结果显示,单克隆的表达水平可以高达30~50 pcd (pg/cell/day)。挑取表达水平最高的3株单克隆,按照常规方法进行无血清驯化和悬浮培养驯化。
取驯化后表达水平最高的克隆进行培养条件的优化,结果显示,在测试的几种培养条件下,该细胞株在250ml摇瓶中的表达水平(10~12天)可以达到1.4g/L(图 2),达到生产要求。
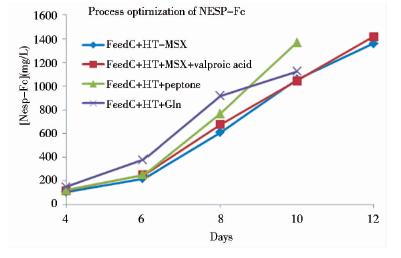
|
| 图 2 NESP-Fc细胞株培养条件优化Fig. 2 Optimization of culture conditions The protein concentration was determined by HPLC |
利用ProteinA亲和层析的方法对表达的NESP-Fc融合蛋白进行了纯化,取纯化后的融合蛋白进行蛋白质电泳和免疫印迹分析,结果显示融合蛋白还原条件下分子量为65kDa左右,在非还原条件下为130kDa左右(图 3),推测是融合蛋白形成了二聚体。
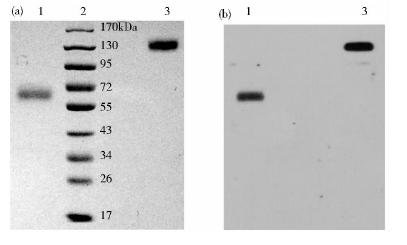
|
| 图 3 NESP-Fc纯化产物电泳和分析Fig. 3 SDS-PAGE and Western blotting analyses of NESP-Fc (a) SDS-PAGE (b) Anti-EPO antibody Western blotting 1: Reduced NESP-Fc; 2: Protein marker; 3: Non-reduced NESP-Fc |
UT-7细胞株是一种EPO生长依赖型的细胞,本文采用CCK-8试剂盒通过检测在不同浓度EPO或融合蛋白作用下的UT-7细胞生长情况,检测该融合蛋白的体外生物学活性。检测结果表明NESP-Fc可以刺激UT-7细胞的生长,阳性重组人的EPO对照EC50为1.432ng/ml,约合66.4pmol/L(图 4a),NESP-Fc的EC50值为7.58ng/ml,按照单体的分子量为65kDa计,约合115pmol/L(图 4b)。由此可见NESP-Fc的生物学活性与重组人的EPO相似,没有较大的降低,因此分子改造是比较成功的。
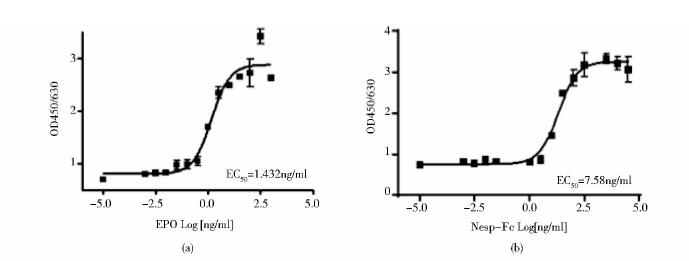
|
| 图 4 NESP-Fc在UT-7细胞上的生物学活性检测Fig. 4 The biological activity assay of NESP-Fc on UT-7 cells (a) Dose-response curve of positive control group (b) Dose-response curve of NESP-Fc |
EPO可以刺激小鼠体内网织红细胞的生成。本文采用近交系雌性BALB/c小鼠,静脉注射给药,通过对高、中、低三个不同剂量组小鼠的周围血网织红细胞计数,从而测定NESP-Fc融合蛋白的体内活性。实验结果表明,NESP-Fc融合蛋白能显著促进网织红细胞的增殖。在相同剂量下,NESP-Fc在促进网织红细胞增殖时与对照组EPO相比更具有长效性。另外,高、中、低三个不同剂量组的结果表明NESP-Fc融合蛋白在促进网织红细胞增殖时具有明显的量效关系,剂量越高,促进网织红细胞增殖的效果越好(图 5)。
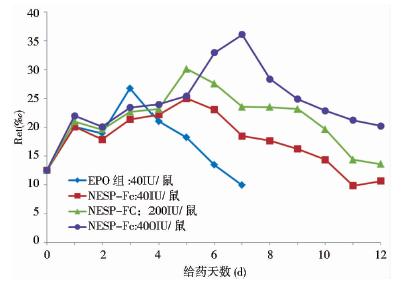
|
| 图 5 NESP-Fc融合蛋白对体内网织红细胞生成的作用Fig. 5 The action of NESP-Fc on the reticulocyte in vivo |
采用SD大鼠,静脉注射给药,检测了药物在大鼠体内的半衰期。表 1中1#、2#、3#为NESP-Fc融合蛋白给药组大鼠,4#、5#、6#为对照组EPO给药组。大鼠检测结果表明,融合蛋白在大鼠体内的半衰期显著延长,其检测t1/2平均值为53h;对照重组人的EPOt1/2平均值为9.78h,与文献报道的相近[6]。文献报道:NESP在大鼠体内的半衰期是25.3h[6];而rhEPO-Fc的半衰期是40h左右[10]。因此,我们构建的NESP-Fc半衰期比以上几种的半衰期更长,可能更具临床应用价值。
| ID | t1/2 | Cl_obs |
| No. | h | ml/h/kg |
| 1# | 51.4846 | 60.7314 |
| 2# | 49.1525 | 63.6151 |
| 3# | 58.3533 | 74.3741 |
| 4# | 10.649 | 17.8324 |
| 5# | 9.3976 | 15.906 |
| 6# | 9.3023 | 13.5207 |
前文所述,由于EPO的半衰期较短,病人每2~3天就要给药一次。这对病人,特别是那些临床上没有其他病症的人带来诸多不便。由此有不少药厂和科研机构研制长效EPO。EPO的PEG化是现在常用的延长EPO半衰期的一种方式,也取得了一定的成功。但是PEG化会导致EPO的结构改变,由此会引起EPO性质(包括特异性)发生改变,从而引起一些机体反应。其他的方法如将EPO与人的血清白蛋白相连,或者是IgG-Fc相连等等;还有的是将EPO或者NESP通过短的linker蛋白或者化学方法连接起来。以上这些方法都在一定程度上提高了EPO的半衰期,但每种方法都有一定的局限性。而本文中将NESP与IgG4的Fc融合的方法尚未见文献报道。
IgG的Fc片段常被用来与活性蛋白连接构成融合蛋白,可以提高活性蛋白在体内的半衰期,从而达到长效的目的[11, 12]。IgG依其在血清中浓度的高低,分为4个亚类,包括IgG1、IgG2、IgG3和IgG4。我们的NESP-Fc融合蛋白选用IgG2的恒定区,是因为IgG2不易与FcγRI、FcγRII和FcγRIII结合,从而降低了可能引起的抗体依赖的细胞毒作用(ADCC)和补体依赖的细胞毒作用(CDC)。同时,还将IgG2中的Val234和Gly237突变为Ala(氨基酸编号参照Kabat数据库),进一步降低CH2可能具有的丝裂原活性,保证了融合蛋白具有较低的毒副作用[13]。
糖基对EPO的生物学活性、水溶性、热稳定性及生物合成均有较大的影响。糖基化发生在特定的氨基酸残基序列上,分为两类:N-连接糖基化,寡糖通过与蛋白质的天冬氨酸的自由基NH2连接到特征序列Asn-X-Ser/Thr(X代表任何一种氨基酸)中的天冬酰胺上;O-连接糖基化是将糖链转移到多肽链的丝氨酸、苏氨酸或羟赖氨酸的羟基的氧原子上[14]。EPO含有4个糖基化位点,其中3个N端糖链(Asn24,38,83)和1个O端糖链(Ser126)。EPO的糖基化程度很高,并有2个二硫键连接。美国Amgen公司研制NESP含有5个N端糖链和1个O端糖链,其N端糖基化位点发生在24,30,38,83和88位。糖基化极大地增加了蛋白的分子量,实验结果显示所表达的NESP-Fc融合蛋白分子量高达200kDa,并且以二聚体的形式存在。
本文中的NESP与IgG4的Fc融合和糖基化位点的增加为延长药物半衰期打下了基础。大鼠体内的半衰期研究结果也显示,该NESP-Fc融合蛋白具有更长的半衰期。 NESP在大鼠体内半衰期长达53个小时。经体内外药效学活性检测,该NESP-Fc融合蛋白能明显促进UT-7细胞的生长,与阳性对照EPO相比,EC50十分相近,改造过程NESP的生物学活性保持良好;而且NESP-Fc融合蛋白能促进小鼠体内网织红细胞的增殖,并且与对照EPO相比,两者药学效果非常相似。因此我们对NESP的改造是成功的,以上各项实验为NESP-Fc的进一步研究提供了强有力的基础。研究结果表明,已优化的融合蛋白细胞株表达量高达1.42g/L,符合工业生产的要求,为工业上NESP-Fc的批量生产提供了条件。
综上所述,本研究的NESP-Fc融合蛋白是一种长效EPO,它的生物学活性良好。本研究为NESP-Fc的临床注册申请和产业化奠定了良好的基础。如进一步研究,有望成为临床上治疗贫血的药物。
| [1] | McClellan W M, Flanders W D, Langston R D, et al. Anemia and renal insufficiency are independent risk factors for death among patients with congesture heart failure admitted to community hospitals: a population-based study. J Am Soc Nephrol, 2002, 13(7):1928-1936. |
| [2] | Fisher S, Roheim P S. Role of liver in the inactivation of erythropoietin. Nature,1963,30(200):899-900. |
| [3] | Koury M J, Bondurant M C. Maintenance by erythropoietin of viability and maturation of murine erythroid precursor cells. J Cell Physiol, 1988, 137(1):65-74. |
| [4] | Pljesa S. Possible complications of erythropoietin therapy in patients with chronic renal failure. Med Pregl, 2004, 57(5-6):254-257. |
| [5] | Egrie J C, Browne J K. Development and characterization of novel erythropoiesis stimulating protein(NESP). Br J Cancer, 2001, 84(suppl 1):3-10. |
| [6] | Macdougall I C. An overview of the efficacy and safety of novel erythropoiesis stimulating protein(NESP). Nephrol Dial Transplant, 2001, 16(suppl 3):14-21. |
| [7] | 程虹,杨思仪,马金伟,等.一种新型高糖基化促红细胞生成素免疫融合蛋白. 中国,CN101870735 A,2010年10月27日. Cheng H, Yang S Y, Ma J W, et al. Manufaction of a New High-glycosylated Fusion Protein. China, CN101870735 A,2010,10,27. |
| [8] | Holm L. Codon usage and gene expression. Nucleic Acids Res, 1986, 14(7):3075-3087. |
| [9] | 汪家政, 范明.蛋白质技术手册.北京:科学出版社,2000.60-120. Wang J Z, Fan M. A Manual of Protein Technology .Beijing :Science Press, 2000.60-120. |
| [10] | Shi X, Yang J, Zhu N, et al. Pharmacokinetics and pharmacodynamics of recombinant human EPO-Fc Fusion protein in vivo. Plos One, 2013 8(7):e72673. |
| [11] | 马金伟,程虹,褚学者,等. 免疫融合蛋白sFcεRIα/mIg(IgG2)的研制. 中国生物工程杂志, 2010,30(10):17-21. Ma J W, Cheng H, Chu X Z, et al. Development of chimera protein: sFcεRIα/mIg (IgG2). China Biotechnology, 2010,30(10):17-21. |
| [12] | Sockolosky J T, Kivimäe S, Szoka F C. Fusion of a short peptide that binds immunoglobulin G to a recombinant protein substantially increases its plasma half-life in mice. PLoS One, 2014,9(7):e102566. |
| [13] | Hsu D H, Shi J D, Homola M, et al. A humanized anti-CD3 antibody, Hum291, with low mitogenic activity, mediates complete and reversible T-cell depletion in chimpanzees. Transplantation, 1999, 68(4):545-554. |
| [14] | Fisher J W. Erythropoietin: physiologic and pharmacologic aspects.Proc Soc Exp Biol Med, 1997, 216(3):358-369. |
 2015, Vol. 35
2015, Vol. 35




