文章信息
- 龚隆财, 罗镇明, 杨雁青, 王振宇, 向军俭, 王宏
- GONG Long-cai, LUO Zhen-ming, YANG Yan-qing, WANG Zhen-yu, XIANG Jun-jian, WANG Hong
- cTnI-linker-TnC融合蛋白的原核表达及鉴定
- Prokaryotic Expression and Identification of cTnI-linker-TnC Fusion Protein
- 中国生物工程杂志, 2015, 35(4): 48-53
- China Biotechnology, 2015, 35(4): 48-53
- http://dx.doi.org/10.13523/j.cb.20150407
-
文章历史
- 收稿日期:2014-12-30
- 修回日期:2015-02-08
2. 广州市疾病与食品安全免疫学快速检测重点实验室暨南大学分室 广州 510632
2. Guangzhou Key Laboratory of Disease and Food Safety Rapid Test, Guangzhou 510632, China
正常情况下肌钙蛋白I(TnI)和肌钙蛋白T(TnT)以及肌钙蛋白C(TnC)以三联体复合物的形式存在于肌原纤维细肌丝上,是肌肉能量供应的重要调控蛋白。由于心肌肌钙蛋白I(cTnI)特异性地存在于心肌组织中,当发生心肌损伤时会释放入血,由于它出现时间早,持续时间长,现已成为心肌细胞损伤的金标准[1]。同时AACC认证的cTnI参考校准物质由于采用HyTest公司专利直接从心肌组织提纯,造成校准品成本较高,且实际应用中使用效果也并不十分理想[2]。研究表明,不同因素会影响cTnI的检测值,包括翻译后修饰(蛋白水解降解[3],磷酸化[4]),与其他分子(如肌钙蛋白C[5],肝素[4])形成复合物以及患者血清中循环的cTnI特异性自身抗体[6]等。并且由于不同检测方法中使用的抗体的抗原决定簇特异性不同,cTnI的检测值可以相差30倍甚至更多[7]。根据HyTest公司研究结果表明不可能找到一对抗体(一个捕获抗体和一个检测抗体)完全不受所有已知的cTnI修饰和干扰的影响。现已证实,心肌损伤早期患者血液中大部分cTnI(>95%)以二元cTnI-TnC复合物形式存在[5, 8],所以制备针对cTnI-TnC复合物的特异性抗体有助于心肌损伤的早期诊断,并且HyTest公司已经成功制备出针对cTnI-TnC复合物的特异性单克隆抗体并应用于cTnI夹心免疫分析,其灵敏度可达0.01ng/ml,远远高于传统的仅针对cTnI单分子的夹心免疫分析方法。由于天然的cTnI-TnC复合物容易受各种因素的影响而解聚[9],所以制备稳定的cTnI-TnC复合物替代天然复合物至关重要。我们从PUBMED中查找人心脏cTnI和cTnC的cDNA序列(NCBI序列编号分别为NM_000363.4和NM_003280.2),并在两者之间加上15个中性氨基酸残基(G4S)3的linker编码序列(即ggtggtggtggttctggtggtggtggttctggtggtggtggttct),构建cTnI-linker-TnC融合蛋白的原核表达系统,在大肠杆菌中成功实现了cTnI-linker-TnC融合蛋白的稳定可溶性高表达。经商品化的特异性抗cTnI单克隆抗体和特异性抗cTnC单克隆抗体鉴定,以及用心肌梗塞患者血清进行免疫反应鉴定,表明重组表达的cTnI-linker-TnC融合蛋白具有较好的免疫原性,保存了cTnI和cTnC单体的天然结构,有望成为天然cTnI-TnC复合物的替代物,为下一步制备高特异性的抗cTnI-TnC复合物的单克隆抗体奠定基础。
1 材料与方法 1.1 材 料表达载体pET28a、pET32a和大肠杆菌BL21由本实验室保存;小量质粒抽提试剂盒及DNA凝胶回收试剂盒购自Axygen有限公司; T4 DNA ligase、DNA标准分子量marker及快切酶BamH I和Hind Ⅲ购自TaKaRa公司;鼠源标准抗cTnI的单克隆抗体19C7以及标准抗cTnC的单克隆抗体7B9购自Hytest公司(货号分别为Cat 4T21和Cat 4T27);人源心肌肌钙蛋白I(cTnI)标准品购自Hytest公司(货号为Cat 8T53);八位心肌梗塞患者血清购自暨南大学附属第一医院,正常人血清由本文作者提供;Balb/c小鼠购自南方医科大学动物实验中心;异丙基-β-D硫代半乳糖苷(IPTG),HRP标记的羊抗小鼠IgG(购自Santa Cruz Biotechnology,Inc.货号为sc-2005),HRP标记的羊抗人IgG(购自EarthOx LLC,货号为E030170-01);普通标准蛋白marker购自Fermentas公司;其余所用化学试剂均为分析纯。
1.2 方 法 1.2.1 重组cTnI-linker-TnC基因的构建在PUBMED数据库中查找cTnI和cTnC的 cDNA序列,用一段柔性肽(G4S)3序列将两者连接起来,并在其N端和C端分别引入酶切位点BamH I和Hind Ⅲ,由华大基因人工合成此段重组序列,插入质粒pUC57-simpe中获得重组质粒pUC57-cTnI-linker-TnC,转化入大肠杆菌克隆菌株DH5α中。
1.2.2 重组表达载体pET32a-cTnI-linker-TnC和pET28a-cTnI-linker-TnC的构建及鉴定Axygen质粒提取试剂盒提取重组质粒pUC57-cTnI-linker-TnC,用内切酶BamH I和Hind Ⅲ进行双酶切,酶切产物用1%琼脂糖凝胶电泳鉴定,Axygen试剂盒回收琼脂糖凝胶中的cTnI-linker-TnC基因片段。用BamH I和HindⅢ双酶切表达载体pET32a和pET28a,在T4 DNA ligase体系中,将cTnI-linker-TnC基因分别插入表达载体pET32a和pET28a中,构建重组质粒pET32a-cTnI-linker-TnC和pET28a-cTnI-linker-TnC,分别转化入感受态克隆菌株DH5α中。涂固体培养基平板(分别含100mg/L氨苄青霉素和70mg/L卡那霉素)挑取单克隆,在LB培养基中培养10h,提取重组质粒pET32a-cTnI-linker-TnC和pET28a-cTnI-linker-TnC,经双酶切后1%琼脂糖凝胶电泳鉴定,并进行基因序列测定。将鉴定正确的重组质粒分别转化入感受态表达菌株BL21(DE3)中,用于诱导表达目的蛋白。
1.2.3 重组蛋白的表达及表达条件优化分别挑取含重组质粒pET32a-cTnI-linker-TnC和pET28a-cTnI-linker-TnC的BL21单克隆菌株,接种至LB培养基中,220r/min、37℃培养3h使得菌体处于对数生长期,用异丙基硫代-β-D-半乳糖苷(IPTG)诱导表达。
在25℃、28℃和37℃三个温度条件下,分别加入终浓度为0.1 mmol/L、0.4 mmol/L、 0.7 mmol/L和1 mmol/L的IPTG诱导目的蛋白表达,选择最佳诱导条件。在诱导后3h、5h和7h测定cTnI-linker-TnC融合蛋白的表达量,确定最佳表达时间。
1.2.4 重组蛋白的纯化及鉴定pET32a作为载体表达的重组蛋白N端带有一个由6个His组成的“标签”,可用NTA树脂进行亲和层析纯化。用含20,60,100,150,300,500 mmol/L咪唑的磷酸盐缓冲液进行梯度洗脱,收集洗脱液后超滤脱盐并测定融合蛋白的浓度。
将纯化后的融合蛋白用12%的SDS-PAGE电泳进行鉴定和间接ELISA鉴定(将不同浓度的融合蛋白用pH9.6的碳酸盐溶液包被于聚苯乙烯板孔内,4℃过夜,分别用商品化的抗cTnI的单克隆抗体19C7(8万倍稀释,融合蛋白包被浓度分别为10,25,50,75,100,125,150,175,200,250ng/ml,包被100μl)和商品化的抗cTnC的单克隆抗体7B9(4万倍稀释,融合蛋白包被浓度分别为10,50,100,150,200,250,300,350,400ng/ml,包被100μl)作为一抗,用辣根过氧化物酶(HRP)标记的羊抗鼠IgG作为二抗;同时用购买的标准cTnI蛋白做阳性对照(19C7 8万倍稀释做为一抗,包被浓度分别为5、15、30、50、70、90、110、130、150、200 ng/ml,包被100μl)和不含目的基因的空载体菌株诱导表达产物做阴性对照)。
1.2.5 融合蛋白免疫原性的鉴定(1)Western blot检测 ①未经纯化的重组质粒pET32a-cTnI-linker-TnC和pET28a-cTnI-linker-TnC表达的融合蛋白作为抗原,商品化的单克隆抗体19C7和7B9作为一抗(均为1万倍稀释),HRP标记的羊抗鼠Ig G作为二抗(1万倍稀释),分别进行Western blot检测。
②重组质粒pET32a-cTnI-linker-TnC表达的融合蛋白,经Ni离子亲和层析柱纯化后300mmol/L咪唑洗脱液作为抗原,商品化的单克隆抗体19C7和7B9作为一抗(均为1万倍稀释),HRP标记的羊抗鼠Ig G作为二抗(1万倍稀释),分别进行Western blot检测;同时用购买的标准cTnI蛋白作为阳性对照。
(2)双抗体夹心ELISA检测 用本实验室已经建立的双抗体夹心ELISA检测方法进行检测,即用单克隆抗体7B9作为捕获抗体(10μg/ml,包被100μl),用HRP-19C7作为检测抗体(1 000倍稀释),加入不同浓度的融合蛋白溶液(800,400,200,100,50,25,12.5,6.25,3.125ng/ml)进行检测;同时加入不含目的基因的空载体菌株诱导表达产物做阴性对照。
(3)心肌梗塞患者血清鉴定 原核表达的融合蛋白作为抗原(800ng/ml,包被100μl),同时用购买的标准cTnI蛋白作为阳性对照(400ng/ml,包被100μl),8位心肌梗塞患者血清作为一抗,HRP标记的羊抗人Ig G作为二抗(1万倍稀释),进行间接ELISA检测;同时用正常人血清作为阴性对照。
2 结 果 2.1 重组表达载体pET28a-cTnI-linker-TnC和pET32a-cTnI-linker-TnC的鉴定1%琼脂糖凝胶电泳(图 1)结果表明,重组质粒pET28a-cTnI-linker-TnC和pET32a-cTnI-linker-TnC经双酶切后成分均一且分子量正确。经测序,DNA序列完全正确(测序结果略)。
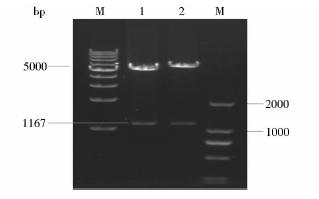
|
| 图 1 重组质粒pET28a-cTnI-linker-TnC和pET32a-cTnI-linker-TnC的酶切鉴定双酶切后目的基因大小为1167bp Fig. 1 The identification of recombinant vectors pET28a-cTnI-linker-TnC and pET32a-cTnI-linker-TnC M: 1kb protein marker and DL2000 marker; 1: Production of pET28a-cTnI-linker-TnC; 2:Production of pET32a-cTnI-linker-TnC |
12% SDS-PAGE电泳结果(图 2)表明,在同样的条件下,重组质粒pET32a-cTnI-linker-TnC的可溶性表达量明显高于重组质粒pET28a-cTnI-linker-TnC的可溶性表达量。
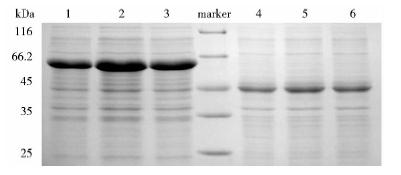
|
| 图 2 融合蛋白cTnI-linker-TnC在表达载体pET32a 和pET28a中表达 融合蛋白cTnI-linker-TnC经重组质粒pET32a-cTnI-linker-TnC表达后的分子量约为60kDa;经重组质粒pET28a-cTnI-linker-TnC表达后的分子量约为40kDaFig. 2 The expression of the fusion protein cTnI-linker-TnC in the pET32a and pET28a vectors 1,2,3: The expression of the fusion protein cTnI-linker-TnC in recombinant vector pET32a-cTnI-linker-TnC for 3h,5h and 7h respectively; M: Protein marker; 4,5,6: The expression of the fusion protein cTnI-linker-TnC in recombinant vector pET28a-cTnI-linker-TnC for 3h,5h and 7h respectively |
通过优化重组表达载体pET32a-cTnI-linker-TnC的表达时间,表达温度和诱导剂IPTG的浓度,结果表明最佳表达条件为28℃、0.4 mmol/L IPTG诱导表达5h(图 2和图 3)。
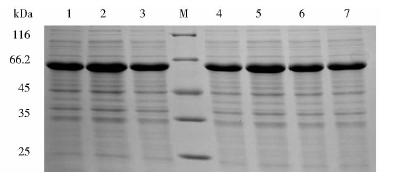
|
| 图 3 融合蛋白cTnI-linker-TnC在表达载体pET32a中表达温度和IPTG浓度的优化Fig. 3 The optimization of the expressing temperatures and concentrations of IPTG in pET32a 1,2,3:The expression of cTnI-linker-TnC at 25℃,28℃and 37℃;M: Protein marker; 4,5,6,7: The concentration of IPTG is 0.1 mmol/L,0.4 mmol/L,0.7 mmol/L and 1 mmol/L |
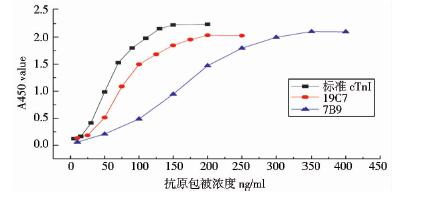
重组表达的融合蛋白cTnI-linker-TnC经NTA树脂纯化后进行SDS-PAGE鉴定(图 4)。分别用抗cTnI的单克隆抗体19C7和抗cTnC的单克隆抗体7B9做间接ELISA鉴定,结果(图 5)表明融合蛋白cTnI-linker-TnC很好地保存了cTnI和cTnC单体的结构,且阴性对照结果为阴性。
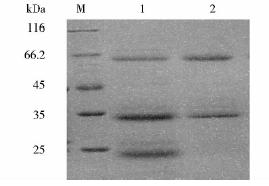
|
| 图 4 融合蛋白cTnI-linker-TnC经NTA树脂纯化后SDS-PAGE鉴定Fig. 4 The purification of cTnI-linker-TnC by NTA column M: Protein marker; 1: 150 mmol/L imidazole;2: 300 mmol/L imidazole |
|
| 图 5 间接ELISA鉴定融合蛋白cTnI-linker-TnC 19C7为抗cTnI的单克隆抗体;7B9为抗cTnC的单克隆抗体;标准cTnI作为阳性对照Fig. 5 The identification of cTnI-linker-TnC by indirect ELISA |
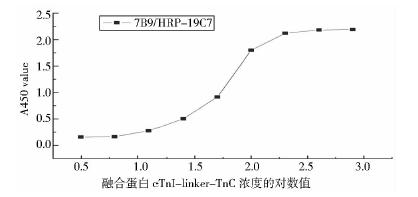
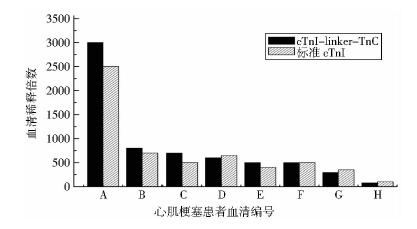
Western blot检测结果(图 6)表明,两种单克隆抗体19C7和7B9均能够与两种表达载体pET32a和pET28a表达的融合蛋白发生特异性免疫反应;经NTA树脂纯化后的融合蛋白也可与两种单克隆抗体发生特异性反应(图 7)。双抗体夹心ELISA实验结果(图 8)表明,融合蛋白cTnI-linker-TnC的检测限为6~200ng/ml。心肌梗塞患者血清间接ELISA结果(图 9)表明,当OD值为1.0且融合蛋白cTnI-linker-TnC作为抗原时,八位心肌梗塞患者血清稀释倍数分别为3 000、800、700、600、500、500、300、80倍;当OD值为1.0且标准cTnI作为抗原时,八位心肌梗塞患者血清稀释倍数分别为2 500、700、500、650、400、500、350、100倍;且正常人血清不反应。

|
| 图 6 融合蛋白cTnI-linker-TnC在表达载体pET32a 和pET28a中表达后的Western blot 鉴定Fig. 6 The Western blot identification of the fusion protein cTnI-linker-TnC in pET32a and pET28a vectors (a) Specific monoclonal antibody (19C7) of anti-cTnI 1:The expression products of cTnI-linker-TnC-pET28a; 2:The expression products of cTnI-linker-TnC-pET32a (b) Specific monoclonal antibody (7B9) of anti-cTnC 1:The expression products of cTnI-linker-TnC-pET32a; 2:The expression products of cTnI-linker-TnC-pET28a |
|
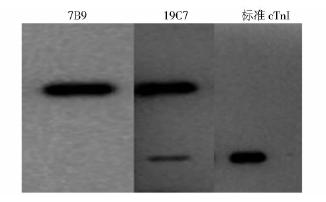
| 图 7 Western blot 鉴定300mmol/L咪唑洗脱液 7B9为抗cTnC的单克隆抗体;19C7为抗cTnI的单克隆抗体;标准cTnI作为阳性对照Fig. 7 The Western blot identification of the 300mmol/L eluent |
|
| 图 8 双抗体夹心ELISA检测融合蛋白cTnI-linker-TnCFig. 8 The identification of cTnI-linker-TnC by double antibody sandwich ELISA |
|
| 图 9 心肌梗塞患者血清间接ELISA反应鉴定Fig. 9 The identification of cTnI-linker-TnC by indirect ELISA with the serum of myocardial infarction patients |
现已证实,心肌损伤早期患者血液中大部分cTnI(>95%)以二元cTnI-TnC复合物形式存在[5, 8],游离的cTnI较少,并且由于其30~110之间的肽段和TnC结合形成复合物而稳定,但是其N端和C端未形成复合物的部分很容易被蛋白水解酶水解[3]。由于cTnI和cTnC在Ca2+离子的作用下有形成IC复合物的趋势[10],因此有的学者尝试在Ca2+、Mg2+存在的条件下让分别重组表达的cTnI和cTnC蛋白结合,但结果发现这种结合稳定性差,特别是在低浓度和有EDTA或EGTA存在的情况下很容易解离[11]。所以,游离的和非融合的cTnI都不稳定。而Liu等[9]研究发现重组表达的ScTnI-C和ScTnI-C-2的稳定性得到了很大程度的提高(它们在2~8℃条件下能够稳定保存4个月,在-20℃条件下至少能够稳定保存一年)。
由于载体pET32a的前导序列中多了一段硫氧还蛋白标签(Trx-tag)序列,使得重组表达的融合蛋白cTnI-linker-TnC在pET32a表达载体中的可溶性表达量远远高于在pET28a表达载体中的可溶性表达量.所以我们选择了pET32a表达载体作为最佳表达载体并对其表达条件进行了优化。但是从Western blot结果(图 6和图 7)可以看出,未经NTA树脂纯化的表达产物未发生降解,而经NTA树脂纯化的300mmol/L 咪唑洗脱液则出现了降解,且降解产物可以与抗cTnI的单克隆抗体反应而不与抗cTnC的单克隆抗体反应,说明此降解发生在亲和纯化过程中,所以,纯化条件有待进一步优化。
尽管我们已经成功地实现了融合蛋白cTnI-linker-TnC的可溶性表达,并且ELISA和Western blot检测结果也表明我们表达的融合蛋白cTnI-linker-TnC具有很好的免疫原性,有望成为天然cTnI-C复合物的替代物。 但是由于cTnI本身是一种由5个α螺旋构成的链状结构[12]而具有较强的可塑性,且它在大肠杆菌原核表达载体中表达时由于缺乏真核细胞中所具备的翻译折叠系统,所以,重组表达的融合蛋白cTnI-linker-TnC的空间构型可能存在较大差异,而这种差异为我们制备多种针对cTnI-C复合物的特异性单克隆抗体奠定了基础。
| [1] | 杨振华,潘柏申,许俊堂,等.中华医学检验分会文件.心肌损伤标志物的应用准则.中华检验医学杂志,2002,25(3):185. Yang Z H, Pan B S, Xu J T, et al. Documents of Chinese Society of Laboratory Medicine. Application guidelines of myocardial injury markers. Chinese Journal of Laboratory Medicine, 2002,25(3):185. |
| [2] | Panteghini M. Standardization of cardiac troponin I measurements: the way forward clinical chemistry. Clin Chem,2005, 51(9):1594-1597. |
| [3] | Katrukha A G, Bereznikova A V, Filatov V L, et al. Degradation of cardiac troponin I: implication for reliable immunodetection. Clin Chem, 1998, 44(12): 2433-2340. |
| [4] | Katrukha A, Bereznikova A, Filatov V, et al. Biochemical factors influencing measurement of cardiac troponin I in serum. Clin Chem Lab Med,1999,37(11-12):1091-1095. |
| [5] | Katrukha A G, Bereznikova A V, Esakova T V, et al. Troponin I is released in bloodstream of patients with acute myocardial infarction not in free form but as complex. Clin Chem,1997, 43(8 Pt 1): 1379-1385. |
| [6] | Eriksson S, Halenius H, Pulkki K, et al. Negative interference in cardiac troponin I immunoassays by circulating troponin autoantibodies. Clin Chem, 2005, 51(5):839-847. |
| [7] | Datta P, Foster K, Dasgupta A. Comparison of immunoreactivity of five human cardiac troponin I assay toward free and complexed forms of the antigen: Implications for assay discordance. Clin Chem, 1999, 45 (12):2266-2269. |
| [8] | Wu A H, Feng Y J, Moore R, et al. Characterization of cardiac troponin subunit release into serum after acute myocardial infarction and comparison of assays for troponin T and I. Clin Chem, 1998, 44(6 Pt 1): 1198-1208. |
| [9] | Liu S, Zhang M Y, Song Q, et al. Recombinant single chain cardiac troponin I-C polypeptides: Superior calibration and control materials for cardiac troponin I immunoassays. Clin Lab,2001,47(1-2):19-27. |
| [10] | 刘大彪,张明明,卢仁泉,等. 重组人心肌TnI-TnC复合物的特性及其初步应用.放射免疫学杂志. 2008, 21(1):84-86. Liu D B, Zhang M M, Lu R Q, et al. Characteristic properties of recombinant human cardiac TnI-TnC complex and its assay. J of Radioimmunology. 2008, 21(1):84-86. |
| [11] | 黄应峰,王英明,朱乃硕. 人心肌肌钙蛋白I和C亚基的基因工程表达及两者的结合实验.复旦大学学报,2004, 43(2):175-180. Huang Y F, Wang Y M, Zhu N S. The expression of human cTnI and cTnC in E.coli and their combination assay. Journal of Fudan University(Natural science). 2004, 43(2):175-180. |
| [12] | Ferrieres G, Calzolari C, Mani J C, et al. Human cardiac troponin I: precise identification of antigenic epitopes and prediction of secondary structure. Clin Chem, 1998,44(3): 487-493. |
 2015, Vol. 35
2015, Vol. 35




