文章信息
- 满善晴, 孔祥祯, 董小明, 陈慧, 詹轶群, 李长燕, 杨晓明
- MAN Shan-qing, KONG Xiang-zhen, DONG Xiao-ming, CHEN Hui, ZHAN Yi-qun, LI Chang-yan, YANG Xiao-ming
- HPD基因启动子报告基因载体构建与转录活性分析
- Construction of HPD Promoter Reporter Vector and Analysis of Its Transcriptional Activity
- 中国生物工程杂志, 2015, 35(4): 30-41
- China Biotechnology, 2015, 35(4): 30-41
- http://dx.doi.org/10.13523/j.cb.20150405
-
文章历史
- 收稿日期:2015-01-19
- 修回日期:2015-02-03
2. 军事医学科学院放射与辐射医学研究所 北京 100850
2. Institute of Radiation Medicine, Academy of Military Medical Science, Beijing 100850, China
4-羟苯丙酮酸二加氧酶(4-hydroxyphenylpyruvate dioxygenase,HPD)是酪氨酸分解代谢途径的关键酶。酪氨酸属芳香族氨基酸,在体内可通过5步反应转变为延胡索酸和乙酰-CoA,最终进入三羧酸循环,参与能量代谢。酪氨酸首先在酪氨酸转氨酶催化下将氨基转移到α-酮戊二酸上,本身转变为4-羟苯丙酮酸,后者经加氧反应形成尿黑酸。尿黑酸通过氧化形成4-顺丁烯二酰乙酰乙酸,再通过异构酶形成4-延胡索酰乙酰乙酸,最后在4-延胡索酰乙酰乙酸水解酶作用下,形成延胡索酸和乙酰Co-A。其中,4-羟苯丙酮酸转变为尿黑酸反应就是由HPD催化完成的。HPD的先天性缺失可导致常染色体隐性遗传病III型酪氨酸血症的发生[4, 5, 6]。在肝损伤过程中,HPD在血清中的表达明显上调,提示HPD可作为肝损伤的特异性标志物[7]。但目前对HPD特异表达的调控机制并不清楚。本研究通过构建HPD基因启动子荧光素酶报告基因载体,检测其在肝源细胞中的特异转录活性,进而揭示其肝脏特异性表达的调控机制。
1 材料与方法 1.1 试 剂人的肝癌细胞系HepG2、人的正常肝源细胞系L02和人胚肾细胞HEK293为本实验室保存;LATaq酶、NheI和XhoI限制性内切核酸酶、T4连接酶、DNA Ladder 2 000和15 000等均购自TaKaRa公司; PCR及酶切产物纯化试剂盒均购自Bio-MIGA公司;荧光素酶报告基因载体pGL3-Basic、报告基因内参载体pRL-TK、荧光素酶检测试剂盒等均购自Promega公司;基因组DNA提取试剂盒、高浓度质粒小量提取试剂盒、转染试剂VigoFect均购自威格拉斯公司;胎牛血清购自MD公司;H-DMEM、胰蛋白酶等均购自Gibco公司。
1.2 HPD基因启动子序列数据获取及生物信息学分析在UCSC (http://www. genome.ucsc.edu /)网站中以HPD为基因名查找其基因组DNA序列,并获得其自起始位点上游2 000 bp至下游39bp的启动子序列;利用TFSEARCH、Alggen在线数据库进行启动子和转录因子结合位点的特征分析;利用Genecards在线数据库查找相关基因及转录因子的表达谱。
1.3 引物设计利用Dnastat公司的EditSeq软件对HPD基因组启动子序列和荧光素酶报告基因载体pGL3-Basic的多克隆酶切位点进行分析。利用引物设计软件,设计HPD基因启动子序列和系列缺失体序列的PCR扩增引物并分别命名为HPD-2000-F、HPD-1000-F、HPD-800-F、HPD-700-F、HPD-600-F、HPD-500-F、HPD-400-F,其中HPD-R为公用下游引物,HPD-2000-F—HPD-400-F是上游引物,上、下游引物分别引入NheⅠ和XhoⅠ酶切位点,见表 1,所用引物均由上海生物工程公司合成。
| Primer | Primer sequence | Range | Construction |
| HPD-2000-F | 5′CTA GCTAGC ATCATAGCTCACTGCAACCTTTAAC3′ | -2000~+39 | pGL3-HPD-2000 |
| HPD-1000-F | 5′CTA GCTAGC ACTTAAGGAGCTGAGGTGGACACT3′ | -1000~+39 | pGL3-HPD-1000 |
| HPD-800-F | 5′CTA GCTAGC TCACCTCTCCAGGCCTCAGTTTCCC3′ | -800~+39 | pGL3-HPD-800 |
| HPD-700-F HPD-600-F | 5′CTA GCTAGC TAAAGTGTGGGTCCTGGAGTTAGAA3′ 5′CTA GCTAGC ATTATAACCAACACTGAGAGTGTCC 3′ | -700~+39 -600~+39 | pGL3-HPD-700 pGL3-HPD-600 |
| HPD-500-F | 5′CTA GCTAGC CAAATGAGGCTCAAAGGGATATGGT3′ | -500~+39 | pGL3-HPD-500 |
| HPD-400-F | 5′CTA GCTAGC AATACAACGCTGTGACGCAAACAGG 3′ | -400~+39 | pGL3-HPD-400 |
| HPD-R | 5′CCG CTCAGA CATGATTGATCTTAGTCAAACCTCC3′ |
根据UCSC数据库查到的HPD基因组序列,以转录起始位点为+1,选取上游2 000bp至下游39bp约2kb片段作为待研究的HPD基因启动子序列,设计该片段的PCR扩增引物(HPD-2000-F)。从人肺癌细胞系HepG2中提取人基因组DNA,以其为模板进行PCR 扩增,用1%的琼脂糖凝胶电泳分离PCR产物并回收纯化得到人HPD基因启动子片段,并命名为HPD-2000。PCR扩增体系为:10×LAPCR Buffer 5μl; dNT PMix 8μl; 引物(F+R)2μl;模板(人基因组DNA)0.2μg; LATaq酶 0.5μl; 最后用双蒸水补齐至50μl。扩增条件为:94℃预变性,15min;94℃变性30s,55℃退火30s,72℃ 延伸1min/kb (30 cycles);72℃后延伸,10min。
1.5 人HPD基因启动子片段与荧光素酶报告基因载体的重组用NheI和XhoI这两种酶同时对HPD-2000和pGL3-Basic空载体进行双酶切,双酶切体系为:目的片段/空载体 2μg;cutsmart buffer 5μl;NheI酶 2.5μl; XhoI酶 2.5μl;双蒸水补齐至50μl。然后37℃水浴8~12h;跑电泳切胶回收得到双酶切产物。将酶切产物在T4连接酶的作用下16℃连接过夜。连接体系为:目的片段双酶切回收产物 6.5μl;荧光素酶报告基因空载体双酶切回收产物 2μl;Buffer 1μl;T4 Ligase 0.5μl。将连接产物转化于DH5α感受态菌株,涂LB-Amp+ 平板,挑取单克隆,进行菌落PCR和双酶切鉴定。菌落PCR鉴定体系为:菌液 2μl;PCR Mix 10μl; 双蒸水补齐至20μl。双酶切鉴定体系为:目的片段/空载体 0.5μg;CutSmart Buffer 1μl;NheI酶 0.5μl; XhoI酶 0.5μl;双蒸水补齐至10μl。然后37℃水浴8~12h;跑电泳鉴定。取阳性克隆测序,测序正确后,成功获得此载体,命名为pGL3/HPD-2000。
1.6 HPD基因启动子系列缺失体荧光素酶报告基因载体的构建为构建HPD 5′系列缺失体的荧光素酶报告基因载体,以构建的pGL3/HPD-2000质粒为模板,分别从拟缺失处选取25个碱基(带上NheI酶切位点)作为上游引物(HPD-1000-F~HPD-400-F),使用同一个下游引物(加有XhoI酶切位点),即HPD-R,见表 1,进行PCR扩增即得到缺失体片段。然后依据上述pGL3/HPD-2000载体构建方法将各缺失片段克隆到pGL3-Basic上即得到5′系列缺失体:pGL3/HPD-1000、 pGL3/HPD-800、pGL3/HPD-700、pGL3/HPD-600、 pGL3/HPD-500 和pGL3/HPD-400。
1.7 细胞培养使用高糖型DMEM培养基(含10%胎牛血清)在T25细胞培养瓶中培养HepG2、L02和HEK293等细胞系,其培养条件均为37℃、5% CO2,相对湿度为95%;使用0.25%胰蛋白酶-EDTA对培养的细胞进行消化传代。
1.8 Western blot检测首先用适量磷酸缓冲盐溶液(PBS)(提前用冰预冷)对用于提取细胞总蛋白质的HepG2、L02和HEK293等细胞轻柔洗涤2次;然后每细胞瓶中加入2ml的PBS后用细胞刮将细胞从瓶壁上刮下并转移至1.5ml离心管中,离心弃上清液得细胞沉淀。用RIPA裂解细胞沉淀,冰上裂解30min后4℃ 12 000r/min离心30min,弃沉淀得上清液即得细胞总蛋白质。用紫外分光光度法对细胞总蛋白质(2μl)进行定量,然后在总蛋白质溶液中加入适量5×LaodingBuffer后煮沸10min,-20℃保存备用。配制12% SDS-PAGE胶,使用120V恒压对总蛋白质进行分离,以100mA恒流进行电转,将目的蛋白质转移到PVDF膜上。用含5%脱脂奶粉的TBS-T封闭液封闭上述PVDF膜,然后与相应的抗体孵育杂交。一抗按1∶500稀释,二抗按1∶2 000稀释;X射线片显影检测目的蛋白质的表达量。
1.9 细胞转染以适当的密度接种HepG2、L02和HEK293细胞于24孔板,经24h贴壁生长,细胞达到50%~70%铺满率时用转染试剂VigoFect,根据不同实验设计确定转染试剂和质粒的用量,将VigoFect和质粒分别与25μl PBS混匀,放置5min后将二者混合,室温放置20min,加入培养的细胞中,6h后将培养液吸出换新鲜的含10%FBS的DMEM培养基继续培养24h。
1.10 荧光素酶报告基因活性检测按Promega公司提供的双荧光素酶检测方法进行荧光素酶报告基因活性检测实验。弃去培养液,用PBS洗涤细胞2次,每孔加入100μl细胞裂解液,室温放置摇床上摇动裂解20min 后,吸取30μl上清液作为荧光素酶底物,加入30μl LARⅡBuffer测定荧光素酶发光值; 再加入30μl反应终止液(Stop & G lOR),测定作为内标的海肾荧光素酶发光值,两者比值即为荧光素酶的相对活性(relative luciferase activity,RLA),再以对照组为参照作图。RLA 的数值为3次重复实验的结果。
1.11 统计学分析计量数据以均值、标准差表示,运用SPSS16.0统计学软件进行数据分析,统计学分析方法采用t检验,以P<0. 05为差异有显著性统计学意义。
2 结 果 2.1 HPD特异表达于肝源细胞在Genecards数据库中查询HPD的组织细胞特异性表达,发现HPD在肝脏及肝源细胞中有较高水平的表达,而在其他组织中表达含量较低或无表达(图 1a)。为了进一步验证HPD在我们所选用的HepG2、L02和HEK293这三种细胞中的表达情况,我们提取这三种细胞的总蛋白质,Western blot检测HPD的表达,结果显示,HPD在肝源细胞系L02和HepG2中有较高表达,而在HEK293中无表达(图 1b)。因此,在本研究中选用不表达HPD的HEK293细胞系作为阴性对照细胞系,而表达HPD的肝源细胞系L02和HepG2作为实验组细胞系。
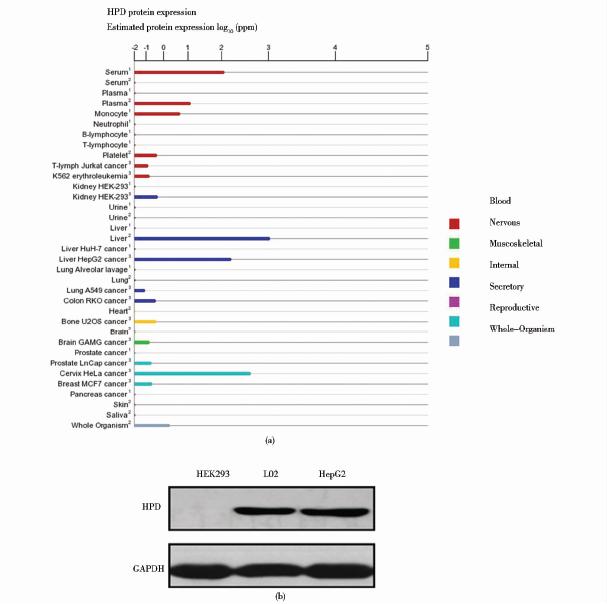
|
| 图 1 HPD在肝源细胞系中的特异表达 Fig. 1 The specific expression of HPD in liver cells (a) HPD expression in the genecards online databases (b) HPD expression in HepG2,L02 and HEK293 cell lines by Western blot |
应用UCSC 数据库查找人HPD基因5′侧翼序列,获得人HPD基因自转录起始位点上游-2 000bp至转录起始位点下游39bp共2 039bp的序列,将这段序列作为候选启动子序列(图 2)。本文的启动子截短体报告基因载体的构建策略如图 3所示。

|
| 图 2 HPD基因启动子序列分析Fig. 2 The analysis of the HPD gene promoter sequence |
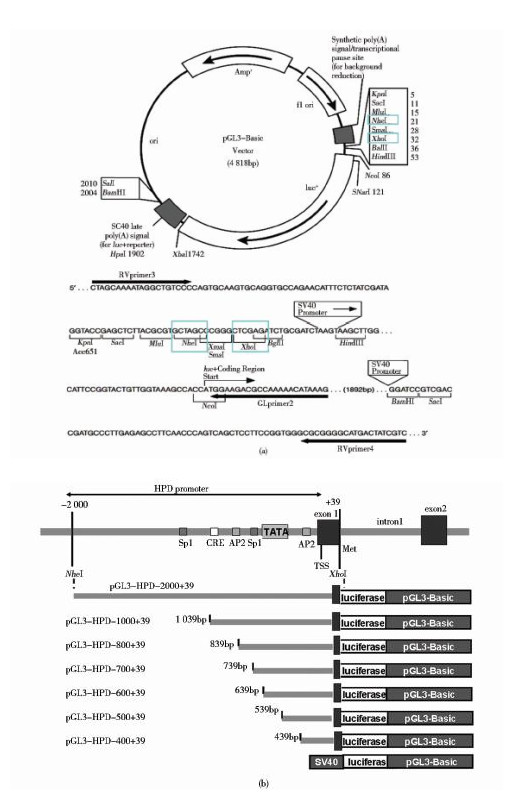
|
| 图 3 HPD基因启动子荧光素酶报告基因载体的构建策略Fig. 3 The constructional strategy of the HPD gene promoter reporter gene constructs (a)It is the pGL3-Basic vector map and all the constructions reported in this paper were cloned into NheI and Xho I restriction enzyme sites (b)It is the strategy for the series of HPD promoter deletion luciferase reporter gene vector constructions and a series of seven different promoter deletion luciferase reporter gene vector constructions were obtained from the 2 000bp fragments |
以人肝癌细胞系HepG2基因组DNA 为模板,PCR扩增-2 000~+39bp片段,PCR扩增结果如图 4所示,琼脂糖凝胶电泳结果显示成功克隆得到HPD基因启动子2 000bp长度的片段。将PCR 产物插入pGL3-Basic载体,构建重组载体pGL3(-2 000~+39),对获得的阳性重组子提取质粒,用NheI/XhoI双酶切鉴定,结果如图 5所示,重组质粒可酶切出正确大小的条带,结合测序结果,表明我们已经成功构建HPD上游2 000bp调控区报告基因载体。
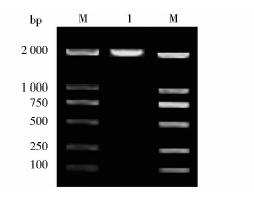
|
| 图 4 HPD基因启动子-2 000~+39bp片段的克隆Fig. 4 Cloning of HPD gene promoter -2 000~+39bp fragment |
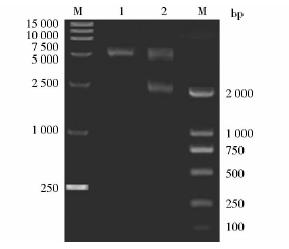
|
| 图 5 pGL3/HPD-2000双酶切鉴定Fig. 5 pGL3/HPD-2000 double enzyme cutting identification M:Represents the DL-15 000 and DL-2000 marker;1: pGL3-Basic double digestion producter obtained by NheI and Xho I,and its size is 4.8kb; 2: pGL3/HPD-2000 double digestion producter obtained by NheI and Xho I,and its size is 4.8kb and 2kb |
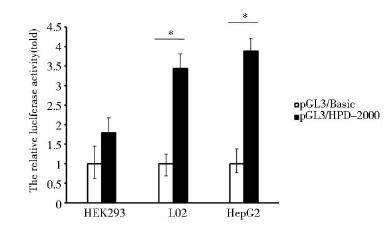
将pGL3(-2 000~+39)重组质粒转染HepG2、L02及HEK293等细胞系,发现该区域在表达HPD的肝源细胞系HepG2和L02细胞中具有较强转录荧光素酶活性,而在不表达HPD的HEK293细胞中则不具有转录活性(图 6),该结果说明HPD具有明显的肝细胞特异性,并且是通过其上游调控区2 000bp来调节其特异性表达的。
|
| 图 6 pGL3/HPD-2000在HEK293、L02和HepG2中的转录活性分析Fig. 6 The luciferase assays of pGL3/HPD-2000 in HEK293,L02,and HepG2 cell |
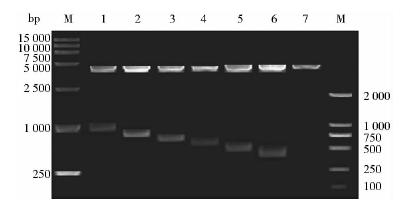
为了明确调控HPD特异表达的具体区域,我们进一步以pGL3(-2 000~+39)为模板,设计系列PCR引物,构建策略如图 6所示。PCR扩增又获得了6个不同长度的PCR片段,扩增结果如图 7所示,结果显示我们已成功克隆得到HPD-1 000~HPD-400这6个不同长度的片段。将PCR 产物经NheI/XhoI双酶切插入pGL3-Basic 载体构建得到重组载体。对获得的阳性重组子提取质粒,用NheI/XhoI双酶切鉴定,结果如图 8所示,所有重组子均可酶切出正确大小的条带,结合测序结果,表明我们已经成功构建HPD上游调控区系列缺失体的报告基因载体,分别为pGL3(-1 000~+39)、pGL3(-800~+39)、pGL3(-700~+39)、pGL3(-600~+39)、pGL3(-500~+39)、pGL3(-400~+39)。

|
| 图 7 HPD基因启动子片段的PCR扩增产物Fig. 7 The PCR amplification products of HPD gene promoter fragments M: Represents DL-2000 marker; 1~6: Represents the plasmids from HPD-1 000 to HPD-400 |
|
| 图 8 pGL3/HPD-1000~ pGL3/HPD-400质粒的双酶切鉴定Fig. 8 The double enzyme digestion of pGL3 / HPD-1000~ pGL3 / HPD-400 plasmids M: Represents the DL-15 000 and DL-2 000 marker; 1~6: Represents the objective fragment bands of the plasmids from pGL3 / HPD-1000 to pGL3 / HPD-400 and with its luciferase vector corresponding to the strip; 7: The strip of pGL3 / Basic cuted by double enzymes |
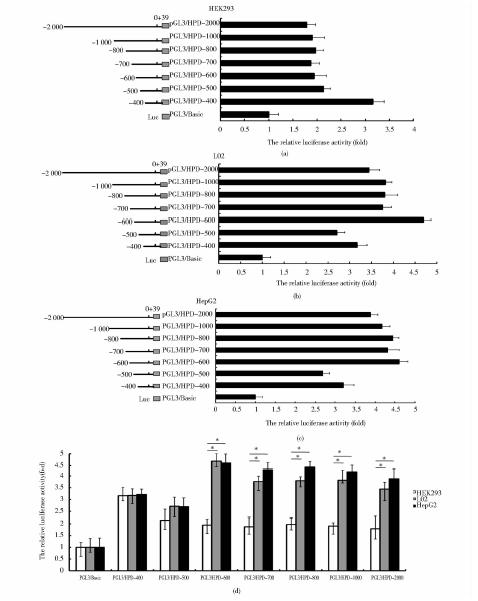
将系列报告基因载体分别转染HEK293、L02、HepG2细胞,24h后采用双荧光素酶报告检测系统检测转录活性,结果如图 9所示,-2 000~-600区域在肝源细胞L02和HepG2中均具有较强的转录活性,而在HEK293细胞中则活性较低(*P=0.005 6)。-500~+39区域虽然在两种肝源细胞中略高,但与HEK293细胞相比无显著差别。-400~+39区域转录活性在三种细胞中无明显差别。该结果显示调控HPD肝脏特异表达的关键区域位于-600~-400。
|
| 图 9 HPD基因启动子系列缺失体在HEK293、L02、HepG2三种细胞中的转录活性分析Fig. 9 The luciferase assays of HPD gene promoter deletions in HEK293,L02 and HepG2 cell (a) The luciferase assays of HPD gene promoter deletions in HEK293 cell (b) The luciferase assays of HPD gene promoter deletions in L02 cell (c) The luciferase assays of HPD gene promoter deletions in HepG2 cell (d) The luciferase assays of HPD gene promoter deletions in HEK293,L02 and HepG2 cell |
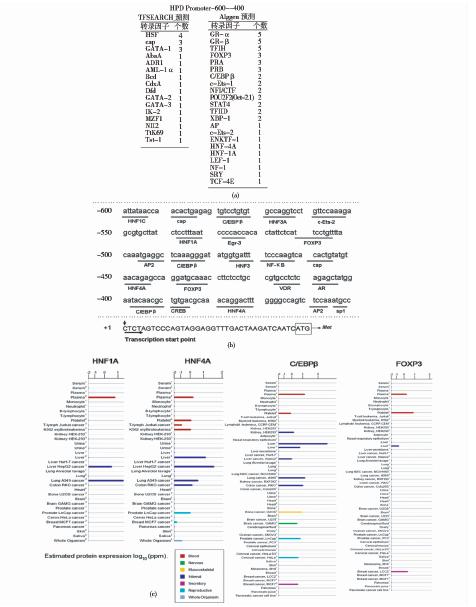
为了进一步探究在HPD基因启动子序列-600~-400区域是否存在调控HPD在肝脏中特异表达的潜在转录因子,我们运用TFSEACH和Alggen在线数据库对这一区域潜在的转录因子结合位点进行了初步预测。发现在预测到的潜在转录因子中,有许多都与肝脏中相关基因的表达调控有密切关系,其中有一些已经有相关研究和报道的,如HNF1A、HNF4A、C/EBPβ及FOXP3,结果如图 10所示。并且,我们运用Genecards在线数据库重点查找了以上4种转录因子的表达谱,发现这4种转录因子均在肝脏中有特异性表达,结果如图 10c所示。这些发现提示我们HPD基因启动子序列-600~-400区域内预测到的转录因子如HNF1A、HNF4A、C/EBPβ及FOXP3可能参与了HPD基因在肝脏中特异表达的转录调控。这一推测还需要进一步实验证据的支持。
|
| 图 10 HPD基因启动子序列上转录因子结合位点的预测分析Fig. 10 The prediction of transcription factor binding sites in HPD promoter sequence (a)The transcription factor binding sites prediction results of HPD gene promoter sequence from TFSEACH and Alggen (b) The transcription factor binding sites in -600 ~ -400 area of HPD gene promoter sequence (c) The protein expression profiles of HNF1A,HNF4A,C/EBP β and FOXP3 from Genecards |
目前功能基因组学研究是基因分子生物学研究领域中非常重要的一个方面。在生物体内DNA转录成RNA是基因选择性表达的关键过程,基因表达调控也主要发生在这一转录水平。基因表达调控在生命过程的各阶段均有体现,调控出现异常便会导致疾病的发生和发展。近年来,对基因顺式作用元件和转录因子及其转录调控的研究已成为功能基因组学研究热点之一。前期研究表明HPD是一种酪氨酸代谢酶,特异表达于肝脏,但对其转录调控机制并不清楚。本研究通过构建HPD基因上游调控区报告基因载体,并检测其在不同细胞类型中的转录活性,发现HPD上游-600~-400bp存在调控HPD肝脏特异表达的关键元件,为后续其转录调控的研究奠定了理论基础。
肝脏是人体内的生化工厂,作为机体最重要的器官之一至少承担着5 000种以上的生理功能。例如,大部分血浆蛋白质的合成,糖类、蛋白质、脂类、尿素等物质的代谢调节,生物转化和外源化学物质的解毒等功能几乎均由肝脏承载,这些功能的发挥主要与肝脏中特异蛋白质的表达有关[8]。作为一个重要的代谢脏器,肝脏是固醇酶类、药物代谢酶类、脂质合酶类等代谢酶类特异性表达的器官。这些肝脏特异性基因的表达是由一系列肝脏富集的特异转录因子与其基因启动子上顺式作用元件的相互作用调控的。并且,已有许多研究报道了这些相关酶类在肝脏中特异性表达的分子机制研究。Miyajima等[9]在2009年研究了细胞色素P4501A2(CYP1A2)启动子的GC盒对其特异表达于肝脏组织及其CpG甲基化修饰的调控作用。他们发现GC盒对CYP1A2启动子活性及其通过CpG甲基化介导的表观遗传修饰发挥着重要调控作用,这是CYP1A2基因特异表达于肝脏组织的重要调控机制。同样,人类卵磷脂胆固醇酰基转移酶(LCAT)在肝脏中高表达,Hoppe等[10]在1998年发现SP1、SP3、SP3通过相互作用,激活LCAT启动子区域的顺式作用元件,调控LCAT的表达。药物反应元件核受体PXR主要是在肝脏和小肠中表达,其表达与各种代谢紊乱失调相关。Kumari等[11]在2015年发现ETS家族成员与PAX5、LEF-1共同协同调控了PXR基因的转录调控,为研究PXR基因调控奠定了重要的基础。由这些代谢酶的相关研究进展,我们推测HPD作为代谢酶,其表达调控很可能也是通过肝脏特异转录因子的调控来实现的。
通过对HPD基因上游-600~-400区域进行生物信息学预测发现,该区域含有许多肝脏特异性表达的转录因子结合位点,如HNF1A、HNF4A、HNF3C、CEBPa、FOXP3等[12]。这些转录因子均在在肝脏中有特异性表达,尤其属于肝细胞核因子家族的HNF1A和HNF4A等在肝脏中的特异性表达已被众多研究证实[13, 14]。并且,已有许多研究报道这些转录因子在调控肝脏特异性表达中发挥着重要的调控作用。Chiang等[15]在2014年的研究中发现,在以人肝癌细胞系HepG2作为药物代谢模型的体外研究中,肝细胞核因子-1α(HNF1A)上调了细胞色素P450氧化酶重要家族成员CYP3A4药物代谢酶的活性,并且这一上调依赖于利福平、代谢硝苯地等诱导剂的剂量和诱导时间。肝细胞核因子HNF4也是细胞色素P450在肝脏中特异性表达的关键转录因子[16]。Martínez-Jiménez等[17]在2006年的研究中发现,细胞色素是以一种HNF4A介导的受过氧化物酶体共激活因子PGC1α和类固醇受体共激活因子1(SRC1)共调控的。SLC2A2主要分布于肝脏与糖代谢相关。Aline等[18]在2013年发现转录因子HNF-1α、HNF-4α和Foxa2是SLC2A2在肝脏和肾脏中特异表达的关键调控因子。Pramfalk等[19]在2014年的研究中发现,TG相互作用因子1—tgif1抑制了参与胆固醇代谢的甾醇-O-酰基转移酶2(SOAT2)的启动子活性,并且这一作用也受肝细胞核因子1α和4α的协调调控。许多研究发现,CCAAT增强子结合蛋白家族(C/EBP)转录因子参与肝脏中代谢相关基因的转录调控。Croniger等[20]早在1998年就研究发现磷酸烯醇式丙酮酸羧激酶(PEPCK)基因启动子与C/EBPβ有较高的结合,C/EBPβ是PEPCK基因在糖皮质激素依赖性条件下进行转录激活的一个重要调控因子。这一发现的重要意义就是通过C/EBPβ这一基因表达调控因子将哺乳动物的代谢疾病与基因的转录调控联系起来。Dang等[21]为研究叉头蛋白3(FOXP3)是否参与肝细胞癌(HCC)的发病机制,对309例肝癌、13例正常肝组织标本,采用实时定量PCR和测序检测等方法,并结合秩和检验和Spearman秩相关系数数据分析,比较分析了肝癌细胞和正常肝组织中FOXP3 mRNA的表达及其启动子甲基化状态的差异。此研究发现FOXP3基因在肝癌标本的表达明显高于在正常肝组织中的表达,且FOXP3 mRNA水平与其甲基化呈负相关。其结论是FOXP3的表达及它的低甲基化可能参与HCC的恶性进展过程。有研究报道,HSS基因启动子-206 ~-186区域内存在一个HNF4的负性调控元件,转录因子HNF4可以在肿瘤细胞内与该元件相互作用,从而调节该基因的转录。我们在本研究中预测到了在HPD基因启动子-600~-400区域存在着许多肝脏特异转录因子的结合位点,而且HPD的表达谱(图 1a)也证明HPD主要的表达器官是肝脏。那么,HPD的肝脏特异表达调控是否与HNF1A、HNF4A、CEBPa及FOXP3等这些已有报道与肝脏特异性表达调控相关的转录因子有关,还需要进一步的研究证明。下一步我们可以通过EMSA、CHIP等实验验证其结合位点,并通过突变结合位点检测其转录活性变化,进而明确这些转录因子对HPD的调控作用。
现代基因分子生物学研究已经进入了功能基因组时代,因此,关于组织特异性表达调控元件的研究具有重要的理论意义和实际意义,这对现代生物学的发展具有重要的推动作用。利用HPD基因启动子调控区这种调控肝脏特异性表达的特性,可以介导肝脏疾病的靶向治疗。目前,大量研究已经成功利用细胞特异启动子实现目的基因在特定组织器官中的特异表达。肝组织中的白蛋白基因和甲胎蛋白基因里有肝脏特异性转录调控序列,如启动子、增强子,能启动基因仅在肝组织表达,在基因治疗研究中得到了很好应用,为病毒性肝炎、遗传代谢疾病、肿瘤性疾病等与肝脏密切相关疾病的致病机制和基因治疗的研究奠定了基础[22]。其中程纪华等[23]在2000年研究了甲胎蛋白启动子调控表达p53基因的肝癌细胞靶向性基因治疗载体;郝萍[24]在2004年研究了甲胎蛋白启动子调控DTA基因表达对肝癌细胞靶向治疗的作用;孙强玲[25]在2002年构建了HBV启动子调控的肝细胞高表达载体并对其在肝癌基因治疗的靶向性调控中发挥的抑癌作用进行了研究。因此,探索HPD基因启动子结构及其相互作用的转录因子,不仅为继续深入探索HPD在肝脏等器官组织的特异性表达调控机制奠定研究基础,而且也为制备肝脏损伤等疾病模型,用于特异性药物的筛选和评价提供了重要的理论基础。
| [1] | Baldwin J E, Crouch N P, Fujishima Y, et al. 4-Hydroxyphenylpyruvate dioxygenase appears to display a-ketoisocaproate dioxygenase activity in ratliver. Bioorg Med Chem Lett,1995, 5(8):1255-1260. |
| [2] | Ruetschi U, Cerone R, Perez-Cerda C, et al.Mutations in the 4-hydroxyphenylpyruvate dioxygenase gene (HPD) in patients with tyrosinemia typeIII, Hum Genet, 2000,106:654-662. |
| [3] | Graham R Moran. 4-hydroxyphenylpyruvate dioxygenase. Archives of Biochemistry and Biophysics,2005,433 (11):117-128. |
| [4] | Corinne R, Matthieu G, Yohann M, et al. 4-hydroxyphenylpyruvate dioxygenase catalysis. The Journal of Biological Chemistry, 2011,286(7):26061-26070. |
| [5] | Shah D D, Conrad J A, Heinz B, et al. Evidence for the mechanism of hydroxylation by 4-hydroxyphenylpyruvatedioxygenase and hydroxymandelate synthase from intermediate partitioning in active site variants. Biochemistry,2011, 50(5):7694-7704. |
| [6] | Yasuhiko T, Kimitoshi N, Shirou M, et al.Gene expression prowles of homogentisate-treated Fah-/-Hpd-/-mice using DNA microarrays. Molecular Genetics and Metabolism,2006,89(8):203-209. |
| [7] | Wang J, Huo K K, Ma L X, et al. Toward an understanding of the protein interaction network of the human liver. Molecular Systems Biology,2011,536(11):1744-4292. |
| [8] | 于海涛.肝细胞核因子HNF-1α调控Hepassocin启动子活性的研究.北京:中国人民解放军军事医学科学院放射与辐射医学研究所,2008. Yu H T.The Research on the Promoter Activity of the Hepassocin gene Regulated by HNF-1α.Beijing:Institute of Radiation Medicine,Academy of Military Medical Science,2008. |
| [9] | Miyajima A, Furihata T, Chiba K.Functional analysis of GC Box and its CpG methylation in the regulation of CYP1A2 gene expression. Drug Metab Pharmacokinet, 2009,24(3):269-276. |
| [10] | Hoppe K L, Francone O L.Binding and functional effects of transcription factors Sp1 and Sp3 on the proximal human lecithin:cholesterol acyltransferase promoter. J Lipid Res,1998,39(5):969-977. |
| [11] | Kumari S, Saradhi M, Rana M, et al. Pregnane and xenobiotic receptor gene expression in liver cells is modulated by Ets-1 in synchrony with transcription factors Pax5, LEF-1 and c-jun. Exp Cell Res,2015,330(2):398-411. |
| [12] | 侯琳, 钱敏平, 朱云平,等. 转录因子结合位点生物信息学研究进展. Hereditas,2009, 31(4): 365-373. Hou L, Qian M P, Zhu Y P, et al. Advances on bioinformatic research in transcription factor binding sites. Hereditas, 2009, 31 (4): 365-373. |
| [13] | 齐安东, 张杰, 李磊,等.HNF-1α在肝癌组织中的表达及意义. 山东医药,2009,49(3):96-97. Qi A D, Zhang J, Li L, et al.The expression and significance of HNF-1 alpha in hepatocellular carcinoma tissue. Shandong Medical Journal, 2009,49 (3): 96-97. |
| [14] | 龙云,唐红,刘聪,等.肝细胞核因子4α和3β在人主要器官中的表达. 世界华人消化杂,2006,14(25): 2504-2509. Long Y, Tang H, Liu C, et al.Expression of hepatocyte nuclear factor 4α and 3βin human tissues. World Chinese Journal for Digestion, 2006,14 (25): 2504-2509. |
| [15] | Chiang T S, Yang K C, Chiou L L, et al. Enhancement of CYP3A4 activity in He PG2 cells by lentiviral transfection of hepatocyte nuclear factor-1alpha. Plos One,2014,9(4):94885-94895. |
| [16] | Taro E A, Frank J G. Regulation of P450 genes by liver-enriched transcription factors and nuclear receptors. Biochimica et Biophysica Acta, 2003,1619(30):223-234. |
| [17] | Martínez-Jiménez C P, Castell J V, Gómez-Lechón M J, et al.Transcriptional activation of CYP2C9, CYP1A1, and CYP1A2 by hepatocyte nuclear factor 4alpha requires coactivators peroxisomal proliferator activated receptor-gamma coactivator 1alpha and steroid receptor coactivator 1. Mol Pharmacol,2006,70(5):1681-1692. |
| [18] | Aline D S, Helayne S F, Maristela M, et al. Okamotoa,hepatocyte nuclear factors 1α/4α and forkhead box A2 regulate the solute carrier 2A2 (Slc2a2) gene expression in the liver and kidney of diabetic rats. Life Sci,2013,93(22):805-813. |
| [19] | Pramfalk C, Melhuish T A, Wotton D, et al. TG-interacting factor 1 acts as a transcriptional repressor of sterol O-acyltransferase 2. J Lipid Res,2014,55(4):709-717. |
| [20] | Croniger C,Leahy P,Reshef L, et al. C/EB Pand the control of phosphoenolpyruvate carboxykinase gene transcription in the liver.J Biol Chem,1998, 273(48):31629-31632. |
| [21] | Dang S, Chen P, Zhang B, et al.Expression and methylation status of FOXP3 in human hepatocellular carcinoma. Chinese Journal of Hepatology,2014,22(8):616-619. |
| [22] | 王亚莉,唐红.肝脏特异性转录调控序列的研究进展.生物医学工程学杂志,2009,26(2):443-447. Wang L Y,Tang H.Progress of researches on liver-specific transcriptional regulatory sequence.Journal of Biomedical Engineering,2009,26(2):443-447. |
| [23] | 程纪华,冷希圣,彭吉润,等.甲胎蛋白启动子调控表达p53 基因的肝癌细胞靶向性基因治疗载体的研究.中华医学杂志,2000, 80(6):461-463. Cheng J H,Leng X S,Peng J R,et al.Construction of a hepatoma-targeting vector of adeno-associated virus containing human a-fetoprotein promoter and wild p53 gene in gene therapy of liver cancer.Chinese Medical Journal,2000, 80(6):461-463. |
| [24] | 郝萍. 甲胎蛋白启动子调控DTA基因表达对肝癌细胞靶向治疗的实验研究.重庆:第三军医大学新桥医院肿瘤中心,2004. Hao P.Gene Therapy for Hepatoma Cells Using Diphtheria ToxinA under the Control of Promoter of the Human a-feto Portein Gene.Chongqing:Xinqiao Hospital Cancer Center,Third Military Medical University,2004. |
| [25] | 孙强玲.HBV启动子调控的肝细胞高表达载体构建及抑癌作用研究.北京:中国人民解放军军事医学科学院放射与辐射医学研究所,2002. Sun Q L.Construction of Hepatocyte High Expression System of Vectors Driven by HBV Gene Promoter and Study of Anticancer Effct.Beijing:Institute of Radiation Medicine,Academy of Military Medical Science,2002. |
 2015, Vol. 35
2015, Vol. 35




