文章信息
- 张银川, 刘萌萌, 张雅婷, 桂芳, 张爱华, 闭兰, 潘勇兵
- ZHANG Yin-chuan, LIU Meng-meng, ZHANG Ya-ting, GUI Fang, ZHANG Ai-hua, BI Lan, PAN Yong-bin
- 表达全人源抗人IgE单抗的细胞株构建及筛选
- Construction and Screening of Recombinant Cell Line Expressing Fully-human mAbs against Human IgE
- 中国生物工程杂志, 2015, 35(3): 66-74
- China Biotechnology, 2015, 35(3): 66-74
- http://dx.doi.org/10.13523/j.cb.20150310
-
文章历史
- 收稿日期:2015-01-12
- 修回日期:2015-01-28
2. 中国生物技术股份有限公司科研与国际合作部 北京 100029
2. Department of Research and International Cooperation, China National Biotec Group, Beijing 100029, China
IgE介导多种Ⅰ 型超敏反应[1]。目前国外上市的针对IgE的特异性生物制剂主要是人源化的IgG1κ型抗体药物Omalizumab(商品名Xolair®),获批的临床适应症为6岁以上儿童及成年人严重的持续性哮喘以及12岁以上儿童及成年人慢性自发性荨麻疹的辅助治疗,多年的临床应用表明Omalizumab耐受性良好,安全、有效[EDA.Drugs@FDA:Xolair(Omalizumab);EMA.Human medicines:Xolair(Omalizumab)][2, 3]。然而目前Omalizumab尚未获准在我国上市销售,国内哮喘、特发性荨麻疹等患者无特异性好、疗效确切的抗IgE单抗药物可用。即使在可预见的Omalizumab在国内上市的将来,也会因其为市场垄断产品,必然存在价格高昂,于我国患者来说临床可及性极差、使用率低等壁垒。因此,我国急需自主开发安全、有效、价格合理、临床可及的抗IgE单抗药物。全人源抗体药物由于完全为人源蛋白质组分,理论上具有更低的免疫原性和更好的安全性[4]。目前全球尚无全人源抗人IgE单抗进入临床阶段的开发或上市[5]https://clinicaltrials.gov/。因此,全人源抗人IgE单抗药物的开发具有重要的科学价值及社会意义。本研究在项目合作单位成都生物制品研究所有限责任公司采用核糖体展示技术筛选到的一株全人源抗人IgE单链抗体(scFv)的研究基础上[6, 7],鉴于单链抗体为25kDa的小分子抗体片段,分子量低于人体肾脏滤过/清除的分子量cut off值65kDa[8],存在亲和力相对偏低、半衰期短、需频繁给药等缺点,不适于作为哮喘等Ⅰ 型超敏反应性疾病的抗体药物形式。因此,本研究对原创性全人源抗人IgE scFv进行了全长抗体的改构研究,以期获得具有进一步开发价值的候选工程细胞株。 1 材料与方法 1.1 质粒、菌株、培养基和细胞
含有全人源抗人IgE scFv的模板质粒由成都生物制品研究所提供。含有人IgG1重链恒定区基因的模板质粒,人κ轻链恒定区基因的模板质粒,pMH3表达载体,pCApuro表达载体,CHO-S细胞,B001基础培养基,F001流加培养基由杭州安瑞普生物制品研究有限公司提供。pMD19-T sample载体购自TaKaRa公司。DH5α受体菌购自天根生化科技有限公司。DMEM/F12培养基购自GIBCO公司。 1.2 主要试剂
Ex Taq® Hot Start Version购自TaKaRa公司。限制性内切酶EcoR I、Not I和PVUI,LigaFastTM Rapid DNA Ligation System购自Fermentas公司。QIAquick® Gel Extraction Kit,QIAprep® Spin Miniprep Kit购自QIAGEN公司。G418购自GIBCO公司。人源化抗IL-12单抗浓度参考品,由杭州安瑞普生物制品研究有限公司提供。HRP标记的山羊抗人IgG(Fc specific)购自American Qualex公司。糖含量测定试剂盒购自Applygen公司。1ml protein A层析预装柱购自GE公司。重组人IgE购自Abcam公司。重组人FcεRI购自Sino Biological公司。Dip and ReadTM Anti-hIgG Fc Capture (AHC) Biosensors购自ForteBio公司。 1.3 引 物
用于扩增VH、CH、VL、CL基因及overlap拼接H链和L链的引物序列如表 1。其中VH3′和 CH5′含30bp重叠序列,VL3′和CL5′含30bp重叠序列(表中以 标出)。所有引物均委托南京金斯瑞生物科技公司合成。
标出)。所有引物均委托南京金斯瑞生物科技公司合成。
| 引物 | 序列(5′-3′) | 酶切位点 |
| VH5′ (含信号肽序列) | CCGGAATTCCACCATGGAGAAAGACACACTCCTGCTATGGGTACTGCTGCTCTGGGTTCCAGG TTCCACTGGTGAGGTGCAGCTGGTGCAGTC | EcoR I |
| VH3′ | 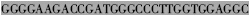 TGAGGAGACGGTGACCAGGG TGAGGAGACGGTGACCAGGG
| |
| CH5′ | 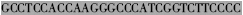
| |
| CH3′ | TTTTCCTTTTGCGGCCGCTTATCATTTACCCGGAGACAGGGAGAG | Not I |
| VL5′ (含信号肽序列) | CCGGAATTCCACCATGGAGAAAGACACACTCCTGCTATGGGTACTGCTGCTCTGGGTTCCA GGTTCCACTGGTGACATTATGATGACCCAGTC | EcoR I |
| VL3′ | 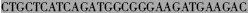 AGATGGTGCAGCCACAGTTC AGATGGTGCAGCCACAGTTC
| |
| CL5′ | 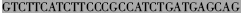
| |
| CL3′ | TTTTCCTTTTGCGGCCGCTTATCAACACTCTCCCCTGTTGAAGCT | Not I |
从含有全人源抗人IgE scFv的模板质粒PCR扩增VH、VL基因,分别从含有人IgG1重链恒定区基因和含人κ轻链恒定区基因的模板质粒PCR扩增CH、CL基因,采用overlap PCR方法分别拼接成全长抗体的重链H链(VH-CH)及轻链L链(VL-CL)基因,分别将H链及L链基因克隆入pMD19-T sample载体,PCR、EcoRⅠ 和NotⅠ 双酶切以及核苷酸测序验证拼接的H链及L链基因的正确性。 1.5 重组表达质粒的构建及鉴定
采用EcoRⅠ 和NotⅠ 核酸内切酶分别酶切pMD19T-H、pMD19T-L以及pMH3、pCApuro表达载体,QIAquick Gel Extraction Kit纯化回收目的基因H链、L链以及表达载体片段,连接分别构建pMH3-H、pMH3-L、pCApuro-H及pCApuro-L四种重组表达质粒,转化DH5α受体菌,QIAprep Spin Miniprep Kit试剂盒提取质粒进行PCR、EcoRⅠ 和NotⅠ 双酶切以及核苷酸测序鉴定。 1.6 重组表达质粒共转染CHO-S细胞及Dot-blot筛选克隆
用PVUⅠ 限制性内切酶线性化处理pMH3-H、pMH3-L、pCApuro-H和pCApuro-L质粒,采用电穿孔方法将上述四种线性化的重组表达质粒共转染CHO-S细胞,然后细胞置平皿中培养,G418加压筛选。一次电转化分别进行培养皿→96孔细胞培养板→24孔细胞培养板→培养皿→96孔细胞培养板→24孔细胞培养板的两轮亚克隆筛选,以HRP标记的山羊抗人IgG(Fc specific)采用化学发光Dot-blot法对细胞克隆的抗体表达量进行监测,平行设置已知浓度的人源化抗IL-12单抗作为浓度参考品。 1.7 克隆的悬浮驯化及40ml摇瓶批次培养
每一次电转染挑取经两轮亚克隆筛选后表达量较高的6个克隆,转入T75培养瓶,序贯经含10%FBS的CHO-S细胞贴壁培养基DMEM/F12及CHO-S细胞无血清悬浮基础培养基B001进行无血清悬浮驯化。完成驯化后液氮冻存原始种子,并将此24个细胞克隆转入40ml摇瓶用B001培养基37℃,5%CO2,120r/min摇床振荡进行批次培养。每天进行细胞计数、细胞活率监测及采用测糖试剂盒进行糖浓度检测。当葡萄糖浓度低于2g/L时,补加葡萄糖。待细胞活率低于80%时,结束批次培养,离心收集上清。采用1ml Protein A亲和层析柱小量纯化样品,紫外分光光度法测定蛋白浓度,推算批次培养上清的抗体表达量。 1.8 克隆的40ml摇瓶及3L摇瓶的流加培养
据40ml摇瓶批次培养结果选取抗体表达量最高及细胞生长代谢较好的2个候选克隆进行40ml摇瓶及3L摇瓶的流加培养。以4×106cells/ml的密度分别接种2株候选克隆细胞30ml于40ml摇瓶中或600ml于3L摇瓶中,置37℃ 恒温摇床培养,转速120r/min,基础培养基为B001,按总体积的3%每天补加F001流加培养基,每天检测培养液中葡萄糖浓度,并补加葡萄糖浓缩液,保持培养液中葡萄糖浓度在3g/L以上,每天监测细胞密度和细胞活率,并取上清通过ELISA法检测抗体表达量。待细胞活率低于80%时,结束流加培养,离心收取上清。收集的上清采用0.2μm滤膜过滤及Protein A亲和层析柱一步纯化,纯化的样品分装保存于-20℃用于后续的鉴定研究。 1.9 表达抗体的结合活性(亲和力)鉴定
以Fortebio公司Octet RED384仪器采用生物膜光干涉技术检测亲和力。以抗人IgG-Fc传感器分别捕获两株候选单抗,浓度均为20 μg/ml,然后与不同浓度的商购重组人IgE进行结合和解离,通过曲线拟合计算各浓度下的Kon和Kdis,计算平衡解离常数(KD),KD=Kdis(1/M)∶Kon(1/[Ms])。 1.10 改造后全抗体与改造前scFv生物学活性比较
选取亲和力相对较低的候选单抗,以GE公司Biacore 3000分子相互作用仪对改构后的全长抗体与改构前其母本scFv的亲和力及中和活性进行了比较研究。以氨基偶联的方式将商购的重组人IgE(rhIgE)连接到CM5芯片上,一系列梯度稀释的候选全长单抗或scFv分别与CM5芯片上偶联的rhIgE反应,计算亲和力,实验设置rhIgE与商购的重组人FcεRI亲和力对照。将候选全长单抗稀释为500nmol/L、166.7nmol/L、55.6nmol/L、18.5nmol/L、6.2nmol/L、2.1nmol/L、0.7nmol/L、0.23nmol/L和0.08nmol/L的9个浓度梯度,将scFv稀释为500nmol/L、166.7nmol/L、55.6nmol/L、18.5nmol/L、6.2nmol/L和2.1nmol/L的7个浓度梯度,不同浓度的候选全长单抗和scFv分别与1.5μg/ml(8nmol/L)的rhIgE在37℃孵育30min。然后将混合物与连接有FcεRI-α的CM5芯片反应,将1.5μg/ml(8nmol/L)hIgE直接与FcεRI-α的CM5芯片反应作为对照,测得共振单位(resonance unit,RU)值,用候选全长单抗或scFv的浓度与抑制率拟合曲线,计算EC50和EC90。 2 结 果 2.1 VH、CH、VL、CL基因克隆及全长H链及L链基因拼接
成功克隆预期片段大小分别为480bp、1 000bp、465bp、275bp的VH、CH、VL、CL目的基因(图 1)。采用一步overlap PCR成功拼接获得预期片段大小分别为1480bp和740bp的H链(VH-CH)及L链(VL-CL)基因(图 1)。PCR、双酶切及核苷酸测序结果表明拼接的H链及L链基因完全正确。
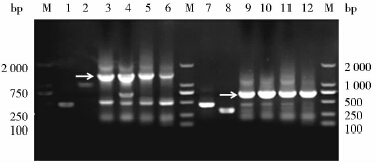
|
| 图 1 基因克隆及H链和L链基因拼接 Fig. 1 Cloned VH,CH,VL,CL genes and H chain,L chain genes assembly by overlap PCR 1:VH;2:CH;3,4,5,6: H chain(VH-CH);7:VL;8:CL;9~12:L chain(VL-CL);M:DL2000 Marker |
成功构建pMH3-H、pMH3-L、pCApuro-H、pCApuro-L四种重组真核表达质粒,EcoRⅠ和NotⅠ双酶切鉴定结果如图 2,分别在pMH3(8 453bp)、pCApuro(6 444bp)载体片段和目的基因H(1 480bp)、L(740bp)链预期大小位置出现了酶切条带。核苷酸测序结果表明重组表达质粒中插入的目的基因H链及L链序列正确。
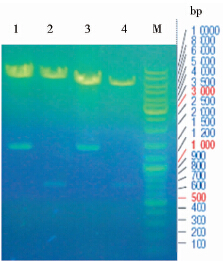
|
| 图 2 重组表达质粒的双酶切鉴定 Fig. 2 EcoRⅠand NotⅠdigestion of recombinant expression plasmids 1:pMH3-H; 2:pMH3-L;3:pCApuro-H;4:pCApuro-L;M:DNA ladder |
共进行了4次电转染8轮有效筛选,第一次和第二次电转染轻、重链的质量比为1∶2,第三次和第四次电转染轻、重链的质量比为1∶1,电转质粒的总质量均为20μg。每一次电转染挑选出抗体表达量较高的6个克隆进入后续悬浮驯化及40ml摇瓶批次培养筛选。例举一次电转染的两轮亚克隆Dot-blot结果如图 3(□表示挑取的克隆)。

|
| 图 3 克隆的Dot Blot检测结果 Fig. 3 Titer of clones determined by Dot-blot (A)(B) The first round subcloning(96-well plate) (C) The first round subcloning(24-well plate) (D)(E) The second round subcloning(96-well plate) (F) The second round subcloning(two 24-well plates) |
四次电转染共挑取的24个候选克隆无血清悬浮驯化后经40ml摇瓶7天批次培养的培养上清抗体表达量如图 4所示。第一、二、三、四次电转克隆的最高表达量分别为83.7mg/L(1G1D3)、68.6mg/L(1B5F10)、174.9mg/L(2F4A8)及194.5mg/L(2B9A6)。选取抗体表达量及细胞生长代谢较好的2个克隆,分别命名为Mab1#和Mab2#,进行进一步的筛选研究。
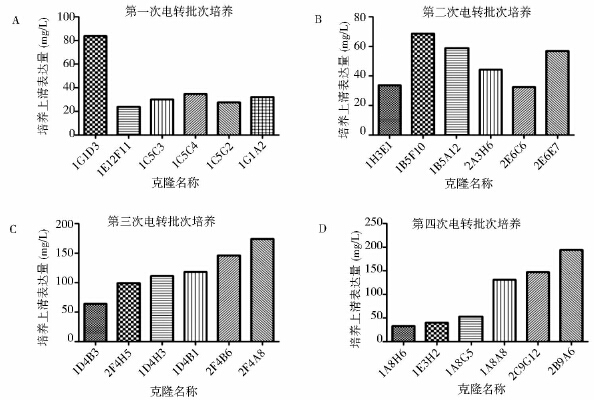
|
| 图 4 24个候选克隆40ml摇瓶批次培养抗体表达量 Fig. 4 Volumetric productivity of 24 clone candidates in batch culture(40ml shaker flasks) |
Mab1#和Mab2#分别进行了3个和4个40ml摇瓶流加培养,2株克隆的抗体平均表达量分别为469.8mg/L和476.5mg/L(图 5)。各进行的1个3L摇瓶流加培养结果显示Mab1#和Mab2#克隆的抗体体积产量分别达到470.1mg/L和499.5mg/L;两者的最大细胞密度均能达到9.1×106 cells/ml,但细胞密度增长速率不同,Mab1#株第4天达到最大细胞密度,而Mab2#株第5天达到;Mab1#在细胞活率方面略优于Mab2#(图 5)。
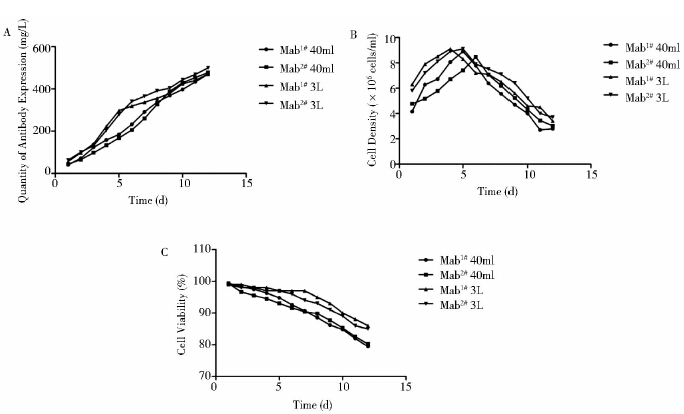
|
| 图 5 2个候选克隆流加培养结果(40ml及3L摇瓶) Fig. 5 Fed-batch culture of two clone candidates in 40ml or 3L shaker flasks |
采用生物膜光干涉技术(BLI)测得Mab1#和Mab2#两株单抗的亲和力分别为8.94×10-9 M和5.38×10-9 M(图 6),即均为nM级。与现有唯一上市的抗人IgE单抗Omalizumab的亲和力相当[9, 10, 11]。
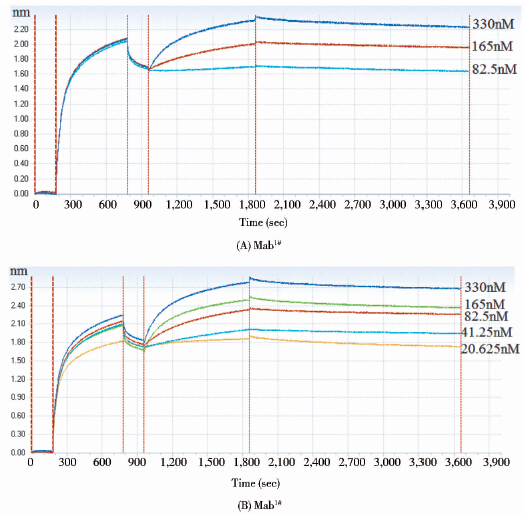
|
| 图 6 2株候选单抗与重组人IgE的动态结合和解离曲线 Fig. 6 Kinetic curves of two candidates associated and dissociated with recombinant human IgE |
表面等离子共振技术(SPR)亲和力检测结果显示,Mab1#全长单抗、母本scFv以及商购的重组人FcεRI与商购的重组人IgE的亲和力分别为8.6nM、37nM以及0.42 nM(图 7)。采用生物膜光干涉技术(BLI)及表面等离子共振技术(SPR)测得的Mab1#全长单抗的亲和力分别为8.94nM和8.6nM(参见图 6及图 7),结果具有较好的一致性。中和活性检测结果显示Mab1#全长单抗的EC50为3nM,EC90为9nM;母本scFv的EC50为71nM,EC90为372nM(图 8)。改造后的Mab1#株全长抗体较改造前的scFv母本单链抗体的亲和力提高4.3倍,中和活性(EC50)提高了23.7倍,中和活性(EC90)提高了41.3倍。
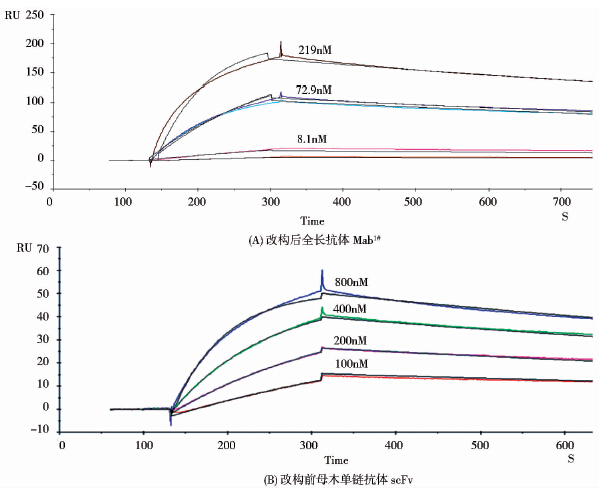
|
| 图 7 改构前后抗体与rhIgE的动态结合和解离曲线 Fig. 7 Kinetic curves of antibodies associated and dissociated with hIgE |
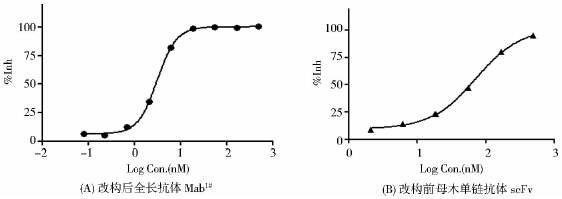
|
| 图 8 改构前后抗体抑制rhIgE与FcεRI结合的量效关系曲线 Fig. 8 The concentration-response relationship curve of antibodies inhibiting rhIgE combined to FcεRI |
重组工程细胞及其细胞库系统使生产用种子细胞具有共同的始祖细胞、保持相同的遗传和生物学特征,是实现重组基因工程产品持续生产、保持产品质量一致性的前提和基础,在基因工程产品的产业化开发过程中具有非常重要的地位。因此本研究在合作单位采用核糖体展示技术筛选到的具有自主知识产权的原创性全人源抗人IgE单链抗体基因基础上[6, 7],鉴于单链抗体存在亲和力相对偏低、半衰期短、需频繁给药等缺点,展开了高效表达全人源抗人IgE全长单抗的重组工程细胞株的构建及筛选研究。采用一步overlap PCR技术对单链抗体基因进行了全长抗体改构的设计、拼接与鉴定,核苷酸测序结果表明成功获得了与预期理论序列完全一致的目的基因序列,即全长的IgG1κ型H链及κ链基因。
研究采用杭州安瑞普生物制品研究有限公司的专利高效表达载体 pMH3和pCApuro[12]。在重组表达质 粒转染CHO宿主细胞的构建中,对重链重组质粒和轻链重组质粒的转染比例进行了摸索,分别以2∶1和1∶1的比例(质量比)电转染CHO-S细胞,筛选结果显示,重/轻链以1∶1的质量比能筛选到表达量更高的克隆,与一些文献报道结果一致[13, 14],即限定重链的比重而加大轻链的比重更有利于重轻链的装配,提高分泌到胞外的抗体水平。
在克隆筛选阶段采用了以Dot-blot法检测细胞孔板24h表达量的快速规模克隆筛选技术。结果显示每次电转染经过一次克隆和二次克隆的两轮筛选,克隆的纯度在迅速增加,能有效实现获得单个克隆的筛选目标。同时,随着选择压力和筛选轮次的增加,Dot-blot监测到的目标抗体表达量在不断地提高。经过4次电转染和8轮亚克隆筛选,挑取了表达量较高的24个克隆进行无血清悬浮培养驯化及40ml摇瓶的批次培养,据抗体表达量及细胞生长代谢情况选取Mab1#和Mab2#两株候选克隆进行进一步的40ml摇瓶及3L摇瓶的流加培养研究。结果两株候选克隆在批次培养中的体积产量均接近0.5g/L,达到了制定的阶段筛选目标。
为了判定全抗体改造是否成功,研究采用生物膜光干涉技术对2株候选克隆表达抗体的亲和力进行了测定,结果Mab1#株和Mab2#株的亲和力分别为8.94nM和5.38nM,同目前全球唯一上市的抗IgE单抗奥马株亲和力相当(EMA注册资料显示据检测实验的不同奥马株亲和力位于0.02nM~ 7.7nM之间[11];钱卫珠等[10]采用SPR技术测得奥马株的亲和力为23.8nM,文献报道亲和力为26nM)。研究选取了其中亲和力稍低的Mab1#株全长抗体,采用SPR技术对其与改造前的母本单链抗体的亲和力及中和活性进行了“头对头”的比较学研究。结果Mab1#株全长单抗的亲和力为8.6nM,与采用生物膜光干涉技术测得的亲和力结果具有较好的一致性。Mab1 株全长单抗抑制hIgE与FcεRI结合的EC50为3nM,EC90为9nM。改造后的全长抗体Mab1#株较改造前的其母本单链抗体亲和力提高了4.3倍,中和活性(EC50)提高了23.7倍,中和活性(EC90)提高了41.3倍。
综上可见,本研究成功将表达原创性全人源抗人IgE的单链抗体(约25kDa)改造为亲和力及中和活性均大幅提升的全长抗体(约150kDa),确定了表达全人源抗人IgE单克隆抗体的原创性基因序列,成功获得2个候选细胞株,待接续进行进一步的筛选鉴定研究。
致谢 感谢成都生物制品研究所有限责任公司王明蓉教授及杭州安瑞普生物制品研究有限公司对本研究提供的帮助。
| [1] | 周光炎. 免疫学原理.上海:上海科技出版社, 2007. 229-239. Zhou G Y. Principles of Immunology. Shanghai: Shanghai Sciences Press, 2007. 229-239. |
| [2] | Kopp M V. Omalizumab: Anti-IgE therapy in allergy. Curr Allergy Asthma Rep, 2011,11(2):101-106. |
| [3] | Wu K C,Jabbar-Lopez Z K. Omalizumab, an anti-IgE mAb, receives approval for the treatment of chronic idiopathic/spontaneous urticaria. J Invest Dermatol, 2015, 135(1):13-15. |
| [4] | Nelson A L,Dhimolea E,Reichert J M. Development trends for human monoclonal antibody therapeutics. Nat Rev Drug Discov, 2010,9(10):767-774. |
| [5] | Polosa R,Casale T. Monoclonal antibodies for chronic refractory asthma and pipeline developments. Drug Discov Today, 2012,17(11-12):591-599. |
| [6] | Wang M R, Zhang Y X, Du T F,et al. Bacterial expression and characterization of a novel human anti-IgE scFv fragment. MAbs, 2011,3(5):495-499. |
| [7] | 王明蓉,张勇侠,高 强,等. 全人源重组抗-IgE抗体.中国专利, CN:200810032639.2. 2008-07-30. Wang M R,Zhang Y X,Gao Q,et al. Fully human recombinant anti-IgE antibody.China Patent, CN:200810032639.2. 2008-07-30. |
| [8] | Weisser N E, Hall J C. Applications of single-chain variable fragment antibodies in therapeutics and diagnostics. Biotechnology Advances, 2009,27(4): 502-520. |
| [9] | 钱卫珠. 新型抗IgE人源化单克隆抗体的结构与功能研究. 上海:第二军医大学,肿瘤研究所,2011. Qiang W Z. Development and characterization of a novel anti-IgE monoclonal antibody. Shanghai:Second Military Medical University, Cancer Research Institute,2011. |
| [10] | Putnam W S, Li J, Haggstrom J, et al. Use of quantitative pharmacology in the development of HAE1, a high-affinity anti-IgE monoclonal antibody. AAPS J, 2008,10(2):425-430. |
| [11] | EMEA Xolair: EPAR-Scientific Discussion. .http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Scientific_Discussion/human/000606/WC500057295.pdf. |
| [12] | Hui M Z. Use of chick beta actin gene intron-1. International Patent, WO/2008/091276. 2008-07-31. |
| [13] | Schlatter S, Stansfield S H, Dinnis D M, et al. On the optimal ratio of heavy to light chain genes for efficient recombinant antibody production by CHO cells. Biotechnology Progress, 2005,21(1): 122-133. |
| [14] | Ho S C, Bardor M, Li B, et al. Comparison of internal ribosome entry site (IRES) and Furin-2A (F2A) for monoclonal antibody expression level and quality in CHO cells. PLoS One, 2013,8(5): e63247. |
 2015, Vol. 35
2015, Vol. 35




