文章信息
- 钱鑫, 郭红颜, 周庆峰
- QIAN Xin, GUO Hong-yan, ZHOU Qing-feng
- 4-羟基苯乙酸-3-羟化酶A重组表达菌株的构建及其对羟基酪醇的生物转化研究
- Construction of 4-Hydroxyphenylacetate-3-hydroxylase A Expression Strain and Its Biotransformation Effect on Hydroxytyrosol
- 中国生物工程杂志, 2015, 35(3): 56-60
- China Biotechnology, 2015, 35(3): 56-60
- http://dx.doi.org/10.13523/j.cb.20150308
-
文章历史
- 收稿日期:2014-12-22
- 修回日期:2015-01-12
2. 上海医药工业研究院 上海 200040;
3. 商丘师范学院生命科学学院 商丘 476000
2. Shanghai Institute of Pharmaceutical Industry, Shanghai 200040, China;
3. Institution of Lifescience, Shangqiu Normal University, Shangqiu 476000, China
羟基酪醇(hydroxytyrosol,HT)化学名为3,4-二羟基苯乙醇,是一种具有强抗氧化活性的天然多酚类化合物,主要以酯化物橄榄苦苷的形式存在于橄榄的果实和枝叶中。橄榄苦苷经水解后得到HT单体。HT结构简单、分子质量小,具有很多有益于人体健康的生物药理活性,因此逐渐受到生物和医学界的重视,成为近年来研究的热点[1, 2]。
目前,羟基酪醇的获得方法主要包括生物提取法和化学合成法。生物提取法主要采用橄榄的各个部位或制备橄榄油过程中产生的残渣和废水提取和分离羟基酪醇,但该技术制备成本高,难以大规模使用[3, 4]。化学合成法是以 3,4-二羟基苯乙酸和酪醇为原料化学合成羟基酪醇,但是生产过程中催化剂价格昂贵且污染严重,因此也不是最佳制备手段[5, 6]。生物转化是指利用微生物细胞所含酶系对外源化合物进行结构修饰和改造而获得所需要的目的产物的生理生化反应。主要涉及羟基化、环氧化、脱氢、加氢、水解等各类化学反应,具有成本低、效率高和污染小等诸多优点,广泛应用于天然化合物的生物合成、药用成分筛选及新药开发等领域[7]。4-羟基苯乙酸-3-羟化酶A(HHA)就是一种可以将酪醇进行结构修饰和改造成羟基酪醇的关键酶,主要通过羟基化的化学反应进行底物的改造[8]。因此,本研究首先从BL21(DE3)中扩增到HHA基因序列,进一步酶切后连接到pET28a载体中,将获得的重组表达载体pET28a-HHA转化到BL21(DE3)获得重组工程菌,经IPTG诱导表达后添加底物酪醇,利用重组菌转化生产羟基酪醇,最终获得一条制备羟基酪醇的生物转化技术途径。 1 材料与方法 1.1 材 料 1.1.1 菌株与质粒
大肠杆菌BL21(DE3)和pET28a载体均由河南农业大学生命科学学院分子生物学实验室提供。 1.1.2 工具酶与试剂(盒)T4DNA连接酶、dNTP、限制性内切核酸酶NcoI、HindⅢ的购买、引物合成和DNA测序均来自于上海生工生物工程股份有限公司;Taq DNA聚合酶、IPTG、卡那霉素、柱式质粒小量抽提试剂盒、柱式DNA胶回收试剂盒及柱式PCR产物纯化试剂盒购自北京康为世纪生物科技有限公司产品;羟基酪醇标准品购自上海翰思化工有限公司;其他试剂均为国产分析纯或进口试剂。 1.2 实验方法 1.2.1 HHA基因PCR扩增
根据NCBI数据库中大肠杆菌BL21(DE3)中的HHA序列设计引物,引物序列如下:Primer1为5′- GGGCCATGGGATTAATACTGTAGAGGTCGACATGAAACCAG-3′,下划线为NcoⅠ位点,Primer2为5′-TTTAAGCTTCGACGAATGCGTGAAGGGGC -3′,下划线为Hind Ⅲ位点。选择大肠杆菌BL21(DE3)为DNA模板。
反应条件:95℃预变性10min;94℃变性30s,60℃复性30s,72℃延伸2min,35个循环;72℃再延伸10min。
反应结束后采用1%的琼脂糖凝胶进行电泳鉴定,以标准核酸分子为对照;PCR产物按PCR产物纯化试剂盒说明书所述方法进行回收。 1.2.2 重组质粒的构建
pET28a-HHA的构建 利用NcoⅠ和Hind Ⅲ限制性内切核酸酶对质粒pET28a进行双酶切,用DNA胶回收试剂盒割胶回收线性载体片段。
将PCR扩增产物与线性载体片段用T4DNA连接酶在16℃环境下连接过夜,连接产物导入大肠杆菌感受态细胞DH5α,涂布在含卡那霉素(50μg/ml)的LB平板上。挑取单菌落至LB液体培养基(含卡那霉素50μg/ml)中,37℃、220r/min振荡培养过夜,重组子进行菌液PCR和NcoⅠ/Hind Ⅲ双酶切鉴定,阳性重组质粒由生工生物工程(上海)股份有限公司完成测序。
1.2.3 重组蛋白HHA在大肠杆菌中的表达
重组质粒转入感受态细胞大肠杆菌BL21(DE3)中,涂布在LB平板(含50μg/ml卡那霉素)上。重组子的鉴定同1.2.2 。挑取菌落BL21(DE3)(pET28a-HHA)接种于LB液体培养液(含50μg/ml卡那霉素)。37℃下220r/min振荡培养至A600nm=0.7,添加IPTG至0.5mmol/L,继续培养3h后,离心收集菌体,磷酸盐缓冲液(pH=0.7) 洗涤两次后,用等体积超纯水重悬菌体,取100μl菌液,加入20μl 5×上样缓冲液,沸水浴加热5min后,取10μl进行SDS-PAGE蛋白质电泳分析。对照组为含有pET28a的空质粒的重组菌。 1.2.4 重组大肠杆菌生物合成羟基酪醇
重复1.2.3 的方法将诱导后的重组菌离心收集菌体,用磷酸盐缓冲液(pH=7)洗涤两次,再用等体积的磷酸盐缓冲液(pH=7)重悬菌体,制备成转化所用的静息细胞。
将适量底物酪醇(15mmol/L)加入静息细胞转化液,置于37℃环境下220r/min转化24h[9]。生物合成途径如图 1所示。
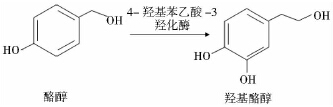
|
| 图 1羟基酪醇生物合成途径 Fig. 1 Biosynthetic pathway of hydroxytyrosol |
将转化所得反应液在2 500g离心力下离心并去除菌体,保留所得的反应液用0.22μm尼龙针头过滤器除菌过滤。将上述所得反应液用乙酸乙酯溶解后进行萃取,去除水相并保留有机相。将所得溶液用旋转蒸发仪浓缩,浓缩条件:低温循环泵温度-5℃,旋转蒸发器温度25℃,循环水式真空泵真空度0.085MPa。用微量进样器取所得浓缩后的样液在薄层色谱版上进行点样。原料酪醇和羟基酪醇标准品为对照组。将点了样的薄层板放在有展开剂的展开槽中,通过毛细管作用展开,展开后的薄层板经过干燥后,用紫外线照射检出斑点。 1.2.6 气相色谱-质谱联用仪(GC-MS)定性分析
选择除菌过滤后的反应液为待测样品。色谱条件:色谱柱型号:毛细管DB-5;载气系统:氦气;起始温度为60℃,维持5min,以每分钟30℃的速率升至270℃,维持5min;进样口温度为250℃,离子源温度为220℃,传输线温度为270℃。质谱条件为:离子源和四级杆温度为170℃;电子电离能量:70e;质谱数据采集范围:m/z 30~450。 2 结果与分析 2.1 重组质粒的构建与目的基因的表达 2.1.1 HHA基因PCR扩增结果
以大肠杆菌BL21(DE3)为DNA模板,经PCR扩增,扩增产物经质量分数1%琼脂糖凝胶电泳分析,如图 2所示,得到一条大约为2 100bp的DNA条带,与理论值(2 141bp)相符。
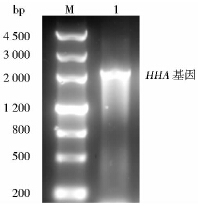
|
| 图 2 4-羟基苯乙酸-3-羟化酶(HHA)基因的PCR扩增产物 Fig. 2 PCR amplified products of 4-hydroxyphenylacetate-3-hydroxylase (HHA) gene M:DNA marker;1:PCR amplified products |
以含重组质粒pET28a-HHA的大肠杆菌BL21(DE3)为DNA模板,进行菌液PCR,PCR产物经1%的琼脂糖凝胶电泳分析,结果如图 3所示,泳道3出现与HHA基因片段大小一致的DNA特异性条带,经阴性对照(泳道1)表明,在没有模板的情况下没有特异性目的片段出现。抽提含有目的基因的质粒,进行NcoⅠ和Hind Ⅲ双酶切鉴定,如图 3所示,泳道2在约5 300bp处出现一条与空质粒大小相似的条带,而另外两条条带大小相加即为目的基因片段大小,因为目的片段中含有NcoⅠ位点。选择NcoⅠ为酶切位点是为了保持目的片段的天然完整性。测序结果与GenBank中的HHA序列完全一致,即成功构建了重组质粒pET28a-HHA。
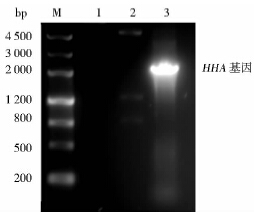
|
| 图 3 重组质粒的鉴定 Fig. 3 Identification of the recombinant plasmid M:DNA marker;1:Negative control; 2:The result of double digestion;3:Target gene |
SDS-PAGE电泳结果(图 4)显示:含有重组质粒pET28a-HHA的重组菌(泳道1、2、3)经IPTG诱导在约58.8kDa和18.5kDa处产生两条明显的蛋白质电泳带,与预计的重组蛋白大小相符,这正是目的蛋白的两个亚基。表明HHA基因在宿主大肠杆菌BL21(DE3)中得到有效表达。含空载体的菌株(泳道4)并没有目的蛋白。
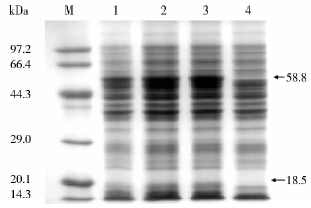
|
| 图 4 重组菌 E.coli(pET28a-HHA) 蛋白表达SDS-PAGE分析 Fig. 4 SDS-PAGE analysis for recombinant E. coli pET28a-HHA M:Protein marker;1,2,3:The expression protein of recombinant E. coli (pET28a-HHA);4:E.coli BL21(DE3)(pET 28a) |
在作者构建的重组菌参加催化作用的反应液里生成了目的产物羟基酪醇(图 5a),用包含空质粒的阴性对照与原料反应,则反应结果中不含有羟基酪醇(图 5b),说明只有加入酪醇的重组菌才会生成羟基酪醇。质谱结果如图 6所示。

|
| 图 5 重组菌 E.coli(pET28a-HHA) 蛋白表达SDS-PAGE分析 Fig. 5 SDS-PAGE analysis for recombinant E. coli pET28a-HHA (a) 1:Ttyrosol;2:Product of biological transformation (Recombinant strain);3:Standard hydroxytyrosol (b) 1:Ttyrosol;2:Product of biological transformation(regative control);3:Standard hydroxytyrosol |

|
| 图 6 质谱图 Fig. 6 Mass spectrogram |
气相色谱检测结果(图 7)显示:图 7(b)中反应液里的酪醇和羟基酪醇的保留时间与图 7(a)中酪醇的保留时间和图 7(c)中羟基酪醇的保留时间一致,分别为11min和12.20min。说明在E.coli BL21(DE3)(pET28a-HHA) 工程菌参与催化反应的反应液里成功将酪醇转化生成了羟基酪醇,而反应不够彻底以至于反应液里仍有酪醇存在。MS质谱检测经搜库后发现匹配结果为羟基酪醇(hydroxytyrosol,HT)。

|
| 图 7 气相色谱图 Fig. 7 Gas chromatogram (a) Ttyrosol (b) Product of biological transformation (c) Standard hydroxytyrosol |
羟基酪醇具有抗癌、抗菌、抗炎、抗糖尿病等多种生物和药理活性,因此具有极大的市场需求[10]。生物转化法是将微生物细胞发酵培养一定时间,离心后收集菌体制备成静息细胞,然后将静息细胞悬浮于含有底物的缓冲液中进行生物转化。该方法具有防止生长细胞对产物降解、产物处理方便、培养基成分污染小等诸多优点,因而逐渐成为微生物转化生产中的一种重要技术方式[11, 12, 13]。作者充分利用大肠杆菌细胞发酵培养和制备静息细胞上操作的方便及生物转化污染小的 优点。酪醇价格相对低廉,因此是制备羟基酪醇的理想原料,4-羟基苯乙酸-3-羟化酶是一种加氧酶,能有效利用氧分子催化形成氢氧化物,是酪醇催化生成羟基酪醇的关键酶,由于该酶价格昂贵,因此难以应用于工业生产中大规模化学制备羟基酪醇。为有效解决这一问题,本研究利用基因工程技术,成功将4-羟基苯乙酸-3-羟化酶基因克隆到pET28a质粒载体上,进而将重组质粒转入到大肠杆菌BL21(DE3)中,确保重组4-羟基苯乙酸-3-羟化酶在大肠杆菌宿主细胞得到高效表达。研究结果,工程菌株可充分将酪醇摄入胞内,利用重组HHA酶将酪醇羟基化合成羟基酪醇[14]。作为橄榄中的一种天然化合物,羟基酪醇具有很高的营养价值和经济价值,尽管本研究利用生物转化技术成功制备了羟基酪醇,但对重组工程菌株的最佳培养条件、底物酪醇的适宜浓度和羟基酪醇的最佳产率还没有进行优化,因此,在后续研究中,我们重点围绕制备羟基酪醇的各项参数与指标,进一步优化羟基酪醇制备工艺,为今后采用生物转化法规模生产羟基酪醇奠定一定的基础。
| [1] | Rahmani A H, Albutti A S, Aly S M. Therapeutics role of olive fruits/oil in the prevention of diseases via modulation of anti-oxidant, anti-tumour and genetic activity. Int J Clin Exp Med,2014,7(4):799-808. |
| [2] | Capasso R, Evidente A, Avolio S, et al. A highly convenient synthesis of hydroxytyrosol and its recovery from agricultural waste waters. Agric Food Chem, 1999, 47(4):1745-1748. |
| [3] | Ferdinando Bolanos J, Rodrigufez G, Rodriguez R, et al. Production in large quantities of highly purified hydroxytyrosol from liquid-solid waste of two phase olive oil processing or alperujo. Agric Food Chem, 2002, 50(23):6804-6811. |
| [4] | Allouche N, Fki I, Sayadi S. Toward a high yield recovery of antioxidants and purified hydroxytyrosol from olive mill wastewaters. Agric Food Chem, 2004, 52(2):267-273. |
| [5] | Angelino D, Gennari L, Blasa M, et al. Chemical and cellular antioxidant activity of phytochemicals purified from olive mill waste waters. J Agric Food Chem, 2011, 59(5):2011-2018. |
| [6] | Briante R, LaCara F, Febbraio F. Bioactive derivatives from oleuropein by a biotransformation on Olea europaea leaf extracts. J Biotechnol, 2002, 93(2):109-119. |
| [7] | Kuo H J, Wei Z Y, Lu P C. Bioconversion of pinoresinol into matairesinol by use of recombinant Escherichia coli. Appl Environ Microbiol, 2014, 80(9):2687-2692. |
| [8] | Coulombel L, Nolan L C, Nikodinovic J, et al. Biotransformation of 4-halophenols to 4-halocatechols using Escherichia coli expressing 4-hydroxyphenylacetate 3-hydroxylase. Appl Microbiol Biotechnol, 2011, 89(6):1867-1875. |
| [9] | 潘晓霞,李静静,何文森,等.苯乙酮酸脱羧酶基因的克隆与表达及静息细胞生物转化乙基香兰素的研究.食品与生物技术学报,2013,1:1673-1689. Pan X X, Li J J, He W S, et al. Cloning and expression of benxoylformate decarboxylase gene and study on biotransformation of ethyl vanillin by resting cell.Journal of Food Science and Biotechnology,2013,1:1673-1689. |
| [10] | Azabou S, Najjar W, Ghorbel A, et al. Mild photochemical synthesis of the antioxidant hydroxytyrosol via conversion of tyrosol. Agric Food Chem, 2007, 55(12):4877-4882. |
| [11] | Bai C, Yan X, Takenaka M, et al. Determination synthetic hydroxytyrosol in rat plasma by GC-MS. Agric Food Chem, 1998, 46(7):4998-5001. |
| [12] | Miralles P, Chisvert A, Salvador A. Determination of hydroxytyrosol and tyrosol by liquid chromatography for the quality control of cosmetic products based on olive extracts. J Pharm Biomed Anal, 2015,102(3):157-161. |
| [13] | Nagaaawa T, Hurh B, Yamane T, et al. Production of 6-hydroxynicotinic acid from nicotinic acid by resting cells of Pseudomonus flaorescens TN5. Biosci Biotechnol Bioche, 1994, 58(4):665-668. |
| [14] | Karel S F, Libicki B, Robertson C R. The immobilization of whole cells: engineering principles. Chem Eng Sci, 1985, 40(6):1321-1354. |
 2015, Vol. 35
2015, Vol. 35




