文章信息
- 刘亚龙, 闫东明, 翁樑, 邹雪, 刘丹, 彭超, 苏亚南, 闫锦锦, 张静, 郭志燕
- LIU Ya-long, YAN Dong-ming, WENG Liang, ZOU Xue, LIU Dan, PENG Chao, SU Ya-nan, YAN Jin-jin, ZHANG Jing, GUO Zhi-yan
- 重组大肠杆菌不耐热肠毒素B亚单位的中试发酵及纯化工艺
- Pilot-scale Fermentation and Purification of a Recombinant E. coli Heat-labile Enterotoxin B Subunit
- 中国生物工程杂志, 2015, 35(2): 78-83
- China Biotechnology, 2015, 35(2): 78-83
- http://dx.doi.org/10.13523/j.cb.20150212
-
文章历史
- 收稿日期:2014-10-28
- 修回日期:2014-12-09
不耐热肠毒素(Heat-labile enterotoxin,LT)是肠产毒性大肠杆菌(Enterotoxigenic E. coli,ETEC)分泌的一种热不稳定性肠毒素,能引起人畜的严重腹泻,是最好的粘膜免疫佐剂之一[1,2,3]。LT由1个活性中心A亚单位和5个毒素受体结合位点B亚单位组成,5个完全相同的B亚基在空间形成环状五聚体,LTA位于中央,其C端以非共价键与LTB结合[4]。
LT作为粘膜免疫佐剂的观点已获得认可,郭学军等[5]使BALB/c小鼠同时口服靶抗原卵清蛋白(ovalbumin,Ova)和LT后,研究发现小鼠体内产生的抗Ova的IgG抗体和sIgA抗体水平较高,且IgG水平比单独口服Ova后产生的抗体高30倍。此外单独口服Ova的小鼠没有产生粘膜免疫反应,而Ova与LT同时口服后,发生了粘膜免疫反应,表明LT具有粘膜佐剂作用。LT的A亚单位为毒性部分,限制了其作为免疫佐剂在人体上的应用;B亚单位无毒且具有良好的粘膜佐剂活性,从而被广泛研究应用[6,7,8]。
LTB作为LT的无毒部分,具有良好的粘膜佐剂功效,已在许多基因工程亚单位疫苗中得到应用。Rock等[9]将LTB与人绒毛膜促性腺激素(human chorionic gonatropin,HCG)β亚基的羧基末端肽进行融合,其表达产物免疫小鼠,产生了识别重组HCGβ亚基或天然HCG的抗体反应,表明LTB具有较好的粘膜佐剂功能。Jobling等[10]采用LTB基因与肺炎链球菌表面蛋白A(pneumococcal surface protein A,PspA)的基因融合表达产物免疫小鼠,产生了具有免疫活性的重组蛋白。Verweij等[11]将重组LTB蛋白与流感表面抗原进行混合,通过鼻腔免疫小鼠,发现了高效价的sIgA和IgG抗体,暗示了重组LTB蛋白作为免疫佐剂能够促进机体对蛋白抗原的免疫应答,从而提高抗体产生的水平。
本研究克隆出LTB基因,成功构建了原核表达质粒,通过中试发酵、纯化等技术大量获得高纯度的LTB蛋白,为LTB作为疫苗佐剂研究提供了基础材料。 1 材料与方法 1.1 材 料 1.1.1 菌株及质粒
E.coli DH5α及E.coli BL21(DE3)空白菌株由本实验室提供,LTB-UreB重组质粒由本实验室提供,质粒pMD18-T、pET28a购自宝生物工程(大连)有限公司。 1.1.2 试剂及仪器
质粒DNA提取试剂盒、DNA凝胶回收试剂盒均购自AXYGEN公司,限制性内切酶NcoⅠ、XhoⅠ、T4 DNA连接酶、Taq DNA聚合酶、DNA marker购自宝生物工程(大连)有限公司,Q sepharose High Performance、Sephadex G-25介质购自GE公司,层析柱购自南京大学普阳科学仪器研究院,发酵罐购自上海宝兴生物设备有限公司(罐体积为50L),管式离心机购自西门子(中国)有限公司。 1.1.3 培养基
Ⅰ、Ⅱ代种子培养基:每升含有10g蛋白胨、5g酵母粉、10g氯化钠,用5mol/L氢氧化钠溶液调节pH至7.4,使用前加入氨苄青霉素至100 μg/ml。
发酵培养基:每升含15.6g磷酸氢二钠、4.3g磷酸二氢钾,1g氯化铵,1g硫酸镁,0.67g氯化钠,3.6g胰蛋白胨,4g酵母粉,6g酸水解酪蛋白,5g葡萄糖,2mg 氯化锌,2.4mg 六水氯化钴,5mg硼酸,4.2mg五水硫酸铜,4mg七水硫酸亚铁,1.6mg四水氯化锰,pH7.4,使用前加入氨苄青霉素至100 μg/ml。
补料培养基:每升含200g葡糖糖、150g酵母粉、150g蛋白胨、18.7g硫酸镁。 1.2 方 法 1.2.1 重组表达载体的构建
以LTB-UreB重组质粒为模板,采用引物5′-CCATGGCTCCTCAGTCTATTA CAGAACTATG-3′和5′-CTCGAGGTTTTCCATACTGATTGCCGCA-3′进行PCR扩增,将PCR产物与pMD18-T载体连接,连接产物转化E.coli DH5α,挑选单克隆,提取质粒,利用NcoⅠ、XhoⅠ双酶切鉴定正确后,送交生工生物工程(上海)有限公司测序。将鉴定正确的阳性重组质粒与pET28a载体分别用NcoⅠ、XhoⅠ双酶切,采用胶回收试剂盒回收LTB基因片段和pET28a载体片段,以T4 DNA酶8 ℃连接过夜后,转化E.coli BL21(DE3),挑选单克隆,通过双酶切进行鉴定,将鉴定正确的菌种保存于20%甘油中,-20 ℃冻存。 1.2.2 重组LTB基因工程菌的中试发酵
重组LTB基因工程菌中试发酵分为一代种子培养、二代种子培养和发酵培养三步。将含有重组质粒pET28a-LTB的E.coli BL21(DE3)菌种以1∶100的比例接种于含Kan抗性的LB培养基中,37 ℃、115 r/min摇床培养16h,此为一代种子。按1%的接种量将一代种子接种于含Kan抗性的LB培养基中,37 ℃、250 r/min摇床培养4h,此为二代种子。将二代种子按10%接种量接种于发酵培养基中进行发酵培养。初始发酵条件为:培养基体积25L,温度37 ℃,pH 7.4,发酵罐溶氧60%,搅拌转速200 r/min。随着发酵过程的进行,菌体密度增大、耗氧增加,因此将转数改为级联溶氧控制,以保证发酵液中的溶氧不低于25%。发酵0.5 h后开始补充碳源,添加速度为12 ml/min,6 h补完;发酵1 h后补充氮源,速度为20 ml/min,6.5 h补完。当发酵罐中菌体OD600>30时(约5~6h),加入终浓度为0.5 mmol/L的异丙基-β-D-硫代半乳糖苷(Isopropyl-beta-D-thiogalactopyranoside,IPTG)开始诱导表达。诱导表达后,每隔1 h取样1次,测定OD600,并将留样进行SDS-PAGE实验,以检测目的蛋白表达量。诱导4h后,结束发酵,利用管式离心机20 000 r/min离心收集菌体。 1.2.3 菌体破碎、包涵体蛋白的洗涤及裂解
称取发酵菌体按1∶10(W/V)的比例加入10 mmol/L pH8.5的Tris-HCl 缓冲液,利用高压均质机800bar破菌两次,管式离心机20 000 r/min离心收集沉淀,沉淀即为以包涵体形式表达的重组LTB蛋白。称取包涵体蛋白,按照1∶10(W/V)的比例分别用洗涤液Ⅰ(10 mmol/L Tris-HCl、1% Triton X-100)、洗涤液Ⅱ(12.5 mmol/L Tris-HCl、2 mol/L Urea)洗涤,各重复2次,洗涤条件为:20 ℃搅拌30 min,4 500 r/min离心30 min。将洗涤后的包涵体沉淀用裂解液(50 mmol/L Tris-HCl、8 mol/L Urea)裂解16 h,裂解后,重组LTB包涵体即以可溶性蛋白的形式溶解在裂解液上清中。10 000 g离心60 min,收集上清液,以进行重组LTB蛋白的纯化工作,并利用SDS-PAGE检测裂解液中目的蛋白的纯度。 1.2.4 重组LTB蛋白的纯化
采用Q Sepharose High Performance阴离子交换层析纯化重组LTB蛋白,用平衡液(50 mmol/L Tris-HCl、8 mol/L Urea)平衡Q柱后,将裂解液上清直接上样,线流速为50 cm/h。由于本研究构建载体表达的重组LTB蛋白不与Q柱结合,用平衡液冲柱后,目的蛋白直接从穿透峰中流出,而大部分杂蛋白都与Q柱结合,留在Q柱中,因此,通过分段收集样品可收得纯度较高的目的蛋白。将分段接收的样品进行蛋白电泳检测,发现杂蛋白先从Q柱中流穿,目的蛋白流出较晚,在峰后部收取的样品中目的蛋白的纯度可达到98%。收集的目的蛋白经Sephadex G-25层析脱盐和去除尿素,获得高纯度的、复性的目的蛋白。 1.2.5 免疫双扩散法鉴定重组LTB的蛋白活性配制1.5%的琼脂糖凝胶板,冷却后打孔,在中央孔内加入1μg的兔抗血清,周边孔分别滴加LTB蛋白(1μg、5μg)、阴性对照及空白对照,进行交叉琼脂免疫双扩散实验,以测定重组LTB蛋白的生物活性。 2 结 果 2.1 重组表达载体的构建
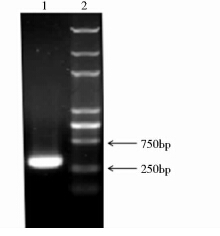
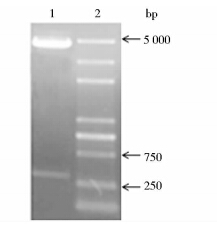
以LTB-UreB重组质粒为模板进行PCR扩增,产物经1%琼脂糖凝胶电泳鉴定(图 1)。LTB目的基因理论值为330bp,由图 1可知,扩增目的基因片段大小与理论值一致,表明成功克隆出LTB基因。将LTB片段连接到pET28a载体上后,通过NcoⅠ、XhoⅠ双酶切鉴定,理论值应得到5 230bp的载体和330bp的片段,经琼脂糖凝胶电泳鉴定后发现,结果与理论值相符,表明质粒构建成功(图 2)。
|
| 图 1 LTB基因PCR产物琼脂糖凝胶电泳检测结果 Fig. 1 Electrophoretic profile of PCR product of LTB 1:Product of PCR; 2: DNA marker DL5000 |
|
| 图 2 重组质粒pET28a-LTB双酶切琼脂糖凝胶电泳检测结果 Fig. 2 Restriction map of recombinant plasmid pET28a-LTB 1:Recombinat plasmid pET28a-LTB by NcoⅠ,XhoⅠ;2: DNA marker DL5 000 |
经研究确定的最佳诱导表达条件为:诱导温度为37 ℃,pH7.4,开始诱导的标准为OD600≥30,诱导4h停止。重组菌经IPTG诱导后,分别于诱导0、1、2、3、4 h取样,测定OD600,并进行SDS-PAGE检测。OD结果表明,随着诱导时间的延长,OD600逐渐升高,诱导4 h时达到最高。SDS-PAGE结果表明(图 3),重组LTB蛋白分子量为12 kDa,未诱导时,无目的蛋白表达,随着诱导时间的延长,重组LTB蛋白产量持续增加,诱导4 h时达到最高,目的蛋白的表达量占菌体总蛋白的25.4%。
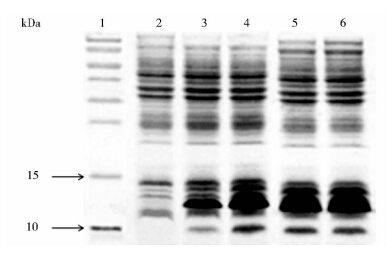
|
| 图 3 表达产物的SDS-PAGE检测结果 Fig. 3 SDS-PAGE profile of expressed LTB 1:Protein markers; 2:Before induction(0h);3~6:1,2,3 and 4h after induced by IPTG |
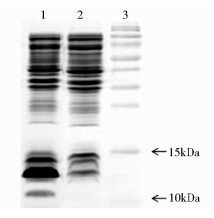
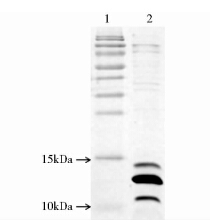
菌体破碎后离心,分别收集沉淀和上清,进行SDS-PAGE检测,结果表明,LTB条带均在沉淀中,上清中没有表达(图 4),即重组LTB蛋白是以包涵体形式存在,无可溶性表达。将包涵体蛋白洗涤后进行裂解,经SDS-PAGE检测(图 5),目的蛋白纯度为44.7%,表明四次洗涤过程可去除一部分杂蛋白,起到粗纯的作用。
|
| 图 4 菌体破碎后沉淀及上清的SDS-PAGE检测结果 Fig. 4 SDS-PAGE profile of precipitation and broken cell supernatant 1:Cell disruption precipitation; 2: Broken cell supernatant; 3: Protein markers |
|
| 图 5 包涵体裂解液SDS-PAGE检测结果 Fig. 5 SDS-PAGE profile of inclusion lysated 1: Protein markers; 2: Inclusion lysated |
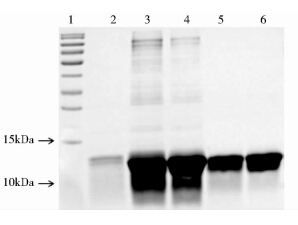
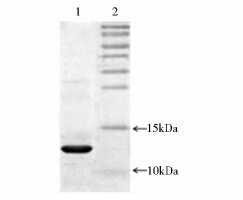
经Q Sepharose High Performance层析纯化后,可得到纯度为98%的目的蛋白。SDS-PAGE结果可知(图 6),在相对分子质量为12 kDa处有一明显的条带,与理论值大小完全相符,表明表达的重组蛋白为LTB蛋白。纯化的目的蛋白经Sephadex G-25层析后,使蛋白复性,SDS-PAGE检测结果表明(图 7),LTB蛋白纯度为95.7%。
|
| 图 6 Q柱纯化样品SDS-PAGE检测结果 Fig. 6 SDS-PAGE profile of Q column-purified 1: Protein markers; 2,3,4,5:Peak flow through the sample at different times |
|
| 图 7 G-25层析样品的SDS-PAGE检测结果 Fig. 7 SDS-PAGE profile of G-25 sample 1:Recombinant LTB protein chromatographied by G-25; 2: Protein markers |
将1μg兔抗血清、空白对照、阴性对照和重组LTB蛋白加入到琼脂糖凝胶板中,置于37 ℃孵育48 h后,观察并记录实验结果。实验结果显示,在兔抗血清与重组LTB蛋白之间出现明显的白色沉淀带,而兔抗血清与阴性对照、空白对照之间未出现白色沉淀带(图 8),表明纯化的重组LTB蛋白具有较强的活性。
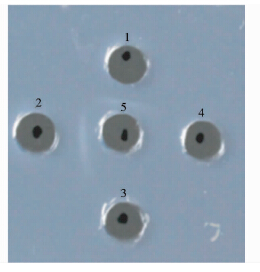
|
| 图 8 重组LTB蛋白免疫双扩散检测结果果 Fig. 8 The result of protein immune double diffusion of recombinant LTB 1,2:Recombinant LTB;3:Negative control;4:Blank;5: Antiserum of rabbit |
目前多数疫苗通过皮下或肌肉注射接种,无法诱导粘膜产生抗体,而且绝大多数抗原经粘膜免疫时免疫原性较弱,因此开发能够增强疫苗免疫原性的粘膜佐剂变得尤为重要。多项研究表明LTB具有较好的粘膜免疫佐剂作用[12,13],且天然LTB和基因工程生产的LTB都有良好的粘膜免疫佐剂功能[14]。
目前,LTB发酵及诱导表达均采用三角瓶进行,该方法产量低,发酵条件难以控制,无法达到工业化生产要求。本研究构建的pET28a-LTB重组质粒能够高效表达LTB,表达产量可占总蛋白的20%以上。本文利用发酵罐进行发酵培养重组LTB菌种,通过本文中所述的参数及条件控制,在诱导表达后,使目的蛋白表达量达到了总菌体蛋白量的25.4%,解决了因摇瓶发酵产量低的难题,实现了LTB的生产。
蛋白质纯化和复性是基因工程下游工艺,不同的蛋白质由于其理化性质不同,其纯化和复性的条件也不同[15]。目前LTB纯化主要有两种:一种是采用亲和层析法[16,17],另一种是采用离子交换层析加疏水层析法[1]。然而,前者采用多梯度洗脱法进行纯化且需去除组氨酸标签,而后者则需进行多步纯化才可得到纯度较高的目的蛋白,因此现今人们较多采用的纯化方法生产成本较高,耗时较长,不利于工业化生产。
本研究采用的上述制备方法,使目的蛋白不与Q柱结合,可通过分段接取穿透液的方式进行纯化,不用梯度洗脱即可获得纯度为98%的目的蛋白。将G-25层析复性后的蛋白进行免疫双扩散实验,结果表明本研究中制备的重组LTB蛋白具有良好的免疫活性。本研究中的纯化工艺相对于其他研究中的工艺而言,可达到简捷、高效、省时,节约成本,且不影响目的蛋白的生物学活性的目的,因此,更利于工业化生产,为LTB的产业化奠定了基础。
综上所述,本实验成功构建了LTB基因的高效表达载体,确定了中试发酵生产的工艺条件,建立了更为省时、省事、简便的纯化方法,为LTB的产业化奠定了基础。
| [1] | 田文标, 邹全明, 吴超, 等. 重组大肠杆菌不耐热肠毒素B亚单位的纯化及生物学活性鉴定. 第三军医大学学报, 2003, 25(2): 131-135. Tian W B, Zou Q M, Wu C, et al. Purification and evaluation of the biological activity of recombinant E. coli heat-labile enterotoxin B. Acta Academiae Medicinae Militaris Tertiae, 2003, 25(2): 131-135. |
| [2] | 郭学青, 邹全明. 霍乱毒素及大肠杆菌不耐热肠毒素生物学特性的研究. 世界华人消化杂志, 2000, 8(3): 325-326. Guo X Q, Zou Q M. Research cholera toxin and Escherichia coli heat-labile enterotoxin biological. World Chinese Jourmal of Digestology, 2000, 8(3): 325-326. |
| [3] | 李文建, 邹全明. 粘膜免疫佐剂肠产毒性大肠杆菌不耐热肠毒素(LT)研究进展. 免疫学杂志, 2000, 16(4): 85-87. Li W J, Zou Q M. Review of enterotoxic Escherichia coli (ETEC) heat-labile enterotoxin (LT) as mucosal. Immunological Journal, 2000, 16(4): 85-87. |
| [4] | 邹全明, 童文德, 毛旭虎, 等. 口服重组幽门螺杆菌疫苗及其制备方法. 中国, 1927394, 2007-03-14. Zou Q M, Tong W D, Mao X H, et al. Oral recombinant Helicobacter pylori vaccine and preparation method. China, 1927394, 2007-03-14. |
| [5] | 郭学军, 张锦霞, 朱平. 大肠杆菌不耐热肠毒素(LT)突变体LTR72的表达与鉴定. 中国兽医学报, 2003, 23(1)l: 46-48 Guo X J, Zhang J X, Zhu P. Escherichia coli heat-labile enterotoxin (LT) expression and identification of mutations in the body LR72. Chinese Journal of Veterinary Science, 2003, 23(1): 46-48. |
| [6] | Zhang G G, Li D X, Zhang H H, et al. Enhancement of mucosal immune response against the M2eHBc+ antigen in mice with the fusion expression products fo LTB and M2eHBc+ through mucosal immunization route. Vet Res Commun, 2009, 33(7): 735-747. |
| [7] | Liang S, Hosur K B, Nawar H F, et al. In vivo and in vitro adjuvant activities of the B subunit of Type IIb heat-labile enterotxin (LT-IIb-B5) from Escherichia coli. Vaccine, 2009, 27(32): 4302-4308. |
| [8] | Sim J S, Pak H K, Kim D S, et al. Expression and characterization of synthetic heat-labile enteroxtoxin B subunit and hemagglutinin neuraminidase-neutralizing epitope fusion protein in Escherichia coli and tobacco chloroplasts. Plant Mol Biol Rep, 2009, 27(3): 388-399. |
| [9] | Rock E P, Reich K A, Lyu D M, et al. Immunogenicity of a fusion protein linking the beta subunit carboxyl terminal peptide of human chorionic gonadotropin to the B subunit of Escherichia coli heat labileent erotoxin. Vaccine, 1996, 14(16): 1560-1568. |
| [10] | Jobling M G, Palmer L M, Erbe J L, et al. Construction and characterization of versatile cloning vectors for the efficient delivery of native foreign proteins to the periplasm of Escherichia coli. Plasmid, 1997, 38(3): 158-173. |
| [11] | Verweij W R, De H L, Holtro P M, et al. Musosal immunoadjuvant of recombinant Escherichia coli heat-labile enterotoxin and its B subunit: induction of systemic IgG and secretory IgA responses in mice by intranasal immunization with influenza virus surface antigen. Vaccine, 1998, 16(20): 2069-2076. |
| [12] | 张国广, 罗茂春, 董艳美, 等. LTB的表达及其粘膜免疫佐剂活性分析. 厦门大学学报(自然科学版), 2013, 51(5): 918-922. Zhang G G, Luo M C, Dong Y M, et al. LTB expression and mucosal immune adjuvant activity analysis. Journal of Xiamen University (Natural Science), 2013, 51(5): 918-922. |
| [13] | 葛俊伟, 姜艳平, 杨敏, 等. 大肠杆菌不耐热肠毒素B亚单位在大肠杆菌中的表达及其特性研究. 东北农业大学学报, 2010, 41(6): 109-112. Ge J W, Jiang Y P, Yang M, et al. Expression and characterization of LTB subunit of Escherichia coli in prokaryocyte. Journal of Northeast Agricultural University, 2010, 41(6): 109-112. |
| [14] | 黄思扬, 马超, 雷清, 等. 大肠杆菌不耐热肠毒素B亚单位的克隆、表达及初步纯化. 生物技术, 2005, 15(6): 17-20. Huang S Y, Ma C, Lei Q, et al. Cloning, expression and purification of Escherichia coli heat-labile enterotoxin B subuint. Biotechnology, 2005, 15(6): 17-20. |
| [15] | 张锦霞, 郭学军, 李毅, 等. 大肠杆菌不耐热肠毒素B亚单位在原核细胞中的高效表达. 中国预防兽医学报, 2006, 28(2): 160-163. Zhang J X, Guo X J, Li Y, et al. High level expression of the LTB subunit of Escherichia coli heat-labile enterotoxin in prokaryocyte. Chinese Journal of Preventive Vterinary Medicine, 2006, 28(2): 160-163. |
| [16] | 冯强, 杨珺, 张卫军, 等. 大肠杆菌不耐热肠毒素B亚单位的分泌表达与性质鉴定. 免疫学杂志, 2004, 20(5): 364-368. Feng Q, Yang J, Zhang W J, et al. Secretory expression and characterization of Escherichia coli heat-labile enterotoxin B subunit. Immunological Journal, 2004, 20(5): 364-368. |
| [17] | 崔文禹, 李媛媛, 单璞, 等. 大肠杆菌不耐热肠毒素B亚单位的原核表达、纯化及其粘膜免疫佐剂作用. 中国生物制品学杂志, 2011, 24(12): 1417-1420. Cui W Y, Li Y Y, Dan P, et al. Prokarytic expression, purification and mucosal immunoadjuvantivity of E. coli heat-labile enterotoxin B subunit. Chinese Joumal of Biologicals, 2011, 24(12): 1417-1420. |
 2015, Vol. 35
2015, Vol. 35




