文章信息
- 石漫漫, 乔长晟, 朱明, 李雪, 刘姗姗
- SHI Man-man, QIAO Chang-sheng, ZHU Ming, LI Xue, LIU Shan-shan
- 高产雷帕霉素的游动放线菌菌种的选育
- The Breeding of High-yielding Actinoplanes of Rapamycin
- 中国生物工程杂志, 2015, 35(2): 72-77
- China Biotechnology, 2015, 35(2): 72-77
- http://dx.doi.org/10.13523/j.cb.20150211
-
文章历史
- 收稿日期:2014-10-22
- 修回日期:2014-11-04
2. 天津北洋百川生物技术有限公司 天津 300457
2. Tianjin Peiyang Biotrans Co., Ltd, Tianjin 300457, China
雷帕霉素(rapamycin)又名西罗莫司,是具独特作用机制的含氮三烯大环内酯类抗生素,具有抗真菌、抗增殖和抗肿瘤作用[1]。雷帕霉素是目前世界上最有前途的新型强效免疫抑制剂,可用于器官移植抗排斥作用,它的免疫抑制作用比环孢菌素强数十倍,是肾毒性最低的免疫抑制剂,还可用于治疗类风湿性关节炎、红斑狼疮等自身免疫性疾病,目前发展为基因治疗药[2]和抗肿瘤药物[3],具有广阔的应用前景。
常压室温等离子体(atmospheric and room temperature plasma,ARTP)诱变技术是近几年来发展起来的一种微生物诱变育种技术。该技术无需真空装置,操作简易,成本低,产生的等离子体分布均匀,射流温度低,活性粒子浓度高。用该技术处理微生物菌种时,与生物大分子和细胞的作用效果明显,微生物基因组的突变速度快、产生突变的多样性大,是获得非转基因生物的有效手段[4,5,6,7]。
紫外线是一种使用最早、沿用最久、应用广泛、效果明显的物理诱变剂。尽管几十年来,不断有各种新的诱变剂出现,但到目前为止,经诱变处理后得到的抗生素高产菌中,有80%左右是通过紫外线诱变后经筛选获得的。紫外线迄今仍然是微生物育种中最常用和有效的诱变剂之一[8,9,10]。
核糖体工程(ribosome engineering)是由日本国家食品研究所的Ochi教授[11]首先提出的,它以胞内的核糖体和RNA多聚酶为对象,利用各类抗生素的抗性突变作为筛选标记来表征二者的功能变化,从转录和翻译两个水平来激活微生物细胞的生物合成潜能[12]。其理论依据[13]是微生物核糖体在结构上经过修饰改造后可以直接或间接地激活表达次级代谢调控相关的沉默基因,进而激发微生物的生物合成潜能,大幅度提高其次级代谢产物的产量甚至从中获得新的生物活性物质。
雷帕霉素广泛的应用,使其具有明显的社会和经济效益,其市场需求也在逐渐增大,而目前国内外报道的雷帕霉素的生产主要通过吸水链霉菌的发酵富集和分离纯化得到,且其产量很低,国内文献报道的最高产量也仅达到450mg/L左右。但Kojima[14]等报道游动放线菌也能合成雷帕霉素,且其合成能力比吸水链霉菌ATCC 29253强10倍以上,但尚未见该菌用于生产的报道。本研究以游动放线菌BCLP-016为出发菌株,首次将常压室温等离子体诱变和紫外诱变复合,用于高产雷帕霉素菌株的选育中,以提高雷帕霉素的产量,便于其进一步工业化生产,满足市场需求。 1 材料与方法 1.1 菌 株
游动放线菌(Actinoplanes)BCLP-016,由天津北洋百川生物技术有限公司保存。 1.2 培养基
斜面及平板培养基:燕麦片35g/L,葡萄糖15g/L,酵母粉10g/L,蛋白胨8g/L,琼脂20g/L,碳酸钙3g/L,pH 7.0~7.2,121℃,灭菌20min。
种子培养基:可溶性淀粉25g/L,蛋白胨5g/L,葡萄糖20g/L,黄豆饼粉10g/L,碳酸钙3g/L,pH 7.0~7.2,121℃,灭菌20min。
发酵培养基:葡萄糖45 g/L,黄豆饼粉40 g/L,淀粉15 g/L,硫酸铵1 g/L,碳酸钙4g/L,pH 7.0~7.2,121℃,灭菌30min。 1.3 试 剂
实验所用链霉素、庆大霉素、氯霉素和红霉素均购自生工生物工程(上海)有限公司,利福平购自北京索莱宝科技有限公司。 1.4 方 法 1.4.1 雷帕霉素含量的测定
采用高效液相色谱法(HPLC),具体的操作条件如下:
高效液相色谱Agilent technologies 1200 series,检测器:紫外检测器;色谱柱GRACE AlltimaTM C18 5u 250×4.6mm,5μm;流动相:甲醇∶乙腈∶水=60∶25∶15(v∶v∶v);流速:1ml/min,检测波长:277nm,进样量:20μl。 1.4.2 pH的测定
采用PHSJ-4A型数显式pH计测定pH值。 1.5 菌株的诱变处理 1.5.1 菌株的诱变处理流程
制备出发菌株孢子悬液→常压室温等离子体(ARTP)诱变→根据菌落形态初筛→发酵复筛→斜面保存,检验稳定性→制作高产菌株的孢子悬液→紫外诱变→根据核糖体工程原理抗性初筛→发酵复筛→转接斜面保存,遗传稳定性实验。 1.5.2 出发菌株的ARTP诱变
(1)单孢子悬液的制备 取活化好的出发菌株BCLP-016斜面用0.85%的生理盐水洗下,用接种针将孢子刮下制成孢子悬浮液,再将其转入带有玻璃珠的三角瓶内充分振荡,打散后用带有纱布和棉花的无菌漏斗过滤,得单孢子悬浮液,使孢子数量控制在107~108个/ml。
(2)ARTP诱变致死率曲线的制作 本实验采用由清华大学研发的常压室温等离子体诱变系统,对出发菌株BCLP-016的孢子进行处理。取10μl单孢子悬液于直径为1cm的圆形铁片上,置于以氦气作为工作气体,电源功率为110W,工作气流量10L/min的常压室温等离子体诱变系统中,处理距离为2mm,分别处理0、30、45、60、75、90、105、120、150、180s。将处理完的小铁片置于装有1ml 0.85%生理盐水的EP管中,并将上述10个照射剂量的孢子悬液分别进行梯度稀释,取各照射剂量的10-1,10-2,10-3三个稀释度的孢子悬液0.1ml涂平板,每个梯度做三个平行。将平板于28℃的培养箱中倒置培养10~14d,以未经ARTP处理的孢子悬液(处理0s)涂布的平板做对比,计算致死率。以ARTP处理时间为横坐标,致死率为纵坐标绘制致死率曲线。
(3)ARTP诱变后菌株的初筛 选择高、中、低三个不同致死率下的照射时间,分别对出发菌株BCLP-016的孢子悬浮液进行常压室温等离子体诱变处理;然后把不同照射时间的孢子悬液混合均匀,取1ml混合液进行梯度稀释,取10-2,10-3,10-4 三个稀释度的孢子悬液进行涂布平板。28℃,倒置培养10~14d后,根据菌落的形态变化,随机挑选部分具有特殊形态的单菌落,转接斜面保藏。
(4)菌株的复筛 用0.85%的生理盐水10ml将斜面菌株的孢子洗下,转接3 ml孢子液到种子培养基中,每株斜面的孢子液转接2个种子摇瓶,28℃,220 r/min,培养48~54h;转接5ml种子液到发酵培养基,每瓶种子液转接2瓶发酵作为平行,28℃,220r/min发酵7d。取新鲜的雷帕霉素发酵液,加入等体积甲醇,于220 r/min下振荡浸提2h,12 000 r/min离心10min,取上清液,过针孔过滤器后,用HPLC测定上清液中雷帕霉素的含量,其结果取四瓶发酵的平均值。将获得的高产菌株转接斜面保存。
(5)高产菌株的遗传稳定性实验 将筛选出的高产菌株在斜面培养基上连续转接4~6代,每代菌株转接3瓶发酵作为平行,检测雷帕霉素的产量,并对各代菌株的雷帕霉素产量进行分析比较,检验菌株的遗传性状是否稳定。 1.5.3 高产菌株的紫外诱变
(1)紫外诱变致死率曲线的制作 对通过上述ARTP诱变获得的高产菌株,进行紫外诱变处理,以通过复合诱变的手段,进一步获得高产菌株。
a按照1.5.2 节的方法制作高产菌的单孢子悬液,取5ml于直径7cm带有转子的平皿中,将平皿放在诱变箱的磁力搅拌器上。
b将磁力搅拌器置于功率为30W的紫外灯下30cm处,打开紫外灯,预先照射20min稳定波长,开启磁力搅拌器,打开皿盖,分别照射0,10,30,45,60,75,90,120,150,180。
c将上述10个不同照射时间的孢子悬液分别进行梯度稀释,取各照射时间10-1~10-44个稀释度的孢子悬液0.1ml分别涂布平皿,每个梯度做三个平行。
d在28℃避光的环境下,将平皿倒置培养10~14天,观察平板上单菌落的生长情况。以未经紫外线处理(处理0s)的孢子悬浮液涂布的平板作对比,计算致死率,以紫外照射时间为横坐标,致死率为纵坐标作图绘制致死率曲线。
(2)抗性物质对高产菌株最低抑制浓度(MIC)的确定按照1.5.2 节中孢子悬液的制备方法,将高产菌株的孢子悬液1ml转接到含有不同抗性物质、不同设计水平的种子培养基中,每个处理做三个平行,于28℃,220r/min的摇床中培养7~9d。将培养得到的种子液稀释涂布,观察平板上菌株的生长情况,以确定抗性物质对该菌的最低抑制浓度(MIC)。所设计的抗性物质浓度见表 1。
| 抗性物质 | 设计水平 | |||
| 链霉素(mg/L) | 0.04 | 0.06 | 0.08 | 0.1 |
| 利福平(mg/L) | 0.4 | 0.6 | 0.8 | 1.0 |
| 庆大霉素(mg/L) | 0.2 | 0.4 | 0.6 | 0.8 |
| 氯霉素(mg/L) | 1.0 | 1.5 | 2.0 | 2.5 |
| 红霉素(mg/L) | 0.02 | 0.04 | 0.06 | 0.08 |
(3)菌株的诱变与筛选 选择高、中、低三个不同致死率下的照射时间,分别对获得的高产菌株的孢子悬浮液进行紫外照射处理;然后把不同照射时间的孢子悬液混合均匀,吸取1ml混合的孢子悬液转接于含有不同抗性物质的种子培养基中,每种抗性物质的每个浓度有两个平行,28℃,220r/min培养7~9d。通过观察种子液的颜色变化,以及划板验证,在含有相应抗性物质的种子培养基中能够生长的,即为具有此种抗性的菌株,按照这种方法,将得到的抗性菌的种子液交叉接入含有其他抗性物质的摇瓶里培养。每步得到的抗性种子液都做10倍系列稀释,取10-3、10-4、10-5三个稀释度的种子液涂布,28℃培养5~8d,挑选长出的单菌落,转接斜面保藏。
对初筛菌株斜面按照1.5.2 中的方法进行菌株的复筛,并对筛选得到的高产菌株按照1.5.2中的方法检验其遗传稳定性。 2 结果与讨论 2.1 常压室温等离子体诱变选育 2.1.1 常压室温等离子体诱变的致死率曲线及诱变剂量的选择
为确定常压室温等离子体(ARTP)对出发菌株的诱变剂量,本研究按照1.5.2 中的方法测定了ARTP分别照射0、30、45、60、75、90、105、120、150、180s的致死率,得到的致死率曲线如图 1所示。
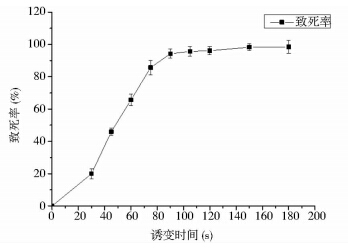
|
| 图 1 ARTP诱变的致死率曲线 Fig. 1 The fatality rate curve of ARTP mutagenesis |
从图 1可以看出,在ARTP照射时间为75s时,致死率达到了86%,当照射时间分别为30s和45s时,致死率分别为20%和46%。对于不同的菌株,在不同的致死率下,其正突变率不容易确定,所以为了增加筛选出高产菌株的概率,本研究采用的ARTP诱变剂量为30s,45s,75s,将经过这三个照射时间处理的孢子悬液混合后,经过稀释涂布,随机挑选具有特殊形态的单菌落用于初筛。 2.1.2 菌株的筛选结果
经过ARTP诱变后,在平板上挑选具有特殊形态的单菌落,其中具有代表性的主要有139株,其典型的形态特征为:不规则凸起、六瓣形凸起、四瓣形凸起、褶皱形凸起、盆地形凸起以及平地形,且出发菌株BCLP-016的菌落形态为不规则凸起。
对挑选出来的具有特殊形态的菌株进行发酵复筛,以筛选得到雷帕霉素高产菌,并考查经诱变后菌落形态与雷帕霉素产量的关系。由发酵复筛结果可知,平地形的菌株负突变率较高,不规则凸起以及盆地形凸起的菌株正突变率较高。通过ARTP诱变的方法,经发酵复筛最终筛选得到一株产量比较高的菌株ARTP-039,其雷帕霉素的产量可达到369.39mg/L,较出发菌株BCLP-016的产量256.86 mg/L,提高了43.81%,其菌落形态为盆地形凸起。 2.1.3 高产菌株ARTP-039的遗传稳定性实验
将筛选出的高产菌株ARTP-039在斜面培养基上连续转接6代,其产孢速度基本一致;雷帕霉素的产量稳定在352.29~365.67 mg/L,其结果见表 2,表明该菌株的遗传性能稳定。
| 传代数 | 1 | 2 | 3 | 4 | 5 | 6 |
| 产量 (mg/L) | 362.17 | 359.96 | 365.67 | 352.29 | 358.55 | 356.71 |
不同菌株对紫外照射的耐受程度不同,为确定紫外诱变的剂量,本研究测定了紫外线分别照射0,10,30,45,60,75,90,120,150,180对菌株ARTP-039的致死率,得到的致死率曲线如图 2所示。
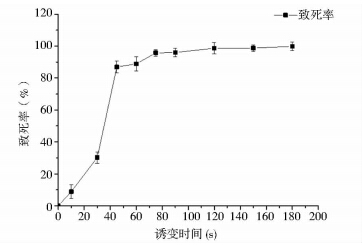
|
| 图 2 紫外诱变的致死率曲线 Fig. 2 The fatality rate curve of UV mutagenesis |
从图 2可以看出,在紫外照射时间为60s时,致死率达到了88%,当照射时间分别为10s和30s时,致死率分别为8%和30%。对于不同的菌株,在不同的致死率下,其正突变率不容易确定,所以为了增加抗性筛选的概率,本研究采用的紫外诱变剂量为10,30,60s,将经过这三个照射时间处理的孢子悬液混合后用于初筛。 2.2.2 抗性物质对菌株ARTP-039的最低抑制浓度(MIC)
由表 3可以看出链霉素、利福平、庆大霉素、氯霉素和红霉素对菌株ARTP-039的最低抑制浓度分别为0.08,0.6,0.6,2和0.04 mg/L。为了得到能耐受这些物质的抗性菌株,在最低抑制浓度的基础上,分别以1倍MIC和1.5倍MIC作为筛菌剂浓度。
| 筛菌剂(mg/L) | 设计水平 | |||
| 链霉素St | 0.04 | 0.06 | 0.08 | 0.1 |
| ++ | + | - | - | |
| 利福平Rif | 0.4 | 0.6 | 0.8 | 1.0 |
| + | - | - | - | |
| 庆大霉素Gen | 0.2 | 0.4 | 0.6 | 0.8 |
| ++ | + | - | - | |
| 氯霉素Chl | 1.0 | 1.5 | 2.0 | 2.5 |
| ++ | + | - | - | |
| 红霉素Er | 0.02 | 0.04 | 0.06 | 0.08 |
| + | - | - | - | |
| 注:“+”表示有菌生长,其个数代表菌落数的多少;“-”代表没有菌生长。 | ||||
按照1.5.3 所给出的初筛思路来筛选具有不同抗性标记的诱变菌株,分别得到了St+系列、St+Gen+系列、St+Gen+Rif+系列、St+Gen+Rif+Chl+系列以及St+Gen+Rif+Chl+Er+系列的抗性菌株共159株,转接斜面保藏,用于摇瓶复筛。最终筛选得到了一株具有链霉素、庆大霉素、利福平、氯霉素和红霉素五种抗性的高产菌株St8+Gen6+Rif9+Chl3+Er4-015(注:St8+Gen6+Rif9+Chl3+Er4表示该菌株耐受五种抗性物质的浓度依次为0.08、0.6、0.9、3和0.04mg/L,015为该菌株的编号),雷帕霉素的产量可达到589.79mg/L,较出发菌株BCLP-016的产量256.86 mg/L,提高了129.61%;较菌株ARTP-039的产量369.39mg/L提高了59.67%。 2.2.4 遗传稳定性实验
将筛选出的高产菌株St8+Gen6+Rif9+Chl3+Er4-015在斜面培养基上连续转接6代,其产孢速度基本一致;雷帕霉素的产量稳定在572.16~588.09mg/L,其结果如表 4所示,表明该菌株的遗传性能稳定。
| 传代数 | 1 | 2 | 3 | 4 | 5 | 6 |
| 产量 (mg/L) | 588.09 | 578.15 | 580.09 | 572.16 | 579.39 | 572.89 |
在进行ARTP诱变的过程中,筛选得到了一株雷帕霉素高产菌株ARTP-039,其雷帕霉素的产量可达到369.39mg/L,较出发菌株BCLP-016的产量256.86 mg/L,提高了43.81%,且其遗传稳定性良好。在此过程中,根据菌株的菌落形态进行初筛,可以得出菌落形态为不规则凸起以及盆地形凸起的菌株,正突变率较高。在以后高产菌株选育的过程中,可以根据此结果,挑选具有正突变率较高的菌落形态的菌株,以大幅度提高雷帕霉素的产量,并提高筛菌效率,减少筛菌的盲目性。
以ARTP诱变过程中筛选出的高产菌株ARTP-039为出发菌株,进行紫外诱变的过程中,以核糖体工程的理论进行抗性筛选,分别得到了St+系列、St+Gen+系列、St+Gen+Rif+系列、St+ Gen+Rif+Chl+系列以及St+ Gen+Rif+Chl+Er+系列的抗性菌株,并通过发酵复筛,最终筛选得到了一株雷帕霉素高产菌株St8+Gen6+Rif9+Chl3+Er4-015,其雷帕霉素的产量可达到589.79mg/L,较出发菌株BCLP-016的产量256.86 mg/L,提高了129.61%;较菌株ARTP-039的产量369.39mg/L提高了59.67%,且其遗传稳定性良好。
综合以上结果可知,对游动放线菌进行常压室温等离子体诱变以及紫外诱变,均能大幅度提高其产生雷帕霉素的能力,且本文中提出的对菌株先进行ARTP诱变,再以筛选出的高产菌进行紫外诱变的复合诱变的筛选思路,对提高雷帕霉素的产量具有良好的效果,可为以后高产菌株的选育过程提供一个良好的方法,以提高筛菌效率。
| [1] | 杨冬.雷帕霉素高产菌株的选育.杭州:浙江大学,材料与化工学院,2006. Yang D.Breeding of rapamycin high-production strains.Hangzhou:Zhejiang University,College of Material Science and Chemical Engineering,2006. |
| [2] | Balter M.Protein matchmaker may lead new gene therapy to the altar.Science,1996,273(5272):183. |
| [3] | Hidalgo M,Rowinsky E K.The rapamycin-sensitive signal transduction pathway as a target for cancer therapy.Oncogene,2000,19(56):6680-6686. |
| [4] | Li H P,Li G,Sun W T,et al.Radio-frequency,atmospheric-pressure glow discharges:producing methods,characteristics and applications in bio-medical fields.AIP Conference Proceedings,2008,982(1):584-591. |
| [5] | Li G,Li H P,Wang L Y,et al.Genetic effects of radio-frequency,atmospheric-pressure glow discharges with helium.Applied Physics Letters,2008,92(22):221504. |
| [6] | Wang L Y,Huang Z L,Li G,et al.Novel mutation breeding method for Streptomyces avermitilis using an atmospheric pressure glow discharge plasma.Journal of Applied Microbiology,2010,108(3):851-858. |
| [7] | Shi J J,Kong M G.Expansion of the plasma stability range in radio-frequency atmospheric-pressure glow discharges.Applied Physics Letters,2005,87(20):201501. |
| [8] | 施巧琴,吴松刚.工业微生物育种学.第2版.北京:科学出版社,2003.201-248. Shi Q Q,Wu S G.Industrial Microbiology Breeding.2nded.Beijing:Science Press,2003.201-248. |
| [9] | 陈红歌,刘新育,张世敏,等.木聚糖酶高产菌株的诱变.微生物学通报,2004,31(6):33-36. Chen H G,Liu X Y,Zhang S M,et al.Mutation of the strain producing higher xylanase.Microbiology China,2004,31(6):33-36. |
| [10] | 杜海英,于宏伟,韩军,等.原生质体诱变选育乳糖酶高产菌株.微生物学通报,2006,33(6):48-51. Du H Y,Yu H W,Han J,et al.Breeding of high-yielding β-galactosidase strains from protoplast of Aspergillus niger.Microbiology China,2006,33(6):48-51. |
| [11] | Ochi K.From microbial differentiation to ribosome engineering.Bioscience Biotechnology and Biochemistry,2007,71(6):1373-1386. |
| [12] | 谢庶洁,肖静,徐俊.微生物核糖体工程研究进展.微生物学报,2009,49(08):981-986. Xie S J,Xiao J,Xu J.Research progress of microbial ribosome engineering.Acta Microbiologica Sinica,2009,49(8):981-986. |
| [13] | 陈丽仙.核糖体工程技术在刺糖多孢菌上的初步应用.福州:福建农林大学,生物学院,2010. Chen L X.Preliminary application of ribosome engineering technology in Saccharopolyspora spinosa.Fuzhou:Fujian Agriculture and Forestry University,College of Biological Sciences,2010. |
| [14] | Kojima N,Kojima Y,Sakakibara T.Novel rapamycin producer.European:001534,1993-11-11. |
 2015, Vol. 35
2015, Vol. 35




