文章信息
- 金超, 柳洁, 季静, 王罡, 曹海燕, 吴疆
- JIN Chao, LIU Jie, JI Jing, WANG Gang, CAO Hai-yan, WU Jiang
- 过表达枸杞LcCHYB基因提高洋桔梗抗氧化性的研究
- Overexpression of LcCHYB to Enhance the Tolerance to Oxidative Stress of Eustoma Grandiflorum
- 中国生物工程杂志, 2015, 35(1): 27-33
- China Biotechnology, 2015, 35(1): 27-33
- http://dx.doi.org/10.13523/j.cb.20150104
-
文章历史
- 收稿日期:2014-05-21
- 修回日期:2014-06-25
2. 天津大学化工学院 天津 300072
2. School of Chemical Engineering and Technology, Tianjin University, Tianjin 300072, China
洋桔梗(Eustoma grandiflorum),又名草原龙胆,原产于美洲,后被引种至日本和欧洲。由于它花型妩媚,花色艳丽,经过多年的培育又出现了新品种[1],因此深受消费者的喜爱,具有广阔的市场前景。但是洋桔梗对生长环境要求较高,盐碱、干旱和强光等非生物胁迫都会严重影响其生长,因此大大阻碍了切花的推广,因此研究人员开始利用植物基因工程的方式培育新的洋桔梗品种,以期提高它的抗逆性而利于推广。
非生物胁迫造成植物胞内产生大量活性氧(reactive oxygen species,ROS),ROS会损坏细胞,造成诸如脂质膜过氧化反应、蛋白质氧化、酶抑制作用及DNA和RNA损伤等,甚至会导致细胞死亡[2]。类胡萝卜素作为一类重要的植物色素,不仅参与光合作用,也是植物体内一类重要的抗氧化物质。叶黄素循环池中的类胡萝卜素尤其是玉米黄质可直接淬灭ROS[3,4],同时触发植物非光化学淬灭作用,淬灭三线态叶绿素和单线态氧,对植物的细胞,特别是光合系统起到防护作用[5,6]。
1999年Havaux等人发现了紫黄质去环氧化酶(violaxanthin de-epoxidase,VDE)功能缺失的拟南芥突变体npq1在强光下不能积累玉米黄质,发生脂质过氧化严重现象,导致叶片发白和组织坏死,并出现光抑制情况,第一次证明了完整的叶黄素循环在光胁迫下的保护作用[7]。2002年,Gotz等人[8]将来自细菌的类胡萝卜素羟化酶基因(CRTZ)转入烟草,使玉米黄质大量积累,并发现光胁迫耐受性和UV抗性均有显著增强。2010年,Wang等人[9]在烟草中过表达八氢番茄红素脱氢酶基因(phytoene deturase,PDS)导致烟草胞内色素的组成发生改变,同时提高了烟草的抗氧化能力,同年,Zhu等人[10]利用靶向突变的方法去除蓝藻PC7022株系合成叶黄素循环分支的基因,并对其进行光抑制和氧化胁迫,发现突变体中ROS大量积累,证明叶黄素循环中的类胡萝卜素可以消除ROS并对蓝藻细胞起到保护作用。武卫党等人[11]在洋桔梗中过表达了来自拟南芥的β-类胡萝卜素羟化酶基因CHYB,并对转基因洋桔梗进行高光胁迫,发现玉米黄质得到大量积累,洋桔梗对氧化胁迫的耐受性有显著提高。因此,玉米黄质和叶黄素循环对植物抵御氧化胁迫具有重要意义,提高合成玉米黄质的基因CHYB的表达有可能是改善植物对氧化胁迫耐受性的一个重要途径。另一方面,氧化作用会造成植物花中细胞色素及醌类物质的氧化,造成褐化等现象,严重影响观赏性。因此提高植物氧化胁迫耐受性也能一定程度上令花朵保持艳丽多姿的形象。
本研究首次利用农杆菌介导法将克隆自枸杞的LcCHYB基因导入洋桔梗的White品系中,并且对其进行过氧化氢胁迫,检测转基因植株相关生理生化指标,探究LcCHYB基因对洋桔梗抗氧化能力的影响,旨在培育出具有强氧化胁迫耐受性的洋桔梗新品种,从而扩大洋桔梗的种植范围,便于市场推广。 1 材料与方法 1.1 材 料 1.1.1 外植体
以洋桔梗Eustoma grandiflorum Shinn 品种White品系的叶盘作为外植体。 1.1.2 质粒载体和农杆菌菌株
本实验所用载体为植物双元表达载体pCambia2300-LcCHYB,该载体含卡纳霉素抗性基因nptⅡ,构建好的载体图谱见图 1。本实验所用根癌农杆菌菌株为C58。载体和菌株均保存于天津大学遗传工程研究所。
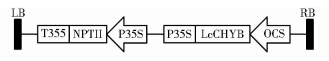
|
| 图 1 质粒pCambia2300-LcCHYB线性图谱-1抗体效价 Fig. 1 The sequence map of pCambia2300-LcCHYB |
将洋桔梗Eustoma grandiflorum Shinn 品种White品系暗培养2周后,取嫩叶用10%次氯酸钠表面灭菌8min,无菌水洗涤3次,最后将其剪切成大小约为5mm×5mm的叶盘,装入无菌三角瓶中备用。 1.2.2 农杆菌侵染液的获得
挑取卡纳霉素浓度为100mg/L的平板上生长良好的 C58菌落,接种至30ml含100mg/L卡纳霉素的YEP液体培养基中,28℃ 180r/min震荡培养12h,并测量菌液吸光度值。当OD600在0.6~0.8时,将菌液取出并倒入50ml离心管,4 000r/min离心10min,弃上清,用农杆菌重悬液等体积重悬,混匀后即得到农杆菌浸染液。 1.2.3 洋桔梗叶盘的侵染转化
将1.2.2 中所得农杆菌侵染液倒入装有洋桔梗叶盘的三角瓶中,使叶盘完全浸没,置于28℃条件下浸泡20min,然后将叶盘从侵染液中取出并放在无菌滤纸上沥干。 1.2.4
不定芽的诱导 将洋桔梗叶盘接种至共培培养基,22℃暗培养3天。然后将共培后的洋桔梗叶盘转移至筛选培养基,于25℃培养间,4 500 Lx光照强度(16h光周期)条件下培养,每2周继代一次,筛选培养基卡纳霉素浓度为70mg/L,头孢霉素的浓度由350mg/L逐渐降低,直至叶盘诱导出愈伤组织,然后将愈伤组织小心剥离并接种至新的增殖培养基。没有卡纳霉素抗性的细胞系逐渐死亡,而具有卡纳霉素抗性的细胞系不断增殖分化出不定芽。
| 培养基名称 | 培养基成分 | pH |
| 农杆菌重悬液 | MS+200 mg/L AS | 5.6~5.9 |
| 共培培养基 | MS+30 g/L 蔗糖+6.4 g/L 琼脂+1.0 mg/L 6-BA+0.04 mg/L NAA+200 mg/L AS | 5.6~5.9 |
| 筛选培养基 | MS+50 g/L 蔗糖+7g/L 琼脂+1.0 mg/L 6-BA+0.04 mg/L NAA+80 mg/L Kn+350 mg/L Cef | 5.6~5.9 |
| 增殖培养基 | MS+50 g/L 蔗糖+7g/L 琼脂+1.0 mg/L 6-BA+0.04 mg/L NAA+80 mg/L Kn+350 mg/L Cef | 5.6~5.9 |
| 生根培养基 | 1/2MS+30 g/L 蔗糖+6.4 g/L 琼脂 +0.3 mg/L NAA+0.3 mg/L IBA+70 mg/L Kn+350 mg/L Cef | 5.6~5.9 |
待不定芽长至3cm时,把它愈伤组织上剥离并接种至生根培养基,进行生根培养,培养条件同上。
待不定芽长出第一条根后,取一片叶子,CTAB法提取基因组DNA,并根据LcCHYB序列设计特异性引物进行PCR验证,引物序列参见表 2。若为阳性则标记为L1,L2等。
| 引物名称 | 引物序列 |
| LcCHYBF | 5′ -CTGCGCTCCGTGCTCTACCAA-3′ |
| LcCHYBR | 5′- TCCCACCACTCTCACCTCACT-3′ |
| EgUBIF | 5′-TCTCGCCGACTACAACATTCA-3′ |
| EgUBIR | 5′-TCCTAGCCAAAGCCATCAAAG-3′ |
待不定芽的主根长至约4cm并附着有大量根毛时,经炼苗后移栽至花盆中,蛭石∶珍珠岩∶营养土=4∶1∶1,细心栽培,待洋桔梗结种子后分别进行收集,经4℃暗培养1周后,对种子进行表面灭菌并接种至卡纳霉素浓度为70mg/L 的1/2 MS培养基中培养,待植株到四叶期时移栽至花盆中,进行后续研究。 1.2.7 RT-PCR分子检测
取洋桔梗的叶片,Trizol法提取总RNA,并根据LcCHYB和EgUBI序列设计特异性进行RT-PCR检测,操作同分子生物学实验技术手册,引物序列见表 2。 1.2.8 氧化胁迫洋桔梗
选取长势大致相同的转基因洋桔梗及野生型相同位置的一对叶片,将其中一片浸没于10%过氧化氢溶液中,置于暗处处理20min,另一片同时在空气中暗处理20min作为对照组。20min后,取出各组叶片终止胁迫。各组测定均重复三次。 1.2.9 洋桔梗叶片相关生理指标的测定
(1)洋桔梗叶片光合荧光参数的检测:利用光合仪(LI-6400XT)测定各组叶片的光合荧光参数Fv/Fm,ФPSⅡ,qP和NPQ值,光合仪的操作见使用说明书。
(2)洋桔梗叶片类胡萝卜素的提取及高效液相色谱检测: 取各组叶片100 mg,提取叶片总类胡萝卜素并利用HPLC进行检测。总类胡萝卜素提取方法及HPLC检测手段见参考文献[11]。
(3)洋桔梗叶片SOD、POD、CAT和MDA值的检测:取各组叶片100 mg,使用南京建成生物工程研究所的试剂盒测定SOD、POD、CAT和MDA,试剂盒名称如表 3所示,使用方法参见使用说明书。
以上测定数据均有三次重复,数据分析使用SPSS软件进行数据统计和差异显著性分析。
| 所测项目 | 试剂盒名称 |
| SOD | A001-1超氧化物歧化酶(SOD)测试盒 |
| POD | A084-2过氧化物酶(POD)测试盒 |
| CAT | A007-1过氧化氢酶(CAT)测试盒 |
| MDA | A003-3植物丙二醛(MDA)测试盒 |
从5个抗性细胞系中挑选长势良好的植株,提取叶片的基因组DNA作为模板,以产物长度为1 100bp左右的引物做PCR检测,并分别以野生型洋桔梗的叶片基因组和质粒pCambia2300-LcCHYB作为阴性和阳性对照。取PCR产物进行琼脂糖凝胶电泳(琼脂糖浓度为1%),对结果进行拍照。结果如图 2所示。从图中可以看出,L1到L5均在长度为1 100 bp的位置上存在与阳性对照位置一致的条带,而野生型则没有。
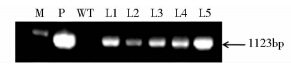
|
| 图 2 转基因洋桔梗不定芽叶片基因组 PCR 检测结果 Fig. 2 Electrophoresis of genomic-PCR products M: Marker Ⅲ (Tiangen,China); P: Positive control,PCR using plasmid; WT: Wild-type,non-transgenic plant; L1~L5: Transformant lines |
收集上述5株洋桔梗的种子,共获得L1 120粒,L2 88粒,L3 102粒,L4 150粒,L5为130粒。分别将其接种至含有70mg/L卡纳霉素的1/2MS培养基中,发现L4和L5的种子萌发率为0,该结果说明,L4和L5为嵌合体,并非真正的转基因植株。取L1、L2和L3的叶片提取总RNA,以LcCHYB和洋桔梗泛素合成酶基因(EgUBI)为模板设计引物,做逆转录PCR分析,结果如图 3所示。从图中可以看出,野生型和抗性苗均可检测出EgUBI的条带,但是只有抗性苗检测出LcCHYB基因的条带,因此可以证明,LcCHYB基因不仅成功导入洋桔梗中并且得到了转录。
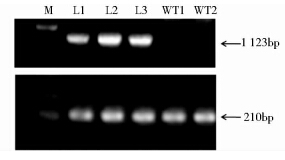
|
| 图 3 RT-PCR产物电泳结果 Fig. 3 Electrophoresis of RT-PCR analysis of E. grandiflorum S M: Marker Ⅲ (Tiangen,China); WT-1WT-2: Negative controls,wild-type; L1-L3: Different transformants |
β-类胡萝卜素羟化酶(CHYB)是类胡萝卜素代谢途径中的一个关键酶,过表达该基因对整个类胡萝卜素代谢途径产生很大的影响,从而影响植株的表型使其产生一定的变化。
通过观察,转基因洋桔梗的叶片呈深绿色且叶片更圆,而野生型洋桔梗的叶片呈翠绿色且为长条形。
转入LcCHYB基因的洋桔梗及野生型洋桔梗的表型如图 4所示。

|
| 图 4 转基因洋桔梗叶片形态变化 Fig. 4 The leaf changes between wild line and transformants WT:Wild type;L3:Transformant line |
在氧化胁迫条件下,由于细胞内产生大量ROS,导致叶绿体膜过氧化并大量生成三线态叶绿素,造成植物光合作用不能正常进行[12],进而打破植物胞内的代谢平衡,因此光合作用是检验植物对氧化胁迫的耐受性的重要指标。本实验所测的光合荧光参数包括Fv/Fm,ФPSⅡ、qP和NPQ,结果如表 4所示。
从结果可知,对照组中L3与WT的各荧光参数值均没有显著差异。
实验组L3的Fv/Fm值和对照组相比,也没有显著差异,但是WT的Fv/Fm值则显著低于对照组,下降约33%;实验组中L3的ФPSⅡ值和对照组相比,也不存在显著差异,但是WT的ФPSⅡ值则显著低于对照组,下降约42%。
另外实验组中,L3的qP值均值高于WT,差值为0.07,但是从误差分析来看两者之间没有显著差异,这说明导入LcCHYB基因对洋桔梗叶片光化学淬灭的影响不大。
实验组中,WT的NPQ值显著降低,下降值为0.02,和对照组相比降低14%;但L3的NPQ值在胁迫条件下则显著高于对照组,提高至0.21,相比对照组L3提高了40%。
通过进一步计算,结果显示在10%过氧化氢胁迫下,实验组L3和WT的光合荧光参数相对差值之间存在显著差异,其中,相差最大的是NPQ值,ФPSⅡ值和Fv/Fm值次之,相差最小的是qP值。
| WT | L3 | ||
| Fv/Fm | 0.89±0.02 | 0.91±0.04 | |
| 对照 | ФPSⅡ | 0.55±0.04 | 0.60±0.05 |
| 组值 | qP | 0.77±0.03 | 0.80±0.02 |
| NPQ | 0.14±0.01 | 0.15±0.02 | |
| Fv/Fm | 0.60±0.03 | 0.87±0.03* | |
| 实验 | ФPSⅡ | 0.32±0.01 | 0.58±0.06** |
| 组值 | qP | 0.72±0.01 | 0.79±0.02 |
| NPQ | 0.12±0.01 | 0.21±0.03** | |
| * P<0.05; ** P<0.01 | |||
类胡萝卜素是一类重要的抗氧化剂,它能直接淬灭单线态氧,其抗氧化能力与分子所含共轭双键的多少成正比[13],叶黄素循环位于经典类胡萝卜素生物合成途径的尾段,所包含的玉米黄质、花药黄质和紫黄质均是具有多共轭双键的类胡萝卜素,具有很强的抗氧化性,同时叶黄素循环也能促发NPQ,将光合作用中产生的过多能量以热能的形式耗散出去以减少ROS等氧化性自由基产生[5],因此玉米黄质及叶黄素循环池的容量是植物对氧化胁迫耐受能力的重要指标。
本实验利用高效液相色谱(HPLC)分析经10% 过氧化氢处理的野生型和转基因植株,结果如表 5所示。
从结果可以看出,对照组中,L3的各类主要胡萝卜素组分含量均显著高于WT,其中总类胡萝卜素、β-类胡萝卜素、玉米黄质、叶黄素循环池和叶黄质的含量分别提高28.1%、17.6%,16.5%,33.7%和22.8%。
| 色素种类及含量 | WT | L3 |
| 对照组 | ||
| Zeaxanthin | 6.89±0.63 | 8.03±0.48* |
| Antheraxanthin | 3.12±0.19 | 4.89±0.22* |
| Violaxanthin | 8.49±0.68 | 10.03±2.08* |
| β-carotene | 7.94±0.42 | 9.34±0.66* |
| Neoxanthin | 6.17±0.64 | 7.52±0.23 |
| Lutein | 45.88±4.56 | 56.32±3.20 |
| VAZ | 18.20±1.22 | 24.33±1.88* |
| Total | 78.81±2.09 | 100.98±3.62* |
| 实验组 | ||
| Zeaxanthin | 4.32±0.28 | 11.74±0.92** |
| Antheraxanthin | 2.20±0.10 | 7.89±0.72* |
| Violaxanthin | 8.03±0.72 | 13.97±1.34* |
| β-carotene | 5.58±0.67 | 8.54±0.59* |
| Neoxanthin | 4.97±0.32 | 7.89±0.40** |
| Lutein | 32.0±3.01 | 49.59±4.78* |
| VAZ | 15.05±1.04 | 34.28±3.01* |
| Total | 57.62±2.96 | 98.30±5.01** |
| * P<0.05 ** P<0.01 | ||
实验组中,L3的总类胡萝卜素含量较对照组没有显著差异,但是有下调的趋势,WT的总类胡萝卜素则发生显著下调,下调的数值是L3下调量的7.91倍。
同时,经过过氧化氢处理后,L3和WT的叶黄质和β-类胡萝卜素含量均发生显著下调,其中WT下调的数值分别是L3的2.06倍和2.95倍。
实验组中,L3和WT的玉米黄质和叶黄素循环池也发生了相应的变化。实验组中,L3的玉米黄质和叶黄素循环池含量均显著高于WT,分别高出7.42 μg/g 和19.23μg/g。和对照组相比,实验组L3的玉米黄质和叶黄素循环分别提高3.71 μg/g和9.95 μg/g,叶黄素循环较对照组扩大1.41 倍,相比之下,WT植株的相应含量则显著下调,分别降低2.57μg/g和3.15 μg/g。 2.6 SOD、POD、CAT和MDA值的分析
植物在长久的进化中,自有一套应对氧化胁迫的酶促系统,其中包括超氧化物歧化酶(SOD)、过氧化物歧化酶(POD)、过氧化氢酶(CAT)和丙二醛(MDA)等。该系统的强弱由这些酶的酶活来表征,同时也是影响植物氧化胁迫耐受性最重要的指标之一。
经测量,各组的SOD、POD、CAT和MDA值如图 5所示。从图中可以看出,对照组中,L3和WT的SOD、POD、CAT和MDA值均没有显著差异,但是实验组的L3和WT的SOD和POD值均上调,CAT和MDA值没有显著差异。
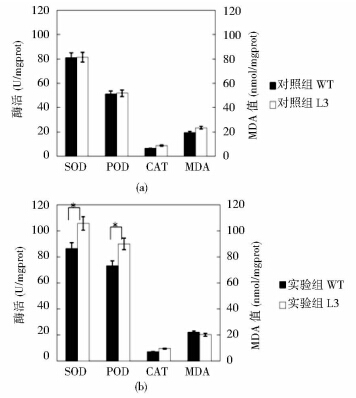
|
| 图 5 转基因和野生型洋桔梗在正常及胁迫条件下SOD、POD、CAT和MDA值 Fig. 5 The value of SOD,POD,CAT and MDA of the transgenic and wild type Eustoma grandiflorum under normal condition(a) and stress(b) |
其中,SOD值L3和WT较对照组分别提高了24.50 U/mgprot和5.62 U/mgprot,POD值分别提高了38.11 U/mgprot 和22.27 U/mgprot,实验组L3的SOD值和POD值相对WT的涨幅分别是WT的4.36倍和1.71倍。 3 讨 论
本文将来自枸杞的LcCHYB基因导入洋桔梗中并通过PCR和RT-PCR进行分子检测,共得到3个转基因细胞系。
对洋桔梗施加10%过氧化氢胁迫处理20 min,并检测其光合荧光参数、类胡萝卜素含量和抗氧化酶活性(SOD、POD、CAT和MDA),发现导入LcCHYB基因后,洋桔梗氧化胁迫耐受性显著升高,不仅类胡萝卜素含量提高,其对抗氧化酶促系统也产生了有益的影响。
目前,关于CHYB基因的研究基本都基于高光胁迫或紫外胁迫。2002年,Gotz等人[8]将克隆自细菌的外源类胡萝卜素羟化酶基因(CRTZ)转入烟草,加强了玉米黄质的生物合成途径,玉米黄质得到大量积累,从而提高了植株的UV抗性。2012年本研究室赵清等[14]将来自拟南芥中的CHYB基因转入烟草,发现烟草中叶黄质含量提高后改善了其UV抗性。武卫党等人[11]继续在洋桔梗中过表达AtCHYB基因,并在洋桔梗生长过程中施以高光胁迫,研究了该基因的产物——玉米黄质的积累提高了植物对高光胁迫的抗逆性。因此本文的结果与上述研究结果得出类似结论,洋桔梗中过表达LcCHYB提高了抗氧化性。
另外本研究培育出具有氧化胁迫强耐受性的洋桔梗,为进一步研究类胡萝卜素对植物抗氧化应激系统的影响提供了植物材料和实验基础,同时将大大有利于洋桔梗作为切花资源的市场推广。
| [1] | Davies K, Winefield C, Lewis D.Research into control of flower colour and flowering time in Eustoma grandiflorum (Lisanthus). Flowering Newsletter, 1997, 23: 24-32. |
| [2] | Asada K, Takahashi M. Production and scavenging of active oxygen in photosynthesis. Photoinhibition, 1987:227-287. |
| [3] | Bouvier F, Backhaus RA, Camara B. Induction and control of chromoplast-specific carotenoid genes by oxidative stress. Journal of Biological Chemistry, 1998, 273(46):30651-30659. |
| [4] | Chen X,Han H,Jiang P, et al, Transformation of β Lycopene cyclase genes from Salicorniaeuropaea and Arabidopsis conferred salt tolerance in Arabidopsis and Tobacco. Plant Cell Physiol,2011,52(5): 909 921. |
| [5] | Ji J, Wang G, Wang J, et al. Functional analysis of multiple carotenogenic genes from Lycium barbarum and Gentiana lutea L. for their effects on β-carotene production in transgenic tobacco..Biotechnology Letters, 2009, 31(2):305-312. |
| [6] | Demmig-Adams B, Adams W W.Antioxidants in photosynthesis and human nutrition.Science, 2002, 298(5601):2149-2153. |
| [7] | Triantaphylidès C, Havaux M. Singlet oxygen in plants: production, detoxification and signaling.Trends Plant Sci, 2009, 14(4):219-228. |
| [8] | Gotz T, Sandmann G, Romer S.Expression of a bacterial carotene hydroxylase gene (crtZ) enhances UV tolerance in tobacco. Plant Molecular Biology, 2002, 50(1): 129-142. |
| [9] | Wang M, Wang G, Ji J. Suppression of the phytoene desaturase gene influence on the organization and function of photosystem II (PSII) and antioxidant enzyme activities in tobacco. Environmental And Experimental Botany, 2010, 67(3):460-466. |
| [10] | Zhu Y H, Graham J E, Ludwig M, et al. Roles of xanthophyll carotenoids in protection against photoinhibition and oxidative stress in the cyanobacterium Synechococcus sp. strain PCC 7002. Archives of Biochemistry and Biophysics, 2010, 504(1):86-99. |
| [11] | Wu W, Ji J, Wang G., et al. Overexpression of AtchyB in Eustoma grandiflorum shinn enhances its tolerance to high-light via zeaxanthin accumulation. Plant Molecular Biology Reporter, 2012, 30(6):1433-1444. |
| [12] | Havaux M, Niyogi K K. The violaxanthin cycle protects plants from photooxidative damage by more than one mechanism. Proceedings of the National Academy of Sciences, 1999, 96(15):8762-8767. |
| [13] | Perez-Galvez A. Minguez-Mosquera MI. Structure-reactivity relationship in the oxidation of carotenoid pigments of the pepper (Capsicum annuum L).Journal of Agricultural and Food Chemistry, 2001, 49(10):4864-4869. |
| [14] | Qing Z, Gang W, Jing J, et al. Over-expression of Arabidopsis thaliana β-carotene hydroxylase (chyB) gene enhances drought tolerance in transgenic tobacco. Journal of Plant Biochemistry and Biotechnology, 2014, 23 (2):190-198. |
 2015, Vol. 35
2015, Vol. 35



 ,
, 