文章信息
- 易守会, 王东林, 吴志鹃, 杨文影, 赵启成, 陈晓品
- YI Shou-hui, WANG Dong-lin, WU Zhi-juan, YANG Wen-ying, ZHAO Qi-cheng, CHEN Xiao-pin
- MUC1对人结肠癌细胞HCT116生物学行为的影响
- Effect of MUC1 on Biological Behaviour of Human Colorectal Cancer Cell HCT116
- 中国生物工程杂志, 2015, 35(1): 15-20
- China Biotechnology, 2015, 35(1): 15-20
- http://dx.doi.org/10.13523/j.cb.20150102
-
文章历史
- 收稿日期:2014-10-24
- 修回日期:2014-11-27
2. 重庆市肿瘤医院 重庆 400011
2. Department of Oncology, Chongqing Cancer Hospital, Chongqing 400011, China
结直肠癌(colorectal carcinoma,CRC)发病率在肿瘤中居第三位,且其发病率逐年升高。在结直肠癌发病早期,90%的患者可通过手术治疗痊愈,但大部分患者在确诊时已是中晚期,虽经手术和放化疗等综合治疗,结果仍预后差并且产生肿瘤耐药[1,2]。
MUC1是一个大分子跨膜糖蛋白,由细胞膜外部分、跨膜部分和膜内部分组成,最先由Shimizu[3]于1982年从人的乳汁中分离得到,编码基因位于lq21。MUC1正常表达于导管上皮细胞管腔面,在上皮来源的肿瘤组织中高表达,异常糖基化,失去极性,分布于整个细胞表面。MUC1的胞外段可作为受体与其配体结合,或作为配体与其受体相互作用,胞内段与多条信号通路相互联系,在肿瘤的增殖、侵袭转移和化疗耐药中起重要作用[4,5]。
MUC1作为一个癌蛋白在乳腺癌的研究中较为深入。为了研究MUC1在结肠癌中的作用,本实验以MUC1表达阴性的人结肠癌细胞株HCT116为主要研究对象,通过慢病毒转染获得稳定表达MUC1的HCT116细胞株,观察MUC1对细胞增殖、侵袭和化疗敏感性的影响。 1 材料与方法 1.1 材料及试剂
人结肠癌细胞株HCT116由本实验室保存。MUC1慢病毒表达载体由上海吉凯基因技术有限公司构建。RPMI1640、DMEM高糖培养基、胎牛血清(美国Hyclone公司);细胞总蛋白质提取试剂盒(上海贝博公司)、MUC1鼠单克隆抗体(美国Santa Cruz公司)、β-actin鼠单克隆抗体、山羊抗鼠IgG抗体-HRP标记(北京中杉金桥公司);Trizol试剂、PCR kit试剂盒(日本TaKaRa公司);Matrigel基质胶(美国BD公司);MTT、DMSO、Annexin V-PE/7-AAD试剂盒(美国Sigma公司);CCK试剂盒、Caspase-3活性检测试剂盒(碧云天)。SDS-PAGE蛋白质电泳仪、蛋白质转膜仪(美国Bio-Rad公司);PCR仪(美国Applied Biosysems公司);凝胶成像系统(美国Bio-Rad公司)。引物采用软件Primer 5.0设计,由上海生工技术有限公司合成。 1.2 方 法 1.2.1 细胞培养
人结肠癌细胞HCT116在含10%胎牛血清和双抗(100U/ml青霉素和0.1mg/ml链霉素)的RPMI1640 (1640,Hyclone)培养基中于37℃和5% CO2的孵育箱中培养。 1.2.2 细胞转染
在6孔板里接种2×104个细胞,培养24h后,取MOI值为40将含有MUC1表达片段的慢病毒(LV-MUC1)和空白对照慢病毒(Vector)分别感染HCT116细胞,病毒感染的同时加入5μg/ml的聚凝胺(polybrene)以增加感染效率,感染第二天去除含病毒的培养基更换为完全培养基,48h后加入2μg/ml的嘌呤霉素筛选,以后以1μg/ml的嘌呤霉素维持培养。实验分为MUC1病毒组和空病毒组。 1.2.3 半定量RT-PCR
收集对数生长期的细胞,采用Trizol法提取细胞总RNA,通过半定量RT-PCR分析MUC1 mRNA表达。MUC1上游引物为5′-GCACCGACTACTACCA AGAG-3′,下游引物为5′-AAGGAAATGGC ATCACT-3′,退火温度55℃,扩增片段大小258bp;B-actin上游引物5′-TGACGTGGAC ATCCGCAAAG-3′,下游引物5′-CTGGAAG GTGGACAGCGAGG-3′,退火温度60℃,扩增片段大小205bp。 1.2.4 Western blot实验
提取细胞总蛋白质并定量,调整蛋白质上样量至相同水平进行SDS-PAGE电泳,电泳完毕后,200mA转膜2h之后加5%脱脂奶粉37℃封闭1h;加1∶200稀释的MUC1抗体、1∶1500稀释的β-actin抗体,4℃过夜;TBST洗涤,加1∶2500稀释的二抗,37℃孵育1h,TBST洗涤后ECL发光。 1.2.5 CCK法检测细胞增殖
分别消化MUC1病毒组细胞和空病毒组细胞,按4000个/孔接种于96孔板培养,设置5个时间点(6h、24h、48h、72h和96h),每个时间点设置5个孔,37℃、5% CO2孵箱中培养至各时间点,CCK法检测450nm吸光度值,实验共重复3次。 1.2.6 软琼脂克隆形成实验
用蒸馏水制备1.2%和0.7%的低溶点琼脂糖液,高压灭菌后,40℃水浴保温。1.2%的琼脂糖与2×DMEM(含有2×抗生素和20%的胎牛血清)按1∶1混匀后,2.5ml/孔加入6孔板,室温下冷却(30min)至凝固,作底层琼脂。分别消化MUC1病毒组细胞和空病毒组细胞,并计数细胞50×104ml-1。底层琼脂冷却后,按1∶1加入0.7%的琼脂糖与2×DMEM培养液,并加入20μl细胞悬液混匀后,1.0ml/孔注入铺有底层琼脂的6孔板,每孔含1×104个细胞。待上层琼脂凝固后,放入37℃、5% CO2孵箱中培养2周后,置于倒置显微镜下观察细胞克隆形成情况,随机选择3个视野进行克隆计数(含有30个细胞以上的集落计为1个克隆),取其平均值作为克隆的形成数。 1.2.7 Transwell侵袭实验
取50mg/L的matrigel,按1∶8稀释,各室加入100μl,放入37℃培养箱中,凝固后取出,用1640洗两遍。分别消化MUC1病毒组和空病毒组细胞,用1640洗2遍,用1640重悬并计数为50×104/ml,先向每个Transwell小室下室加入600μl含10%胎牛血清的1640培养液,再向每个小室上室加入200μl细胞悬液(1×105 cells),将板置于37℃、5% CO2孵箱中培养48h,用无菌棉签擦除上室内细胞,用PBS洗两遍,4%多聚甲醛固定30min,0.1%结晶紫染色,于倒置显微镜下选取3个不同视野计数穿过膜的细胞数,并采集图像。 1.2.8 MTT法测奥沙利铂24h IC50
分别消化MUC1病毒组和空病毒组细胞,并计数细胞,按4 000个/孔接种于96孔板培养,待细胞长至70%密度时,加入0μg/ml、2μg/ml、4μg/ml、8μg/ml和64μg/ml奥沙利铂培养24h,MTT法检测490nm吸光度值。每一浓度设置5个复空,实验重复3次。 1.2.9 流式细胞仪检测细胞凋亡
分别消化MUC1病毒组和空病毒组细胞,并计数细胞,按10×104个/孔接种于6孔板,待细胞长至70%密度时,加奥沙利铂(5μg/ml)培养36h后,按Annexin V-PE/7-AAD试剂盒操作手册进行。重悬细胞于50μl Binding Buffer和5μl 7-AAD混合液中,室温、避光、反应10min,加入450μl Binding Buffer和1μl Annexin V-PE,室温、避光、反应10min,流式细胞仪分析。 1.2.10 Caspase-3活性检测
分别消化MUC1病毒组和空病毒组细胞,并计数细胞,按10×104个/孔接种于6孔板,待细胞长至70%密度时,加奥沙利铂(5μg/ml)培养36h后收集细胞。加100μl裂解液,冰浴15min,4℃16 000转离心15min,收集上清液,按照Caspase-3活性检测试剂盒说明书所示具体步骤操作,用酶标仪检测405nm吸光度值。 1.2.11 统计学处理
使用prism 5.0统计软件对结果进行统计分析,数据用Mean±SEM表示,采用t检验,P<0.05为差异有统计学意义。 2 结 果 2.1 细胞转染
慢病毒转染HCT116细胞后经嘌呤霉素筛选在荧光显微镜下观察转染率达90%以上(图 1)。半定量RT-PCR结果表明MUC1 mRNA在 MUC1病毒组表达,在空病毒组不表达(图 2)。Western blot结果显示,MUC1蛋白在MUC1病毒组表达,在空病毒组不表达(图 2)。
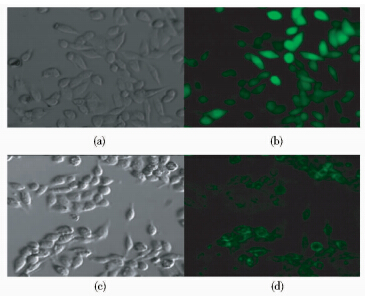
|
| (a) Control lentivirus group white light (b) Control lentivirus group fluorescence (c) MUC1 lentivirus group white light (d) MUC1 lentivirus group fluorescence 图 1 慢病毒转染HCT116细胞的荧光图片(100×) Fig. 1 Fluorescence microscopc mages of HCT116 cells infected with lentivirus(100×) |
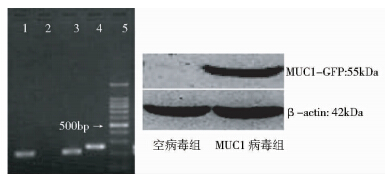
|
| 1: Control lentivirus group β-actin; 2: Control lentivirus group MUC1; 3: MUC1 lentivirus group β-actin; 4: MUC1 lentivirus group MUC1; 5: Maker 图 2 慢病毒转染HCT116细胞MUC1 mRNA和MUC1蛋白表达 Fig. 2 Expression of MUC1 mRNA and MUC1 protein in HCT116 cells after transfected with lentivirus |
根据各个时间点所测的OD值(450nm)绘制细胞生长曲线。结果表明,MUC1病毒组与空病毒组的细胞增殖无差异(图 3);软琼脂克隆形成实验显示,与空病毒组相比,MUC1病毒组软琼脂克隆形成能力明显增强[(26.0±2.31) vs (5.67±1.45) (P<0.05)] (图 4)。以上实验表明,MUC1对细胞的贴壁生长无显著影响,但能增强细胞的非锚定依赖生长能力。
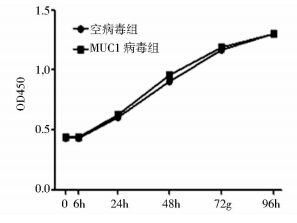
|
| 图 3 细胞生长曲线 Fig. 3 Cell growth curve |
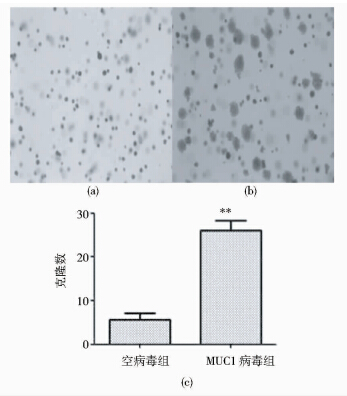
|
| (a) Control lentivirus group (b) MUC1 lentivirus group(c) Histogram 图 4 软克隆形成实验(40×) Fig. 4 Soft agar colony formation assay (40 ×) |
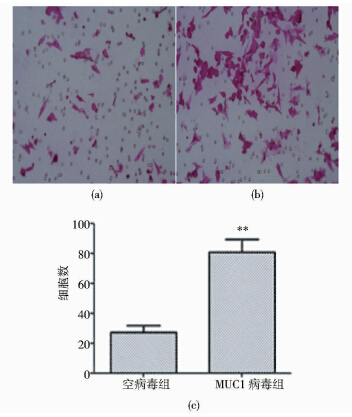
通过Transwell实验检测MUC1对HCT116细胞侵袭能力的影响。MUC1病毒组穿过小室纤维素膜的细胞数与空病毒组相比有明显差异[(27.3±4.41) vs (81.0±8.14) (P<0.05)](图 5)。
|
| (a) Control lentivirus group (b) MUC1 lentivirus group(c) Histogram 图 5 Transwell实验(200×) Fig. 5 Transwell migration assay (200 ×) |
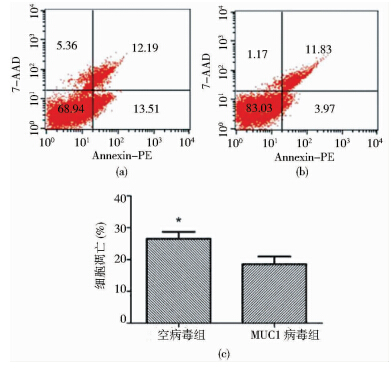
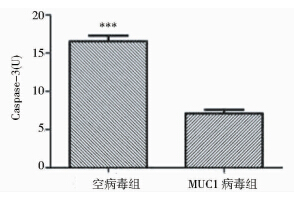
由MTT实验所得OD值采用prism 5.0统计软件计算IC50,两组细胞奥沙利铂作用24h后人IC50分别为:空病毒组IC50为14.27±0.25,MUC1病毒组IC50为26.03±0.20。奥沙利铂(5μg/ml)处理细胞36h后,流式细胞仪检测两组细胞的凋亡,凋亡率分别为26.6±1.22、18.5±1.44(图 6)。以上结果显示,转染MUC1后细胞对奥沙利铂的敏感性降低(P<0.05)。奥沙利铂(5μg/ml)处理细胞36h后,酶底物反应法检测两组细胞的Caspase-3活性,两组细胞的Caspase-3活性(U)分别为16.56±0.73、7.11±0.49(P<0.05) (图 7)。结果显示,MUC1降低结肠癌细胞对奥沙利铂的敏感性与Caspase-3活性相关。
|
| (a) Control lentivirus group (b) MUC1 lentivirus group(c) Histogram 图 6 流式细胞仪检测细胞调亡 Fig. 6 Flow cytometry apoptosis |
|
| 图 7 Caspase-3活性 Fig. 7 Caspase-3activity |
MUC1作为一个癌蛋白与肿瘤的发生、发展及耐药密切相关。为了研究MUC1对人结肠癌细胞HCT116的影响,我们通过慢病毒转染、嘌呤霉素筛选、半定量RT-PCR和Westernb blot鉴定,获得稳定表达MUC1的HCT116细胞株。
CCK法检测细胞增殖结果显示,空病毒组细胞与MUC1病毒组细胞的增殖无差异;软琼脂克隆形成实验结果显示,MUC1病毒组的克隆形成数大于空病毒组。以上实验表明MUC1对HCT116细胞的贴壁生长没有影响,但能显著增强HCT116细胞的非锚定依赖生长能力。Tamada等[6]使用MUC1基因转染ES-2透明腺癌细胞系得到表达MUC1的ES-2细胞系和不表达MUC1的对照细胞系,经过体外和体内实验发现,MUC1对ES-2细胞的体外生长无影响,但是能促进ES-2细胞的体内生长。Li等[7]的研究发现,大鼠3Y1细胞过表达人MUC1能够诱导细胞发生恶性转化,并增加其软琼脂克隆形成能力。
Transwell的实验结果显示,MUC1病毒组穿过小室纤维素膜的细胞数明显多于空病毒组,表明MUC1能增强结肠癌细胞的侵袭能力。研究发现,MUC1与肿瘤的侵袭转移有关,在患者的转移灶和循环肿瘤细胞中发现高水平MUC1的表达[8]。Hom等[9]的研究发现,小鼠乳腺肿瘤细胞DA3转染MUC1后,细胞间质标志物表达水平升高,上皮标志物表达水平降低,细胞通过基质胶的能力增强。Chen等[10]发现,PI3K/Akt/mTOR途径的激活可通过诱导MMP9的表达,降解细胞外基质,利于肿瘤细胞的侵袭和转移。已往的研究表明,MUC1与PI3K→Akt信号通路有关,MUC1-CY20HPM区酪氨酸(Tyr-20)的磷酸化使MUC1-C和PI3Kp85调节亚基的Src同源区2(SH2)结构域相互作用,阻止PI3Kp85亚单位对P110催化亚基的抑制,激活PI3K→Akt信号通路[11,12]。此外,MMP-9的启动子区含有NF-κB的结合位点[13],MUC1-C与NF-κB信号通路有关,其可以直接和IKKβ-IKKγ复合体相互作用,诱导IκBα降解,释放RelA进入细胞核,从而激活NF-κB信号通路[14]。但是MUC1促进侵袭转移的具体机制还不是很清楚,需要进一步的研究。
转移性结肠癌最主要的治疗方式是化疗,奥沙利铂是转移性结肠癌一线治疗的主要用药,但随着其在临床的运用,耐药问题逐步凸现出来。研究报道,MUC1的过表达阻止基因毒性抗癌药物诱导的细胞凋亡[15,16]。Deng等[17]用siRNA抑制胃癌细胞MUC1表达,使胃癌细胞对曲妥珠单抗的敏感性增加。研究表明,合并使用MUC1-C的胞内段抑制剂GO-201/203和化疗药物,可以增加化疗药物的敏感性,增加肿瘤细胞的凋亡[18]。本研究发现,转染MUC1后,奥沙利铂作用细胞24h后IC50显著升高(P<0.05);奥沙利铂(5μg/ml)处理细胞36h后,空病毒组细胞的凋亡率约为MUC1病毒组细胞的1.5倍,提示MUC1可降低结肠癌细胞对奥沙利铂的敏感性。以往的研究发现,MUC1阻止药物诱导的DNA损伤导致的细胞凋亡可能通过以下机制:①MUC1-C定位于线粒体外膜,减弱线粒体细胞色素c的释放[19],MUC1-C直接与Bax相结合阻断Bax激活线粒体凋亡途径的功能[20];②在细胞质中黏蛋白与c-Abl相结合,阻止c-Abl入核从而抑制细胞凋亡[16]。本研究发现,MUC1可以显著降低奥沙利铂作用细胞后Caspase-3的活性,提示MUC1降低结肠癌细胞对奥沙利铂的敏感性与Caspase-3活性相关。
本实验通过慢病毒转染获得稳定表达MUC1的人结肠癌细胞株HCT116,发现转染MUC1后,细胞的软琼脂克隆形成能力明显增高、侵袭能力增强、对奥沙利铂的化疗敏感性降低。初步探讨MUC1耐药机制发现这可能与Caspase-3的活性相关。但对于引起Caspase-3活性下降的具体机制需要进一步的研究。总的来说,本研究为结肠癌的治疗提供了一个新思路,有可能通过抑制MUC1促进结肠癌细胞凋亡、抑制结肠癌细胞侵袭、提高结肠癌细胞对奥沙利铂的敏感性,从而抑制结肠癌的发展。
| [1] | Jemal A, Bray F, Center M M, et al. Global cancer statistics. CA Cancer J Clin, 2011, 61(2):69-90. |
| [2] | Siegel R, DeSantis C, Virgo K, et al. Cancer treatment and survivorship statistics, 2012. CA Cancer J Clin, 2012, 62(4):220-241. |
| [3] | Shimizu M, Yamauchi K. Isolation and characterization of mucin-like glycoprotein in human milk fat globule membrane. J Biochem, 1982, 91(2):515-524. |
| [4] | Nath S, Mukherjee P. MUC1: a multifaceted oncoprotein with a key role in cancer progression. Trends Mol Med, 2014, 20(6):332-342. |
| [5] | Kufe D W. MUC1-C oncoprotein as a target in breast cancer: activation of signaling pathways and therapeutic approaches. Oncogene, 2013, 32(9):1073-1081. |
| [6] | Tamada Y, Takeuchi H, Suzuki N, et al. Biological and therapeutic significance of MUC1 with sialoglycans in clear cell adenocarcinoma of the ovary. Cancer Sci, 2007, 98(10):1586-1591. |
| [7] | Li Y Q, Liu D, Chen D S, et al. Human DF3/MUC1 carcinoma-associated protein functions as an oncogene. Oncogene, 2003, 22(38):6107-6110. |
| [8] | Horm T M, Schroeder J A. MUC1 and metastatic cancer expression, function and therapeutic targeting. Cell Adhes Migr, 2013, 7(2):187-198. |
| [9] | Horn G, Gaziel A, Wreschner D H, et al. ERK and PI3K regulate different aspects of the epithelial to mesenchymal transition of mammary tumor cells induced by truncated MUC1. Exp Cell Res, 2009, 315(8):1490-1504. |
| [10] | Chen J S, Wang Q, Fu X H, et al. Involvement of PI3K/PTEN/AKT/mTOR pathway in invasion and metastasis in hepatocellular carcinoma: Association with MMP-9. Hepatol Res, 2009, 39(2):177-186. |
| [11] | Raina D, Kharbanda S, Kufe D. The MUC1 oncoprotein activates the anti-apoptotic phosphoinositide 3-kinase/Akt and Bcl-x(L) pathways in rat 3Y1 fibroblasts. J Biol Chem, 2004, 279(20):20607-20612. |
| [12] | Raina D, Kosugi M, Ahmad R, et al. Dependence on the MUC1-C oncoprotein in non-Small cell lung cancer cells. Mol Cancer Ther, 2011, 10(5):806-816. |
| [13] | Kim Y, Kang H, Jang S W, et al. Celastrol inhibits breast cancer cell invasion via suppression of NF-kappa B-mediated matrix metalloproteinase-9 Expression. Cell Physiol Biochem, 2011, 28(2):175-184. |
| [14] | Ahmad R, Raina D, Trivedi V, et al. MUC1 oncoprotein activates the I kappa B kinase beta complex and constitutive NF-kappa B signalling. Nat Cell Biol, 2007, 9(12):U1419-U1146. |
| [15] | Ren J, Agata N, Chen D S, et al. Human MUC1 carcinoma-associated protein confers resistance to genotoxic anticancer agents. Cancer Cell, 2004, 5(2):163-175. |
| [16] | Raina D, Ahmad R, Kumar S, et al. MUC1 oncoprotein blocks nuclear targeting of c-Abl in the apoptotic response to DNA damage. Embo J, 2006, 25(16):3774-3783. |
| [17] | Deng M, Jing D D, Meng X J. Effect of MUC1 siRNA on drug resistance of gastric cancer cells to trastuzumab. Asian Pac J Cancer Prev, 2013, 14(1):127-131. |
| [18] | Raina D, Uchida Y, Kharbanda A, et al. Targeting the MUC1-C oncoprotein downregulates HER2 activation and abrogates trastuzumab resistance in breast cancer cells. Oncogene, 2014, 33(26):3422-3431. |
| [19] | Ren J, Raina D, Chen W, et al. MUC1 oncoprotein functions in activation of fibroblast growth factor receptor signaling. Mol Cancer Res, 2006, 4(11):873-883. |
| [20] | Ahmad R, Alam M, Rajabi H, et al. The MUC1-C oncoprotein binds to the BH3 domain of the pro-apoptotic BAX protein and blocks BAX function. J Biol Chem, 2012, 287(25):20866-20875. |
 2015, Vol. 35
2015, Vol. 35




