扩展功能
文章信息
- 王璐, 郝馨凝, 尚猛, 姜宛均, 汪子豪, 郭忱然, 冀好强, 王振旭, 刘起勇
- WANG Lu, HAO Xin-ning, SHANG Meng, JIANG Wan-jun, WANG Zi-hao, GUO Chen-ran, JI Hao-qiang, WANG Zhen-xu, LIU Qi-yong
- 2022-2023年内蒙古东部地区布氏田鼠病原体携带状况调查
- Investigation on pathogens carried by Lasiopodomys brandtii in eastern Inner Mongolia, China, 2022-2023
- 中国媒介生物学及控制杂志, 2025, 36(2): 268-273
- Chin J Vector Biol & Control, 2025, 36(2): 268-273
- 10.11853/j.issn.1003.8280.2025.02.020
-
文章历史
- 收稿日期: 2024-09-18
2 传染病溯源预警与智能决策全国重点实验室, 中国疾病预防控制中心传染病预防控制所媒介生物控制室, 世界卫生组织媒介生物监测与管理合作中心, 北京 102206;
3 南京医科大学公共卫生学院, 江苏 南京 211166
2 National Key Laboratory of Intelligent Tracking and Forecasting for Infectious Diseases, Department of Vector Biology and Control, National Institute for Communicable Disease Control and Prevention, Chinese Center for Disease Control and Prevention, WHO Collaberating Centre for Vector Surveillance and Management, Beijing 102206, China;
3 School of Public Health, Nanjing Medical University, Nanjing, Jiangsu 211166, China
布氏田鼠(Lasiopodomys brandtii)是啮齿目(Rodentia)仓鼠科(Cricetidae)田鼠亚科(Microtinae)毛足田鼠属(Lasiopodomys)的小型哺乳动物,是田鼠型鼠疫耶尔森菌(Yersinia pestis,鼠疫菌)的主要宿主,也是锡林郭勒地区肝毛细线虫的主要宿主之一[1],还能够传播巴尔通体、立克次体等多种病原体[2-3]。布氏田鼠在我国主要分布于内蒙古自治区(内蒙古)锡林郭勒盟北部和呼伦贝尔市西北部的典型草原区[4],国外主要分布于蒙古国中部、东部及俄罗斯外贝加尔山脉地区[5],其种群密度高、营群居生活和繁殖力强的特点既提高了种群扩张的速度也增加了病原体传播的概率。内蒙古地区属于温带大陆性气候,其夏季温暖湿润、冬季寒冷干燥的气候特点营造了明显的气候梯度,适宜啮齿类动物生长,也为鼠类营造了良好的栖息环境[6]。
为了解内蒙古东部锡林郭勒盟、呼伦贝尔和通辽市的布氏田鼠病原体携带情况,本研究在布氏田鼠活跃度高的地区设置捕获样地采样并进行鼠传病原体检测,为当地鼠源疾病防控提供科学依据。
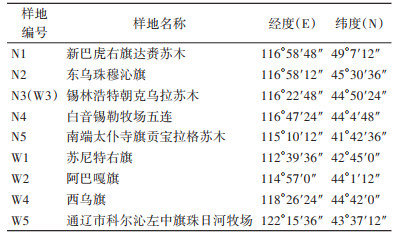
1 材料与方法 1.1 样品采集在内蒙古自北向南(N1-N5)、自西向东(W1-W5)设置9个调查样地(其中N3和W3重合为一地),见表 1。2022-2023年5、7、9月参照《全国病媒生物监测实施方案》,以花生米为诱饵采用鼠夹法和鼠笼法进行调查,鼠夹法通过标准大号钢板鼠夹300夹间隔5 m进行捕获,鼠笼法通过间隔5 m或洞口布笼的方式进行捕获。
|
捕获鼠捡取后1鼠1袋用异氟烷麻醉,按照《啮齿动物学(第二版)》[7]进行形态学鉴定,并记录捕获时间、地点、性别、体质量及体表寄生虫等,解剖后取肝、脾、肾、肺等器官装入冻存管置于-80 ℃保存待检。
1.2 核酸提取剪取肝、脾、肺3种组织总量约绿豆粒大小的样本置于研磨管中,加入200 µl磷酸盐缓冲液(phosphate buffer saline,PBS)及少量1 mm研磨珠(塞维尔生物科技有限公司),放入RZ-Gr96高通量研磨仪(北京国科融智生物技术有限公司)研磨,运行参数设置为速度1 600 r/m,研磨30 s暂停10 s,循环3次,所得匀浆离心后取上清液转移至病毒RNA/DNA提取试剂盒(西安天隆生物科技有限公司)第1列和第7列,添加20 µl蛋白酶K,放入TIANLONG NP968核酸提取仪(西安天隆生物科技有限公司),插入搅拌套,设定运行参数后进行自动化提取。程序运行结束后吸取第6列和第12列洗脱液至干净的离心管中,使用ND-1000分光光度计(美国Thermo NanoDrop)进行浓度和纯度测定,DNA浓度在10 ng/μl~100 ng/μl认为浓度良好,过高可能会产生PCR抑制或出现荧光测量问题,过低会导致实验信号弱检测灵敏度降低或测序困难的问题;DNA纯度A260/A280比值在1.8~2.0认为核酸提取良好,比值< 1.8或 > 2.0可能存在污染物质或者核酸降解、浓度过低,需要重新提取样品DNA,测定良好的样品核酸置于-80 ℃冷冻保存。
1.3 PCR扩增核酸提取结束后,针对《全国病媒生物病原学监测方案(试行)》(中疾控传发〔2020〕13号)中所列的6种致病菌和2种病毒进行TaqMan探针荧光定量PCR(real-time quantitative PCR,qPCR)和反转录qPCR(reverse transcription qPCR,RT-qPCR)检测,所需引物和探针由北京擎科生物科技股份有限公司合成,反应体系和PCR反应条件见表 2,阴性对照和阳性对照样本分别为ddH2O和病原体质粒稀释标准品(105~106),设置平行对照,试剂混匀后使用ABI 7500型实时荧光定量PCR仪[赛默飞世尔科技(中国有限)公司]进行扩增检测。

|
将巴尔通体阳性样本测序,PCR扩增RNA聚合酶亚单位基因(rpoB基因),正向引物RpoF:5'-GCACGATTGCATCATCATTTTCC-3',反向引物RpoR:5'-CGCATTATGGTCGTATTTGTCC-3',预期扩增目的片段333 bp。测序引物由北京德奥平生物公司合成,一代测序由生工生物工程(上海)股份有限公司完成,测序结果与美国国立生物技术信息中心(National Center of Biotechnology Information NCBI)数据库中现有巴尔通体序列进行比对,下载同源性较高的作为参考序列,使用MEGA 11.0进行同源性分析,邻接法构建系统进化树,设置Bootstrap值为1 000,模型为Maximum Composite Likelihood,利用软件FigTree v1.4.5查看并美化系统发育树。
1.5 统计学分析使用Excel 2021软件对数据进行整理,IBM SPSS Statistics 27.0进行统计分析,病原体阳性率的比较采用t检验、χ2检验和Fisher确切概率法,P < 0.05为差异有统计学意义。
2 结果 2.1 鼠类捕获情况共捕获鼠类2 013只,其中布氏田鼠1 032只,占捕获总鼠数的51.27%。N1新巴虎右旗达赉苏木捕获布氏田鼠652只,占N1捕获鼠类总数的93.14%(652/700),N2东乌珠穆沁旗捕获216只,占87.45%(216/247),N4白音锡勒牧场五连捕获158只,占95.76%(158/165),W4西乌旗捕获6只,占2.78%(6/216),2023年N4地区9月未捕捉到布氏田鼠。
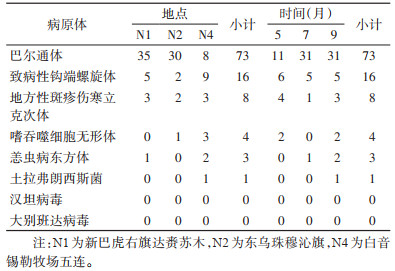
2.2 病原体检测结果N1、N2和N4捕获的布氏田鼠按照采样时间、地点、性别、寄生虫携带状态等分层随机抽样共检测240只,其中巴尔通体(Bartonella)阳性率30.42%(73/240),其后依次是致病性钩端螺旋体(Leptospira)6.67%(16/240)、地方性斑疹伤寒立克次体(Rickettsia typhi)3.33%(8/240)、嗜吞噬细胞无形体(Anaplasma phagocytophilum)1.67%(4/240)、恙虫病东方体(Orientia tsutsugamushi)1.25%(3/240)、土拉弗朗西斯菌(Francisella tularensis)0.42%(1/240),大别班达病毒(Dabie bandavirus)和汉坦病毒(Hantavirus)未检出。见表 3。
|
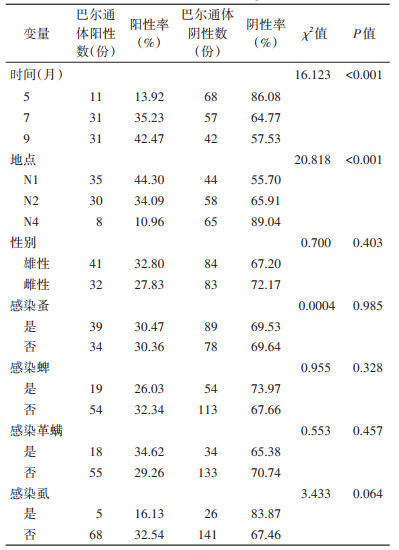
巴尔通体5(春季)、7(夏季)、9(秋季)月阳性率递增,阳性率分别为13.92%(11/79)、35.23%(31/88)和42.47%(31/73),不同季节阳性率差异有统计学意义(χ2=16.123,P < 0.001),见表 4。5月巴尔通体阳性率与7、9月的差异均有统计学意义(χ2=10.036,P=0.002;χ2=15.459,P < 0.001),7月和9月阳性率差异无统计学意义(χ2=0.883,P=0.347)。不同地点巴尔通体阳性率差异有显著统计学意义(χ2=20.818,P < 0.001),自南向北样地月均温逐渐降低,而阳性率逐渐增加;N4与N1、N2的阳性率差异均有统计学意义(χ2=20.795,P < 0.001;χ2=11.840,P < 0.001),而N1和N2间阳性率差异无统计学意义(χ2=1.826,P=0.177)。雄鼠巴尔通体阳性率为32.80%,雌鼠为27.83%,不同性别鼠阳性率差异无统计学意义(χ2=0.700,P=0.403)。染蚤鼠巴尔通体阳性率(30.47%)和未染蚤鼠阳性率(30.36%)差异无统计学意义(χ2=0.000,P=0.985)。
|
致病性钩端螺旋体不同地点阳性率差异有统计学意义(P=0.043),其中N4白音锡勒牧场阳性率最高,为12.33%(9/73),不同月份钩端螺旋体阳性率差异无统计学意义(P=0.900)。
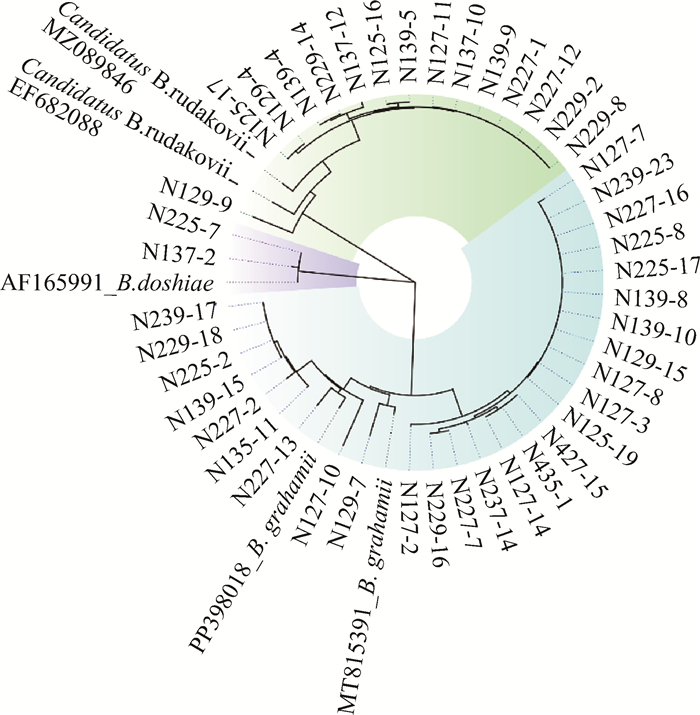
2.3 病原体测序结果共检出73份巴尔通体阳性样本,44份成功使用rpoB基因扩增,所得序列应用NCBI基于局部比对算法的搜索工具(basic local alignment search tool,BLAST)比对,结果显示共3种巴尔通体,分别是格拉汉姆巴尔通体(B. grahamii)、道志巴尔通体(B. doshiae)、Candidatus B. rudakovii,其中新巴尔虎右旗N129-7样本携带的格拉汉姆巴尔通体与柴达木盆地MT株(序列号:MT815391)序列相似性达100%,2株道志巴尔通体N137-2和N225-7都与法国AF株(序列号:AF165991.1)相似性较高,15株N1、N2鼠携带的Candidatus B. rudakovii与捷克共和国2017年欧亚红松鼠(Sciurus vulgaris)脾样品检测到的巴尔通体(序列号:MZ089846.1)以及西西伯利亚田鼠检测到的巴尔通体(序列号:EF682088.1)序列相似性较高。
本研究巴尔通体进化树分析被划分为3大簇。Candidatus Bartonella rudakovii 15株均在N1和N2地区的鼠体内检出,N1、N2 2株道志巴尔通体与法国AF株归为一簇,27株格拉汉姆巴尔通体归为一簇,为内蒙古布氏田鼠感染的优势菌株,在不同月份和地区广泛检出。见图 1。
|
| 注:Candidatus B. rudakovii_MZ089846、Candidatus B. rudakovii_ EF682088为Candidatus Bartonella rudakovii,AF165991_B. doshiae为道志巴尔通体,MT815391_B. grahamii为格拉汉姆巴尔通体。 图 1 2022-2023年内蒙古自治区东部地区捕获布氏田鼠携带巴尔通体基于rpoB基因序列构建的系统进化树 Figure 1 Phylogenetic tree constructed using the rpoB gene sequences of Bartonella carried by Lasiopodomys brandtii captured in eastern Inner Mongolia, 2022-2023 |
| |
布氏田鼠是我国大兴安岭以西到内蒙古中部锡林郭勒草原的典型优势鼠种,锡林郭勒高原为布氏田鼠鼠疫自然疫源地,本研究采样点设置遵循南北温度梯度和东西降水梯度的原则,布氏田鼠仅在同一降水梯度带内的新巴尔虎右旗、东乌珠穆沁旗、白音锡勒区域以及相邻经度的西乌旗区域被捕获,限制其东西扩散的主要因素是植被和水热条件[1]。本次采样自北向南捕获鼠数量递减,2023年白音锡勒地区9月未捕捉到布氏田鼠。有研究表明布氏田鼠种群数量呈现出南部边界范围缩小的趋势,导致该现象产生的原因既与气候变暖驱使啮齿动物适生区北移有关[8],也与北部退化的草地更有利于布氏田鼠栖息有关[5]。
目前针对布氏田鼠感染病原体的研究,主要聚焦于体内寄生虫[9]和鼠疫菌,本次调查发现该鼠的其他致病菌阳性率也较高,巴尔通体的阳性率达到30.42%,且在不同季节和不同地点的差异均有统计学意义。从春季到秋季阳性率递增,秋季达到高峰,与内蒙古其他鼠种的巴尔通体感染情况一致[10-11],空间分布呈现自南向北阳性率递增的趋势,N1呼伦贝尔市新巴尔虎右旗鼠巴尔通体阳性率(44.30%)远高于其他地区,这可能与呼伦贝尔地区布氏田鼠密度高,病原体传播速度快有关。序列比对发现布氏田鼠感染的巴尔通体以B. grahami居多,与既往内蒙古布氏田鼠研究一致[12],该种巴尔通体具有基因交流密切、重组发生频繁的特点,且亚洲种群的序列差异程度相较于欧美地区明显偏高[13],这可能是造成进化树B. grahami处于不同分支的原因。作为人兽共患传染病病原体,巴尔通体普遍存在于啮齿动物、鹿科动物、反刍动物和食肉动物中[14],已有超过15种巴尔通体被认为可引起人畜共患传染病[15],通常会引起猫抓病、战壕热、秘鲁疣等[16-18],目前尚无有效针对巴尔通体的免疫预防方法,仍应通过控制鼠及其体表寄生虫、监测鼠和媒介相关病原体等方法减少巴尔通体的传播。
鼠类作为致病性钩端螺旋体最常见的储存宿主,也被认为是人钩端螺旋体病最重要的传染源[19],钩端螺旋体在鼠体内可随感染动物的尿液排出体外,人类间接暴露于尿液污染的水、潮湿环境或直接接触受感染的动物或其组织而引起疾病的发生[20]。我国幅员辽阔、气候适宜,钩端螺旋体宿主丰富,蒙古国南部紧邻我国内蒙古自治区,钩端螺旋体阳性率高达1/3[21],本次调查发现内蒙古东部草原布氏田鼠钩端螺旋体阳性率为6.67%,提示我国内蒙古地区仍存在钩端螺旋体的潜在威胁,在降雨增多、气候变暖的季节和地区仍应防范鼠源疾病感染的风险。莫氏立克次体是地方性斑疹伤寒的病原体[22],主要在黑龙江、吉林、陕西、甘肃、宁夏、广东、福建、四川、云南等省(自治区)分布[23],本次调查阳性鼠样本的检出提示应加强病例未出现地区的监测,减少病原体随啮齿动物扩散而外溢的可能性。
研究应用Taqman探针法qPCR和RT-qPCR进行病原体检测,该技术具有灵敏度特异度高、安全性强、操作简便、可以定量操作的优点[24],广泛应用于临床诊断、分子生物学研究、畜牧与动物医学等方面。巴尔通体测序研究选用的rpoB基因是一种单拷贝基因,能够消除单个物种间序列变化差异所带来的影响,具备一定的种内鉴别性,是最常用的实验室诊断鉴定位点之一,然而本次研究中部分样本未呈现良好的测序结果,出现套峰、重叠峰,考虑可能与保存过程中存在冻融、退火温度和时间欠优化等有关。
内蒙古北部与俄罗斯和蒙古国接壤,其中呼伦贝尔市地处中、俄、蒙3国交界,是跨境旅游热点地区[12];锡林郭勒盟位于内蒙古中部,草原旅游文化氛围浓厚,近年来内蒙古旅游业蓬勃发展[25],经济交流频繁和人员流动加剧促进病原体传播,提示内蒙古地区应加强卫生管控和病原体监测。本次调查揭示了布氏田鼠病原谱的丰富性,未来除继续监测上述病原体外,还应关注媒介传播对病原体扩散的影响,并构建内蒙古地区不同鼠种的病原谱,从源头上防控鼠源疾病的发生流行,为有效应对病原体传播提供科学依据。
利益冲突 无
| [1] |
付和平, 卜凡, 袁帅, 等. 典型草原布氏田鼠种群生态学研究进展[J]. 内蒙古农业大学学报: 自然科学版, 2022, 43(5): 71-79. Fu HP, Bu F, Yuan S, et al. Advances in population ecology of Brandt's vole (Lasiopodomys brandtii) in typical steppe[J]. J Inner Mongolia Agric Univ: Nat Sci Ed, 2022, 43(5): 71-79. DOI:10.16853/j.cnki.1009-3575.2022.05.009 |
| [2] |
陈宇飞, 靳木子, 白潇. 内蒙古西部口岸地区鼠类及其携带病原体调查[J]. 中国国境卫生检疫杂志, 2023, 46(6): 536-538. Chen YF, Jin MZ, Bai X. Investigation on rodents and their pathogens in western port area of Inner Mongolia[J]. Chin J Front Health Quarant, 2023, 46(6): 536-538. DOI:10.16408/j.1004-9770.2023.06.007 |
| [3] |
董利. 内蒙古东部草原鼠体表恙螨分布及携带立克次体研究[D]. 济南: 山东大学, 2023. DOI: 10.27272/d.cnki.gshdu.2023.001750. Dong L. Study on the distribution of chigger mites on the surface of rodents and their carrying Rickettsia in the eastern grassland of Inner Mongolia[D]. Jinan: Shandong University, 2023. DOI: 10.27272/d.cnki.gshdu.2023.001750.(in Chinese) |
| [4] |
Xu DL, Xu MM, Wang DH. Effect of temperature on antioxidant defense and innate immunity in Brandt's voles[J]. Zool Res, 2019, 40(4): 305-316. DOI:10.24272/j.issn.2095-8137.2019.045 |
| [5] |
Li K, Kohn MH, Zhang SM, et al. The colonization and divergence patterns of Brandt's vole (Lasiopodomys brandtii) populations reveal evidence of genetic surfing[J]. BMC Evol Biol, 2017, 17(1): 145. DOI:10.1186/s12862-017-0995-y |
| [6] |
Feng G, Yan H, Yang XT. Climate and food diversity as drivers of mammal diversity in Inner Mongolia[J]. Ecol Evol, 2019, 9(4): 2142-2148. DOI:10.1002/ece3.4908 |
| [7] |
郑智民, 姜志宽, 陈安国. 啮齿动物学(第二版)[M]. 上海: 上海交通大学出版社, 2012: 47-48, 170-171. Zheng ZM, Jiang ZK, Chen AG. Rodenticology (2nd Ed)[M]. Shanghai: Shanghai Jiao Tong University Press, 2012: 47-48, 170-171. |
| [8] |
Bai DF, Wan XR, Li GL, et al. Factors influencing range contraction of a rodent herbivore in a steppe grassland over the past decades[J]. Ecol Evol, 2022, 12(2): e8546. DOI:10.1002/ece3.8546 |
| [9] |
Ni HB, Sun YZ, Qin SY, et al. Molecular detection of Cryptosporidium spp. and Enterocytozoon bieneusi infection in wild rodents from six provinces in China[J]. Front Cell Infect Microbiol, 2021, 11: 783508. DOI:10.3389/fcimb.2021.783508 |
| [10] |
李晋宇, 白雪峰, 闫文喆, 等. 内蒙古自治区东部草原达乌尔黄鼠携带重要病原体的分布研究[J]. 中国媒介生物学及控制杂志, 2024, 35(3): 374-380. Li JY, Bai XF, Yan WZ, et al. Distribution of major pathogens carried by Spermophilus dauricus in the eastern grassland of Inner Mongolia Autonomous Region, China[J]. Chin J Vector Biol Control, 2024, 35(3): 374-380. DOI:10.11853/j.issn.1003.8280.2024.03.021 |
| [11] |
汪子豪, 常楠, 李晋宇, 等. 内蒙古长爪沙鼠病原体监测研究[J]. 中国媒介生物学及控制杂志, 2024, 35(4): 422-428. Wang ZH, Chang N, Li JY, et al. Pathogen surveillance results of Meriones unguiculatus in Inner Mongolia Autonomous Region, China[J]. Chin J Vector Biol Control, 2024, 35(4): 422-428. DOI:10.11853/j.issn.1003.8280.2024.04.007 |
| [12] |
Wen XX, Fang YQ, Jiang F, et al. Prevalence and genetic diversity of rodent-associated Bartonella in Hulunbuir border regions, China[J]. Heliyon, 2024, 10(15): e35009. DOI:10.1016/j.heliyon.2024.e35009 |
| [13] |
Berglund EC, Ellegaard K, Granberg F, et al. Rapid diversification by recombination in Bartonella grahamii from wild rodents in Asia contrasts with low levels of genomic divergence in Northern Europe and America[J]. Mol Ecol, 2010, 19(11): 2241-2255. DOI:10.1111/j.1365-294X.2010.04646.x |
| [14] |
Deng HK, Pang QX, Zhao BS, et al. Molecular mechanisms of Bartonella and mammalian erythrocyte interactions: A review[J]. Front Cell Infect Microbiol, 2018, 8: 431. DOI:10.3389/fcimb.2018.00431 |
| [15] |
Okaro U, Addisu A, Casanas B, et al. Bartonella species, an emerging cause of blood-culture-negative endocarditis[J]. Clin Microbiol Rev, 2017, 30(3): 709-746. DOI:10.1128/CMR.00013-17 |
| [16] |
Minnick MF, Anderson BE, Lima A, et al. Oroya fever and verruga peruana: Bartonelloses unique to South America[J]. PLoS Negl Trop Dis, 2014, 8(7): e2919. DOI:10.1371/journal.pntd.0002919 |
| [17] |
Allizond V, Costa C, Sidoti F, et al. Serological and molecular detection of Bartonella henselae in specimens from patients with suspected cat scratch disease in Italy: A comparative study[J]. PLoS One, 2019, 14(2): e0211945. DOI:10.1371/journal.pone.0211945 |
| [18] |
Jin XX, Gou YZ, Xin YX, et al. Corrigendum: Advancements in understanding the molecular and immune mechanisms of Bartonella pathogenicity[J]. Front Microbiol, 2023, 14: 1260035. DOI:10.3389/fmicb.2023.1260035 |
| [19] |
李喆, 徐颖华, 辛晓芳. 我国钩端螺旋体分子分型研究进展[J]. 疾病监测, 2022, 37(4): 512-516. Li Z, Xu YH, Xin XF. Progress in research of molecular typing of Leptospira in China[J]. Dis Surveill, 2022, 37(4): 512-516. DOI:10.3784/jbjc.202109130500 |
| [20] |
邹亚明, 程进, 李满金, 等. 江苏省无锡市2020-2023年小型兽类感染病原体监测结果分析[J]. 中国媒介生物学及控制杂志, 2024, 35(4): 429-434. Zou YM, Cheng J, Li MJ, et al. An analysis of pathogen surveillance results of small mammals in Wuxi, Jiangsu Province, China, 2020-2023[J]. Chin J Vector Biol Control, 2024, 35(4): 429-434. DOI:10.11853/j.issn.1003.8280.2024.04.008 |
| [21] |
Esson C, Samelius G, Strand TM, et al. The prevalence of rodent-borne zoonotic pathogens in the South Gobi desert region of Mongolia[J]. Infect Ecol Epidemiol, 2023, 13(1): 2270258. DOI:10.1080/20008686.2023.2270258 |
| [22] |
Sun QT, Liu Y, Han YN, et al. Rodent ecology and etiological investigation in China: Results from vector biology surveillance-Shandong Province, China, 2012-2022[J]. China CDC Wkly, 2024, 6(36): 911-917. DOI:10.46234/ccdcw2024.193 |
| [23] |
赵哲, 贺真, 龙泳. 我国常见鼠传疾病流行病学特点及防治研究现状[J]. 中华卫生杀虫药械, 2021, 27(6): 578-581. Zhao Z, He Z, Long Y. Research progress on epidemiology and control of main rodent-borne diseases in China[J]. Chin J Hyg Insert Equip, 2021, 27(6): 578-581. DOI:10.19821/j.1671-2781.2021.06.024 |
| [24] |
Pathak S, Awuh JA, Leversen NA, et al. Counting mycobacteria in infected human cells and mouse tissue: A comparison between qPCR and CFU[J]. PLoS One, 2012, 7(4): e34931. DOI:10.1371/journal.pone.0034931 |
| [25] |
李瑞凤. 内蒙古旅游发展的生态环境效应研究[D]. 呼和浩特: 内蒙古财经大学, 2024. DOI: 10.27797/d.cnki.gnmgc.2024.000077. Li RF. Study on eco-environmental effects of tourism development in Inner Mongolia[D]. Hohhot: Inner Mongolia University of Finance and Economics, 2024. DOI: 10.27797/d.cnki.gnmgc.2024.000077.(in Chinese) |
 2025, Vol. 36
2025, Vol. 36


