扩展功能
文章信息
- 詹尚, 李芳, 阿布力米提·莫明, 张花花, 王思远, 雒涛, 王慧乾, 陈建辉, 吾力肯·吐尔达力, 赵国玉, 张渝疆
- ZHAN Shang, LI Fang, MOMING Abulimiti, ZHANG Hua-hua, WANG Si-yuan, LUO Tao, WANG Hui-qian, CHEN Jian-hui, TUERDALI Wuliken, ZHAO Guo-yu, ZHANG Yu-jiang
- 新疆维吾尔自治区北疆地区蜱及啮齿动物携带病毒的调查
- Investigation of viruses carried by ticks and rodents in northern Xinjiang Uygur Autonomous Region, China
- 中国媒介生物学及控制杂志, 2025, 36(2): 258-267
- Chin J Vector Biol & Control, 2025, 36(2): 258-267
- 10.11853/j.issn.1003.8280.2025.02.019
-
文章历史
- 收稿日期: 2024-11-13
2 新疆维吾尔自治区疾病预防控制中心消毒与感染控制中心, 新疆 乌鲁木齐 830002;
3 新疆病媒传染病重点实验室, 新疆 乌鲁木齐 830002;
4 西安大兴医院, 陕西 西安 710016;
5 浙江中医药大学金华研究院, 浙江 金华 321000
2 Center for Disinfection and Infection Control, Xinjiang Uygur Autonomous Region Center for Disease Control and Prevention, Urumqi, Xinjiang 830002, China;
3 Xinjiang Key Laboratory of Vector-Borne Infectious Diseases, Urumqi, Xinjiang 830002, China;
4 Xi'an Daxing Hospital, Xi'an, Shanxi 710016, China;
5 Jinhua Research Institute of Zhejiang University of Traditional Chinese Medicine, Jinhua, Zhejiang 321000, China
虫媒病毒是由蚊、蜱等节肢动物携带并通过叮咬传播感染人及动物的一类病毒[1]。目前全球已发现虫媒病毒600余种,与人类和动物密切相关的主要集中在黄病毒科(Flaviviridae)、披膜病毒科(Togaviridae)、泛布尼亚病毒科(Peribunyaviridae)、白纤病毒科(Phenuiviridae)、内罗病毒科(Nairoviridae)和呼肠孤病毒科(Reoviridae)等[2-3]。
新疆维吾尔自治区(新疆)地处亚欧大陆腹地,生态地理环境复杂,孕育了丰富多样的媒介生物及虫媒病原体。新疆蜱类有43种,啮齿动物10科34属75种[4-6]。蜱作为仅次于蚊的第二大节肢动物媒介,能携带或传播细菌、病毒、立克次体等170余种病原体[7]。其中蜱传病毒种类繁多,主要有5科14种可引起人类相关疾病[8]。此外,啮齿动物作为蜱、螨、蚤等多种体表寄生虫的宿主,亦可携带多种与人类密切相关的病毒,包括布尼亚病毒科(Bunyaviridae)、冠状病毒科(Coronaviridae)、沙粒病毒科(Arenaviridae)、环状病毒科(Circoviridae)、小RNA病毒科(Picornaviridae)病毒等[9]。不断挖掘和掌握新疆地区的虫媒病原体及其所致的疾病是一项不可或缺的长期工作。目前,高通量测序技术[high throughput sequencing, HTSeq,又称下一代测序(next-generation sequencing technology,NGS)]因其成本降低、灵敏度高、效率高、检测范围广泛等优点,已成为发现新病原体的重要手段,得到广泛应用。与此同时,鉴于核酸PCR检测技术在大量单个病原体检测时的快速、可重复和低成本性,有利于准确评估疾病的流行状态,故本研究同时采用高通量测序和普通PCR检测2种方法对新疆北疆地区采集的蜱和捕获的啮齿动物脏器样本进行病毒检测,以了解和掌握新疆地区蜱和啮齿动物携带的病毒资源信息,及时发现可能存在的具有重要生物医学等价值的潜在病原微生物,同时评估重要病毒在蜱和啮齿动物中的流行水平,为该类疾病的防控提供科学支撑。
1 材料与方法 1.1 蜱和啮齿动物样本来源本研究样本均来源于本课题组在2013-2024年期间采集于新疆北疆地区天山山地、准噶尔盆地及阿勒泰山地地带11个县(市、区),包括精河县、乌苏市、克拉玛依市、乌鲁木齐市米东区、福海县、北屯市、布尔津县、阜康市、吉木萨尔县、奇台县和木垒县。用于本研究的蜱样本包括草原革蜱(Dermacentor nuttalli)、亚洲璃眼蜱(Hyalomma asiaticum)和盾糙璃眼蜱(Hy. scupense)共60 118只,啮齿动物包括大沙鼠(Rhombomys opimus)、子午沙鼠(Meriones meridianus)、长尾黄鼠(Spermophilus undulatus)、灰仓鼠(Cricetulus migratorius)、小家鼠(Mus musculus)、三趾跳鼠(Dipus sagitta)和柽柳沙鼠(Me. tamariscinus)共1 117只。其中,高通量测序样本为2014-2017、2024年采集的蜱和2020、2022年捕获的啮齿动物样本。普通PCR检测样本为2014-2017年采集的蜱和2013-2015年啮齿动物样本。
1.2 样本处理、RNA提取及cDNA制备蜱和啮齿动物样本按采集地点、时间和种类进行分组抽样检测,蜱虫30~50只为1组,啮齿动物样本根据采集情况分组,单次捕获数量少的鼠种按1~3只为1组,数量较多的按5~8只为1组。每组蜱和啮齿动物脑、肺、肝、脾、肾、肠样本用高效组织细胞破碎仪(D1000,新纵科,武汉)研磨破碎。取200 μl蜱或动物组织匀浆液,采用Trizol总RNA提取试剂盒(美国赛默飞世尔科技公司)提取组织样本RNA[10]。取2 μg RNA,采用HiScript Ⅲ第一链cDNA合成试剂盒(R301,南京诺唯赞生物科技有限公司)制备cDNA反转录体系。反应体系混匀后,37 ℃反转录40 min,75 ℃灭活反转录活性10 min,将反转录的cDNA置于-80 ℃备用,样本保存期间质量良好。
1.3 高通量测序与数据分析按照蜱和啮齿动物种类、采集时间和地点随机抽取几组样本,将提取的每组等量RNA进行混匀后构建高通量测序文库,每库总RNA量约5 μg。高通量测序依据样本测序时的技术状态应用的测序方法有所不同,2014年采用454高通量测序,2015年为Illumina HiSeq 2500 RNA-seq测序,2016年以后采用Illumina Hiseq 3000平台测序。测序采用双端测序,测序长度为150 bp。高通量测序数据使用Fastqc v0.11.9和Trimmomatic v0.32程序进行测序质量质控,并去除低中质量数据,然后用Trinity 2.5程序进行序列组装和拼接。通过基于局部比对算法的搜索工具(basic local alignment search tool,BLAST)的BLASTn和BLASTx进行病毒核酸和氨基酸序列的比对,根据比对结果对拼接的序列进行注释,整理病毒相关序列信息。以上过程使用高通量测序数据病毒自动识别软件v1.0(著作权人:王君、王思远、邓菲)完成,运行平台为Linux。所有病毒序列通过美国国立生物技术信息中心(NCBI)比对结果进行人为校准。
1.4 病毒核酸PCR检测根据高通量测序获得的病毒序列信息设计特异性检测引物,见表 1。

|
病毒核酸检测采用巢式PCR方法。第1轮PCR反应体系为50 μl,包括1~3 μl cDNA、正、反向引物(20 mmol/ml)各1 μl、2× Mix buffer 25 μl(武汉擎科生物技术有限公司),ddH2O补充至50 μl。PCR反应条件为:95 ℃预变性5 min;95 ℃变性30 s,56~60 ℃(按照不同引物选择不同退火温度)退火30 s,72 ℃延伸20~30 s,循环35次;72 ℃延伸5 min。巢式PCR第2轮反应以前一轮PCR产物为摸板,按同样体系和反应条件进行扩增。PCR扩增产物经1%~1.5%的琼脂糖凝胶电泳检测,阳性PCR产物进行NGS。
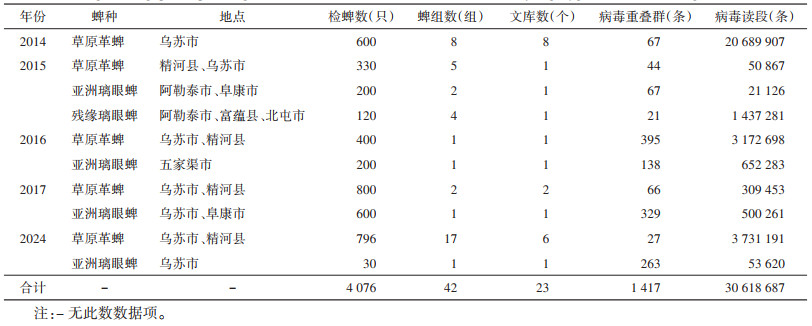
2 结果 2.1 蜱样本病毒检测 2.1.1 蜱样本病毒高通量测序结果采用高通量测序平台共计抽样测序北疆地区7个县市(精河县、乌苏市、五家渠市、阜康市、富蕴县、北屯市和阿勒泰市)采集的亚洲璃眼蜱、草原革蜱和盾糙璃眼蜱42组4 076只,建立23个测序文库。对测序得到的病毒序列拼接后,获得1 417条病毒重叠群(contigs)和3.1×107条双端测序病毒读段(reads),见表 2。
|
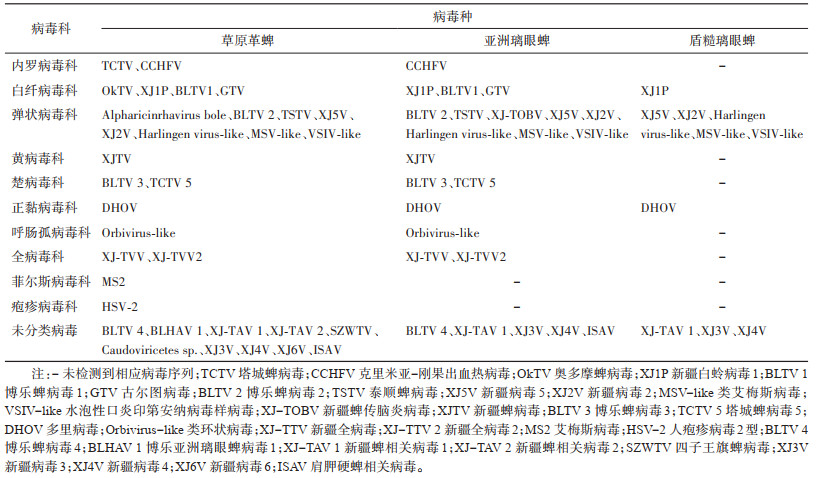
经高通量测序数据的组装、拼接和注释,获得12科24种及10种未分类病毒序列;其中,从北疆地区草原革蜱、亚洲璃眼蜱和盾糙璃眼蜱共计发现34种病毒序列,其中在草原革蜱测序文库中发现33种病毒序列,占总病毒种类的97.06%,其中泰顺蜱病毒(Taishun tick virus,TCTV)、奥多摩蜱病毒(Okutama tick virus,OkTV)、Alpharicinrhavirus bole、艾梅斯病毒(Emesvirus zinderi,MS2)、人疱疹病毒2型(Human alphaherpesvirus 2,HSV-2)、博乐亚洲璃眼蜱病毒1(Bole hyalomma asiaticum virus 1,BLHAV 1)、新疆蜱相关病毒1(Xinjiang tick associated virus 1,XJ-TAV 1)、Caudoviricetes sp.、四子王旗蜱病毒(SZW tick virus,STV)、新疆病毒6(Xinjiang 6 virus,XJ6V)仅见于草原革蜱;从亚洲璃眼蜱中发现24种,占总病毒种类的70.59%,其中新疆蜱传弹状病毒(Xinjiang tick borne rhabdovirus,XJ-TOBV)仅见于亚洲璃眼蜱测序文库;从盾糙璃眼蜱中发现10种,且在以上2种蜱测序文库中均有发现,占总病毒种类的29.41%,见表 3。发现的34种病毒中可感染人和动物的病毒有4科5种,包括CCHFV,GTV、DHOV、BLTV 1、TCTV 4。
|
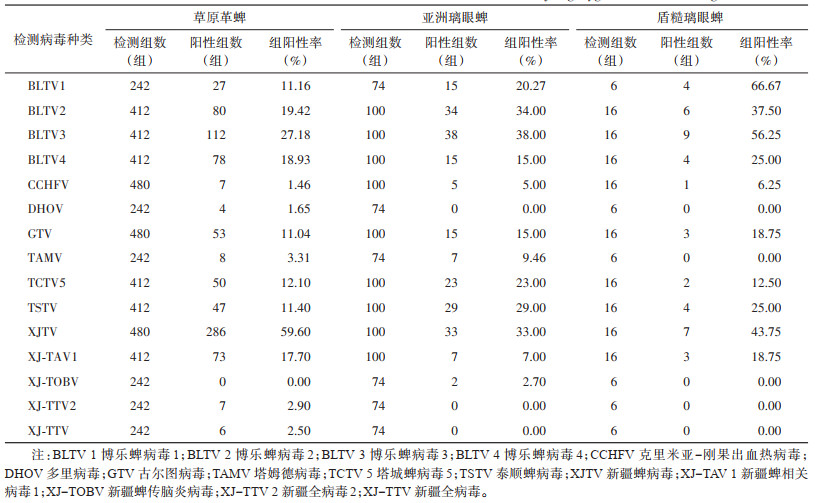
采用反转录PCR(reverse transcription PCR,RT-PCR)方法于2014-2017年在北疆地区精河县、木垒县、福海县、富蕴县、乌苏市、阜康市、五家渠市、克拉玛依市、北屯市9个县(市)检测蜱类样本共计596组56 042只,其中亚洲璃眼蜱100组7 910只、草原革蜱480组47 608只、盾糙璃眼蜱16组524只,共检出病毒8科13种及2种未分类病毒。其中,从草原革蜱中检出14种病毒,占检出病毒总数的93.33%,其中,DHOV、新疆全病毒(Xinjiang totivirus,XJ-TVV)和新疆全病毒2(Xinjiang totivirus 2,XJ-TVV2)仅于草原革蜱中检出;从亚洲璃眼蜱中检出12种病毒,占检出病毒总数的80.00%,XJ-TOBV仅从该蜱中检出;从盾糙璃眼蜱检出10种病毒,且这10种病毒于草原革蜱、亚洲璃眼蜱中也均检出,占检出病毒总数的66.67%。在检出的15种病毒中,BLTV 1在草原革蜱、亚洲璃眼蜱和盾糙璃眼蜱中组阳性率分别为11.16%、20.27%及66.67%,GTV组阳性率分别为11.04%、15.00%及18.75%,DHOV仅在草原革蜱中检出,为1.65%;在PCR法检出的15种病毒中,仅TAMV高通量测序阴性。见表 4。
|
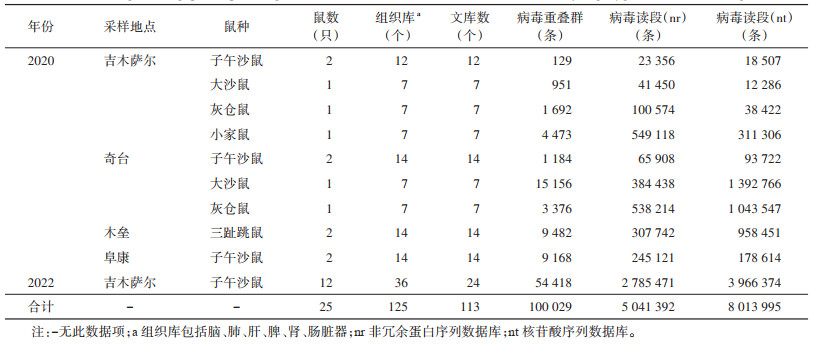
抽样测序北疆地区吉木萨尔县、奇台县、木垒县、阜康市4个县(市)捕获大沙鼠、子午沙鼠、灰仓鼠、三趾跳鼠及小家鼠25只125个组织样本库,测序后经质控检验,共获得113个测序文库,其中DNA测序文库12个,通过对非冗余蛋白序列数据库(non-redundant protein sequence database,nr)与核苷酸序列数据库(nucleotide sequence database,nt)比较注释分别获得5.0×106和8.0×106条病毒读段,获得1.0×105条病毒重叠群。见表 5。
|
经BLAST比对分析,获得23科55种及4种未分类病毒序列信息,其中,子午沙鼠携带病毒最多,达45种,占啮齿动物样本检出病毒种类总数的76.27%,且其中有37种仅检出于该鼠;其次是灰仓鼠,共检出13种病毒序列,占检出病毒种类总数的22.03%,其中有7种仅在该鼠中检出;小家鼠和三趾跳鼠分别检出7种和6种病毒序列,分别占检出病毒种类总数的11.86%和10.17%,其中,瘟病毒D型(Pestivirus D)、Curionopolis curiovirus(CURV)及小家鼠小RNA病毒(Mus musculus picornavirus,MmuPV)序列仅在小家鼠中检出,猪细环病毒(Torque teno sus virus,TTSuV)和CRESS virus sp.序列仅在三趾跳鼠中检出;从大沙鼠中检出5种病毒序列,占检出病毒种类总数的8.47%,Anelloviridae sp.仅在该鼠中检出。依据各鼠种的检测个体数评估病毒种类检出情况发现,灰仓鼠和小家鼠测序得到的病毒种类序列最多,均为7.0种病毒/只,其次是三趾跳鼠,为3.5种病毒/只,子午沙鼠和大沙鼠相差不大,分别为2.7和2.5种病毒/只。在发现的59种病毒中,人兽共患病毒有4科4种,为TAMV、BLTV 1、RHV和EMCV。见表 6。
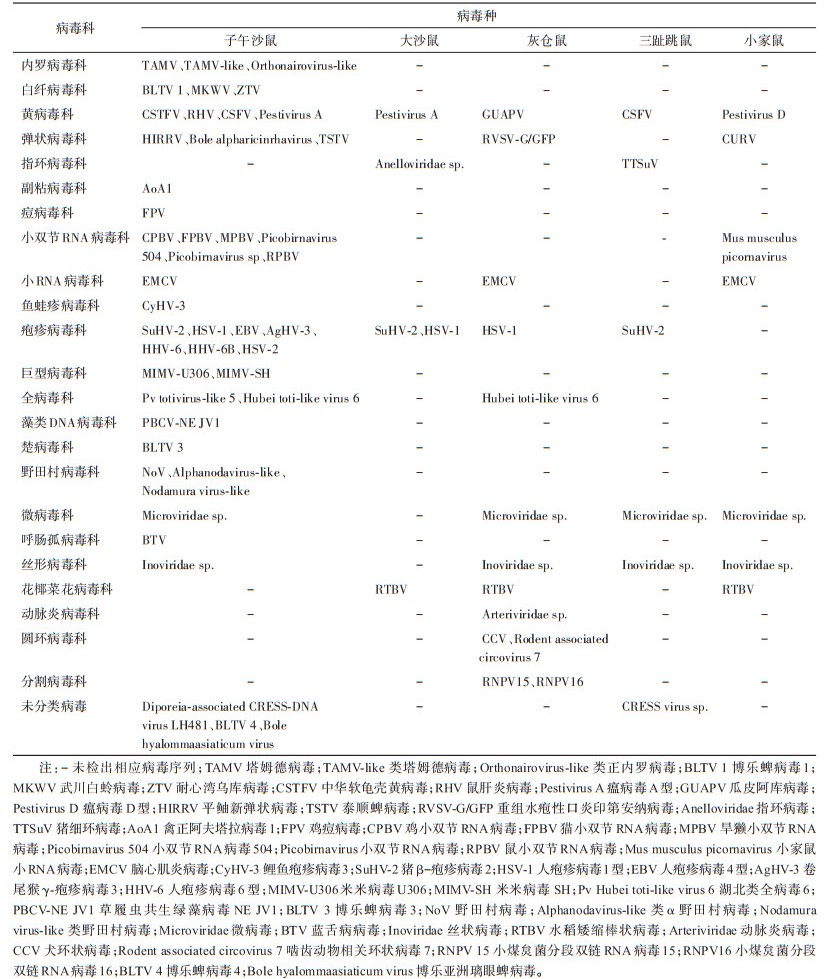
|
采用PCR方法对北疆地区吉木萨尔县、玛纳斯县、布尔津县、奇台县、木垒县、乌鲁木齐市、乌苏市、阜康市8个县(市)捕获的6种啮齿动物153组1 092只样本进行CCHFV和GTV特异性核酸检测。结果显示,CCHFV在大沙鼠、子午沙鼠、三趾跳鼠和长尾黄鼠4种啮齿动物中检出,其中三趾跳鼠检出率最高,为25.00%,其他3种啮齿动物检出率在6.50%~9.09%;GTV在大沙鼠、子午沙鼠和长尾黄鼠中的检出率高于CCHFV,分别为16.00%、18.18%和20.00%。见表 7。
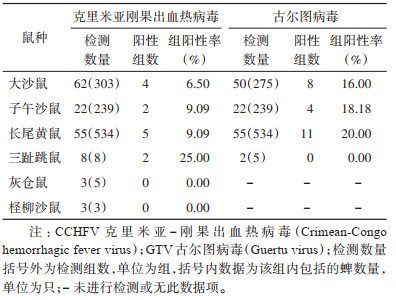
|
近年来,新发虫媒传染病在全球的发病率逐步上升,对全球公共卫生安全的威胁日益增长[11]。自1965年新疆暴发克里米亚-刚果出血热(Crimean-Congo hemorrhagic fever,CCHF)疫情以来,陆续在该地区发现多种病毒,如CCHFV、蜱传脑炎病毒(Tick-borne encephalitis virus,TBEV)、西尼罗病毒(West Nile virus,WNV)、流行性乙型脑炎病毒(Japanese encephalitis virus,JEV)及Tahyna病毒(Tahyna virus,TAHV)等[9-13]。本研究通过高通量测序技术,在北疆地区蜱和啮齿动物中分别发现36及59种病毒,包括已明确的人兽共患病毒,如CCHFV和DHOV,以及潜在感染人和动物的新虫媒病毒,如TAMV、GTV、BLTV 1、TCTV 5,表明新疆虽然在过去已发现大量虫媒病毒,但发现的这些病毒可能仅是冰山一角,依然有大量的新病原体待发现。高通量测序等新技术的应用可以大幅提高新病原体发现的效率,然而由于成本等因素的制约,对大量样本的检测往往是抽样进行,传统逐份样本病毒PCR检测仍然是疫源地调查和疾病流行病学评价中的重要手段。本研究对采获的样本同时开展逐份样本PCR检测和抽样高通量测序,二者结果并不完全一致,可能是由于传统核酸检测对于丰度较低的病毒检测存在一定的局限性。
新疆蜱媒病毒具有特定传播媒介,过去已从新疆的全沟硬蜱(Ixodes persulcatus)、森林革蜱(D. silvarum)、亚洲璃眼蜱、边缘革蜱(D. marginatus)和草原革蜱中分别分离到蜱传脑炎病毒、东部马脑炎病毒(Eastern equine encephalitis virus,EEEV)、新疆出血热病毒及新环状病毒(New circular virus,NCV)[13]。本研究通过高通量测序发现,草原革蜱携带病毒最多,为33种;其次为亚洲璃眼蜱,携带24种;盾糙璃眼蜱携带病毒最少,为10种。此外,还发现不同蜱种间特异性携带病毒种类数存在不同,如有10种病毒仅在草原革蜱中发现,1种病毒(XJ-TOBV)仅在亚洲璃眼蜱中发现,而未在盾糙璃眼蜱中发现特异性病毒。RT-PCR结果显示,从草原革蜱、亚洲璃眼蜱及盾糙璃眼蜱中分别检出14、12及10种病毒。其中,3种病毒(DHOV、XJ-TVV、XJ-TVV2)仅从草原革蜱中检出,1种病毒(XJ-TOBV)仅从亚洲璃眼蜱中检出,未从盾糙璃眼蜱中检出特异性病毒。这种不同蜱种间携带病毒种类数量不同的现象在其他研究中也有体现,Jia等[14]通过高通量测序发现全沟硬蜱、长角血蜱(Haemaphysalis longicornis)、森林革蜱、亚洲璃眼蜱、血红扇头蜱(Rhipicephalus sanguineus)和微小扇头蜱(Rh. microplus)携带病原体种类数存在差异,全沟硬蜱携带病原体种类最多,而血红扇头蜱携带病原体种类最少。这可能是由于全沟硬蜱的宿主范围比血红扇头蜱更广,研究表明全沟硬蜱可寄生于近300种不同的脊椎动物,包括啮齿类动物、鸟类和一些爬行动物,而血红扇头蜱的宿主范围相对较窄,主要宿主为家犬[15-16]。其次,啮齿动物和鸟类携带种类广泛的病原体,可能通过蜱吸血在不同蜱个体间传播,这进一步增加了蜱接触和传播多种病原体的机会[8, 17]。
本研究通过高通量测序在啮齿动物中发现的中华软龟壳黄病毒(Chinese soft-shelled turtle flavivirus,CSTFV)、平鲉新弹状病毒(Hirame novirhabdovirus,HIRRV)及野田村病毒(Nodamura virus,NoV)等,会对水产养殖业构成严重威胁;发现的水稻矮缩棒状病毒(Rice tungro bacilliform virus,RTBV)会对水稻经济作物的产量造成严重影响;发现的瘟病毒A型、禽正阿夫塔拉病毒1(Avian orthoavulavirus 1,AOaV-1)、猪细环病毒等会对禽畜类养殖业造成重大经济损失。值得注意的是,发现的CCHFV、GTV、TAMV、BLTV1、TCTV5、DHOV及疱疹病毒科等多种病毒会对人类健康及当地公共卫生安全构成严重威胁,应予以高度关注。此外,本研究还发现不同鼠种个体间携带病毒种类数不同,如灰仓鼠和小家鼠个体携带病毒种类最多,均为7种病毒/只,其次是三趾跳鼠,为3.5种/只,大沙鼠最少,为2.5种/只。这种差异在最近的文献中也有报道,Chen等[18]在2 443只蝙蝠、鼠及鼩鼱的样本中鉴定出669种病毒,发现每种蝙蝠平均携带11.4种病毒,每种鼠平均携带9.2种,而每种鼩鼱平均携带48.3种。也由此可见,蝙蝠、啮齿类、鼩鼱等哺乳动物携带病毒种类多、危害大,而由于其与蜱存在密切的寄生关系,故其携带的病毒可能通过蜱叮咬在蜱间、蜱和动物间传播,从而加大了对人的致病风险。
综上所述,不同于以往的被动监测,本研究结合高通量测序及RT-PCR技术对新疆北疆地区蜱及啮齿动物携带病毒开展本底调查,这种主动预防策略能对该类疾病的防控提供科学支撑。虽然本研究在新疆北疆地区蜱和啮齿动物中发现了CCHFV、TAMV和GTV等多种具有重要公共卫生意义的病毒,但目前对这些病毒分子特征的认识还不够全面,需要进一步深入开展病毒的遗传变异特征、抗原性和致病性等方面的研究,如特异性药物和疫苗的研发,为虫媒病毒传染病的诊断和防治提供理论基础。此外,应持续对北疆地区虫媒病毒进行主动监测,尤其应加强对北疆地区草原革蜱、亚洲璃眼蜱及子午沙鼠等重要媒介及宿主动物的重点病原体监测,防止虫媒病毒传染病外溢人间。
利益冲突 无
| [1] |
Alcorn MDH, Klimstra WB. Glycosaminoglycan binding by arboviruses: A cautionary tale[J]. J Gen Virol, 2022, 103(2): 001726. DOI:10.1099/jgv.0.001726 |
| [2] |
夏菡, 袁志明. 美国CDC《微生物和生物医学实验室生物安全》(第6版)中虫媒病毒生物安全名录简介[J]. 中国热带医学, 2022, 22(2): 97-100. Xia H, Yuan ZM. Introduction of arbovirus and biosafety catalogue in the Biosafety in Microbiological and Biomedical Laboratories (6th Edition) by U. S. CDC[J]. China Trop Med, 2022, 22(2): 97-100. DOI:10.13604/j.cnki.46-1064/r.2022.02.01 |
| [3] |
Huang Y, Wang SL, Liu H, et al. A global dataset of sequence, diversity and biosafety recommendation of arbovirus and arthropod-specific virus[J]. Sci Data, 2023, 10(1): 305. DOI:10.1038/s41597-023-02226-8 |
| [4] |
贵有军, 史深, 罗勇军, 等. 新疆啮齿动物区系构成及地理分布[J]. 中华卫生杀虫药械, 2021, 27(6): 557-564. Gui YJ, Shi S, Luo YJ, et al. The fauna and geographical distribution of rodents in Xinjiang[J]. Chin J Hyg Insect Equip, 2021, 27(6): 557-564. DOI:10.19821/j.1671-2781.2021.06.021 |
| [5] |
于心, 叶瑞玉, 龚正达. 新疆蜱类志[M]. 乌鲁木齐: 新疆科技卫生出版社, 1997: 3-4. Yu X, Ye RY, Gong ZD. The ticks fauna of Xinjiang[M]. Urumqi: Xinjiang Science and Technology Health Publishing House, 1997: 3-4. |
| [6] |
杨梅花, 黄祥, 赵硕, 等. 凯瑟硬蜱—中国蜱种新记录[J]. 石河子大学学报: 自然科学版, 2020, 38(3): 303-306. Yang MH, Huang X, Zhao S, et al. Ixodes kaiseri—a new record of tick species in China[J]. J Shihezi Univ (Nat Sci), 2020, 38(3): 303-306. DOI:10.13880/j.cnki.65-1174/n.2020.22.020 |
| [7] |
张思华. 蜱与蜱传疾病最新研究进展[J]. 安徽预防医学杂志, 2012, 18(1): 45-48. DOI:1007-1040(2012)01-045-04. Zhang SH. Recent research advances in ticks and tick-borne diseases[J]. Anhui J Prev Med, 2012, 18(1): 45-48. DOI:1007-1040(2012)01-045-04.(in Chinese) |
| [8] |
刘涓, 董娜, 张云智. 引起人类疾病的蜱传病毒研究进展[J]. 中国公共卫生, 2020, 36(4): 646-649. Liu J, Dong N, Zhang YZ. Advances in researches on tick-borne viruses causing human diseases[J]. Chin J Public Health, 2020, 36(4): 646-649. DOI:10.11847/zgggws1124867 |
| [9] |
苏航, 徐春雨, 贾修岐, 等. 啮齿目动物携带病毒的研究进展与展望[J]. 生物化工, 2021, 7(1): 123-126. Su H, Xu CY, Jia XQ, et al. Advances and prospect for rodents carry viruses researches[J]. Biol Chem Eng, 2021, 7(1): 123-126. DOI:10.3969/j.issn.2096-0387.2021.01.033 |
| [10] |
Shen S, Duan XM, Wang B, et al. A novel tick-borne Phlebovirus, closely related to Severe fever with thrombocytopenia syndrome virus and Heartland virus, is a potential pathogen[J]. Emerg Microbes Infect, 2018, 7(1): 95. DOI:10.1038/s41426-018-0093-2 |
| [11] |
夏菡, 袁志明. 70年来我国虫媒病毒发现分布与应对[J]. 中国血吸虫病防治杂志, 2023, 35(5): 427-436, 450. Xia H, Yuan ZM. Discovery and distribution of and response to arbovirus in China over the past seven decades[J]. Chin J Schistosomiasis Control, 2023, 35(5): 427-436, 450. DOI:10.16250/j.32.1374.2023152 |
| [12] |
阿不力提甫·阿不力孜, 努尔比亚·吾不力阿西木, 塔依尔·吾不力. 2003年巴楚县2例新疆出血热病例诊治报告[J]. 地方病通报, 2007, 22(5): 63. Abuliz A, Wubuliaximu N, Wubuli T. Diagnosis and treatment report of 2 cases of Crimeam-Congo hemorrhagic fever in Bachu County in 2003[J]. Endem Dis Bull, 2007, 22(5): 63. DOI:10.13215/j.cnki.jbyfkztb.2007.05.046 |
| [13] |
寇春, 段晓梅, 张渝疆, 等. 新疆地区虫媒病毒调查研究状况[J]. 中国人兽共患病学报, 2016, 32(3): 301-305, 311. Kou C, Duan XM, Zhang YJ, et al. Status on arbovirus investigation in Xinjiang, China[J]. Chin J Zoonoses, 2016, 32(3): 301-305, 311. DOI:10.3969/j.issn.1002-2694.2016.03.018 |
| [14] |
Jia N, Wang JF, Shi WQ, et al. Large-scale comparative analyses of tick genomes elucidate their genetic diversity and vector capacities[J]. Cell, 2020, 182(5): 1328-1340. e13. DOI:10.1016/j.cell.2020.07.023 |
| [15] |
许士奇. 全沟硬蜱种群生态及蜱传病原体研究[D]. 石家庄: 河北师范大学, 2015. Xu SQ. Studies on population ecology of Ixodes persulcatus and its infection with the tick-borne pathogens[D]. Shijiazhuang: Hebei Normal University, 2015. (in Chinese) |
| [16] |
Dantas-Torres F. The brown dog tick, Rhipicephalus sanguineus (Latreille, 1806) (Acari: Ixodidae): From taxonomy to control[J]. Vet Parasitol, 2008, 152(3/4): 173-185. DOI:10.1016/j.vetpar.2007.12.030 |
| [17] |
李娟, 林栩慧, 陈志虹, 等. 侯鸟携带蜱及蜱传播疾病流行概况[J]. 动物医学进展, 2019, 40(6): 107-111. Li J, Lin XH, Chen ZH, et al. Epidemic status of tick and tick-borne diseases associated with wild birds[J]. Prog Vet Med, 2019, 40(6): 107-111. DOI:10.16437/j.cnki.1007-5038.2019.06.020 |
| [18] |
Chen YM, Hu SJ, Lin XD, et al. Host traits shape virome composition and virus transmission in wild small mammals[J]. Cell, 2023, 186(21): 4662-4675. e12. DOI:10.1016/j.cell.2023.08.029 |
 2025, Vol. 36
2025, Vol. 36


