扩展功能
文章信息
- 葛文君, 肖迪, 张慧芳, 赵春春, 伦辛畅, 宋秀平, 郭玉红, 梁莹, 刘起勇, 孟凤霞
- GE Wen-jun, XIAO Di, ZHANG Hui-fang, ZHAO Chun-chun, LUN Xin-chang, SONG Xiu-ping, GUO Yu-hong, LIANG Ying, LIU Qi-yong, MENG Feng-xia
- 基于MALDI-TOF MS的蚊虫种类鉴定技术初步研究
- A preliminary study on the identification of mosquito species based on MALDI-TOF MS
- 中国媒介生物学及控制杂志, 2025, 36(2): 238-245, 267
- Chin J Vector Biol & Control, 2025, 36(2): 238-245, 267
- 10.11853/j.issn.1003.8280.2025.02.016
-
文章历史
- 收稿日期: 2024-11-06
蚊类是具有重要公共卫生意义的节肢动物[1],是登革热、疟疾、黄热病、流行性乙型脑炎等传染病的传播媒介,严重威胁着人类健康。随着我国“一带一路”倡议的不断推进,带来了全球化和经济的不断发展,同时也对新时期蚊媒传染病的防控造成了挑战。近几十年来,新发、再发蚊媒传染病层出不穷,造成巨大的公共卫生负担,成为了新的公共卫生问题。每年因蚊虫传播疾病而死亡的人数约为72.5万[2],世界卫生组织(WHO)2019年将登革热列为全球十大健康威胁之一[3]。蚊类不仅危害严重,且种类繁多。根据Harbach[4]统计,截止到2024年10月28日,全球已知蚊虫3 727种。我国蚊虫约21属400余种[5]。有研究表明,我国31个省(自治区、直辖市)已知可携带或作为媒介传播病毒的蚊虫有7属55种[6]。
快速准确地识别蚊虫,是媒介蚊虫基础研究以及蚊媒疾病有效防控的基础[7]。蚊虫的形态学鉴定,需要丰富的专业知识水平和长期积累的工作经验,且要求样本完整[8];而分子鉴定花费较贵、耗时较长[9]。基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption/ionization time-of-flight mass spectrometry,MALDI-TOF MS)作为一种近年来广泛应用的微生物新型鉴定技术,其基本原理是样品与基质在样本靶上形成共结晶,利用激光作为能量来源辐射共结晶体,基质分子吸收能量与样品解吸附并使其电离,经过飞行时间检测器,将不同质荷比(m/z)的离子分开,形成特异性肽质量指纹谱(peptied mass fingerprinting,PMF)[10]。近年来,MALDI-TOF MS已被用于节肢动物鉴定,在果蝇及蜱、白蛉和蚤类等媒介生物的种类鉴定中应用[11-13],具有快速、准确、高通量、成本低等优点。
本研究以4种蚊虫的实验室品系为研究对象,探索MALDI-TOF MS用于蚊种鉴定所需的样本条件,进行蚊种MALDI-TOF MS鉴定方法的初步研究,为蚊虫种类鉴定提供一种新手段,为我国蚊虫监测与相关传染病的防控提供技术支持。
1 材料与方法 1.1 试虫中国疾病预防控制中心传染病预防控制所媒介生物控制室饲养的白纹伊蚊(Aedes albopictus)、淡色库蚊(Culex pipiens pallens)、三带喙库蚊(Cx. tritaeniorhynchus)和中华按蚊(Anopheles sinensis)的实验室品系。白纹伊蚊人工膜供给兔血6~8 h,其余3种蚊虫小白鼠供血6~8 h。
冷冻样品为死亡蚊虫置于-20 ℃冰箱保存2~10 d;干燥样品为死亡蚊虫置于硅胶中保存7~14 d。
1.2 仪器质谱仪为德国布鲁克公司的Microflex LRF,数据采集软件为该公司的FlexControl v. 3.4,数据库构建分析软件为该公司的MALDI Biotyper v. 4.1.8,谱图分析软件为该公司的FlexAnalysis v. 3.4,样品承载靶为该公司的MSP 96 target ground steelTM 600-μm。
1.3 主要试剂18.2 MΩ超纯水,α-氢基-4-羟基肉桂酸(CHCA,美国Sigma-Aldrich公司)饱和液,色谱级乙腈(ACN,美国Thermo Fisher Scientific公司),三氟乙酸(TFA,美国Sigma-Aldrich公司);色谱级无水乙醇(上海麦克林生化科技股份有限公司);色谱级甲酸(FA,美国Sigma-Aldrich公司)。
1.4 质谱样品前处理(1)在体视显微镜下根据《中国动物志·昆虫纲·双翅目·蚊科》(上、下)[14-15]观察蚊虫头、胸、腹等部位特征,进行形态学鉴定。(2)单只蚊样品置于1.5 ml EP管中,加入500 μl磷酸盐缓冲液(PBS)溶液,震荡洗涤约3 min。(3)加入500 μl色谱级75%乙醇溶液,震荡洗涤约3 min。(4)用昆虫针将整只蚊样品解剖为头、胸、腹、足4部分,或取完整的整只蚊样品,向管中加入20 μl 70%甲酸、20 μl 50%乙腈;头、胸和足样品,加入15 μl 70%甲酸和15 μl 50%乙腈。(5)每管中加入适量ϕ=1 mm的氧化锆珠,置于自动研磨机中研磨。(6)低温高速离心(15 294×g,8 min)后,将上清液吸取至新的EP管中,置于-40 ℃冰箱保存备用。
1.5 靶板上样样品沉淀于96孔靶板上。每份样品取1 μl上述上清液点于1个圆孔内,每个样品点6个平行孔,以仪器校正标准品做质量控制,室温下自然干燥,形成“斑点”。随后,在每个斑点及标准品上覆盖1 μl CHCA基质溶液(以体积比超纯水∶ACN∶TFA=50%∶47.5%∶2.5%配制标准溶剂的CHCA饱和溶液)。室温下干燥数分钟后,将靶板导入Microflex LT MALDI-TOF MS质谱仪进行分析。
1.6 MALDI-TOF MS数据采集MALDI-TOF MS数据采集采用线性阳离子模式。采集的相对分子质量范围为2 000~20 000,参数设定为:离子源1电压20 kV,离子源2电压18.35 kV,透镜电压6 kV;延时提取,100 ns;激光频率60 Hz,100 shots采集1个样品结晶点,每张谱图相对峰强度累积达3×104~4×104,手动采集12张谱图形成1张肽质量指纹谱。质量校准和仪器参数优化使用中国疾病预防控制中心传染病预防控制所研制的仪器校正标准品(专利号:ZL 2015 1 0246677.8)。校正后相对分子质量平均偏差 < 3。
1.7 肽质量参考谱的构建采用Biotyper v. 4.1.8软件中的主谱图预测(main spectra projection,MSP)功能,构建肽质量指纹谱。参数设置如下:MSP,200;最小谱图频率,25%;MSP最大峰数目,70。每张入库参考谱由12张谱图经过归一化、平滑、基线修正、挑选之后形成含有平均质荷比、峰强度、出现频率的显著性共性峰系列。
1.8 聚类分析采用Biotyper v. 4.1.8软件,根据峰的位置、强度和频率信息,采用无偏算法生成主谱图,并根据肽质量指纹谱的质量信号和强度进行聚类分析。
1.9 参考谱库评价采用内部交叉评价验证,扣除待验证蚊虫样本本身的参考谱搜索数据库。谱图经系统标准方法处理后,采用软件搜索含有281张参考谱的数据库。使用软件标准参数——鉴定分值判读,标准采用厂商标准:分值≥2.30表示种水平高可信度识别,分值≥2.00表示种水平识别,分值≥1.70表示属水平识别,分值为 < 1.70表示未识别。
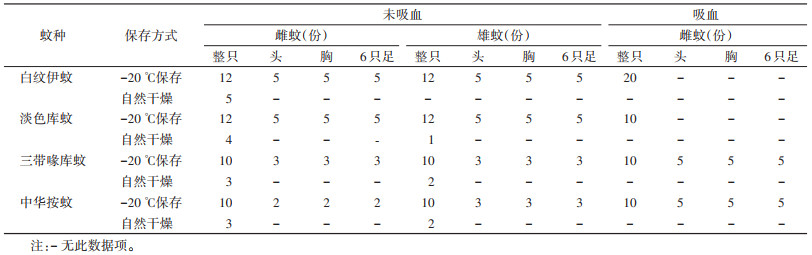
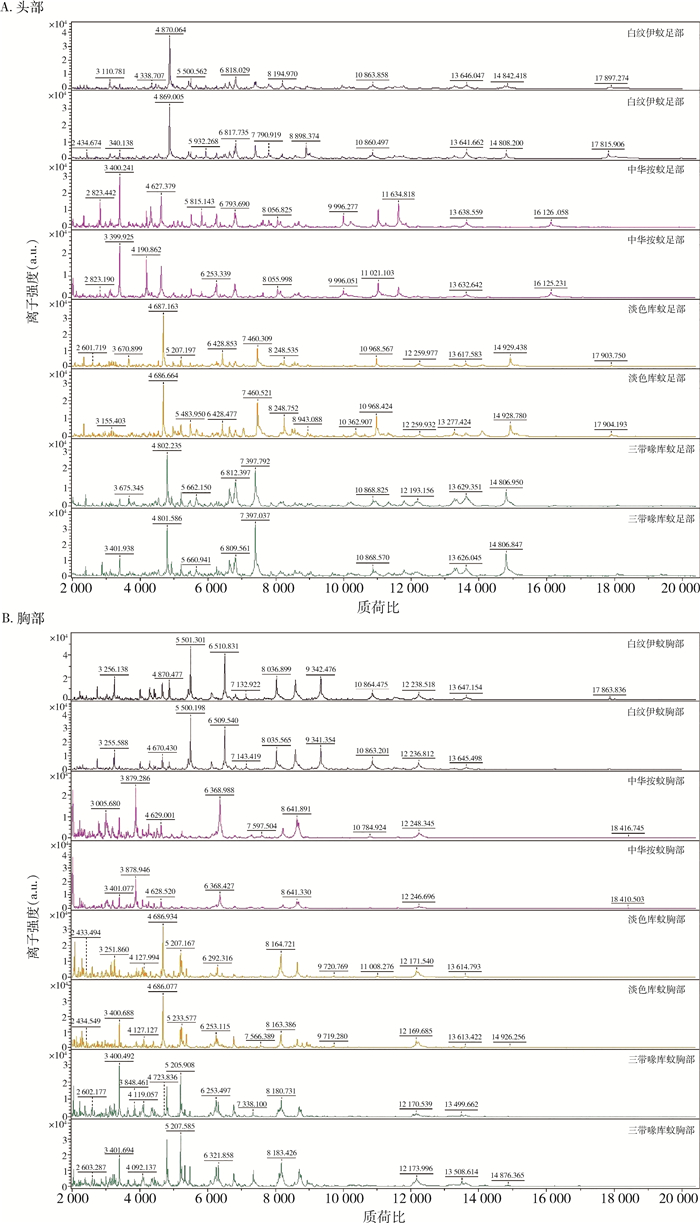
2 结果 2.1 MALDI-TOF MS参考指纹谱库的建立对4种蚊虫的281只样品进行谱图的采集与汇总,建立标准肽质量指纹谱,最终构建了包括4种蚊虫的4个身体部位、2种不同保存方式和2种吸血状态的标准肽质量参考谱数据库。蚊虫建库信息见表 1,标准肽质量指纹谱见图 1。
|
|
| 图 1 4种蚊虫足部和胸部肽质量指纹谱 Figure 1 Peptied mass fingerpeinting of the thorax and legs of four mosquito species |
| |
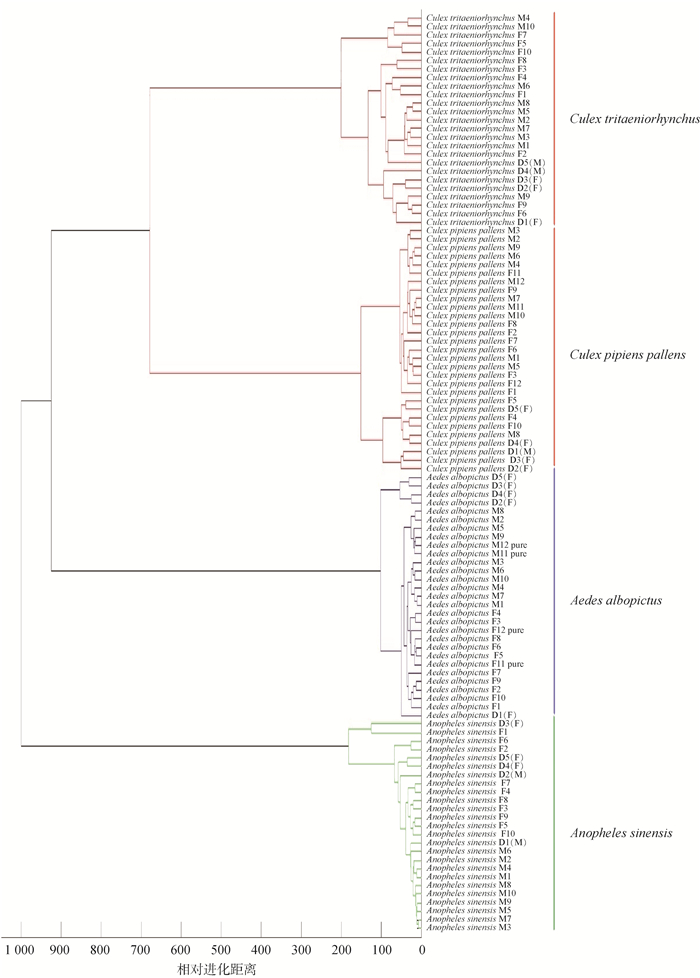
MSP聚类分析结果显示,-20 ℃保存和硅胶干燥保存样品肽质量指纹谱均能准确区分聚类,且将冷冻样品和干燥样品混合进行肽质量指纹谱聚类采集、分析,样品也能准确区分聚类,2种保存方式样品对蚊种MALDI-TOF MS鉴定结果无影响。见图 2。
|
| 注:样品表示为蚊种拉丁名+保存方法/样品性别+数字,其中F表示雌性,M表示雄性;D表示干燥样品,其余均为冷冻样品;数字表示样本编号;pure表示100%纯乙腈提取样本,其余样本为50%乙腈提取样本。 图 2 4种蚊虫(整只)干燥和冷冻样品肽质量指纹谱聚类分析结果 Figure 2 Results of cluster analysis for peptide mass fingerprints of whole dried and frozen samples of four mosquito species |
| |
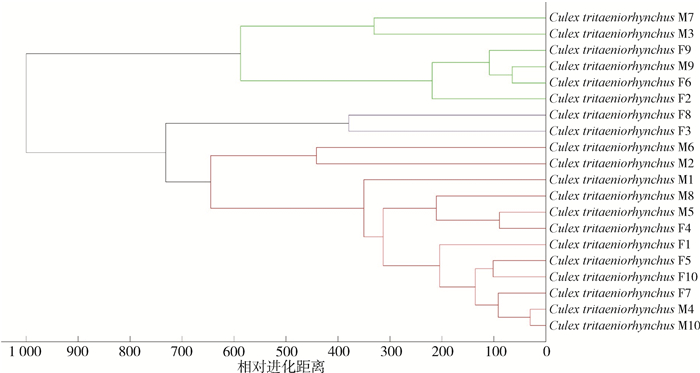
对三带喙库蚊整只雌蚊、雄蚊的样品进行MSP分析,样品谱未见按照雌、雄聚类,但按照种类聚类,显示不同性别来源样品未对种类鉴定产生影响。见图 3。
|
| 注:样品表示为蚊种拉丁名+性别+数字,其中F表示雌性,M表示雄性,数字表示样本编号。 图 3 三带喙库蚊整只雌、雄蚊样品肽质量指纹谱聚类分析结果 Figure 3 Results of cluster analysis for peptide mass fingerprints of whole female and male mosquito samples of Culex tritaeniorhynchus |
| |
吸血后的4种蚊虫整只样品肽质量指纹谱MSP聚类分析结果显示,除白纹伊蚊外,其余3种蚊虫的指纹谱均未按种类聚类,结果无法准确区分蚊虫种类。三带喙库蚊和中华按蚊吸血前后的21份头部、胸部和足部样品指纹谱MSP聚类分析结果显示,样品并未按吸血、未吸血聚类,仅按种类聚类;无论是三带喙库蚊还是中华按蚊,吸血前、后的胸部、足部、头部样品蛋白谱图中峰的位置、强度和频率均未出现明显的变化,见图 4,未对种类鉴定结果产生影响。
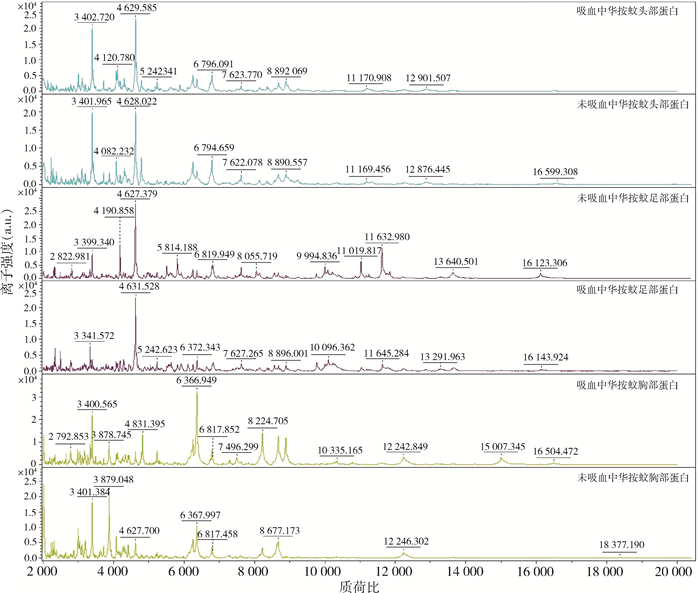
|
| 图 4 中华按蚊吸血前后头部、胸部和足部肽质量指纹谱 Figure 4 Peptide mass fingerprints of the head, thorax, and foot of Anopheles sinensis before and after blood-sucking |
| |
肽质量指纹谱聚类结果显示,蚊虫头部、胸部和足部样本的指纹谱均能按照种类聚类,且4条足样本即可完成谱图采集。将头部、胸部和足部样品的指纹谱随机混合进行聚类分析,各样品指纹谱均按照种类聚类。见图 5。
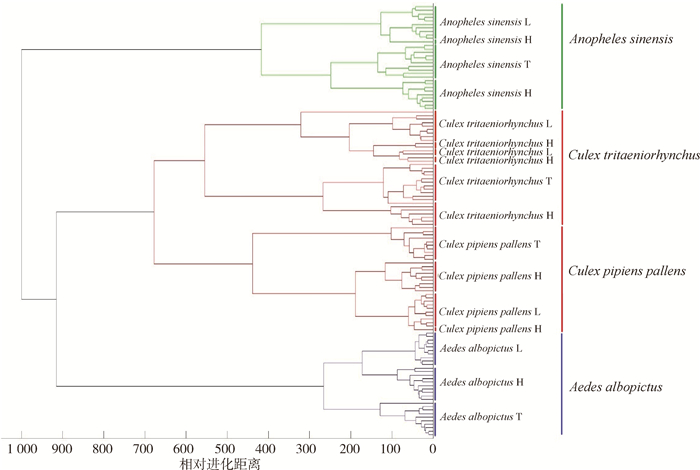
|
| 注:样品表示为蚊种拉丁名+样品采集部位,其中L表示足,H表示头部,T表示胸部。 图 5 4种蚊虫头部、胸部和足部样品肽质量指纹谱混合聚类分析结果 Figure 5 Results of mixed cluster analysis for peptide mass fingerprints of the head, thorax, and foot samples of four mosquito species |
| |
选择4种蚊虫中的120份样品进行内部交叉特异性验证,结果表明,120只蚊虫样本全部正确鉴定到种,且鉴定分值均 > 2.00,表明鉴定结果可信度高,内部验证信息见表 2。
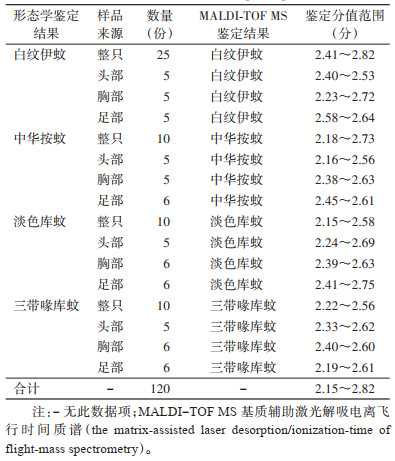
|
目前,形态学鉴定依然是蚊虫种类鉴定的“金标准”[16],但该种方法耗时、且对研究者的专业知识要求高,不利于其广泛使用,有研究表明,参与研究的昆虫学家在属和种水平上分别仅成功鉴定了81%和64%的蚊虫标本[8]。除此之外,当蚊虫标本损坏、存在近缘种或蚊虫复合体时,该技术的使用也受到限制[17]。而分子鉴定在一定程度上能解决上述问题,常见的用于蚊种鉴定的分子工具包括细胞色素C氧化酶亚基Ⅰ和Ⅱ基因(COⅠ和COⅡ)及细胞色素b基因,其中使用频率最高的蛋白质编码基因是COⅠ[18-19]。但分子鉴定花费贵、耗时长,且在某些近缘蚊种鉴定上存在一定限制[9, 20]。
本研究发现,从样品的保存方式、性别、吸血状态和来源部位4个因素来看,除吸血后的腹部样品无法准确鉴定外,其余因素均不影响MALDI-TOF MS的蚊虫种类鉴定结果,仅使用1只蚊虫样本的头部、胸部或4条足就可完成样本的谱图采集,都能准确区分到种,这也证实了蛋白质谱的可重复性和特异性,也说明MALDI-TOF MS的适用条件较为广泛,这有利于该技术在现场蚊虫监测标本中的应用,因为现场采集到的蚊虫标本往往由于条件限制无法冷冻保存或不完整,例如蚊虫的足部易碎,在标本保存和处理中容易丢失,这种情况下,选择蚊虫的其他身体部位进行MALDI-TOF MS分析,即可解决上述问题,这也体现了MALDI-TOF MS技术用于种类鉴定的优势;如果标本保存较完整,采用来自同一标本的足部和胸部指纹谱同时用于某一物种的鉴定,2个结果互相印证,可以增强MALDI-TOF MS鉴定的成功率和准确性[16, 20]。但本研究不推荐单独使用蚊虫头部用于鉴定,因为在实验过程中发现,蚊虫头部的蛋白谱图较难采集,会大大影响鉴定的效率,更推荐使用胸部或足部指纹谱用于鉴定。本研究用吸血前后的三带喙库蚊、中华按蚊的头、胸、足评估吸血对肽质量指纹谱的影响,聚类分析后发现吸血并不影响蚊种鉴定结果;但腹部不是鉴定的最佳部位,原因是饱血后的蚊虫腹部肽质量指纹谱会受蚊虫摄入血餐的影响,故蚊虫腹部不建议用于MALDI-TOF MS进行蚊种鉴定,这也与Vega-Rúa等[21]、Niare等[22]的研究结果一致。受腹部血餐的影响,吸血后的整只蚊虫样品也不能准确鉴定蚊虫种类。为实现标本的充分利用,当1只吸血雌性蚊虫的胸部和足部用于蚊种鉴定后,腹部可用来分析血餐来源,而头部用于其携带病原体检测[23],实现1个样本的多目标检测分析。
内部交叉验证结果表明,当测试物种肽质量指纹谱被正确包含在参考数据库中时,MALDI-TOF MS是鉴定蚊虫的可靠工具。与分子生物学鉴定每个样品平均需花费约40元人民币(试剂盒和双向测序)、且耗时较长相比,MALDI-TOF MS用于蚊种鉴定仅需要1 μl的蛋白提取液即可进行种类鉴定,灵敏度高,检测96个样本仅需4~5 h即可完成,每个样品的成本约为1元人民币。相关文献表明,利用MALDI-TOF MS还能够区分同一复合体的按蚊[24-25]。因此MALDI-TOF MS具有快速、高通量、准确、成本低,可鉴别近缘蚊种的特点。
本研究重点对用于MALDI-TOF MS蚊种鉴定的可能影响肽质量指纹谱的因素进行初步探索,以为蚊虫肽质量指纹谱图采集的标准化和实际应用的可操作性提供技术支持,但还存在一定的局限性:(1)研究对象中未包含近缘蚊种,未评估MALDI-TOF MS鉴定近缘蚊种的准确性;(2)仅使用了实验室饲养的蚊虫,实验室品系的温度、湿度等饲养条件相同,而野外蚊虫种群具有不同的生境条件,可能导致蛋白质组成和含量改变,从而使肽质量指纹谱发生变化。在今后的研究中,本研究会补充近缘蚊种,评估该技术鉴定近缘蚊种的能力;同时纳入多种野外种群蚊虫,扩大丰富蚊虫MALDI-TOF MS数据库,并进一步探究不同地理种群蚊虫对蚊虫肽质量指纹谱的影响。
利益冲突 无
| [1] |
Nebbak A, Almeras L, Parola P, et al. Mosquito vectors (Diptera: Culicidae) and mosquito-borne diseases in north Africa[J]. Insects, 2022, 13(10): 962. DOI:10.3390/insects13100962 |
| [2] |
The Lancet Global Health. Vector control: Time for a planetary health approach[J]. Lancet Glob Health, 2017, 5(6): e556. DOI:10.1016/S2214-109X(17)30185-7 |
| [3] |
World Health Organization. Ten threats to global health in 2019[EB/OL]. (2019-01-10)[2024-11-06]. https://www.who.int/news-room/spotlight/ten-threats-to-global-health-in-2019/.
|
| [4] |
Harbach RE. Family Culicidae Meigen, 1818[EB/OL]. (2024-10-18)[2024-11-06]. https://mosquito-taxonomic-inventory.myspecies.info/node/13679.
|
| [5] |
刘起勇. 2005-2020年我国媒介生物传染病报告病例: 流行趋势、防控挑战及应对策略[J]. 中国媒介生物学及控制杂志, 2022, 33(1): 1-7. Liu QY. Reported cases of vector-borne diseases in China, 2005-2020: Epidemic trend, challenges in prevention and control, and related coping strategies[J]. Chin J Vector Biol Control, 2022, 33(1): 1-7. DOI:10.11853/j.issn.1003.8280.2022.01.001 |
| [6] |
Atoni E, Zhao L, Hu C, et al. A dataset of distribution and diversity of mosquito-associated viruses and their mosquito vectors in China[J]. Sci Data, 2020, 7(1): 342. DOI:10.1038/s41597-020-00687-9 |
| [7] |
付文博, 陈斌. 蚊科昆虫分类及区系研究历史和现状概述[J]. 昆虫学报, 2018, 61(1): 122-138. Fu WB, Chen B. Taxonomy and fauna of Culicidae: History and current knowledge[J]. Acta Entomol Sin, 2018, 61(1): 122-138. DOI:10.16380/j.kcxb.2018.01.014 |
| [8] |
Jourdain F, Picard M, Sulesco T, et al. Identification of mosquitoes (Diptera: Culicidae): An external quality assessment of medical entomology laboratories in the MediLabSecure Network[J]. Parasit Vectors, 2018, 11(1): 553. DOI:10.1186/s13071-018-3127-7 |
| [9] |
Beebe NW. DNA barcoding mosquitoes: Advice for potential prospectors[J]. Parasitology, 2018, 145(5): 622-633. DOI:10.1017/S0031182018000343 |
| [10] |
汤旭, 肖迪, 张慧芳, 等. MALDI-TOF-MS鉴定布鲁氏菌方法建立和评价[J]. 中国人兽共患病学报, 2016, 32(9): 772-778. Tang X, Xiao D, Zhang HF, et al. Establishment and evaluation of identification of Brucella by MALDI-TOF-MS[J]. Chin J Zoonoses, 2016, 32(9): 772-778. DOI:10.3969/j.issn.1002-2694.2016.09.002 |
| [11] |
Yssouf A, Flaudrops C, Drali R, et al. Matrix-assisted laser desorption ionization-time of flight mass spectrometry for rapid identification of tick vectors[J]. J Clin Microbiol, 2013, 51(2): 522-528. DOI:10.1128/JCM.02665-12 |
| [12] |
Chavy A, Nabet C, Normand AC, et al. Identification of French Guiana sand flies using MALDI-TOF mass spectrometry with a new mass spectra library[J]. PLoS Negl Trop Dis, 2019, 13(2): e0007031. DOI:10.1371/journal.pntd.0007031 |
| [13] |
Sánchez-Juanes F, Calvo Sánchez N, Belhassen García M, et al. Applications of MALDI-TOF mass spectrometry to the identification of parasites and arthropod vectors of human diseases[J]. Microorganisms, 2022, 10(11): 2300. DOI:10.3390/microorganisms10112300 |
| [14] |
陆宝麟. 中国动物志. 昆虫纲. 第8卷. 双翅目. 蚊科(上)[M]. 北京: 科学出版社, 1997: 243-245, 403-404, 432-434. Lu BL. Fauna Sinica. Insecta, vol. 8. Diptera: Culicidae Ⅰ[M]. Beijing: Science Press, 1997: 243-245, 403-404, 432-434. |
| [15] |
陆宝麟. 中国动物志. 昆虫纲. 第9卷. 双翅目. 蚊科(下)[M]. 北京: 科学出版社, 1997: 31-34. Lu BL. Fauna Sinica. Insecta, vol. 9. Diptera: Culicidae Ⅱ[M]. Beijing: Science Press, 1997: 31-34. |
| [16] |
Yssouf A, Almeras L, Raoult D, et al. Emerging tools for identification of arthropod vectors[J]. Future Microbiol, 2016, 11(4): 549-566. DOI:10.2217/fmb.16.5 |
| [17] |
Bamou R, Costa MM, Diarra AZ, et al. Enhanced procedures for mosquito identification by MALDI-TOF MS[J]. Parasit Vectors, 2022, 15(1): 240. DOI:10.1186/s13071-022-05361-0 |
| [18] |
Batovska J, Blacket MJ, Brown K, et al. Molecular identification of mosquitoes (Diptera: Culicidae) in southeastern Australia[J]. Ecol Evol, 2016, 6(9): 3001-3011. DOI:10.1002/ece3.2095 |
| [19] |
郭秀霞, 程鹏, 刘丽娟, 等. 基于mtDNA-COⅠ基因的山东省蚊种群遗传多样性分析[J]. 中国血吸虫病防治杂志, 2018, 30(1): 37-41. Guo XX, Cheng P, Liu LJ, et al. Analysis of population genetic diversity of mosquitoes from Shandong Province based on mitochondrial DNA cytochrome oxidase subunit Ⅰgene fragment[J]. Chin J Schisto Control, 2018, 30(1): 37-41. DOI:10.16250/j.32.1374.2017091 |
| [20] |
Sevestre J, Diarra AZ, Laroche M, et al. Matrix-assisted laser desorption/ionization time-of flight mass spectrometry: an emerging tool for studying the vectors of human infectious diseases[J]. Future Microbiol, 2021, 16: 323-340. DOI:10.2217/fmb-2020-0145 |
| [21] |
Vega-Rúa A, Pagès N, Fontaine A, et al. Improvement of mosquito identification by MALDI-TOF MS biotyping using protein signatures from two body parts[J]. Parasit Vectors, 2018, 11(1): 574. DOI:10.1186/s13071-018-3157-1 |
| [22] |
Niare S, Berenger JM, Dieme C, et al. Identification of blood meal sources in the main African malaria mosquito vector by MALDI-TOF MS[J]. Malar J, 2016, 15: 87. DOI:10.1186/s12936-016-1152-6 |
| [23] |
Tahir D, Almeras L, Varloud M, et al. Assessment of MALDI-TOF mass spectrometry for filariae detection in Aedes aegypti mosquitoes[J]. PLoS Negl Trop Dis, 2017, 11(12): e0006093. DOI:10.1371/journal.pntd.0006093 |
| [24] |
Müller P, Pflüger V, Wittwer M, et al. Identification of cryptic Anopheles mosquito species by molecular protein profiling[J]. PLoS One, 2013, 8(2): e57486. DOI:10.1371/journal.pone.0057486 |
| [25] |
Raharimalala FN, Andrianinarivomanana TM, Rakotondrasoa A, et al. Usefulness and accuracy of MALDI-TOF mass spectrometry as a supplementary tool to identify mosquito vector species and to invest in development of international database[J]. Med Vet Entomol, 2017, 31(3): 289-298. DOI:10.1111/mve.12230 |
 2025, Vol. 36
2025, Vol. 36


