扩展功能
文章信息
- 任佳荣, 李世豪, 付邦, 王紫航, 刘蓬勃, 宋秀平, 方心悦, 梁莹, 刘小波, 刘起勇
- REN Jia-rong, LI Shi-hao, FU Bang, WANG Zi-hang, LIU Peng-bo, SONG Xiu-ping, FANG Xin-yue, LIANG Ying, LIU Xiao-bo, LIU Qi-yong
- 2015-2020年航空旅客数及气象因素对广东省登革热本地传播的影响
- Effects of the volume of air passengers and meteorological factors on local transmission of dengue fever in Guangdong Province, China, 2015-2020
- 中国媒介生物学及控制杂志, 2025, 36(2): 177-182
- Chin J Vector Biol & Control, 2025, 36(2): 177-182
- 10.11853/j.issn.1003.8280.2025.02.007
-
文章历史
- 收稿日期: 2024-10-15
2 山东大学齐鲁医学院公共卫生学院媒介生物控制学系, 山东 济南 250012;
3 浙江中医药大学公共卫生学院, 浙江 杭州 320053
2 Department of Vector Control, School of Public Health, Cheeloo College of Medicine, Shandong University, Jinan, Shandong 250012, China;
3 School of Public Health, Zhejiang Chinese Medical University, Hangzhou, Zhejiang 320053, China
登革热是一种由登革病毒(Dengue virus,DENV)引起的急性传染病,在中国主要通过白纹伊蚊(Aedes albopictus)和埃及伊蚊(Ae. aegypti)叮咬传播。该病主要流行于美洲、东南亚以及西太平洋等地区的城市化和半城市化区域[1]。根据世界卫生组织(World Health Organization,WHO)的统计,2000-2019年全球报告的登革热病例从50万增加至520万,全球约有50%的人口处于适宜登革热传播的地区,每年约有1亿~4亿人处于感染风险中[2]。1997-2020年中国大陆地区登革热病例整体呈现上升趋势[3],气候变化、全球化、城市化等多维因素使得登革热的地理分布呈现从东南沿海向西部、北部扩散的趋势[4-5]。当前登革热传播范围不断扩大,风险人群不断增加,且该病尚无治疗的特效药,广泛可用的疫苗仍在研发中,因此带来了严重的公共卫生风险与疾病负担[6]。
广东省是我国受登革热威胁最严重的省份之一,2005-2020年该省报告的登革热本地病例总数占全国累积报告病例总数的74%[7]。既往研究证据显示,目前登革热在广东省尚未形成地方性流行,主要是由东南亚国家输入的病例引发的本地扩散传播[8]。国际航空旅客运输是广东省登革热传播的重要驱动因素之一[9],随着东南亚航空旅客数的变化,广州、深圳市等广东省城市登革热的本地传播风险也随之变化[10]。此外,气象因素对登革热传播也会产生显著的影响。例如,气温、相对湿度和降水等通过影响媒介伊蚊的繁殖发育、传播病毒的能力、孳生环境和种群密度等[11-14],进而影响登革热的传播。随着全球化的发展,作为我国南大门的广东省与东南亚的经济、贸易、文化等的交流更加密切,且广东省属于亚热带季风气候,夏季长且降水充沛,为媒介伊蚊生长繁殖和登革热传播提供了理想环境,因此,广东省有较高的登革热输入和本地传播风险。综合考虑航空旅客数和气象因素双重因素对登革热本地传播的影响,将有助于该省制定更有效的防控策略措施,降低登革热的传播及暴发风险。
广义相加模型(generalized additive model,GAM)是在广义线性模型(generalized linear model,GLM)的基础上发展而来,能够捕捉不同的解释变量对响应变量未知的线性或非线性统计关系,且具有良好的可解释性,适用于多种分布类型的数据[15]。本研究基于2015-2020年广东省广州、佛山、惠州等8个市的逐月登革热病例监测数据,结合同期的气象因素以及以广东省为目的地的东南亚航空旅客数据,应用GAM分析气象因素、航空旅客数与登革热本地传播的关系,研究结果可为深入理解广东省登革热的传播模式及制定精准防控策略提供科学依据。
1 材料与方法 1.1 登革热病例数据收集2015年1月-2020年12月,广东省广州、佛山、惠州、梅州、汕头、深圳、湛江和珠海市8个城市的逐月登革热病例监测数据。数据来源于中国疾病预防控制信息系统传染病报告信息管理系统,依据《登革热病例监测指南》(中疾控传防发〔2014〕360号)将病例分为本地病例、境外输入病例2类。本地病例定义为发病前14 d内未离开本县(市、区)(现住址)的登革热病例;境外输入病例定义为发病前14 d内到过登革热流行的国家或地区的病例。
1.2 气象数据2015年1月-2020年12月的逐月气象资料来源于国家科技基础条件平台-国家地球系统科学数据共享服务平台(http://www.geodata.cn)。本研究纳入气温数据(月平均最低气温、月平均最高气温、月平均气温)、月降水数据、月平均相对湿度数据,空间分辨率为1 km×1 km。
1.3 航空旅客数2015年1月-2020年12月以广东省为目的地的东南亚10个国家(缅甸、泰国、柬埔寨、老挝、越南、菲律宾、马来西亚、新加坡、印度尼西亚、东帝汶)逐月的航空旅客数(包括直达航空旅客数、中转航空旅客数、总航空旅客数)数据,来源于航空数据公司OAG(https://www.oag.com/airline-schedulesflight-status-data-solutions)。
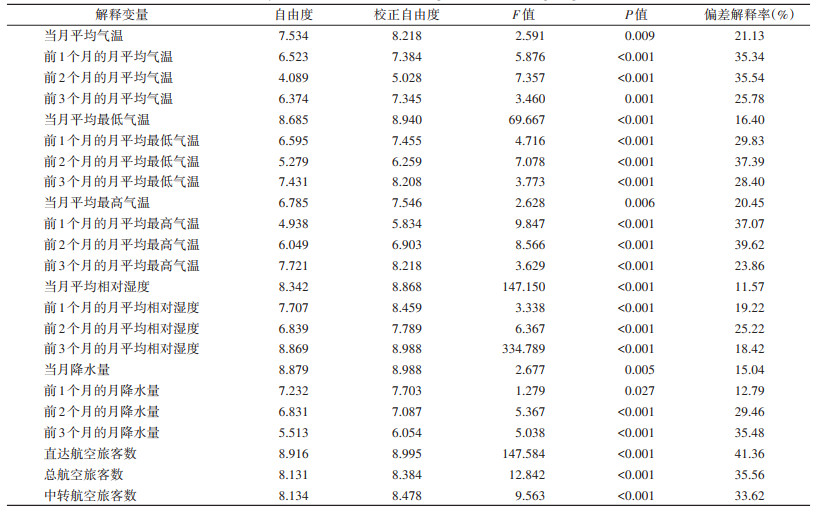
1.4 研究方法 1.4.1 单因素分析以登革热本地病例数作为响应变量,以提前0~3个月的气象因素及航空旅客数等23个潜在影响因素作为解释变量。登革热本地病例数呈过度离散分布,因此本研究拟合类泊松回归的GAM模型,使用自然立方样条平滑函数,逐一将每个解释变量引入模型,根据统计量F值、P值以及偏差解释率(deviance explained,单位为%,其大小反映单一解释变量对于响应变量变化的贡献程度)分析每个影响因素对登革热本地传播影响的显著性。
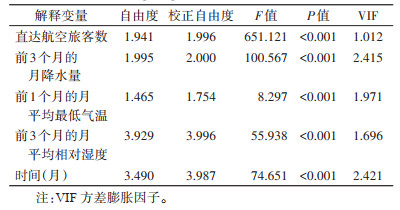
1.4.2 多因素分析多因素分析包括最优模型的筛选和共线性诊断。筛选出单因素分析中有统计学意义的影响因素作为解释变量,使用样条平滑函数进一步构建多因素GAM模型,以探究它们与登革热本地传播的关系。模型中加入月份以控制季节性趋势的影响。最优模型选择的标准包括:调整判定系数(R2)最大、偏差解释率最大、广义交叉验证指数(generalized cross validation,GCV)最小,并对登革热的传播具有生物学意义。对于最终选定的模型,使用方差膨胀因子(variance inflation factor,VIF)对解释变量进行共线性诊断。GAMs模型拟合公式如下:
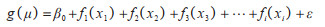
|
式中,g(μ)代表连接函数,μ代表登革热本地病例数的期望值,β0代表模型的截距,x1,x2,x3,…,xi代表解释变量,f1()+ f2()+ … + fi()代表各解释变量的平滑函数,ε代表随机误差。使用R 4.3.1软件中的“mgcv”包进行建模,P < 0.05为差异有统计学意义。
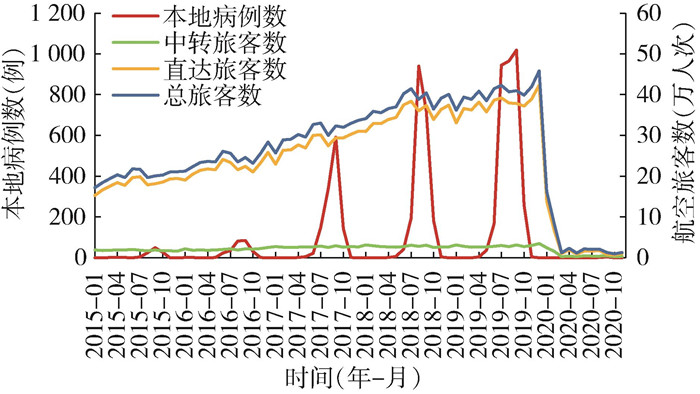
2 结果 2.1 登革热流行和航班往来描述性分析广东省广州、佛山、惠州、梅州、汕头、深圳、湛江和珠海市等8个城市与东南亚国家之间有国际航班往来。2015- 2020年,研究地区累计报告登革热病例8 739例,其中本地病例7 121例,境外输入病例1 574例。输入病例中1 396例(86.28%)来自东南亚。2015-2020年以广东省为目的地的东南亚航空旅客总数约1 901.25万人次,其中直达航空旅客约1 744.28万人次,中转旅客约156.97万人次。年度趋势分析显示,总航空旅客数自2015年的236.40万人次增长至2019年的481.30万人次,呈现出显著的逐年增长趋势,受新型冠状病毒感染疫情影响,2020年骤降。直达航空旅客数也呈现出相似的增长后急剧下降趋势。中转航空旅客数在2015-2019年呈现平稳趋势,2020年骤降。见图 1。
|
| 图 1 2015-2020年广东省登革热本地病例数与来自东南亚航空旅客数时间趋势图 Figure 1 Time courses of local dengue cases and the volume of air passengers from Southeast Asia in Guangdong Province, 2015-2020 |
| |
单因素分析发现,所有23个解释变量对登革热本地传播均有显著影响(均P < 0.05),所有解释变量与登革热本地传播之间存在显著的非线性关系(自由度均 > 1)。其中直达航空旅客数对登革热本地传播的影响最为显著,偏差解释率为41.36%;当月平均相对湿度影响相对最小,偏差解释率为11.57%。见表 1。
|
将单因素分析中具有统计学意义的影响因素纳入GAM进行拟合,以探究其与登革热本地传播的复杂关系。最终选定的最优模型R2=0.611,偏差解释率为74.19%,GCV为17.756,纳入的解释变量为直达航空旅客数、前1个月的月平均最低气温、前3个月的月降水量和前3个月的月平均相对湿度。共线性检验结果显示,所有纳入模型的解释变量VIF均 < 5,显示这些变量之间不存在共线性问题。见表 2。
|
最优模型中直达航空旅客数、月降水量、月平均最低气温、月平均相对湿度与登革热本地病例之间的暴露-反应曲线见图 2。直达航空旅客数与登革热本地传播之间整体上呈现近似线性的正相关关系,随着直达航空旅客数的增加,本地登革热病例数呈现单调递增的趋势。前1个月的月平均最低气温与登革热本地传播之间也呈现近似线性的正相关关系。前3个月的月降水量与登革热本地病例之间呈现倒“U”形的非线性关系,登革热本地病例数随着降水量的增加呈现先上升后下降的趋势,在约295 mm时达到高峰。前3个月的月平均相对湿度与登革热本地病例之间也呈现倒“U”形的非线性关系,阈值为70.93%。登革热本地病例传播呈现明显的时间趋势,高发月份为9-11月,在10月达到高峰。
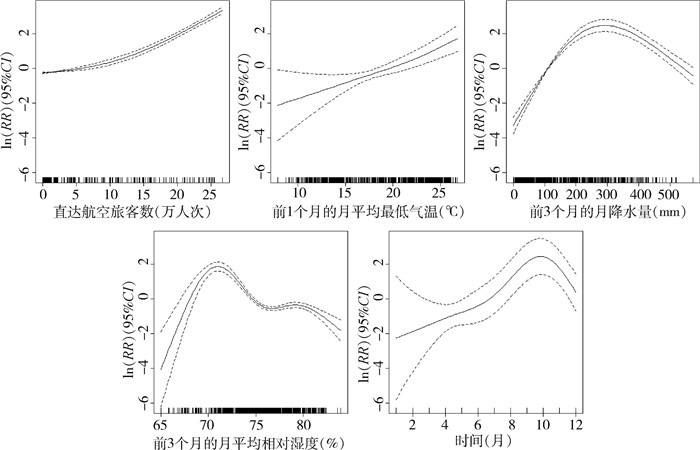
|
| 注:RR相对危险度;CI置信区间。 图 2 广义相加模型对广东省登革热本地病例数的多因素分析结果 Figure 2 Generalized additive model-based multivariable analysis of local dengue cases |
| |
本研究基于广东省8个市2015年1月-2020年12月的逐月登革热报告病例数据,利用GAM分析了研究地区航空旅客数结合气象因素对登革热本地传播的影响,发现航空旅客数、月平均最低温度、月降水量、月平均相对湿度对登革热本地传播均存在一定的非线性影响。
本研究发现广东省登革热本地传播与来自东南亚直达航空旅客数呈现近似线性的正向关系。2015-2019年,随着东南亚直达航空旅客数量的增长,广东省登革热本地传播风险也随之上升。2020年新型冠状病毒感染疫情“社会面”管控措施与登革热风险传播之间存在很强的关联[16],航空旅客数减少,广东省的本地病例随之减少,这一自然对照试验的建立进一步说明登革热的输入与国际航空交通转运路线建立有关。研究发现,中国登革热病例的输入及本地季节性流行与东南亚国家的登革热发病率高度一致,在5-10月,来自东南亚的航空旅客数增加,受感染者与广东省本地的媒介伊蚊接触,会导致广东省本地登革热传播风险的增加和流行期的延长[10]。当前,柬埔寨、印度尼西亚、老挝等10个国家登革热媒介伊蚊的杀虫剂抗药性发生率正在增加[17],加大了东南亚国家登革热防控的难度。且随着“一带一路”倡议的不断推进,东南亚国家与我国之间的人口、贸易往来不断增强,来自东南亚的登革热输入风险将会持续增加。另外,随着居民生活水平的提升和交通的便捷化,越来越多的中国居民可能会前往距离较近的东南亚国家旅游[18]。2016-2017年,在广州白云机场检测出的登革病毒感染者中,有74%为中国游客,且主要感染来源为东南亚地区[19]。提示从东南亚返回中国的航空旅客可能比东南亚国家前往我国的航空旅客更有可能将登革病毒输入中国。
登革热本地传播与前1个月的月平均最低气温呈现近似线性的相关关系。温度能够影响媒介伊蚊的生长发育过程和登革热传播周期的许多环节。在15~30 ℃的温度范围内,随着温度升高,白纹伊蚊卵的孵化、化蛹和羽化时间缩短,孵化率、化蛹率和羽化率增加。当温度 < 15 ℃或 > 40 ℃时,伊蚊的生长发育受到抑制[20]。当温度从18 ℃升高至32 ℃时,登革病毒在白纹伊蚊体内的复制速度加快,外潜伏期缩短,使得白纹伊蚊能够更快地成为有效媒介[13]。此外,温度的升高使得易感人群裸露在外的皮肤面积增加,增加了人-蚊接触的机会,从而增加登革热的感染风险。本文所研究的广东地区5-10月的月平均最低气温在17~27 ℃之间,为媒介伊蚊的生长和登革热的传播提供了有利的条件。
本研究发现,前3个月的月降水量与登革热本地传播风险呈现倒“U”型的关系,阈值约为295 mm,超过这一阈值后,登革热传播风险呈现下降趋势,这与以往的研究基本一致[21]。白纹伊蚊幼蚊在多种小型蓄水容器中生长发育,如废弃轮胎、垃圾桶、花瓶等[22]。降水量的增加会为幼蚊创造更多的孳生地,但当降水量过高时,可能冲毁繁殖栖息地使幼蚊和蛹溢出,从而降低幼蚊的存活率。另外,雌性白纹伊蚊倾向于在半满的容器中产卵,降水量过大时,满灌容器的溢水速度加快,这可能间接产生产卵趋避效应,进而会使得伊蚊的种群密度降低[23]。本研究发现在相对湿度 < 70.93%时,其对登革热本地传播有正向影响。以往有学者以广州市为研究地区确定了相对湿度对登革热传播的影响阈值为76%[21],这与本研究结果基本一致。相对湿度对伊蚊卵的孵化有显著影响,随相对湿度的增加孵化率升高,在相对湿度75%时最高[24];过高和过低的相对湿度均不利于孵化。此外,相对湿度还会影响白纹伊蚊幼蚊的生长发育速率、成蚊的生长与繁殖[25]。
本研究综合分析了来自东南亚的航空旅客数量、月平均最低温度、月降水量以及月平均相对湿度等因素,发现它们对广东地区登革热的本地传播具有非线性影响。航空旅行可使传染源输入与本地媒介伊蚊接触,在自然环境与社会经济因素的共同驱动下建立本地传播。本研究结果为今后登革热的防控提供了一定的数据参考,并提示在本地登革热防控中,不仅需要关注输入后驱动本地登革热暴发的环境因素,也要关注登革热的输入。特别是发现东南亚地区登革热暴发流行时,港口应该加强对该地区入境旅客的登革热检验检疫工作,本地医疗机构要加强对有在该地区旅居史的人员的登革热检测诊断,进一步强化本地媒介伊蚊的防控。
利益冲突 无
| [1] |
Bhatt S, Gething PW, Brady OJ, et al. The global distribution and burden of dengue[J]. Nature, 2013, 496(7446): 504-507. DOI:10.1038/nature12060 |
| [2] |
World Health Organization. Dengue-Global situation[EB/OL]. (2023-12-21)[2024-10-15]. https://www.who.int/emergencies/disease-outbreak-news/item/2024-DON518.
|
| [3] |
胡学锋, 吴霜, 吴媛媛, 等. 1997-2020年中国大陆登革热病例数量变化及时间序列拟合研究[J]. 中国国境卫生检疫杂志, 2022, 45(3): 216-219. Hu XF, Wu S, Wu YY, et al. Quantity changes and analysis of dengue fever cases by time series fitting in China's mainland from 1997 to 2020[J]. Chin Front Health Quar, 2022, 45(3): 216-219. DOI:10.16408/j.1004-9770.2022.03.011 |
| [4] |
刘起勇. 新时代媒介生物传染病形势及防控对策[J]. 中国媒介生物学及控制杂志, 2019, 30(1): 1-6, 11. Liu QY. Epidemic profile of vector-borne diseases and vector control strategies in the new era[J]. Chin J Vector Biol Control, 2019, 30(1): 1-6, 11. DOI:10.11853/j.issn.1003.8280.2019.01.001 |
| [5] |
Yue YJ, Liu XB, Xu M, et al. Epidemiological dynamics of dengue fever in Chinese mainland, 2014-2018[J]. Int J Infect Dis, 2019, 86: 82-93. DOI:10.1016/j.ijid.2019.06.015 |
| [6] |
Messina JP, Brady OJ, Golding N, et al. The current and future global distribution and population at risk of dengue[J]. Nat Microbiol, 2019, 4(9): 1508-1515. DOI:10.1038/s41564-019-0476-8 |
| [7] |
Yue YJ, Liu QY, Liu XB, et al. Dengue fever in Chinese mainland, 2005-2020: A descriptive analysis of dengue cases and Aedes data[J]. Int J Environ Res Public Health, 2022, 19(7): 3910. DOI:10.3390/ijerph19073910 |
| [8] |
Cui FF, He FW, Huang XR, et al. Dengue and Dengue virus in Guangdong, China, 1978-2017: Epidemiology, seroprevalence, evolution, and policies[J]. Front Med, 2022, 9: 797674. DOI:10.3389/fmed.2022.797674 |
| [9] |
Chen Y, Yang ZF, Jing QL, et al. Effects of natural and socioeconomic factors on dengue transmission in two cities of China from 2006 to 2017[J]. Sci Total Environ, 2020, 724: 138200. DOI:10.1016/j.scitotenv.2020.138200 |
| [10] |
Lai SJ, Johansson MA, Yin WW, et al. Seasonal and interannual risks of dengue introduction from South-East Asia into China, 2005-2015[J]. PLoS Negl Trop Dis, 2018, 12(11): e0006743. DOI:10.1371/journal.pntd.0006743 |
| [11] |
Reinhold JM, Lazzari CR, Lahondère C. Effects of the environmental temperature on Aedes aegypti and Aedes albopictus mosquitoes: A review[J]. Insects, 2018, 9(4): 158. DOI:10.3390/insects9040158 |
| [12] |
Xu ZW, Bambrick H, Yakob L, et al. Spatiotemporal patterns and climatic drivers of severe dengue in Thailand[J]. Sci Total Environ, 2019, 656: 889-901. DOI:10.1016/j.scitotenv.2018.11.395 |
| [13] |
Liu ZZ, Zhang ZH, Lai ZT, et al. Temperature increase enhances Aedes albopictus competence to transmit Dengue virus[J]. Front Microbiol, 2017, 8: 2337. DOI:10.3389/fmicb.2017.02337 |
| [14] |
Xu L, Stige LC, Chan KS, et al. Climate variation drives dengue dynamics[J]. Proc Natl Acad Sci USA, 2017, 114(1): 113-118. DOI:10.1073/pnas.1618558114 |
| [15] |
Lin X, Liao Y, Hao YT. The burden associated with ambient PM2.5 and meteorological factors in Guangzhou, China, 2012-2016: A generalized additive modeling of temporal years of life lost[J]. Chemosphere, 2018, 212: 705-714. DOI:10.1016/j.chemosphere.2018.08.129 |
| [16] |
Chen YY, Li NZ, Lourenço J, et al. Measuring the effects of COVID-19-related disruption on dengue transmission in Southeast Asia and Latin America: A statistical modelling study[J]. Lancet Infect Dis, 2022, 22(5): 657-667. DOI:10.1016/S1473-3099(22)00025-1 |
| [17] |
Gan SJ, Leong YQ, Barhanuddin MFHB, et al. Dengue fever and insecticide resistance in Aedes mosquitoes in Southeast Asia: A review[J]. Parasit Vectors, 2021, 14(1): 315. DOI:10.1186/s13071-021-04785-4 |
| [18] |
伦辛畅, 赵春春, 朱彩英, 等. 2011-2019年柬埔寨登革热疫情及赴柬旅游对我国输入登革热的影响分析[J]. 中国媒介生物学及控制杂志, 2021, 32(3): 312-317. Lun XC, Zhao CC, Zhu CY, et al. Impact analysis of dengue fever epidemic in Cambodia and tourism to Cambodia on imported dengue fever in China from 2011 to 2019[J]. Chin J Vector Biol Control, 2021, 32(3): 312-317. DOI:10.11853/j.issn.1003.8280.2021.03.011 |
| [19] |
Feng X, Sun W, Birkhead GS, et al. The surveillance of four mosquito-borne diseases in international travelers arriving at Guangzhou Baiyun International Airport, China, 2016-2017[J]. Travel Med Infect Dis, 2019, 32: 101513. DOI:10.1016/j.tmaid.2019.101513 |
| [20] |
李菊林, 朱国鼎, 周华云, 等. 不同温度下白纹伊蚊发育情况的观察[J]. 中国血吸虫病防治杂志, 2015, 27(1): 59-61. Li JL, Zhu GD, Zhou HY, et al. Effect of different temperatures on development of Aedes albopictus[J]. Chin J Schisto Control, 2015, 27(1): 59-61. DOI:10.16250/j.32.1374.2014078 |
| [21] |
Wu XC, Lang LL, Ma WJ, et al. Non-linear effects of mean temperature and relative humidity on dengue incidence in Guangzhou, China[J]. Sci Total Environ, 2018, 628-629: 766-771. DOI:10.1016/j.scitotenv.2018.02.136 |
| [22] |
杨舒然, 刘起勇. 白纹伊蚊的全球分布及扩散趋势[J]. 中国媒介生物学及控制杂志, 2013, 24(1): 1-4. Yang SR, Liu QY. Trend in global distribution and spread of Aedes albopictus[J]. Chin J Vector Biol Control, 2013, 24(1): 1-4. |
| [23] |
Dieng H, Rahman GMS, Hassan AA, et al. The effects of simulated rainfall on immature population dynamics of Aedes albopictus and female oviposition[J]. Int J Biometeorol, 2012, 56(1): 113-120. DOI:10.1007/s00484-011-0402-0 |
| [24] |
杨振洲, 陆宝麟. 湿度对白纹伊蚊卵存活的影响[J]. 医学动物防制, 1985(4): 1-3. Yang ZZ, Lu BL. Effect of humidity on egg survival of Aedes albopictus[J]. J Med Pest Control, 1985(4): 1-3. |
| [25] |
蔡小双. 温度、相对湿度和光照度对白纹伊蚊生物学参数的影响研究[D]. 广州: 暨南大学, 2020. DOI: 10.27167/d.cnki.gjinu.2020.000386. Cai XS. A study on the effect of temperature, relative humidity and illuminance on the entomological parameters of Aedes albopictus[D]. Guangzhou: Jinan University, 2020. DOI: 10.27167/d.cnki.gjinu.2020.000386.(in Chinese) |
 2025, Vol. 36
2025, Vol. 36


