扩展功能
文章信息
- 刘洋, 李建云, 刘芳, 张喆, 张娇
- LIU Yang, LI Jian-yun, LIU Fang, ZHANG Zhe, ZHANG Jiao
- 内蒙古长爪沙鼠鼠疫自然疫源地巴尔通体感染情况调查
- An investigation of Bartonella infections in the natural foci of Meriones unguiculatus plague in Inner Mongolia Autonomous Region, China
- 中国媒介生物学及控制杂志, 2024, 35(4): 500-507
- Chin J Vector Biol & Control, 2024, 35(4): 500-507
- 10.11853/j.issn.1003.8280.2024.04.021
-
文章历史
- 收稿日期: 2024-03-11
2 内蒙古自治区疾病预防控制中心鼠疫防控科, 内蒙古 呼和浩特 010000
2 Department of Plague Prevention and Control, Inner Mongolia Autonomous Region Center for Disease Control and Prevention, Hohhot, Inner Mongolia 010000, China
巴尔通体属于变形菌纲(Proteobacteria)α变形菌门(Alphaproteobacteria)根瘤菌目(Rhizobiales)巴尔通体科(Bartonellaceae)巴尔通体属(Bartonella),是一组全球分布的革兰阴性兼性胞内细菌。迄今为止,该属至少由53个种7个亚种和一些未命名的巴尔通体种组成。许多巴尔通体被认为是人类和家畜新发传染病的病原体[1]。到2021年,至少有20种巴尔通体被报道感染人类,临床表现从轻微和非特异性的临床症状到危及生命的症状不等[2-3]。在过去的几十年中,研究发现可感染人类的巴尔通体菌株有克氏巴尔通体(B. clarridgeiae)、伊丽莎白巴尔通体(B. elizabethae)、格拉汉姆巴尔通体(B. grahamii)、克勒巴尔通体(B. koehlerae)、B. kosoyi、B. melophagi、罗莎利马巴尔通体(B. rochalimae)、B. tamiae和B. washoensis,而大多数巴尔通体感染为五日巴尔通体(B. quintana)、汉赛巴尔通体(B. henselae)和杆菌样巴尔通体(B. bacilliformis)引起,感染的主要临床表现为发热、疲劳、神经视网膜炎、局部淋巴结肿大和心内膜炎等症状[4-10]。
截至2021年,我国已在黑龙江、陕西、福建、新疆、河南、浙江、云南、广东、海南和青海等省(自治区)发现多种巴尔通体[11-16]。此外,在位于中国北部的内蒙古自治区(内蒙古)发现了长爪沙鼠(Meriones unguiculatus)携带格拉汉姆巴尔通体[17],2012年内蒙古锡林郭勒盟二连浩特市小型兽类巴尔通体检测阳性率为57.26%[18],2015年在内蒙古乌拉特口岸鼠类巴尔通体检测阳性率为38.64%[19],2020年王宁等[20]对内蒙古西部二连浩特、策克、鄂尔多斯3个主要口岸进行调查,巴尔通体的阳性率为43.26%。然而,一些研究只是初步分析了1个单一的短基因片段。为进一步探究中国巴尔通体的多样性和流行病学特征,预防巴尔通体感染人群,本研究收集了内蒙古乌兰察布市四子王旗和杭锦旗郊区的啮齿动物样本,并从3个基因角度对其中的巴尔通体菌株进行了分析研究。
1 材料与方法 1.1 样本采集和DNA提取内蒙古长爪沙鼠鼠疫自然疫源地被黄河天然分为2片相对独立区域,黄河以北是乌兰察布高原疫源地,黄河以南是鄂尔多斯高原疫源地。本研究选取乌兰察布市四子王旗的3个地点(红格尔苏木、白音朝克图和脑木更)和鄂尔多斯市杭锦旗的3个地点(伊和乌素苏木、锡尼镇浩绕柴达木嘎查、亚什图嘎查三社)进行采样。夹夜法捕获的啮齿动物形态学鉴定[21]后无菌操作取肝脏样本,使用DNeasy Blood & Tissue Kit核酸提取试剂盒(德国,QIAGEN公司)提取啮齿动物肝脏组织样本DNA,PCR扩增样本核酸柠檬酸合酶基因(gltA)、细胞分裂蛋白基因(ftsZ)和16S-23S内部转录间隔区(ITS)基因进行检测。
1.2 巴尔通体gltA、ftsZ和ITS基因的扩增各基因的引物信息和PCR反应参数信息见表 1、2。所用仪器为Genesy 96T PCR扩增仪(西安天隆科技有限公司生产)。对所有预期大小的PCR产物送北京睿博兴科生物技术有限公司测序,然后通过基于局部比对算法的搜索工具(BLAST)对所获序列进行同源性比对。
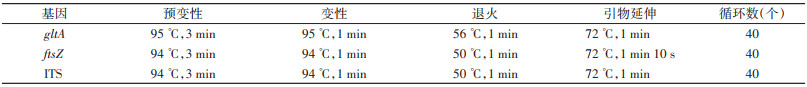
|
将测序得到的gltA、ftsZ、ITS基因序列和GenBank数据库中比对同源性高的巴尔通体菌株序列在MEGA 11.0软件中使用Clustal W方法进行手动比对,并使用SeqMan 7.1软件进行修剪以去除质量差的序列。使用PhyML中的最大似然(maximum likelihood,ML)法,基于核苷酸序列构建系统发育树,通过替代模型测试确定最适合的系统发育模型。自展检验法用来检验置信度,进行1 000次循环。
1.4 统计学分析使用SPSS 27.0软件中的Fisher确切概率检验分析不同鼠种巴尔通体感染率的差异。P<0.01为差异有统计学意义。
2 结果 2.1 鼠类感染巴尔通体情况2021秋季,在内蒙古乌兰察布市四子王旗3地(红格尔苏木、白音朝克图、脑木更)郊区共采集鼠类110只。根据文献[21],鉴定为长爪沙鼠67只、达乌尔黄鼠(Spermophilus dauricus)21只、黄兔尾鼠(Eolagurus luteus)21只和黑线仓鼠(Cricetus barabensis)1只。2022年秋季,在内蒙古杭锦旗(伊和乌素苏木、锡尼镇浩绕柴达木嘎查、亚什图嘎查三社)郊区共采集鼠类65只。形态学鉴定为长爪沙鼠32只、五趾跳鼠(Orientallactaga sibirica)7只、子午沙鼠(M. meridianus)10只、小毛足鼠(Phodopus roborovskii)3只和黑线仓鼠13只。2地共计捕获鼠类175只,其中6种75只检出尔通体核酸阳性,阳性率为42.86%(75/175)。见表 3。
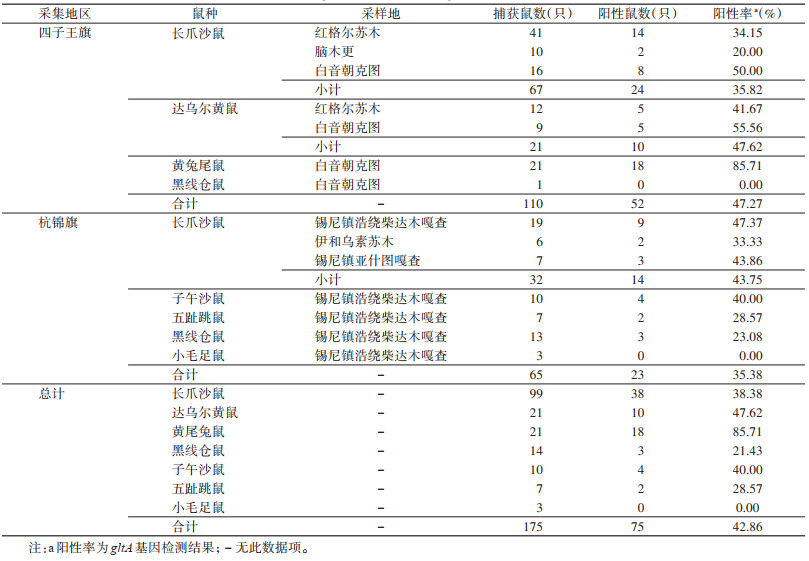
|
经Fisher确切概率检验,检出巴尔通体阳性的6种不同鼠种间巴尔通体阳性率差异有统计学意义(P=0.001)。
2.3 巴尔通体菌株的遗传进化分析基于gltA基因检测巴尔通体阳性的75个样品中,选择31个代表性菌株进行遗传进化分析。以分支Bartonella sp. str8为代表的7份样本与Candidatus B. gerbillinarum(MH618815)的同源性最高为97.65%。以分支Bartonella sp. str46为代表的4份样本与Candidatus B. gerbillinarum(MH618805)的同源性最高为97.06%。以分支Bartonella sp. str39为代表的6分样本与Candidatus B. negeviensis(MH618799)的同源性在92.21%~92.94%。以分支Bartonella sp. str18为代表的4份样本与B. krasnovii strain D1(MH618787)的同源性最高为97.65%。以分支Bartonella sp. str72为代表的5份样本与B. grahamii(AY584854)的同源性最高为96.76%。以分支Bartonella sp. str16为代表的4份样本与B. henselae(MN107415)同源性最高为91.83%,与B. koehlerae(AF176091)的同源性为90.86%,见图 1。Bartonella sp. str20与已知巴尔通体的同源性较低,未纳入分析。
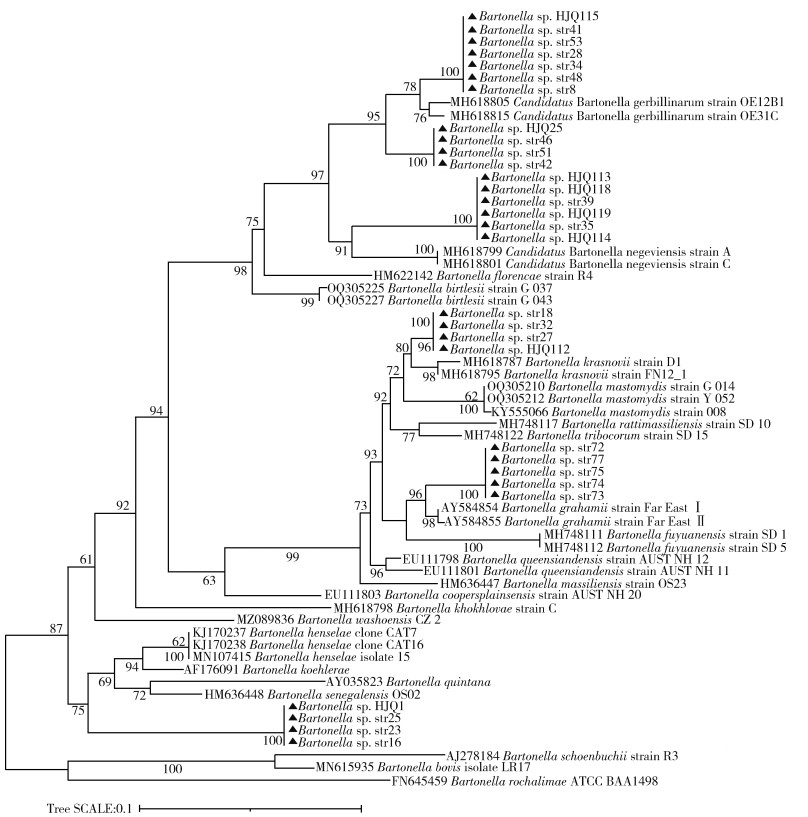
|
| 注:▲表示本研究所获序列。 图 1 基于gltA基因片段的内蒙古自治区长爪沙鼠鼠疫自然疫源地鼠类巴尔通体遗传进化树 Figure 1 Evolutionary tree based on gltA gene fragment for Bartonella in rodents at the natural foci of Meriones unguiculatus plague, Inner Mongolia Autonomous Region |
| |
ftsZ基因序列分析表明,以分支Bartonella sp. str23为代表的3份样本与B. quintana(JQ314416)的同源性最高为86.48%。以分支Bartonella sp. str20为代表的3份样本与B. krasnovii(CP093036)的同源性最高为95.74%。以分支Bartonella sp. str73为代表的5份样本与B. grahamii(AY454530)的同源性最高为95.87%。以分支Bartonella sp. str8为代表的13份样本与B. alsatica(CP058235)的同源性最高为87.07%;与B. taylorii(CP083444)的同源性最高为86.97%,见图 2。与gltA基因相比,选择的31条序列中,Bartonella sp. str16、str18、str42、str53、str72、str77、HJQ112等7条序列因同源性较低,未纳入分析。
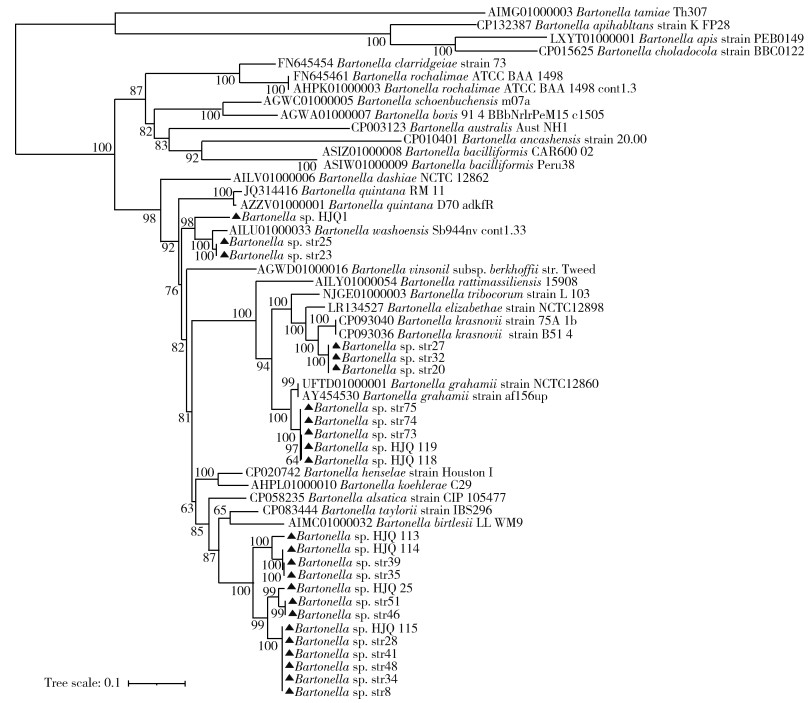
|
| 注:▲本研究所获序列。 图 2 基于ftsZ基因的内蒙古自治区长爪沙鼠鼠疫自然疫源地鼠类巴尔通体遗传进化树 Figure 2 Evolutionary tree based on ftsZ gene fragment for Bartonella in rodents at the natural foci of Meriones unguiculatus plague, Inner Mongolia Autonomous Region |
| |
基于ITS基因的序列分析表明,分支Bartonella sp. str20、str27与B. krasnovii(MH619455)的同源性最高为93.24%。以分支Bartonella sp. str72为代表的3份样本与B. grahamii(AJ269785)的同源性为89.60%,与B. grahamii as4aup(CP001562,图中未示)的同源性为89.79%。以分支Bartonella sp. str35为代表的3份样本与Candidatus B. negeviensis(MH619461)同源性最高为89.35%。分支Bartonella sp. str16、str25与B. washoensis(AB674249)的同源性最高为99.75%,分支Bartonella HJQ1与B. washoensis(AB674251)的同源性为85.79%,与B. koehlerae(AF312490)的同源性为85.15%。以分支Bartonella sp. str8为代表的10份样本与Candidatus B. gerbillinarum(MH619469)的同源性在88.83%~90.64%,见图 3。与gltA基因相比,选择的31条序列中,Bartonella sp. str18、str23、str32、str48、str74、str75、HJQ25、HJQ112、HJQ113、HJQ119等10条序列因同源性较低,未纳入分析。
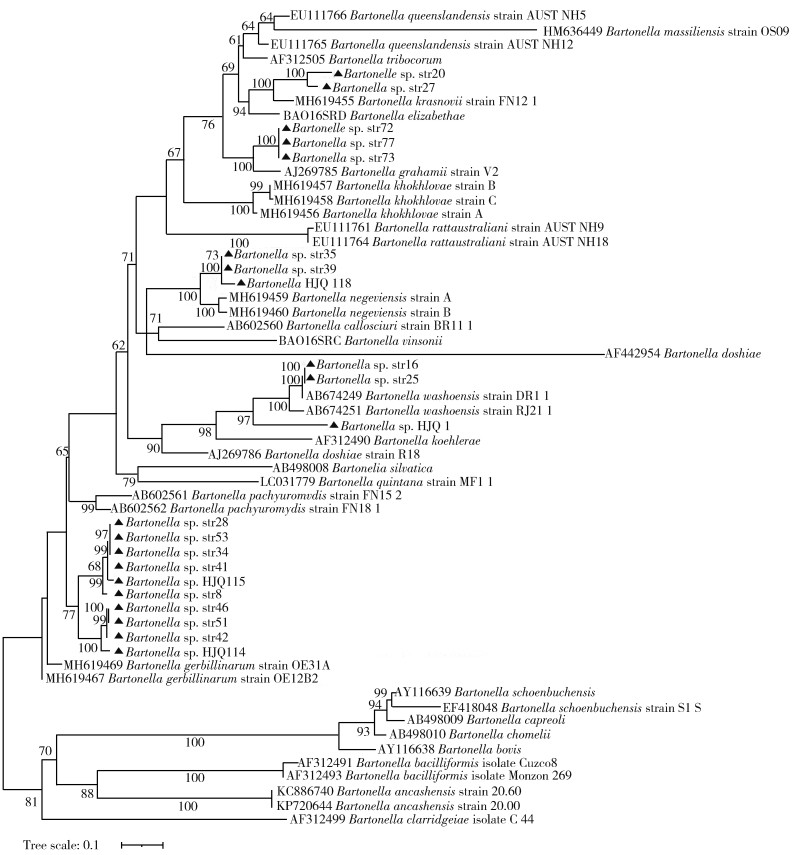
|
| 注:▲本研究所获序列。 图 3 基于ITS基因的内蒙古自治区长爪沙鼠鼠疫自然疫源地鼠类巴尔通体遗传进化树 Figure 3 Evolutionary tree based on ITS gene fragment for Bartonella in rodents at the natural foci of Meriones unguiculatus plague, Inner Mongolia Autonomous Region |
| |
巴尔通体被认为是新出现的人兽共患病病原体,分布在世界各地。啮齿动物和蝙蝠等小型哺乳动物是巴尔通体的主要宿主,目前报道的巴尔通体物种中约2/3由啮齿动物携带。巴尔通体培养是巴尔通体种类鉴定的金标准,但由于巴尔通体生长缓慢,培养困难且费时,所以目前其最实用的鉴定方法是特异性基因的扩增[24]。本研究主要基于gltA、ftsZ、ITS基因对啮齿类携带巴尔通体的流行情况进行调查。gltA基因具有鉴定巴尔通体属的特异性,目前在国内外已较广泛地应用于巴尔通体感染的实验室诊断与调查[25]。Zeaiter等[26]收集大量的临床实验资料对编码ftsZ蛋白N端区和C端区基因系统分析,证明采用编码蛋白C端区ftsZ基因的区域,在判定巴尔通体感染上很有价值。
在本次内蒙古鼠类动物的调查研究中,基于gltA基因的筛查鉴定,巴尔通体的总阳性率为42.86%(75/175)。这一比例低于2020年内蒙古西部口岸鼠类巴尔通体的筛查结果(53.24%)[27],高于呼伦贝尔边境地区口岸的巴尔通体阳性率(20.04%)[28];与先前报道的云南省(43.5%)[29]和山西省(49.52%)[30]鼠类阳性率相近。经基因序列分析与遗传进化分析表明鄂尔多斯高原和乌兰察布高原地区鼠类动物中共检出沙鼠巴尔通体(B. gerbillinarum)、Candidatus B. negeviensis、克拉斯诺夫巴尔通体(B. krasnovii)、格拉汉姆巴尔通体、汉赛巴尔通体、B. washoensis等6种巴尔通体。而基于ftsZ和ITS基因的遗传进化与gltA基因的分析基本相似,个别菌株有所差异,如从四子王旗的长爪沙鼠中检出的菌株Bartonella sp. str23、str25和杭锦旗长爪沙鼠检出的菌株Bartonella sp HJQ1在gltA基因的遗传进化树中与汉赛巴尔通体同源性最高,为91.83%,在ftsZ基因的遗传进化树中与五日热巴尔通体的同源性最高,为86.48%,而在ITS的遗传进化树中从四子王旗的长爪沙鼠中检出的菌株Bartonella sp. str16、str25与B. washoensis的同源性最高,为99.75%。
本次研究所检出的巴尔通体种类在国内其他地区也已被检出[29],且格拉汉姆巴尔通体、B. washoensis、汉赛巴尔通体、五日热巴尔通体4种巴尔通体均可对人类致病。长爪沙鼠、达乌尔黄鼠、黄兔尾鼠、五趾跳鼠、子午沙鼠、黑线仓鼠不同鼠种间巴尔通体感染率差异有统计学意义,表明巴尔通体感染存在宿主差异性。内蒙古人口数量多、农牧区面积大、啮齿动物广泛分布,增大了巴尔通体威胁人类安全的概率。防控巴尔通体病的主要措施应结合当地巴尔通体高感染率鼠种的分布,控制传染源和避免接触传播媒介;疾病预防控制中心等相关部门需加强鼠情的日常监测,注意鼠体表寄生虫的感染情况,制定适宜的处理措施,阻断病原体在鼠与鼠、鼠与人、人与人之间传播。
本研究所获得四子王旗的巴尔通体序列已提交到GenBank数据库,登录号为:OQ263198~OQ263220(gltA基因序列)、OQ263221~OQ263237(ftsZ基因序列)、OQ268229~OQ268245(ITS基因序列)。
利益冲突 无
| [1] |
Majerová K, Gutiérrez R, Fonville M, et al. Hedgehogs and squirrels as hosts of zoonotic Bartonella species[J]. Pathogens, 2021, 10(6): 686. DOI:10.3390/pathogens10060686 |
| [2] |
Krügel M, Król N, Kempf VAJ, et al. Emerging rodent-associated Bartonella: A threat for human health?[J]. Parasit Vectors, 2022, 15(1): 113. DOI:10.1186/s13071-022-05162-5 |
| [3] |
Okaro U, Addisu A, Casanas B, et al. Bartonella species, an emerging cause of blood-culture-negative endocarditis[J]. Clin Microbiol Rev, 2017, 30(3): 709-746. DOI:10.1128/CMR.00013-17 |
| [4] |
Noguchi H. The etiology of verruga Peruana[J]. J Exp Med, 1927, 45(1): 175-189. DOI:10.1084/jem.45.1.175 |
| [5] |
Pitassi LHU, de Paiva Diniz PPV, Scorpio DG, et al. Bartonella spp. bacteremia in blood donors from Campinas, Brazil[J]. PLoS Negl Trop Dis, 2015, 9(1): e0003467. DOI:10.1371/journal.pntd.0003467 |
| [6] |
Okujava R, Guye P, Lu YY, et al. A translocated effector required for Bartonella dissemination from derma to blood safeguards migratory host cells from damage by co-translocated effectors[J]. PLoS Pathog, 2014, 10(6): e1004187. DOI:10.1371/journal.ppat.1004187 |
| [7] |
张振兴, 李玉峰. 巴尔通体病研究进展[J]. 畜牧与兽医, 2012, 44(11): 91-95. Zhang ZX, Li YF. Research progress on bartonellosis[J]. Anim Husb Vet Med, 2012, 44(11): 91-95. |
| [8] |
左双燕. 我国黑龙江林区鼠型动物巴尔通体感染调查与分离鉴定[D]. 长沙: 中南大学, 2012. Zuo SY. Detection and isolation of Bartonella spp. in rodents in Heilongjiang Province of China[D]. Changsha: Central South University, 2012. (in Chinese) |
| [9] |
栗冬梅, 张建中, 刘起勇. 中国巴尔通体与相关疾病的研究进展[J]. 中国人兽共患病学报, 2008, 24(8): 762-765, 770. Li DM, Zhang JZ, Liu QY. Progress of research progress on Bartonella and related diseases in China[J]. Chin J Zoonoses, 2008, 24(8): 762-765, 770. DOI:10.3969/j.issn.1002-2694.2008.08.019 |
| [10] |
Chang CC, Chomel BB, Kasten RW, et al. Bartonella spp. isolated from wild and domestic ruminants in north America[J]. Emerg Infect Dis, 2000, 6(3): 306-311. DOI:10.3201/eid0603.000313 |
| [11] |
An CH, Chen BB, Lyu W, et al. Bartonella species investigated among rodents from Shaanxi Province of China[J]. Biomed Environ Sci, 2020, 33(3): 201-205. DOI:10.3967/bes2020.028 |
| [12] |
Hao LL, Yuan DB, Guo L, et al. Molecular detection of Bartonella in Ixodid ticks collected from yaks and plateau pikas (Ochotona curzoniae) in Shiqu county, China[J]. BMC Vet Res, 2020, 16(1): 235. DOI:10.1186/s12917-020-02452-x |
| [13] |
Li DM, Hou Y, Song XP, et al. High prevalence and genetic heterogeneity of rodent-borne Bartonella species on Heixiazi Island, China[J]. Appl Environ Microbiol, 2015, 81(23): 7981-7992. DOI:10.1128/AEM.02041-15 |
| [14] |
Liu HX, Han TW, Liu WJ, et al. Epidemiological characteristics and genetic diversity of Bartonella species in rodents from southeastern China[J]. Zoonoses Public Health, 2022, 69(3): 224-234. DOI:10.1111/zph.12912 |
| [15] |
Rao HX, Li SJ, Lu L, et al. Genetic diversity of Bartonella species in small mammals in the Qaidam Basin, western China[J]. Sci Rep, 2021, 11(1): 1735. DOI:10.1038/s41598-021-81508-w |
| [16] |
Yao XY, Liu H, Sun J, et al. Epidemiology and genetic diversity of Bartonella in rodents in urban areas of Guangzhou, Southern China[J]. Front Microbiol, 2022, 13: 942587. DOI:10.3389/fmicb.2022.942587 |
| [17] |
Lu X, Peng Y, Geng YY, et al. Co-localization of sampling and sequencing for zoonotic pathogen identification in the field monitoring using mobile laboratories[J]. China CDC Wkly, 2022, 4(12): 259-263. DOI:10.46234/ccdcw2022.059 |
| [18] |
宋秀平, 栗冬梅, 贾丽军, 等. 内蒙古小型兽类巴尔通体感染情况调查[J]. 中国媒介生物学及控制杂志, 2015, 26(3): 233-237. Song XP, Li DM, Jia LJ, et al. Investigation of Bartonella infection in small mammals in Inner Mongolia, China[J]. Chin J Vector Biol Control, 2015, 26(3): 233-237. DOI:10.11853/j.issn.1003.4692.2015.03.004 |
| [19] |
靳木子, 郝广福, 王静, 等. 内蒙古乌拉特口岸地区2015年鼠类携带病原体情况调查[J]. 中国媒介生物学及控制杂志, 2018, 29(3): 296-297. Jin MZ, Hao GF, Wang J, et al. Investigation on natural infection of rodent-borne pathogens in rodent populations in Urad port area, Inner Mongolia, China in 2015[J]. Chin J Vector Biol Control, 2018, 29(3): 296-297. DOI:10.11853/j.issn.1003.8280.2018.03.020 |
| [20] |
王宁, 靳木子, 蒋兰芬, 等. 内蒙古西部口岸地区鼠类及其携带病原体调查[J]. 中华疾病控制杂志, 2020, 24(6): 716-722. Wang N, Jin MZ, Jiang LF, et al. Pathogen investigation of rodents in the western ground crossings of Inner Mongolia[J]. Chin J Dis Control Prev, 2020, 24(6): 716-722. DOI:10.16462/j.cnki.zhjbkz.2020.06.019 |
| [21] |
旭日干. 内蒙古动物志(第五卷)[M]. 呼和浩特: 内蒙古大学出版社, 2016: 25-64, 104-216. Xu RG. Fauna of Inner Mongolia, Volume 5[M]. Hohhot: Inner Mongolia University Press, 2016: 25-64, 104-216. |
| [22] |
Saengsawang P, Kaewmongkol G, Inpankaew T. Molecular detection of Bartonella spp. and hematological evaluation in domestic cats and dogs from Bangkok, Thailand[J]. Pathogens, 2021, 10(5): 503. DOI:10.3390/pathogens10050503 |
| [23] |
Harrus S, Bar-Gal GK, Golan A, et al. Isolation and genetic characterization of a Bartonella strain closely related to Bartonella tribocorum and Bartonella elizabethae in Israeli commensal rats[J]. Am J Trop Med Hyg, 2009, 81(1): 55-58. DOI:10.4269/ajtmh.2009.81.55 |
| [24] |
栗冬梅, 俞东征, 刘起勇, 等. 用分子生物学技术诊断巴尔通体感染[J]. 中华流行病学杂志, 2004, 25(7): 602-606. Li DM, Yu DZ, Liu QY, et al. Study on Bartonella infection using molecular biological diagnostic techniques from China[J]. Chin J Epidemiol, 2004, 25(7): 602-606. DOI:10.3760/j.issn:0254-6450.2004.07.015 |
| [25] |
叶曦, 姚美琳, 李国伟. 巴尔通体实验检测技术简介[J]. 中国人兽共患病学报, 2007, 23(11): 1160-1162. Ye X, Yao ML, Li GW. Introduction to experimental detection technology of Bartonella[J]. Chin J Zoonoses, 2007, 23(11): 1160-1162. DOI:10.3969/j.issn.1002-2694.2007.11.025 |
| [26] |
Zeaiter Z, Liang Z, Raoult D. Genetic classification and differentiation of Bartonella species based on comparison of partial ftsZ gene sequences[J]. J Clin Microbiol, 2002, 40(10): 3641-3647. DOI:10.1128/JCM.40.10.3641-3647.2002 |
| [27] |
陈宇飞, 靳木子, 白潇. 内蒙古西部口岸地区鼠类及其携带病原体调查[J]. 中国国境卫生检疫杂志, 2023, 46(6): 536-538. Chen YF, Jin MZ, Bai X. Investigation on rodents and their pathogens in western port area of Inner Mongolia[J]. Chin J Front Health Quar, 2023, 46(6): 536-538. DOI:10.16408/j.1004-9770.2023.06.007 |
| [28] |
方瑶琦. 呼伦贝尔边境地区啮齿动物携带巴尔通体的分子流行病学研究[D]. 沈阳: 沈阳农业大学, 2023. DOI: 10.27327/d.cnki.gshnu.2023.000911. Fang YQ. Molecular epidemiological study of Bartonella carried by rodents in Hulun Buir border region[D]. Shenyang: Shenyang Agricultural University, 2023. DOI: 10.27327/d.cnki.gshnu.2023.000911.(in Chinese) |
| [29] |
Ying B, Kosoy MY, Maupin GO, et al. Genetic and ecologic characteristics of Bartonella communities in rodents in southern China[J]. Am J Trop Med Hyg, 2002, 66(5): 622-627. DOI:10.4269/ajtmh.2002.66.622 |
| [30] |
Yu J, Zhang XY, Chen YX, et al. Molecular detection and genetic characterization of small rodents associated Bartonella species in Zhongtiao Mountain, China[J]. PLoS One, 2022, 17(2): e0264591. DOI:10.1371/journal.pone.0264591 |
 2024, Vol. 35
2024, Vol. 35



