扩展功能
文章信息
- 龚君淘, 梁自勉, 韦迎阳, 游建文, 江文锋, 奚志勇
- GONG Jun-tao, LIANG Zi-mian, WEI Ying-yang, YOU Jian-wen, JIANG Wen-feng, XI Zhi-yong
- 沃尔巴克氏体不育蚊在登革热高风险社区的现场应用
- Field application of Wolbachia-infected incompatible mosquitoes in communities at high risk for dengue fever
- 中国媒介生物学及控制杂志, 2024, 35(3): 287-292
- Chin J Vector Biol & Control, 2024, 35(3): 287-292
- 10.11853/j.issn.1003.8280.2024.03.005
-
文章历史
- 收稿日期: 2023-10-31
2 广州威佰昆生物科技有限公司, 广东 广州 510535;
3 佛山市疾病预防控制中心, 广东 佛山 528010;
4 广州市江氏杀虫有限公司, 广东 广州 510880;
5 美国密歇根州立大学微生物和分子遗传学系, 美国 密歇根 东兰辛 48824
2 Guangzhou Wolbaki Biotech Co., Ltd., Guangzhou, Guangdong 510535, China;
3 Foshan Center for Disease Control and Prevention, Foshan, Guangdong 528010, China;
4 Guangzhou Jiang's Insecticide Co., Ltd., Guangzhou, Guangdong 510880, China;
5 Department of Microbiology and Molecular Genetics, Michigan State University, East Lansing, MI 48824, USA
白纹伊蚊(Aedes albopictus)是一种常见的世界性重大卫生害虫,目前广泛分布于除南极洲以外各大洲的70多个国家,并呈快速扩散趋势[1]。白纹伊蚊不仅通过叮咬取食人血的方式滋扰人类的正常生活,同时还作为媒介传播诸如登革热、寨卡病毒病、黄热病等人类疾病,严重威胁着全球热带和亚热带地区居民的身体健康和生命安全。近年来,在我国的两广、台湾地区以及云南、福建省等地的登革热暴发流行均与媒介伊蚊的种群变化密切相关,其中白纹伊蚊为大陆地区的媒介伊蚊优势种群[2]。迄今为止,以杀虫剂为主的化学防治策略依然广泛应用于蚊媒疾病的应急处置工作中。尽管有一定的效果,化学防治手段的大面积使用仍然需要付出较大的社会成本,且不具备可持续性,其附带的药物残留和靶标昆虫抗性问题也在新世纪以来引起广泛的担忧[3]。因此,新型有效的蚊媒疾病控制手段亟待开发。近年来,通过释放人工转染一种昆虫胞内共生细菌沃尔巴克氏体(Wolbachia)的伊蚊达到降低野生种群密度或对野生种群改造使其无法携带和传播蚊媒病毒的技术,已经逐渐发展为被国际社会不断在真实世界证实的新型防治策略[4]。
基于沃尔巴克氏体在宿主体内诱导的胞质不相容(cytoplasmic incompatibility,CI)表型以及对多种人类病原体的抗性,可以建立种群压制和种群替换2种虫媒病控制模式[5]。释放人工转染沃尔巴克氏体的伊蚊近年来在多国蚊媒疾病控制现场中不断取得成功[6-11]。截至2022年,全球有23个国家成功开展了基于沃尔巴克氏体的伊蚊控制项目,其中8国采取种群压制模式、15国采取种群替换模式[12]。中国也在2019年报道了通过释放人工饲养的沃尔巴克氏体转染不育白纹伊蚊雄蚊,几乎完全清除了位于广州一座小岛上的野生种群,取得了基于沃尔巴克氏体的种群压制研究领域内的重大进展[13]。然而,在该技术的后续产业化和推广过程中,仍然需要针对沃尔巴克氏体不育蚊在高防控压力、背景复杂的城市防控目标区域内释放的有效性和稳定性进行更进一步的考察评估。与之前现场试验中选择的人口稀疏、地理隔绝且环境单调的小岛不同,本研究通过在地处闹市区的高人口和蚊媒密度、环境复杂的登革热潜在高风险社区持续释放感染沃尔巴克氏体的PAB白纹伊蚊雄蚊(P、A和B 3个字母分别取自wPip、wAlbA和wAlbB 3个沃尔巴克氏体菌株名中具有代表性的大写字母),并对比释放区与对照区白纹伊蚊种群密度变化动态,测试PAB白纹伊蚊作为新型生物农药对野生白纹伊蚊种群的防治效果,为沃尔巴克氏体技术在我国防治蚊媒传染病中的应用积累宝贵的实践经验。
1 材料与方法 1.1 试验用虫试验用虫是由广州威佰昆生物科技有限公司产业化生产的携带沃尔巴克氏体的PAB白纹伊蚊雄蚊,该雄蚊除了其天然携带的wAlbA及wAlbB 2个沃尔巴克氏体菌株,还通过人工转染的方式感染了来自骚扰库蚊(Culex pipiens molestus)的wPip沃尔巴克氏体菌株。饲养条件:温度(27±1) ℃,相对湿度(80±10)%,光周期(L∶D)=12 h∶12 h。
1.2 试验设备与材料成蚊诱捕器(BG-Trap)(Biogents AG,Regensburg,Germany)、诱蚊诱卵器(上海多捷环保科技有限公司)、生化培养箱(上海一恒科学仪器有限公司)、计数器(The Denominator Company,Inc.)、荧光定量PCR仪(广州威佰昆生物科技有限公司)、沃尔巴克氏体荧光定量检测试剂盒(广州达安基因股份有限公司)。
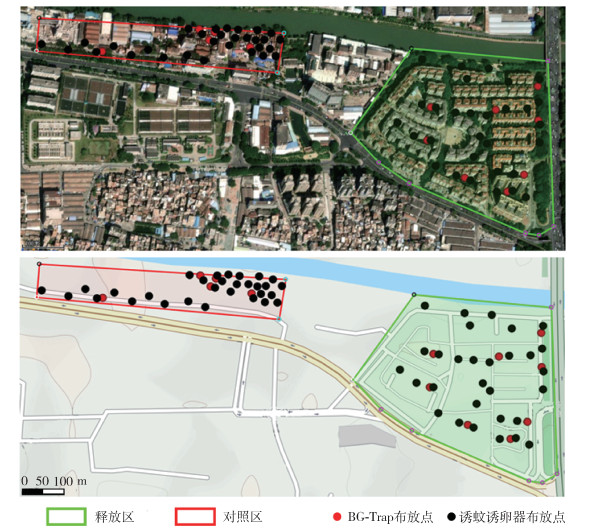
1.3 蚊虫释放与监测方法 1.3.1 释放区与对照区本研究中,PAB白纹伊蚊雄蚊释放区域位于广东省佛山市禅城区金沙新城社区。经2021年勘察,该社区为20多年老社区,全区域住宅均为经济适用房,社区占地面积约160 000 m2,平均楼高约为7层,社区共居住有3 000多户约10 000多人,人口密度约0.062 5/m2。社区内绿植茂密,草丛深处可见丢弃的塑料瓶、盖、杯子等易积水容器,在降雨后可形成蚊媒孳生地。社区周边环境有道路、河流和绿化带等,居民于阳台、天台、门外走廊等区域自种瓜果蔬菜及花卉等绿植。社区内部交通繁忙,人流量较大。受当时新型冠状病毒感染疫情防控和作业能力限制,对照区域选定为附近(直线距离300 m)一旧船厂生活区,占地面积为55 000 m2,共149户250人左右,人口密度约0.004 5人/m2,仅为释放区的7.27%(图 1)。2021年5月20日-6月25日,连续3次随机用诱蚊诱卵器法对释放区和对照区进行调查,发现对照区与释放区的诱蚊诱卵指数(mosq-ovitrap index,MOI)均处于较高水平,差异无统计学意义(Z=-0.218,P=1.000)(表 1)。因此,实验中的对照区与释放区均属于高蚊媒密度社区,当有病例输入时,存在较高的登革热社区传播风险。
|
| 图 1 PAB白纹伊蚊雄蚊释放区与对照区卫星图及监测位置基本信息(广东省佛山市禅城区) Figure 1 Satellite images of release and control sites and information on surveillance points (Chancheng District, Foshan, Guangdong Province, China) |
| |
|
试验过程中,释放区每周根据环境变化或实际现场操作需求分别布放6~8个BG-Trap和30(6月28日-7月26日)或33(7月27日-11月8日)个诱蚊诱卵器,对照区布放3~5个BG-Trap和20(6月28日-9月20日)或40(9月21日-11月8日)个诱蚊诱卵器(图 1)。实验全程(2021年6月28日-11月8日)开展监测,其中,7月15日-11月8日,以2次/周的频率进行PAB雄蚊的释放作业,释放和监测方式参考文献[13]。诱蚊诱卵器与BG-Trap的监测频率均为每周1轮(次)。诱蚊诱卵器监测时长为7 d,即通过每周回收后更新诱蚊诱卵器的方式完成监测工作。BG-Trap则以每周布放,24 h后回收的方式完成监测工作。由于本研究中监测目的不包含对雌蚊的特异性吸引,BG-Trap在监测全程未使用BG-Lure诱饵、二氧化碳气瓶、二氧化碳发生器,或其他监测所用引诱剂。监测期间,除台风、洪水等不可抗因素外,保持诱蚊诱卵器及BG-Trap的位置和操作顺序不发生改变。诱蚊诱卵器回收后,集中放入生化培养箱中持续观察,待其中不再有新幼蚊孵出后统计孵化率和幼蚊孵化数。
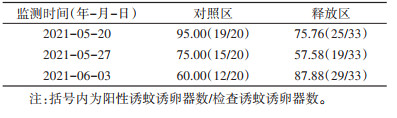
1.3.3 白纹伊蚊密度调查与动态评估PAB雄蚊相较于野生雄蚊的比例可由释放区雄、雌蚊数和对照区雄、雌蚊比推算得出,即释放比(R)。释放比计算方法:
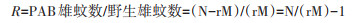
|
式中,N为释放区雄蚊数量,M为释放区雌蚊数量,r为对照区雄、雌比,N、M可直接由释放区BG-Trap得到,r则由对照区BG-Trap得到的雄、雌蚊数量相除计算得到。
考虑到布雷图指数(Breteau index,BI)和MOI[14]在数据获取上只能宏观反映调查区域内的蚊媒密度情况,缺乏更为细节的信息反馈,本研究相较于国内以往的只关注孳生地和诱蚊诱卵器阳性率的调查方法,在释放过程中采用的调查精度放大到了更为具体的本地雌蚊和幼蚊密度上,进一步提高了数据的分辨率。本研究参考《病媒生物密度监测方法蚊虫》(GB/T 23797-2020)[15],采用24 h BG-Trap法作为现场蚊媒密度监测方法,连续对全释放过程监测数据进行统计与评估:
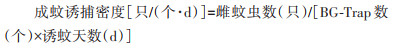
|
其他数据指标包括:(1)平均幼虫孵化数,即每周监测的诱蚊诱卵器中孵化的平均幼虫数。(2)雌蚊相对密度下降率(Rdf)与幼虫相对密度下降率(Rdl),根据《卫生杀虫剂现场药效测定及评价(总则)》(GB/T 27784-2011)[16]中的国家标准用以计算评估,相对密度下降率(Rd)计算公式如下:
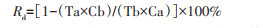
|
式中,Ta为控制区处理后平均密度值,Tb为控制区处理前平均密度值,Ca为对照区处理后平均密度值,Cb为对照区处理前平均密度值。
此外,释放区每周释放量与整个试验过程中释放区和对照区的雄雌比均在每周记录,用于评估释放工作效率以及进行相应的工作调整。
1.4 统计学分析采用Excel 2016软件汇总数据,采用GraphPad Prism Software 6.00软件进行统计分析。为了在全过程的释放和对照区之间比较上述监测值,首先计算出每周所有样本的平均值,然后使用Mann-Whitney U检验分别比较前期监测所得MOI以及PAB白纹伊蚊雄蚊释放后释放区和对照区间各项指标的每周平均值差异,P < 0.05为差异有统计学意义。
2 结果 2.1 释放量与释放比实验期间在金沙新城社区释放PAB白纹伊蚊雄蚊共持续17周(国庆假期除外,共16次),共计释放973.73万只,平均每周释放量为57.28万只。释放量呈显著的前多后少趋势,开始释放后的第7周释放最多,为120.11万只,实验期最后5周释放最少,平均为36.65万只,约为第7周的30.51%。实验开始后,释放区雄蚊总量受到释放的PAB雄蚊影响大大增加,在释放全过程中,PAB雄蚊对野生雄蚊的释放比均 > 1。其中,在开始释放后的前9次有效统计数据释放比均值为7.63,仅有2次 < 5.00,分别为第8周的1.57和第15周的3.69。而在第17、18周未增加释放量的情况下,释放比跃迁至150以上。见图 2。
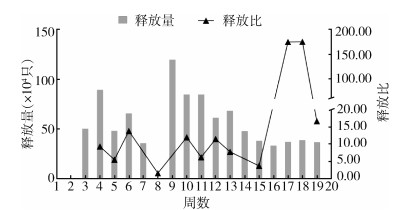
|
| 图 2 PAB白纹伊蚊雄蚊释放基本信息 Figure 2 Basic information on the release of PAB Aedes albopictus males |
| |
自释放PAB白纹伊蚊雄蚊后的第3周开始比较对照区与释放区BG-Trap回收得到的成蚊诱捕密度,并依照前期监测数据计算Rdf。12次有效的监测结果显示,释放开始后释放区内的成蚊诱捕密度显著低于对照区(Z=-4.161,P < 0.001),平均Rdf为71.62%,最高可达93.67%。其中,释放区的成蚊(雌蚊)诱捕密度平均值为1.60只/(个·d),远低于对照区的5.53只/(个·d)(图 3A)。自释放PAB白纹伊蚊雄蚊后的第4周开始比较对照区与释放区诱蚊诱卵器回收得到的平均幼蚊孵化数,并同样依照前期检测数据计算Rdl。12次有效监测结果显示,释放开始后释放区内的平均幼蚊孵化数显著低于对照区(Z=-2.309,P=0.020),平均Rdl为77.15%,最高可达89.45%。其中,释放区平均幼蚊孵化数均值为13.44只,远低于对照区的29.04只(图 3B)。
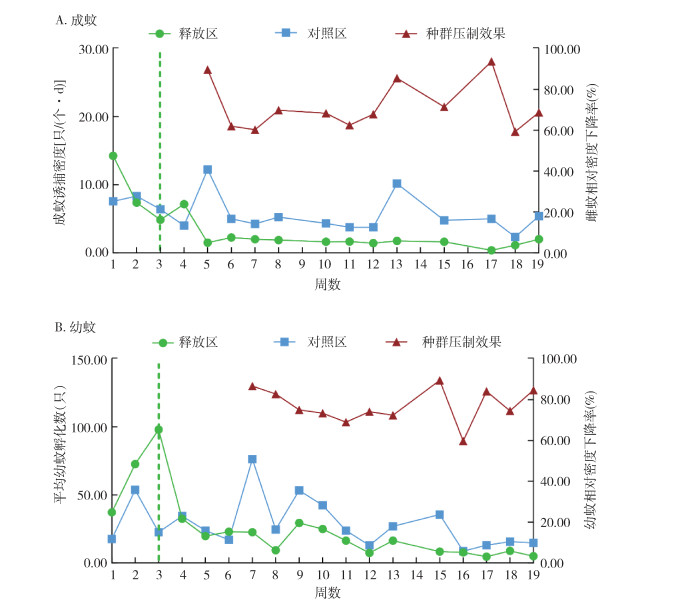
|
| 注:虚线代表PAB雄蚊释放起始时间点。 图 3 白纹伊蚊PAB雄蚊在目标控制区域内对野外种群的压制效果 Figure 3 Suppression effects of released PAB Aedes albopictus males on wild populations in the target area |
| |
基于沃尔巴克氏体的种群压制策略[17],通过持续释放大量携带沃尔巴克氏体的不育白纹伊蚊雄蚊与野生雌蚊交配,所产的卵不能孵化,从而将野生种群数量压低甚至区域性根除,达到“以蚊治蚊”的效果。在国内外,该技术已经陆续成功用于以埃及伊蚊(Ae. aegypti)和白纹伊蚊为媒介的热带蚊媒疾病的防控[12, 18],并被世界卫生组织向全球登革热流行区推荐开展更多的现场测试[19]。而沃尔巴克氏体技术作为一种新型的蚊媒病防控手段,在高人口密度且具有高蚊媒密度的登革热潜在高风险社区的应用报道极少。
本研究对PAB白纹伊蚊雄蚊在目标释放区金沙新城的防治效果进行研究。现场实验结果表明,在开始释放后的17周内,释放区成蚊诱捕密度与平均幼蚊孵化数相较于对照区均有显著下降,雌蚊和幼蚊相对密度下降率均值分别 > 70.00%和75.00%,并均有多次超过国家标准的效果显著标准(80%)[16]。比较释放区释放比和压制效果动态变化趋势发现,释放区的释放比与野生种群的压制效果具有相关性,均呈现先升高再降低而后逐渐趋于平缓,后再显著升高的总体趋势,说明释放比在一定程度上也反映了释放区的压制效果,且PAB雄蚊的释放在雌蚊和幼蚊上体现的压制效果趋势基本一致。而在每周释放PAB雄蚊总量变化不大的前提下,释放后期释放比的大幅上升也说明了野生伊蚊种群数量已经被压制到极低的水平。尽管并没有完全根除释放区的雌蚊,释放区域内长期保持只能监测到1~2只雌蚊的情况下,已经足以保证大幅降低居民被叮咬的风险,同时也大大降低了登革热的社区传播风险。此外,尽管释放区的平均幼蚊孵化数(29.04只)相较于对照区平均值(13.44只)仅下降了50%略多,但考虑到释放前至开始释放当周,释放区的平均幼蚊孵化数相较于对照区呈高速增长的趋势,防控难度较大,且在释放过程中相较于对照区几乎无大幅反弹,PAB雄蚊对释放区幼虫的压制依然取得了比较理想的效果。
不同于实验室研究,本研究主要在人口密集且无有效隔离的社区中进行,因此,现场工作开展时存在很多不确定性和突发影响因素,很难实现选择的对照区与释放区条件完全一致。尽管如此,PAB蚊释放前连续3次调查所得MOI显示2个区域白纹伊蚊发生情况差异无统计学意义。此外,在数据统计时,相对密度下降率的采用也尽可能规避了2个区域基本情况差异带来的影响。在研究时长上,本研究虽然覆盖了该地区近整个蚊媒发生季节,但对PAB雄蚊在这类现场连续多年尺度上的应用效果仍然缺乏足够的参考价值,还需进一步研究。
另一方面,虽然通过释放PAB雄蚊大幅降低了释放区内登革热传播的风险,但是距离真正意义上的“无蚊区”的建立仍然有一定的差距。提升释放雄蚊总量虽然可以进一步达到理想的压制效果,但会导致边际递减效应,不利于该技术的现场应用推广。既往研究表明,在江苏省相近楼层高度的小区中,白纹伊蚊分布与楼层、有无露天场所密切相关,其中一层白纹伊蚊密度远高于其他楼层[20]。然而,金沙新城作为华南地区典型的老社区,不仅一层露天场所的植被覆盖密度高,中高层居民家庭甚至顶层阳台均存在高密度且分散的绿植和隐藏孳生地。受限于实际现场可操作性和监测能力,本次现场测试所选择的对照区多为平房或二层楼房,且人口密度不足释放区的10%,社区总体情况相较于释放区较为简单。实际操作过程中,PAB雄蚊的释放基本在一层的露天场所进行,而白纹伊蚊的飞行扩散高度有限,对于高楼层和顶层孳生地的覆盖仍有不足,在实际释放过程中可能无法充分发挥其防效。因此,在未来应用沃尔巴克氏体技术防治类似区域的野生种群时,通过无人机等辅助释放手段助力不育雄蚊扩散,建立均匀、立体的防控网络,可能对于该技术的高效成熟应用至关重要。
综上所述,PAB白纹伊蚊雄蚊作为一种新型、绿色和靶标专一的蚊媒控制产品,在具有高蚊媒防控压力的复杂社区依然能稳定发挥较强的种群压制效果,为我国日益增长的蚊媒传染病风险控制提供了新思路。沃尔巴克氏体感染不育雄蚊的应用,不仅可以作为除化学防治手段以外的重要补充,也符合有害生物综合治理(integrated pest management,IPM)的可持续发展方针。
利益冲突 无
| [1] |
杨舒然, 刘起勇. 白纹伊蚊的全球分布及扩散趋势[J]. 中国媒介生物学及控制杂志, 2013, 24(1): 1-4. Yang SR, Liu QY. Trend in global distribution and spread of Aedes albopictus[J]. Chin J Vector Biol Control, 2013, 24(1): 1-4. |
| [2] |
孟凤霞, 王义冠, 冯磊, 等. 我国登革热疫情防控与媒介伊蚊的综合治理[J]. 中国媒介生物学及控制杂志, 2015, 26(1): 4-10. Meng FX, Wang YG, Feng L, et al. Review on dengue prevention and control and integrated mosquito management in China[J]. Chin J Vector Biol Control, 2015, 26(1): 4-10. DOI:10.11853/j.issn.1003.4692.2015.01.002 |
| [3] |
Iturbe-Ormaetxe I, Walker T, O'Neill SL. Wolbachia and the biological control of mosquito-borne disease[J]. EMBO Rep, 2011, 12(6): 508-518. DOI:10.1038/embor.2011.84 |
| [4] |
Niang EHA, Bassene H, Fenollar F, et al. Biological control of mosquito-borne diseases: The potential of Wolbachia-based interventions in an IVM framework[J]. J Trop Med, 2018, 2018: 1470459. DOI:10.1155/2018/1470459 |
| [5] |
潘晓玲, 刘起勇, 奚志勇. 基于昆虫共生菌沃尔巴克氏体的蚊媒和蚊媒病控制研究进展[J]. 中国媒介生物学及控制杂志, 2014, 25(1): 1-7. Pan XL, Liu QY, Xi ZY. Advance in developing Wolbachia as a mean to control mosquito and mosquito-borne diseases[J]. Chin J Vector Biol Control, 2014, 25(1): 1-7. DOI:10.11853/j.issn.1003.4692.2014.01.001 |
| [6] |
Nazni WA, Hoffmann AA, Noorafizah A, et al. Establishment of Wolbachia strain wAlbB in Malaysian populations of Aedes aegypti for dengue control[J]. Curr Biol, 2019, 29(24): 4241-4248.e5. DOI:10.1016/j.cub.2019.11.007 |
| [7] |
Utarini A, Indriani C, Ahmad RA, et al. Efficacy of Wolbachia-infected mosquito deployments for the control of dengue[J]. N Engl J Med, 2021, 384(23): 2177-2186. DOI:10.1056/NEJMoa2030243 |
| [8] |
Beebe NW, Pagendam D, Trewin BJ, et al. Releasing incompatible males drives strong suppression across populations of wild and Wolbachia-carrying Aedes aegypti in Australia[J]. Proc Natl Acad Sci USA, 2021, 118(41): e2106828118. DOI:10.1073/pnas.2106828118 |
| [9] |
Crawford JE, Clarke DW, Criswell V, et al. Efficient production of male Wolbachia-infected Aedes aegypti mosquitoes enables large-scale suppression of wild populations[J]. Nat Biotechnol, 2020, 38(4): 482-492. DOI:10.1038/s41587-020-0471-x |
| [10] |
Che-Mendoza A, Martin-Park A, Chávez-Trava JM, et al. Abundance and seasonality of Aedes aegypti (Diptera: Culicidae) in two suburban localities of South Mexico, with implications for Wolbachia (Rickettsiales: Rickettsiaceae)-carrying male releases for population suppression[J]. J Med Entomol, 2021, 58(4): 1817-1825. DOI:10.1093/jme/tjab052 |
| [11] |
Lim JT, Bansal S, Chong CS, et al. Efficacy of Wolbachia-mediated sterility to reduce the incidence of dengue: A synthetic control study in Singapore[J]. Lancet Microbe, 2024, 5(5): e422-e432. DOI:10.1016/S2666-5247(23)00397-X |
| [12] |
龚君淘, 刘起勇, 王以燕, 等. 沃尔巴克氏体控制媒介伊蚊的应用及前景[J]. 农药科学与管理, 2022, 43(10): 20-29. Gong JT, Liu QY, Wang YY, et al. Application and prospect of Wolbachia for Aedes for mosquito vector control[J]. Pestic Sci Admin, 2022, 43(10): 20-29. DOI:10.3969/j.issn.1002-5480.2022.10.005 |
| [13] |
Zheng XY, Zhang DJ, Li YJ, et al. Incompatible and sterile insect techniques combined eliminate mosquitoes[J]. Nature, 2019, 572(7767): 56-61. DOI:10.1038/s41586-019-1407-9 |
| [14] |
杨迎宇, 王莹莹, 陈芸, 等. 上海市宝山区登革热媒介伊蚊密度指数与气象因素滞后效应分析[J]. 中国媒介生物学及控制杂志, 2021, 32(3): 286-290. Yang YY, Wang YY, Chen Y, et al. An analysis of lag effects of meteorological factors on Aedes density indices in Baoshan District, Shanghai, China[J]. Chin J Vector Biol Control, 2021, 32(3): 286-290. DOI:10.11853/j.issn.1003.8280.2021.03.006 |
| [15] |
国家市场监督管理总局, 国家标准化管理委员会. GB/T 23797-2020病媒生物密度监测方法蚊虫[S]. 北京: 中国标准出版社, 2020. State Administration for Market Regulation, Standardization Administration. GB/T 23797-2020 Surveillance methods for vector density-Mosquito[S]. Beijing: China Standard Press, 2020. (in Chinese) |
| [16] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 27784-2011卫生杀虫剂现场药效测定及评价总则[S]. 北京: 中国标准出版社, 2012. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. GB/T 27784-2011 Field efficacy test methods and criterions of public health insecticides-General principles[S]. Beijing: China Standard Press, 2012. (in Chinese) |
| [17] |
杨翠, 奚志勇, 胡志勇. 应用沃尔巴克氏体通过种群压制阻断蚊媒病传播的研究进展[J]. 中国媒介生物学及控制杂志, 2020, 31(1): 113-116. Yang C, Xi ZY, Hu ZY. Blocking transmission of mosquito-borne diseases through population suppression using Wolbachia[J]. Chin J Vector Biol Control, 2020, 31(1): 113-116. DOI:10.11853/j.issn.1003.8280.2020.01.024 |
| [18] |
Caragata EP, Dutra HLC, Sucupira PHF, et al. Wolbachia as translational science: Controlling mosquito-borne pathogens[J]. Trends Parasitol, 2021, 37(12): 1050-1067. DOI:10.1016/j.pt.2021.06.007 |
| [19] |
World Health Organization. Call for public consultation-development of Target Product Profiles (TPPs) for Wolbachia infected Aedes aegypti population replacement intervention[EB/OL]. (2022-08-31)[2023-10-31]. https://www.who.int/news-room/articles-detail/call-for-public-consultation-development-target-product-profiles-wolbachia-infected-aedes-aegypti-population-replacement-intervention.
|
| [20] |
张育富, 张守刚, 朱丁, 等. 江苏省多层住宅居民区不同楼层白纹伊蚊分布调查[J]. 中国媒介生物学及控制杂志, 2021, 32(6): 700-704. Zhang YF, Zhang SG, Zhu D, et al. Distribution of Aedes albopictus in different floors of multi-story residential buildings in Jiangsu Province, China[J]. Chin J Vector Biol Control, 2021, 32(6): 700-704. DOI:10.11853/j.issn.1003.8280.2021.06.009 |
 2024, Vol. 35
2024, Vol. 35


