萱藻(Scytosiphon lomentaria)隶属于褐藻门(Phaeophyta),系泛温性海藻,北至加拿大丘吉尔港,南至南极洲南设得兰群岛之间的沿海海域均有分布[1-2],在中国主要分布于辽东半岛至广东省海陵岛之间的沿海海域[3-4]。萱藻是一种具有极高营养价值、药用价值及生态价值的经济海藻[5-7],开发潜力巨大,但受到过度采集的影响,萱藻的自然资源日渐枯竭。目前,萱藻的人工育苗技术已获得突破,但现有的丝状体扩增主要采用三角烧瓶、广口烧瓶和PP塑料瓶作为扩增容器,丝状体生长速度慢,培养体系光能利用率低,扩增后期培养液pH过高,不但无法快速获得足量的丝状体,而且影响丝状体质量,进而严重制约了萱藻工厂化育苗的规模,阻碍了萱藻养殖产业的发展。因此,研究利用光生物反应器快速扩增萱藻丝状体不但能提高扩增效率,进一步扩大萱藻养殖规模,产生可观的经济效益,而且对恢复野生萱藻资源具有积极意义。
光生物反应器的研究始于1940年代[8],先后有开放池式、搅拌罐式、鼓泡式、管式、气升式、平板式等形态各异的光生物反应器被设计研发[9]。其中,气升式光生物反应器因其具有结构简单,造价低廉,操作方便,扩增高效等优点被人们广泛应用于微藻及大型海藻微观藻体的培养。张芬芬等[10]曾报道利用自行设计的气升式光生物反应器扩增小球藻(Chlorella vulagris)可将收获的藻体干重提高157%,而张栩等[11]发现气升式光生物反应器可促进裙带菜(Undaria pinnatifida)配子体的生长,日均增长率较常规培养提高了50%。
为进一步提高气升式光生物反应器的扩增效率,吴垠等[12]针对性地提出向培养液中补充CO2可解决藻类快速扩增时出现的无机碳浓度不足的问题,实现藻类的高密度培养,而Tang等[13]亦曾报道补充CO2能显著促进斜生栅藻(Scenedesmus obliquus)的生长与多不饱和脂肪酸的合成。然而,补充CO2虽能实现藻类的快速扩增但过量的CO2会引起培养液pH的下降,进而对藻类生长产生不利影响。杨雨玲等[14]曾报道了高浓度CO2会引起坛紫菜(Pyropia haitanensis)丝状体蛋白质及色素含量的降低并造成净光合速率的下降。
目前,适于快速扩增萱藻丝状体的光生物反应器尚未见报道。因此,为探索利用气升式光生物反应器快速扩增萱藻丝状体,了解适于扩增萱藻丝状体的CO2补充量以及过量的CO2是否会对萱藻丝状体的生长及生理产生影响,本实验构建了充空气、连续充CO2与间歇充CO2三种充气条件,探讨补充CO2对气升式光生物反应器中萱藻丝状体生长及生理的影响,并对三种充气条件下扩增获得的萱藻丝状体在孢子囊发育、孢子放散及孢子附着方面的差异做了进一步的比较研究。
1 材料与方法 1.1 材料与条件本实验所用萱藻丝状体取自中国海洋大学海藻繁殖生物学研究室种质库。首先将萱藻丝状体置于光照培养箱中进行充气培养,培养条件为温度(21.0±0.5) ℃,光强40.0~54.0 μmol/m2·s,光周期14:10 L/D,培养液为F1培养液[15]。培养20 d后收集萱藻丝状体,利用组织匀浆机打碎,恢复培养24 h后进行实验。
1.2 气升式光生物反应器的结构特点及装置图气升式光生物反应器由主体、导流筒、空气过滤装置、pH探针、充气装置等部分组成(见图 1)。反应器主体高30.0 cm,内径12.0 cm,导流筒高13.0 cm,内径8.0 cm,工作体积为2.0 L。培养过程中整套装置置于GXZ-300B型光照培养箱以控制光照强度、温度和光周期。

|
(1.计算机;2.监测及控制系统;3. pH探针;4.排气孔;5.接种/取样孔;6.导流筒;7.主体;8.放水阀;9.气体分布器;10.空气过滤器;11. CO2流量计;12. CO2气瓶;13.空气流量计;14.充气泵。1.Computer; 2. Monitoring and control system; 3.pH probe; 4. Air exhaust port; 5. Inoculation and sampling port; 6. Airlift column; 7. Photobioreactor; 8. Drain valve; 9. Gas sparger; 10. Air filter; 11. CO2 flowmeter; 12. CO2 cylinder; 13. Air flowmeter; 14. Air pump.) 图 1 气升式光生物反应器照片及结构简图 Fig. 1 Photo and structural diagram of airlift photobioreactor |
将恢复培养24 h后的萱藻丝状体接种到气升式光生物反应器中,接种密度为0.5 g/L,扩增条件为温度(21.0±0.5) ℃,光生物反应器的表面光强为54.0~63.0 μmol/(m2·s),光周期14:10 L/D。设置三种充气条件:空气1.0 L/min、空气1.0 L/min+CO21.14 mL/min和空气1.0 L/min+间歇充CO2。间歇充CO2是由监测及控制系统控制,在培养液pH高于8.0时开始补充CO2,至培养液pH小于7.5时结束,CO2通入速率为1.14 mL/min。其中,经预实验检验的适宜萱藻丝状体生长的pH范围为7.5~8.0(预实验所设pH条件为7.0、7.5、8.0、8.5、9.0,实验结果显示培养18 d,pH在7.5和8.0的两个实验组中丝状体生物量显著高于其他各组,说明适宜萱藻丝状体生长的pH范围为7.5~8.0)。实验各组均设置三个平行样。实验过程中每3天收集30.0 mL藻液,筛绢过滤后用吸水纸吸干表面水分,称量萱藻丝状体湿重并更换培养液。
萱藻丝状体日均增长率的计算公式:
| $ K = \left[ {\left( {\ln {N_t} - \ln {N_0}} \right)/t} \right] \times 100\% 。$ |
式中: K代表萱藻丝状体日均增长率;N0代表萱藻丝状体起始生物量(g/L);Nt代表t天时萱藻丝状体的生物量(g/L);t代表实验天数(d)。
扩增培养结束后收集丝状体,用吸水纸吸干表面水分,称取1.0 g鲜重藻,采用氧电极法测定光合放氧和呼吸耗氧速率[16],每个充气条件设置3个平行样。剩余丝状体重新接种至气升式光生物反应器中进行孢子囊诱导,接种密度为0.5 g/L,诱导条件及所用培养液参照高伟[15],诱导过程中仍按上述三种方案充气,诱导时间为18 d。实验各组均设置三个平行样。诱导过程中每3 d更换培养液,诱导结束后统计孢子囊比例及直径。
孢子囊比例=孢子囊细胞数/丝状体细胞总数×100%。
诱导实验完成后将上述经过诱导的萱藻丝状体用筛绢过滤后阴干刺激2 h,随后分别置于20 mL灭菌海水中进行孢子放散,放散条件参照张文健[17]。放散2 h后收集孢子液进行观察,取3个平行样使用血球计数板计数孢子放散量。将收集的孢子液稀释至孢子密度为1.0×104 ind./mL备用。
将22 mm×22 mm盖玻片加入至直径90 mm的培养皿中,避免重叠,并向每个培养皿内加入上述备用孢子液20.0 mL,每种萱藻丝状体取3个平行样。附着开始后分别于第2、4、8、12、24、48 h进行观察,每次观察取一片盖玻片在400×显微镜下随机选取10个视野计数孢子附着量,并计算孢子附着率。
孢子附着率=附着孢子数/孢子总数×100%。
1.4 数据分析利用SPSS 23.0和Excel 2016软件进行单因素方差分析和制图,图片采集及孢子囊直径测量软件为ISCapture。对气升式光生物反应器中萱藻丝状体的生长发育拍摄显微照片(见图 2)。

|
(a.扩增18 d充空气组萱藻丝状体;b.扩增18 d连续补充CO2组萱藻丝状体;c.扩增18d间歇补充CO2组萱藻丝状体;d.诱导18 d充空气组成熟的孢子囊;e.诱导18 d连续补充CO2组成熟的孢子囊;f.诱导18 d间歇补充CO2组成熟的孢子囊。箭头指示成熟孢子囊。a. filaments of S. lomentaria in air-aerated group 18-day after amplification; b. filaments of S. lomentaria in continuously aerated with CO2 group 18-day after amplification; c. filaments of S. lomentaria in intermittently aerated with CO2 group 18-day after amplification; d. mature sporangia of filaments of S. lomentaria in air-aerated group 18-day after induction; e. mature sporangia of filaments of S. lomentaria in continuously aerated with CO2 group 18-day after induction; f. mature sporangia of filaments of S. lomentaria in intermittently aerated with CO2 group 18-day after induction. Arrows indicate mature sporangia.) 图 2 气升式光生物反应器中萱藻丝状体的生长发育显微照片 Fig. 2 Growth and development microphoto of filaments of S. lomentaria in airlift photobioreactor |
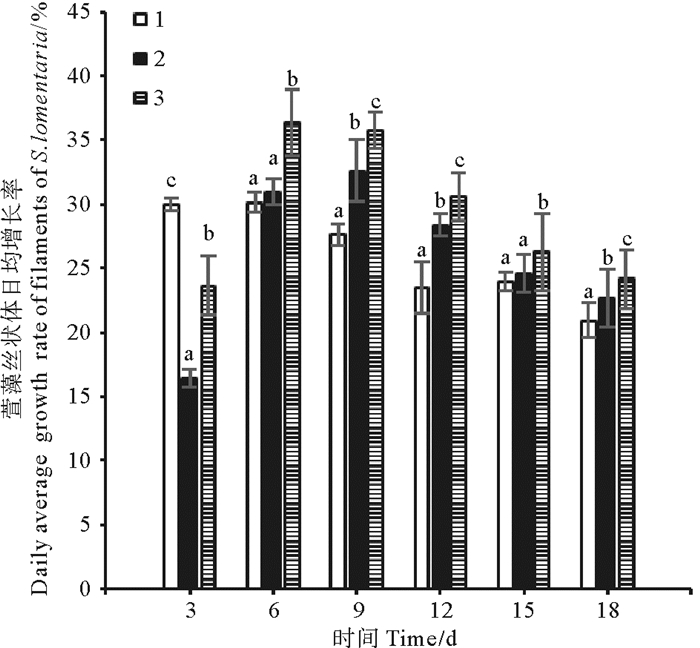
补充CO2对气升式光生物反应器中萱藻丝状体生长的影响如图 3所示。结果显示补充CO2能显著提高气升式光生物反应器中萱藻丝状体的日均增长率。实验第18 d,间歇充CO2组的萱藻丝状体日均增长率最高,为(24.15±2.34)%,显著高于连续充CO2组与充空气组(P < 0.05),同时连续充CO2组的日均增长率为(22.65±2.29)%,显著高于充空气组(P < 0.05)。观察发现各组萱藻丝状体细胞质充盈,呈褐色,丝状体长势良好(见图 2a~c)。
|
(1.充空气组;2.连续充CO2组;3.间歇充CO2组。1.Air-aerated group; 2. Continuously aerated with CO2 group; 3. Intermittently aerated with CO2 group.) 图 3 气升式光生物反应器中萱藻丝状体的日均增长率 Fig. 3 Average daily growth rate of filaments of S.lomentaria in airlift photobioreactor |
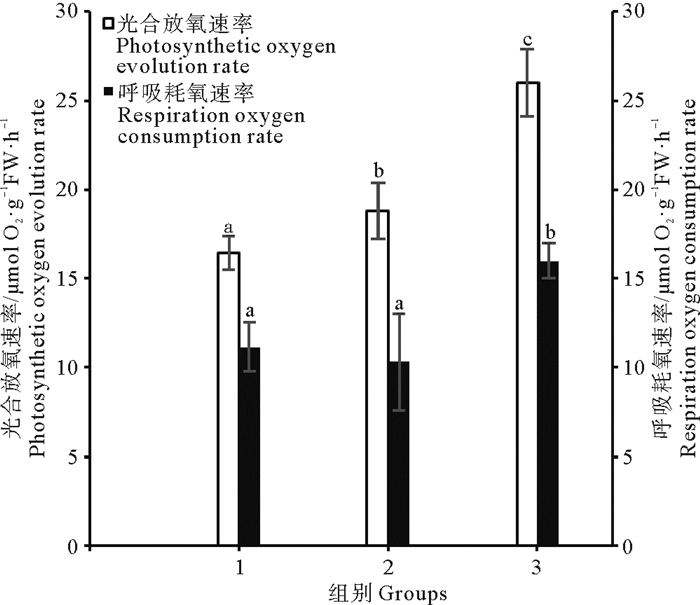
补充CO2对气升式光生物反应器中萱藻丝状体光合及呼吸作用的影响如图 4所示。间歇充CO2组的光合放氧速率及呼吸耗氧速率分别为(25.99±1.88)和(15.98±0.97) μmol O2·g-1 FW·h-1,均显著高于充空气组与连续充CO2组。此外,连续充CO2组的光合放氧速率为(18.80±1.56) μmol O2·g-1 FW·h-1,显著高于充空气组而呼吸耗氧速率仅为(10.31±2.71) μmol O2·g-1 FW· h-1,与充空气组无显著差异。
|
(1.充空气组; 2.连续充CO2组; 3.间歇充CO2组。1.Air-aerated group; 2. Continuously aerated with CO2 group; 3. Intermittently aerated with CO2 group.) 图 4 补充CO2对气升式光生物反应器中萱藻丝状体光合放氧及呼吸耗氧速率的影响 Fig. 4 Effects of supplementing CO2 on the rate of photosynthetic oxygen evolution and respiration oxygen consumption of filaments of S. lomentaria |
各实验组的丝状体均能形成发育良好的单室孢子囊且补充CO2有助于气升式光生物反应器中萱藻丝状体单室孢子囊的形成。表 1显示,各组的初始孢子囊比例差异不显著(p>0.05),诱导18 d,补充CO2条件下萱藻丝状体的单室孢子囊比例均显著高于充空气组(P < 0.05),且间歇充CO2组的孢子囊比例最高,为(51.03±0.78)%,说明在诱导孢子囊阶段,适量补充CO2能促进萱藻丝状体形成孢子囊(见图 2d~f)。
|
|
表 1 补充CO2对萱藻丝状体孢子囊形成与发育的影响 Table 1 Effects of supplementing CO2 on the formation and development of unilocular sporangia of filaments of S.lomentaria |
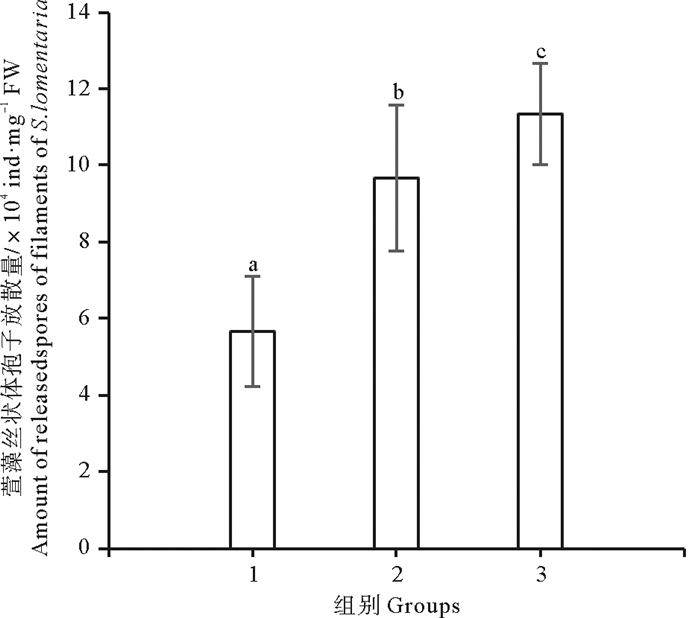
补充CO2对萱藻孢子放散的影响如图 5所示。放散2 h, 补充CO2条件下两个实验组的孢子放散量均显著高于充空气组(P < 0.05),且间歇充CO2组的孢子放散量最高,为(11.33±1.33)×104 ind/mg FW,显著高于连续充CO2组(P < 0.05)。
|
(1.充空气组; 2.连续充CO2组; 3.间歇充CO2组。1.Air-aerated group; 2. Continuously aerated with CO2 group; 3. Intermittently aerated with CO2 group.) 图 5 补充CO2对萱藻丝状体孢子放散的影响 Fig. 5 Effects of supplementing CO2 on the spore releasing of filaments of S. lomentaria |
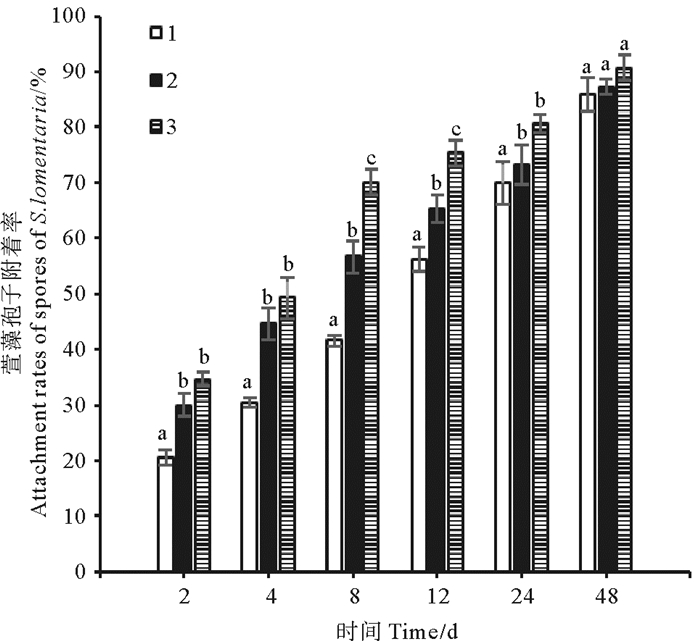
孢子附着结果如图 6所示。各实验组的孢子附着率之间无显著差异。孢子附着48 h后,各实验组的孢子附着状况良好,附着率均高于85%,其中间歇充CO2组的孢子附着率最高,为(90.67±2.40)%。
|
(1.充空气组;2.连续充CO2组;3.间歇充CO2组。1.Air-aerated group; 2. Continuously aerated with CO2 group; 3. Intermittently aerated with CO2 group.) 图 6 补充CO2对萱藻孢子附着的影响 Fig. 6 Effects of supplementing CO2 on the spore attachment of S. lomentaria |
向光生物反应器中通入CO2可以为藻类的光合作用提供充足的无机碳源[18],是促进藻类生长的有效手段。张丽莉等[18]曾报道补充CO2可提高小球藻在对数生长期的光合作用效率,提高生物量产量。徐军田等[19]亦曾报道补充CO2能显著促进龙须菜(Gracilaria lemaneiformis)的生长与藻红蛋白的合成。在本研究中,气升式光生物反应器能快速扩增萱藻丝状体且通入CO2可提高丝状体的光合放氧速率,进一步促进丝状体的生长。通入CO2条件下扩增18 d,间歇充CO2与连续充CO2两组的萱藻丝状体光合放氧速率较充空气组分别提高了57.91%和14.24%,生物量较充空气组分别提高了79.03%和36.74%。这说明在丝状体的高密度培养中,CO2浓度是光合作用的限制因子,补充CO2可促进丝状体对光能的利用及转化,提高光合作用效率,促进丝状体生长。
光合及呼吸作用是藻类生长必不可少的两个过程,其速率直接反映了藻体代谢水平的高低进而体现了生长状况。间歇充CO2组的萱藻丝状体光合放氧速率及呼吸耗氧速率均最高,说明在该条件下萱藻丝状体代谢旺盛,生长状况良好。但连续充CO2组的光合放氧速率及呼吸耗氧速率较间歇充CO2组均偏低,原因可能是过量的CO2被培养液吸收,造成培养液pH严重下降,阻碍了萱藻丝状体光合及呼吸作用的正常进行进而影响了丝状体的生长。测定实验周期中培养液pH的变化发现,连续充CO2组的pH最高仅为7.66而最低可至6.84,且除实验第8~11 d,其余天数pH最大值均低于7.5。与之相比,间歇充CO2组的pH最高可达8.0,且在实验后期需多次补充CO2才能满足丝状体光合作用的需要。因此,高浓度的CO2不仅造成了培养液pH的严重下降,而且抑制了丝状体光合作用的正常进行。Menéndez等[20]曾报道,过低的pH会影响藻类的光合作用,抑制光合作用的进行,Porzio亦曾报道[21]过低的pH会影响墨角藻的CO2浓缩机制,降低碳酸酐酶活性甚至造成组织的损伤。因此,在扩增萱藻丝状体时应控制CO2的通入量,使培养液的pH稳定在7.5~8.0这一适宜萱藻丝状体生长的范围。
大型海藻对pH下降的敏感性因种类而异。Israel等[22]曾报道当海水pH下降至7.5左右时,马尾藻(Sargassum vulgare)的生长速率下降了50%,最大光合速率也有所下降。于娟等[23]则报道了当pH由7.9下降至7.6时,孔石莼(Ulva pertusa)的相对增长率减少了30.28%。在本研究中,萱藻丝状体生长的最适pH范围为7.5~8.0,因此,与马尾藻和孔石莼相比,萱藻丝状体可能更适于在pH相对较低的条件下生长。
3.2 补充CO2对气升式光生物反应器中萱藻丝状体繁殖生物学特征的影响单室孢子囊的诱导以及游孢子的释放是萱藻人工育苗过程中的重要环节。因此,要评价一种光生物反应器是否适于扩增萱藻丝状体除了考虑其对萱藻丝状体的扩增效率外,还应考虑扩增获得的萱藻丝状体能否产生发育良好的单室孢子囊并释放具有活力的游孢子[24-25]。潘双叶[26]曾报道利用简易气升式光生物反应器扩增获得的坛紫菜自由丝状体可在人工诱导条件下正常发育为孢子囊枝,王兰刚亦报道[27]了利用气升式光生物反应器可在人工诱导条件下实现条斑紫菜(Porphyra yezoensis)的自由壳孢子囊枝育苗。因此,气升式光生物反应器可在不影响发育的基础上快速扩增紫菜的微观藻体。本实验结果表明,气升式光生物反应器扩增获得的萱藻丝状体可形成发育良好的单室孢子囊,并释放具有活力的游孢子,完成附着过程。此外,在孢子囊诱导阶段通入适量的CO2不但可以大幅提高萱藻丝状体的孢子囊比例与直径,还可提高萱藻孢子的放散量与附着率。在本研究中,间歇充CO2组的孢子囊比例及孢子放散量分别可达充空气组的2.29倍与2.00倍,孢子附着率较充空气组也有所提高,其原因可能是间歇充CO2组的丝状体光合作用速率高代谢活性强,从而促进了丝状体对培养液中磷的吸收[28],进而促进了孢子囊的发育[29]。同时,发育良好的单室孢子囊更容易集中放散游孢子,提高了孢子放散量。因此,在萱藻丝状体的孢子囊诱导阶段应适量补充CO2以提高丝状体的代谢水平,促进孢子囊的发育及游孢子的释放。
4 结语补充CO2可显著提高萱藻丝状体的生长速率及代谢活性,促进丝状体生殖结构的发育。间歇充CO2条件下萱藻丝状体的日均增长率、光合放氧及呼吸耗氧速率均最高,生长状况良好,代谢旺盛,且诱导后丝状体的孢子囊比例、游孢子的放散量及附着率高于其他条件。连续充CO2虽然同样可提高萱藻丝状体的日均增长率、光合放氧速率与诱导后丝状体的孢子囊比例、游孢子的放散量,但由于过量的CO2引起了培养液pH的严重下降,对上述指标的提高效果远不如间歇充CO2。因此,间歇充CO2是适于扩增萱藻丝状体的CO2补充方式。该结果为合理补充CO2以实现萱藻丝状体的高效扩增提供了数据支持。
| [1] |
Saunders G W, McDevit D C. DNA barcoding unmasks overlooked diversity improving knowledge on the composition and origins of the Churchill algal flora[J]. BMC Ecology, 2013, 13(9): 1-23.
(  0) 0) |
| [2] |
Pellizzari F, Silva M C, Silva E M, et al. Diversity and spatial distribution of seaweeds in the South Shetland Islands, Antarctica: An updated database for environmental monitoring under climate change scenarios[J]. Polar Biol, 2017(40): 1671-1685.
(  0) 0) |
| [3] |
Clayton M N. The morphology, anatomy and life history of a complanate form of Scytosiphon lomentaria (Scytosiphonales, Phaeophyta) from southern Australia[J]. Marine Biology, 1976, 38(3): 201-208.
(  0) 0) |
| [4] |
曾呈奎, 张德瑞, 张峻甫. 中国经济海藻志[M]. 北京: 科学出版社, 1962: 59-60. Zeng C K, Zhang D R, Zhang J F. Chinese Economic Seaweed[M]. Beijing: Science Press, 1962: 59-60. (  0) 0) |
| [5] |
张宇, 付晓婷, 林洪, 等. 萱藻营养品质的分析和评价[J]. 营养学报, 2011, 33(6): 619-620, 623. Zhang Y, Fu X T, Lin H, et al. Analysis and evaluation of nutritional quality of Scytosiphon lomentsrius[J]. Acta Nutrimenta Sinica, 2011, 33(6): 619-620, 623. (  0) 0) |
| [6] |
何洁, 崔铁军, 王家骧, 等. 4种药用海藻有效成份的分析与比较[J]. 中国海洋药物, 1996, 15(3): 23-27. He J, Cui T Y, Wang J X, et al. Analysis and comparison on the effective compositions of four kinds of medicinal seaweeds[J]. Chinese Journal of Marine Drugs, 1996, 15(3): 23-27. (  0) 0) |
| [7] |
Demirbaş A. Biomass resource facilities and biomass conversion processing for fuels and chemicals[J]. Energy Conversion and Management, 2001, 42(11): 1357-1378. DOI:10.1016/S0196-8904(00)00137-0
(  0) 0) |
| [8] |
Burlew J S. Algal culture from laboratory to pilot plant[J]. Algal Culture, 1953(1): 357.
(  0) 0) |
| [9] |
孙芹海, 王长海, 石磊. 2种光生物反应器在微藻培养中的性能比较[J]. 烟台大学学报(自然科学与工程版), 2010, 23(1): 32-37. Sun Q H, Wang C H, Shi L. Characteristic comparison of two photobioreactors in microalgal culture[J]. Journal of Yantai University(Natural Science and Engineering Edition), 2010, 23(1): 32-37. (  0) 0) |
| [10] |
张芬芬, 马晓建, 方书起, 等. 小球藻在内光源气升式反应器中的培养工艺优化[J]. 化工进展, 2018, 37(2): 525-532. Zhang F F, Ma X J, Fang S Q, et al. Optimization of culture technology of Chlorella vulgaris in airlift reactors with internal light source[J]. Chemical Industry Engineering Progress, 2018, 37(2): 525-532. (  0) 0) |
| [11] |
张栩, 李大鹏, 蔡昭铃, 等. 气升式光生物反应器培养裙带菜配子体的初步研究[J]. 海洋科学, 2002(6): 39-43. Zhang X, Li D P, Cai Z L, et al. Studies on growth of gametophytes of Undaria pinnatifida in airlift photobioreactor[J]. Marine Sciences, 2002(6): 39-43. (  0) 0) |
| [12] |
吴垠, 孙建明, 孙培海, 等. CO2浓度对光生物反应器高效培养的湛江叉鞭金藻和盐藻的影响[J]. 水产学报, 2004, 28(6): 741-744. Wu Y, Sun J M, Sun P H, et al. Effects of CO2 concentration on efficiently cultivating Dicrateria zhanjiangensis and Dunaliella sp. in photobioreactor[J]. Journal of Fisheries of China, 2004, 28(6): 741-744. (  0) 0) |
| [13] |
Tang D H, Han W, Li P L, et al. CO2 biofixation and fatty acid composition of Scenedesmus obliquus and Chlorella pyrenoidosa in response to different CO2 levels[J]. Bioresource Technology, 2011, 102(3): 3071-3076. DOI:10.1016/j.biortech.2010.10.047
(  0) 0) |
| [14] |
杨雨玲, 李伟, 陈伟州, 等. 二氧化碳和阳光紫外辐射对坛紫菜丝状体光合生理特性的影响[J]. 水产学报, 2013, 37(8): 1198-1205. Yang Y L, Li W, Chen W Z, et al. Effects of CO2 and UV radiation on photosynthetic performance of conchocelis of Pyropia haitanensis[J]. Journal of Fisheries of China, 2013, 37(8): 1198-1205. (  0) 0) |
| [15] |
高伟.环境因子对萱藻(Scytosiphon lomentaria)丝状体扩增及孢子囊发育的影响[D].青岛: 中国海洋大学, 2012. Gao W. Effect of Enviromental Factors on Filaments Amplification and Sporangia Development of Scytosiphon lomentaria[D]. Qingdao: Ocean University of China, 2012. (  0) 0) |
| [16] |
库姆斯 J, 霍 尔D, 朗S P, 等. 生物生产力和光合作用测定技术[M]. 北京: 科学出版社, 1986. Coombs J, Hoare D, Ron S P, et al. Biological Productivity and Photosynthesis Measurement Techniques[M]. Beijing: Science Press, 1986. (  0) 0) |
| [17] |
张文健, 宫相忠, 高伟. 环境因子对萱藻(Scytosiphon lomentaria)孢子附着的影响[J]. 海洋与湖沼, 2013, 44(6): 1661-1666. Zhang W J, Gong X Z, Gao W. Effect of environmental factors on spore attachment of Scytosiphon lomentaria[J]. Oceanologia et Limnologia Sinica, 2013, 44(6): 1661-1666. (  0) 0) |
| [18] |
张丽莉, 吴垠, 孙建明, 等. 补充CO2对光生物反应器培养小球藻生长和光合作用的影响[J]. 水产科学, 2008, 27(11): 570-573. Zhang L L, Wu Y, Sun J M, et al. Effects of CO2 enrichment on growth and photosynthesis of green alga Chlorella vulagris[J]. Fisheries Science, 2008, 27(11): 570-573. (  0) 0) |
| [19] |
徐军田, 高坤山. 二氧化碳和阳光紫外辐射对龙须菜生长和光合生理的影响[J]. 海洋学报, 2010, 32(5): 144-151. Xu J T, Gao K S. The influence of carbon dioxide and solar UVR on the growth, photosynthesis and pigments contents of Gracilaria lemaneiformis[J]. Acta Oceanological Sinica, 2010, 32(5): 144-151. (  0) 0) |
| [20] |
Menéndez M, Martínez M, Comín F A. A comparative study of the effect of pH and inorganic carbon resources on the photosynthesis of three floating macroalgae species of a Mediterranean coastal lagoon[J]. Journal of Experimental Marine Biology and Ecology, 2001, 256: 123-136.
(  0) 0) |
| [21] |
Porzio L, Buia M C, Lorenti M, et al. Physiological responses of a population of Sargassum vulgare (Phaeophyceae) to high pCO2/low pH: Implications for its long-term distribution[J]. Science of the Total Environment, 2017, 576: 917-925.
(  0) 0) |
| [22] |
Israel A, Hophy M. Growth, photosynthetic properties and Rubisco activities and amounts of marine macroalgae grown under current and elevated seawater CO2 concentrations[J]. Global Change Biology, 2002, 8: 831-840. DOI:10.1046/j.1365-2486.2002.00518.x
(  0) 0) |
| [23] |
于娟, 张瑜, 杨桂朋, 等. 海洋酸化对大型海藻生长以及磷酸盐、硝酸盐吸收利用的影响[J]. 环境科学, 2012, 33(10): 3352-3360. Yu J, Zhang Y, Yang G P, et al. Effects of ocean acidification on growth, phosphate and nitrate uptake of macroalgae[J]. Environmental Science, 2012, 33(10): 3352-3360. (  0) 0) |
| [24] |
高伟, 宫相忠, 张必达. 环境因子对萱藻(Scytosiphon lomentaria)丝状体孢子放散的影响[J]. 海洋与湖沼, 2012, 43(2): 244-248. Gao W, Gong X Z, Zhang B D. Effect of environmental factors on spore releasing of filaments of Scytosiphon lomentaria[J]. Oceanologia et Limnologia Sinica, 2012, 43(2): 244-248. (  0) 0) |
| [25] |
杨儒谦, 宫相忠, 沈世军, 等. 二氧化锗对共培养萱藻丝状体和硅藻生长的影响[J]. 水产学报, 2019, 43(2): 431-440. Yang R Q, Gong X Z, Shen S J, et al. Effects of germanium dioxide on the growth of filaments of Scytosiphon lomentaria and diatoms in co-cultured conditions[J]. Journal of Fisheries of China, 2019, 43(2): 431-440. (  0) 0) |
| [26] |
潘双叶.光生物反应器培养坛紫菜自由丝状体条件优化[D].宁波: 宁波大学, 2002. Pan S Y. Optimization of Culture Conditions for Free Filaments of Porphyra hainanensis in Photobioreactor[D]. Ningbo: Ningbo University, 2002. (  0) 0) |
| [27] |
王兰刚.光生物反应器在条斑紫菜自由丝状体培养及无贝壳育苗中应用研究[D].上海: 上海海洋大学, 2007. Wang L G. Application of Photobioreactor in Free Filament Culture and Shell-Free Seedling Culture of Porphyra yezoensis[D]. Shanghai: Shanghai Ocean University, 2007. (  0) 0) |
| [28] |
闫欣, 曹欣, 陈宇华, 等. 藻类去除水体污染物技术研究进展[J]. 华北水利水电大学学报(自然科学版), 2019, 40(5): 36-40. Yan X, Cao X, Chen Y H, et al. Research progress on removal of water pollutants by algae[J]. Journal of North China University of Water Resources and Electric Power(Natural Science Edition), 2019, 40(5): 36-40. (  0) 0) |
| [29] |
洪丽珍, 宫相忠, 张文健, 等. 五种培养液对萱藻丝状体生长发育的影响[J]. 水产学报, 2015, 39(2): 193-202. Hong L J, Gong X Z, Zhang W J, et al. Effects of five culture media on the growth and development of the filaments of Scytosiphon lomentaria[J]. Journal of Fisheries of China, 2015, 39(2): 193-202. (  0) 0) |
 2020, Vol. 50
2020, Vol. 50


