2. 青岛海洋科学与技术试点国家实验室 海洋渔业科学与食物产出过程功能实验室,山东 青岛 266237
虹鳟(Oncorhynchus mykiss)和硬头鳟(Oncorhynchus mykiss)是同一品种,属冷水型鱼[1-2],其中硬头鳟是降海洄游型,在淡水中生长到合适规格后洄游入海[3-4];虹鳟为陆封型,通常在淡水中养殖,但可进行海水驯养[5]。已有研究表明虹鳟在适宜海水盐度中,其抗病力和生长状况均有所提高[6]。近年来,中国科技工作者采用陆海接力模式在黄海冷水团养殖虹鳟和硬头鳟,即先在淡水中培育鱼种,待长到一定规格后再进行盐度驯化并移入海水中养殖[7],故最适盐度驯化方式养殖虹鳟和硬头鳟,更有利于其在进入海水后存活和生长。
盐度是水环境中重要的理化因子,对鱼类的渗透压及生存生长有着重要影响[8]。鱼类对盐度的适应取决于其鳃、肾和肠的渗透调节功能[9]。当环境盐度改变时,会引起鱼体产生多种生理应激反应,相应地鱼体活性氧(ROS)的产生也会增多[10]。未被及时清除的ROS会对鱼体产生损害,引起酶失活、脂质过氧化和DNA损伤等不利影响[11-12],并且还会攻击鱼体的免疫防疫机制,进一步破坏鱼体的正常生长和存活。丙二醛(MDA)作为活性氧攻击生物膜产生的脂质过氧化物,其浓度高低可作为活性氧引起毒性大小的指标[13]。鱼类拥有抗氧化酶系统,其中抗氧化酶包括超氧化物歧化酶(SOD)、谷胱甘肽过氧化物(GSH-Px)、过氧化氢酶(CAT)[14],此系统对清除过量的活性氧自由基、缓解自身损害和提高免疫细胞的防御能力有重要作用[15]。在非适宜盐度环境下,抗氧化酶系统是鱼体抵抗环境胁迫重要的免疫防御系统[16]。
有关盐度对虹鳟及硬头鳟的消化酶[17]、渗透生理[7]和死亡率[18]等生长指标的影响已有报道,但盐度变化对虹鳟和硬头鳟抗氧化酶活性影响的研究鲜有报道,为探究盐度驯化方式对虹鳟和硬头鳟免疫防御的影响,本研究比较分析了不同盐度变化下虹鳟和硬头鳟肝脏抗氧化酶的变化。
1 材料与方法 1.1 实验材料本实验用虹鳟和硬头鳟均采自山东省日照市万泽丰渔业有限公司鲑鳟鱼繁育基地,孵化自丹麦进口三倍体受精卵,平均体重虹鳟为(99.44±0.26) g(下文简写为99 g虹鳟)、硬头鳟为(99.01±0.61) g(下文简写为99 g硬头鳟)和(394.50±1.16) g(下文简写为395 g硬头鳟),将其淡水暂养2周,养殖容器为圆形玻璃纤维水槽(180 L,R=0.32 m,H=0.60 m)。实验期间,每天8:00和16:00分别投喂人工配合饲料1次。每天换水1次,每次换水约100%,暂养和实验过程均为饱食投喂。
1.2 实验设计暂养结束后,选用相同规格、活泼健壮的虹鳟和硬头鳟开展实验。每个实验都设置了相同的4个盐度驯化方式,T0组:淡水对照组,T30组:从淡水直接过渡至盐度30,T2组和T6组:从淡水直接过渡至盐度14,盐度增加速度分别为2/d(T2)和6/d(T6),以使其适应盐度变化。每个盐度驯化方式设3个平行,其中99 g虹鳟和99 g硬头鳟实验每个平行放养24尾鱼,395 g硬头鳟实验每个平行放养8尾鱼。
养殖容器与暂养容器相同。实验用水由经过沉淀的自然海水(盐度为30)和淡水(盐度为0)调配而成。实验期间温度(16.0±0.5) ℃,溶氧维持在6.0 mg·L-1以上,pH为8.0±0.2,氨氮水平 < 0.5 mg·L-1,光照周期L:D=12:12。为保证水体中溶氧充足,每个水槽采用2个气石,并用气泵24 h充气,3个实验都持续40 d。
1.3 样品的采集与处理99 g虹鳟和99 g硬头鳟分别在升至盐度30后的0.5、1、4、8、15和40 d取样,各组随机取3尾鱼。395 g硬头鳟不同处理组仅在40 d时取样,各组随机取5尾鱼。取样前停食24 h后,使用麻醉剂MS-222(40 mg·L-1)对鱼进行麻醉后进行静脉采血。血液4 ℃冰箱放置3 h自然分层后,4 000 r/min离心10 min后抽取上层血清,用于血清抗氧化酶及丙二醛(MDA)含量的测定。
1.4 指标测定超氧化物歧化酶(SOD)用WST-1法测定,在450 nm处比色测定吸光度值计算其活性,活性单位定义为:每毫克组织蛋白在1 mL反应液中SOD抑制率达50%时所对应的SOD量为一个活性单位。过氧化氢酶(CAT)用可见光法测定,在405 nm处测定H2O2减少的量,活性单位定义为:每毫克组织蛋白每秒钟分解1 μmol的H2O2的量为一个活性单位。谷胱甘肽过氧化酶(GSH-Px)活性通过测定在412 nm波长下谷胱甘肽(GSH)的消耗量计算得出,活性单位定义:每毫克蛋白质,每分钟扣除非酶反应的作用,使反应体系中GSH浓度降低1 μmol/L为一个酶活性单位。丙二醛(MDA)的含量采用南京建成生物研究所生产的试剂盒进行测定。总蛋白含量采用考马斯亮蓝蛋白测定试剂盒进行测定,以牛血清蛋白为标准,计算出总蛋白含量。酶活力、丙二醛及组织总蛋白含量的测定均按南京建成试剂盒进行检测。
1.5 数据统计所有数据采用SAS 9.4 (SAS Institute, Cary, NC, USA)进行分析,采用单因素方差分析(One-way ANOVA),用Tukey比较组间差异[19],以P < 0.05作为差异显著水平。数据采用双因素方差(Two-way ANOVA),以确定不同盐度驯化方式和时间之间是否存在显着差异和相互作用。
2 实验结果 2.1 盐度驯化对虹鳟抗氧化酶和MDA含量的影响如表 1所示,99 g虹鳟血清中SOD活性受盐度驯化方式、时间及其交互作用的影响作用显著(P < 0.05)。随着盐度变化SOD活性如下见图 1A。比较不同处理组的SOD活性发现,T0组(对照组)99 g虹鳟SOD活性基本保持稳定,T2组99 g虹鳟SOD活性,除第4天外,其余时间与对照组相比差异不显著(P>0.05),T6组99 g虹鳟SOD活性呈现先上升,在4 d时达到顶峰,随后下降,在实验结束时显著高于T0组。T30组99 g虹鳟SOD活性先上升,在4 d达到顶峰后下降,并在8 d后趋于稳定,在盐度驯化开始与结束时,T30组SOD活性均显著高于T0组(P < 0.05)。
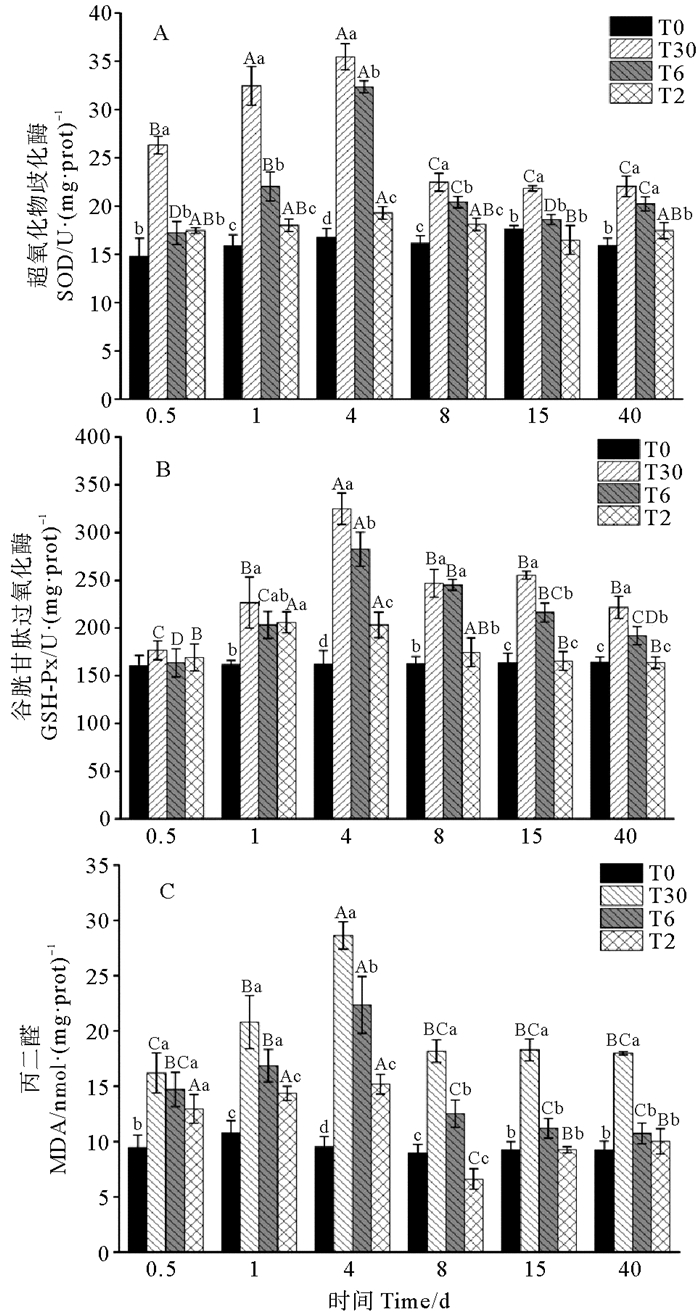
|
(不同小写字母表示同一时间点不同盐度处理组间差异显著(P < 0.05),不同大写字母表示同一盐度处理组下不同时间差异显著(P < 0.05),下同。Different lower-case letters represent significant difference among different salinity acclimatization treatments at the same time (P < 0.05), while different capital letters denote the significant difference among different time points at the same salinity acclimatization treatments (P < 0.05), the same below.) 图 1 不同盐度驯化方式下99 g虹鳟的SOD、GSH-Px和MDA含量 Fig. 1 The antioxidant enzyme and MDA activity of 99 g rainbow trout at different salinity acclimatization methods |
|
|
表 1 驯化方式和时间对99 g虹鳟抗氧化酶影响的双因素P值 Table 1 P value of two-way ANOVAs for the effects of acclimation method and time on serum antioxidant enzyme in 99 g rainbow trout |
比较不同处理组的GSH-Px活性发现,99 g虹鳟血清中GSH-Px活性受盐度驯化方式、时间及其交互作用的影响显著(P < 0.05,见表 1)。随着时间延长,各组虹鳟GSH-Px活性见图 1B。T2组99 g虹鳟GSH-Px活性在第1天显著增高(P < 0.05)并且达到最高值,之后活性降低并在15 d后稳定。T6组和T30组99 g虹鳟GSH-Px活性呈现先上升后下降的趋势,且均在4 d时达到最大值,随之下降在15 d后趋于稳定。在整个盐度驯化实验期间,T30组99 g虹鳟GSH-Px活性显著高于对照组(P < 0.05)。
通过不同处理组的MDA含量发现,99 g虹鳟血清中MDA含量受盐度驯化方式、时间及其交互作用的影响显著(P < 0.05,见表 1)。不同盐度驯化方式下虹鳟血清MDA含量见图 1C。T0组99 g虹鳟MDA含量在40 d内无显著变化。T2组99 g虹鳟MDA含量4 d内升高,在4 d后显著降低,在8 d后与T0组无显著差异(P > 0.05)。T6组和T30组99 g虹鳟MDA含量呈现先升高后降低的趋势,均在4 d时达到顶峰且显著高于其余各组(P < 0.05), 并在8 d后趋于稳定。在盐度驯化实验结束时,T30组99 g虹鳟MDA含量显著高于其余各组(P < 0.05)。
2.2 盐度驯化对不同规格硬头鳟抗氧化酶和MDA含量的影响 2.2.1 盐度驯化对99 g硬头鳟抗氧化酶和MDA含量的影响如表 2所示,99 g硬头鳟血清中SOD活性受盐度驯化方式、时间及其交互作用的影响显著(P < 0.05,见表 2)。不同盐度驯化方式下硬头鳟血清SOD活性见图 2A。比较不同处理组SOD活性发现,与99 g虹鳟一样,整个实验期内T0组(对照组)99 g硬头鳟SOD活性无显著变化,在40 d时T6、T30组显著高于T0组(P < 0.05)。T2组99 g硬头鳟SOD活性在第1天达到最大值,此后保持在较高水平,在第8天显著下降,在40 d时与对照组SOD活性无显著差异(P > 0.05)。T6和T30组99 g硬头鳟SOD活性先增高后下降,在第4天升高到峰值,而后下降,在8 d后趋于稳定,盐度驯化结束时,T6组和T30组99 g硬头鳟SOD活性显著高于T2组(P < 0.05)。
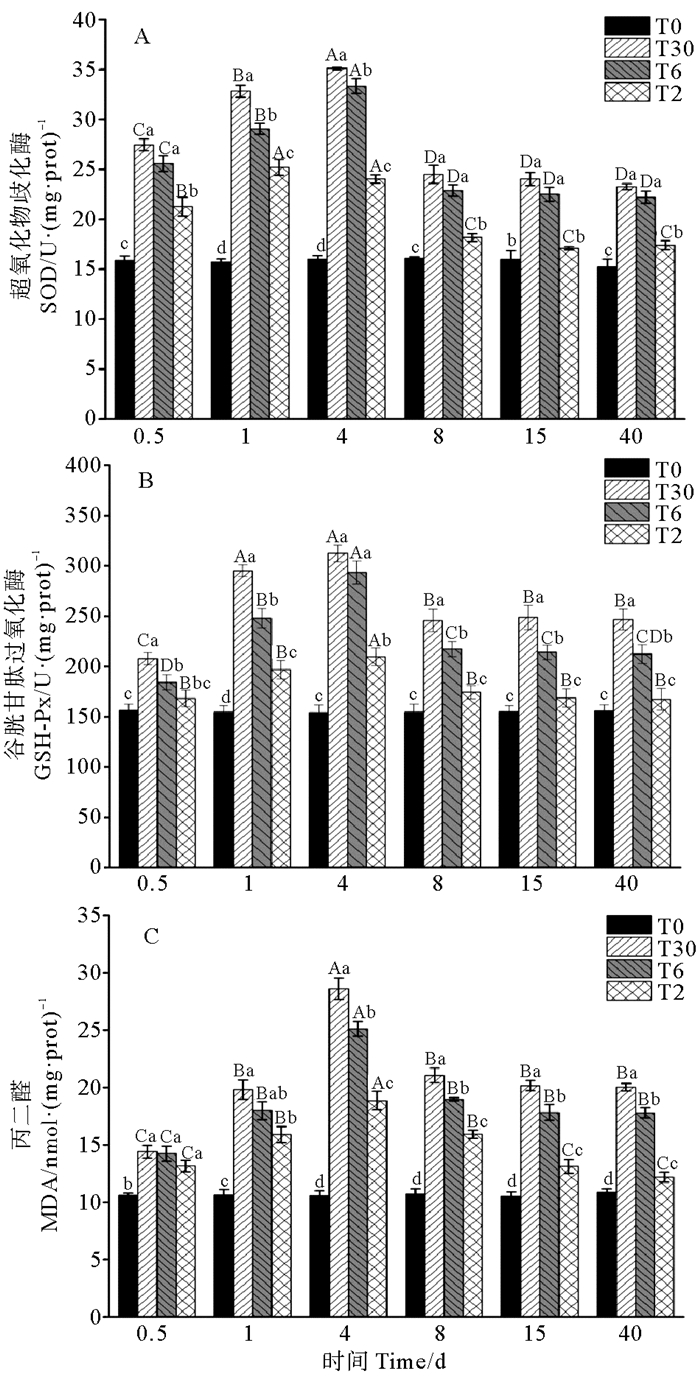
|
图 2 不同盐度驯化方式下99 g硬头鳟的SOD、GSH-Px和MDA含量 Fig. 2 The antioxidant enzyme and MDA activity of 99 g steelhead trout at different salinity acclimatization methods |
|
|
表 2 驯化方式和时间对99 g硬头鳟抗氧化酶影响的双因素P值 Table 2 P value of two-way ANOVAs for the effects of acclimation method and time on serum antioxidant enzyme in 99 g steelhead trout |
盐度驯化方式、时间及其交互作用对99 g硬头鳟血清中GSH-Px活性的影响显著(P< 0.05,见表 2)。不同盐度驯化方式下硬头鳟血清GSH-Px活性见图 2B。T0组99 g硬头鳟GPH-PX活性在40 d内保持稳定。随着时间延长,T2组99 g硬头鳟GSH-Px活性在4 d时显著升高,之后降低,在8 d后保持稳定且与T0组差异不显著(P> 0.05)。T6和T30组99 g硬头鳟GSH-Px活性在第1天显著升高,在4 d时达到顶峰且显著高于其余各组(P< 0.05),之后下降,于15 d后趋于稳定。
盐度驯化方式、时间及其交互作用对99 g硬头鳟血清中MDA含量的影响显著(P< 0.05,见表 2)。不同盐度驯化方式下硬头鳟血清MDA含量见图 2C。T0组99 g硬头鳟MDA含量水平在40 d内一直处于稳定状态,T2组99 g硬头鳟MDA含量先上升后下降,在第4天时达到顶峰,显著高于其余时间点,之后持续下降并在15 d后趋于稳定,在第40天时,T2组99 g硬头鳟MDA含量显著高于T0组(P< 0.05)。T6和T30组99 g硬头鳟MDA含量在0.5 d显著高于T0组(P< 0.05),之后两组MDA含量在第4天达到顶峰,显著高于其他时间点(P < 0.05),第8天后保持稳定。在盐度驯化实验结束时,T6和T30组硬头鳟MDA含量显著高于T2和T0组(P< 0.05)。
2.2.2 盐度驯化对395 g硬头鳟抗氧化酶和MDA的活性的影响不同盐度驯化方式下395 g硬头鳟血清中抗氧化酶活性见图 3。实验结束时,T6和T30组395 g硬头鳟SOD活性显著高于T0和T2组(P < 0.05),T2组SOD活性与T0组SOD活性无显著差异。T6组和T30组395 g硬头鳟CAT活性显著高于T0组和T2组(P < 0.05),T2组CAT活性与T0组无显著差异。T2组395 g硬头鳟GSH-Px活性显著低于对照组,T6和T30组GSH-Px活性显著高于T0组(P < 0.05),T30组活性最高,且显著高于其余各组。T2组395 g硬头鳟MDA含量与对照组无显著差异,而T6和T30组395 g硬头鳟MDA含量显著高于T0组T2组(P < 0.05)。
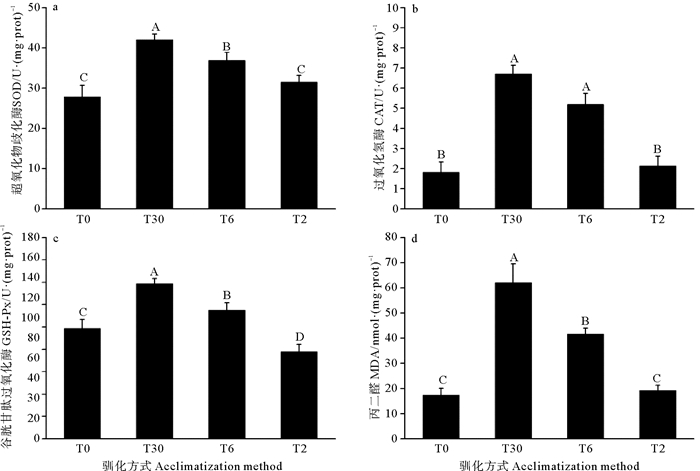
|
(不同大写字母表示同一时间点不同盐度处理组间差异显著(P < 0.05)。Different capital letters represent the significant difference among different salinity acclimatization treatments at the same time (P < 0.05) ) 图 3 不同盐度驯化方式下395 g硬头鳟的抗氧化酶和MDA含量 Fig. 3 The antioxidant enzymes and MDA activity of 395 g steelhead trout at different salinity acclimatization methods |
盐度变化会对鱼体产生胁迫,在高渗海水中,渗透压力会导致鱼体产生多种生理反应,为减少损伤,鱼体会消耗能量进行渗透压调节[20-21],此种能量的消耗不仅打破了离子平衡,还与超氧自由基、过氧化氢、羟自由基等活性氧的产生密切相关[22],大量活性氧的产生会引起鱼体抗氧化系统的响应,从而为活性氧的消除提供前体物质。当盐度发生变化时,血清中抗氧化酶会发生适应性变化[23]。
本研究中,三种盐度驯化方式都可改变虹鳟和硬头鳟的抗氧化酶活性水平。T2、T6和T30组99 g虹鳟和99 g硬头鳟SOD、GSH-Px活性在前4 d明显升高并达到最大值。这暗示最初盐度改变的压力会导致海洋生物活性氧危害,活性氧分子活性极强,从而引起机体抗氧化酶活性升高与其对抗[9, 24]。孙鹏等[25]对条石鲷(Oplegnathus fasciatus)在不同盐度实验也出现了初期抗氧化酶活性显著升高的现象。类似地,Yin等[26]对(5.80±0.30)g幼鱼银鲳(Pampus argenteus)在4种盐度下(25、20、15和10)处理96 h后发现,SOD活性达到最大值,不同的是,盐度驯化后的银鲳GSH-Px活性却呈现出了下降的趋势,与本实验99 g虹鳟和99 g硬头鳟在前4 d GSH-Px活性上升存在差异,这可能是由于不同鱼类酶的活性存在差异,但作为对活性氧最敏感的SOD在两类鱼中表现出了相似性。因此,一定范围生物盐度变化,会使鱼类短期内抗氧化酶活性升高。
随着盐度驯化时间延长,本实验4~8 d内T30、T6及T2组99 g虹鳟和99 g硬头鳟SOD和GSH-Px活性都有不同程度下降。SOD、CAT和GSH-Px活性升高可有效降低活性氧对机体的危害,但在此4~8 d却出现抗氧化酶下降的趋势,这表明该时间段99 g虹鳟和99 g硬头鳟充分调动机体防御机制应对盐度变化产生的活性氧。抗氧化酶发挥消除ROS的重要作用,使机体产生的活性氧含量降低,相应地抗氧化酶活性水平随之下降。Zhao等[27]对施氏鲟(Acipenser schrenchii)进行盐度驯化研究中也发现,随着驯养时间延长抗氧化酶会有不同程度的恢复,这可能与鱼体调节渗透压有关。由此可见,在进行盐度驯化过程中,鱼体也在积极缓解胁迫带来的危害,利用机体更多能量来维持新陈代谢的稳定,从而使体内酶活力恢复至正常水平。
本研究中T2组99 g虹鳟和硬头鳟抗氧化酶在前8 d升高或降低幅度显著,8 d后趋于稳定,基本达到对照组水平,但硬头鳟SOD活性高于对照组。这可能是硬头鳟本身有降海习性,进入海水环境后其生理、行为会有一定转变,从而会出现相应酶分泌能力增强的现象,此种特性更有利于其在进入海水后生长发育。已有研究报道,鲑鳟鱼驯化期1周,可适应海水盐度,移入海域养殖[28]。Xiong等[29]对394.50 g硬头鳟(Oncorhynchus mykiss)采取不同盐度驯化方式时发现,以升盐速度2/d进行盐度驯化为最佳过渡方式。本实验与上述研究得出的结果基本一致,对于100 g左右的虹鳟和硬头鳟采用T2方式进行前期驯化,在其进入海水1周左右,抗氧化酶活力基本恢复到正常水平,这说明两类鱼在此阶段可逐渐适应盐度30水环境。
本实验T6和T30组99 g虹鳟和99 g硬头鳟MDA含量呈现先升高后降低的趋势,但实验结束后2组MDA含量仍高于对照组;395 g硬头鳟MDA含量也出现了相似结果。这表明在T6组和T30组两种盐度驯化下,盐度变化过快超出了两类鱼自身调节所能承受的最大限度,从而使虹鳟和硬头鳟长期处于氧化应激状态且不断产生自由基,抗氧化酶为清除活性氧危害始终处于较高水平状态。盐度变化会导致鱼体内活性氧攻击生物膜中多不饱和脂肪酸,造成脂质过氧化,引起MDA含量的快速升高[30]。随着盐度驯化时间的延长,鱼体适应盐度能力有所增强,及时消除部分过量的活性氧,MDA含量逐渐降低。但鱼体在高盐度胁迫下,长期处于氧化应激状态导致T30组MDA含量不能降低到正常水平。相似地,Martinez-Alvarez[31]报道纳氏鲟(Acipenser naccarii)在盐度35环境中,MDA含量维持在一个较高水平,血浆中抗氧化酶无法有效抑制活性氧的危害。Xu等[32]对海马(hippocampus kuda)研究发现,在盐度35胁迫下,海马幼体MDA含量处于较高的状态。而本实验T30组99 g虹鳟和硬头鳟MDA含量也长时间处于较高水平,此种状态打破了最初自由基的动态平衡,将会对鱼体造成一定的损伤。这表明虹鳟和硬头鳟可能无法适应T30与T6组驯化方式。
本实验中,T2组395 g硬头鳟MDA含量与对照组无显著差异,T2组99 g硬头鳟实验中MDA含量虽从第8天逐渐下降,但实验结束时未达到对照组水平。推测T2组395 g硬头鳟经过一段时间盐度驯化,鱼体逐渐适应其变化,但99 g硬头鳟仍无法彻底维持体内MDA含量的稳定,可能与小规格硬头鳟抗氧化酶调节机制尚不完善有关。小规格虹鳟和硬头鳟虽可通过T2驯化方式逐渐适应海水,但其体内MDA含量与对照组相比较高,也表明此规格可能并不是入海最佳规格。就本实验的研究结果而言,入海规格和其自身适应能力呈正相关性关系,因此,与99 g硬头鳟相比,395 g硬头鳟可能用更短时间即可顺利过渡至海水,维持体内抗氧化酶的稳定。这与Xiong等[29]报道约400 g硬头鳟达到最佳入海规格的结论相符。
4 结语本实验T30组和T6组驯化方式中,99 g虹鳟、99和395 g硬头鳟抗氧化酶活性紊乱,这表明实验鱼可能无法适应该组海水驯化方式。T2组99 g虹鳟、99 g硬头鳟在实验前4 d体内抗氧化酶水平较高,随着驯化时间延长,鱼体可慢慢适应并做出调节至良好状态,这表明实验鱼可逐渐适应T2组驯化方式,但并非最佳入海规格。此外,盐度驯化后大规格(395 g)硬头鳟体内抗氧化酶稳定性优于小规格(99g硬头鳟),这表明395 g硬头鳟对盐度驯化适应能力强于99 g硬头鳟。
| [1] |
Johnsson J, Clarke W. Development of seawater adaptation in juvenile steelhead trout (Salmo gairdneri) and domesticated rainbow trout (Salmo gairdneri)—effects of size, temperature and photoperiod[J]. Aquaculture, 1988, 71(3): 247-263. DOI:10.1016/0044-8486(88)90263-3
(  0) 0) |
| [2] |
Lessard J L, Hayes D B. Effects of elevated water temperature on fish and macroinvertebrate communities below small dams[J]. River Research and Applications, 2003, 19(7): 721-732. DOI:10.1002/rra.713
(  0) 0) |
| [3] |
Duston J. Effect of salinity on survival and growth of Atlantic salmon (Salmo salar) parr and smolts[J]. Aquaculture, 1994, 121(1-3): 1-124. DOI:10.1016/0044-8486(94)90003-5
(  0) 0) |
| [4] |
Morgan J D, Iwama G K. Effects of salinity on growth, metabolism, and ion regulation in juvenile rainbow and steelhead trout (Oncorhynchus mykiss) and fall chinook salmon (Oncorhynchus tshawytscha)[J]. Canadian Journal of Fisheries Aquatic Sciences, 1991, 48(11): 2083-2094. DOI:10.1139/f91-247
(  0) 0) |
| [5] |
Rao G M M. Oxygen consumption of rainbow trout (Salmo gairdneri) in relation to activity and salinity[J]. Canadian Journal of Zoology, 1968, 46(4): 781-786. DOI:10.1139/z68-108
(  0) 0) |
| [6] |
Yada T, Azuma T, Takagi Y. Stimulation of non-specific immune functions in seawater-acclimated rainbow trout, Oncorhynchus mykiss, with reference to the role of growth hormone[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2001, 129(2-3): 695-701. DOI:10.1016/S1096-4959(01)00370-0
(  0) 0) |
| [7] |
熊莹槐, 杨静雯, 董双林, 等. 虹鳟和硬头鳟早期幼鱼渗透生理及能量平衡的比较研究[J]. 中国海洋大学学报(自然科学版), 2019, 49(3): 47-56. Xiong Y H, Yang J W, Dong S L, et al. Comparative studies of osmophysiology and energy budget between juvenile rainbow (Oncorhynchus mykiss) and steelhead trout (O. mykiss)[J]. Periodical of Ocean Univerity of China, 2019, 49(3): 47-56. (  0) 0) |
| [8] |
Rubio V, Sánchez-Vázquez F, Madrid J. Effects of salinity on food intake and macronutrient selection in European sea bass[J]. Physiology & Behavior, 2005, 85(3): 333-339.
(  0) 0) |
| [9] |
Nordrum S, Bakke-McKellep A, Krogdahl A, et al. Effects of soybean meal and salinity on intestinal transport of nutrients in Atlantic salmon (Salmo salar L.) and rainbow trout (Oncorhynchus mykiss)[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2000, 125(3): 317-335. DOI:10.1016/S0305-0491(99)00190-X
(  0) 0) |
| [10] |
Choi C Y, An K W, An M I. Molecular characterization and mRNA expression of glutathione peroxidase and glutathione S-transferase during osmotic stress in olive flounder (Paralichthys olivaceus)[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2008, 149(3): 330-337.
(  0) 0) |
| [11] |
Gabbianelli R, Lupidi G, Villarini M, et al. DNA damage induced by copper on erythrocytes of gilthead sea bream Sparus aurata and mollusk Scapharca inaequivalvis[J]. Archives of Environmental Contamination and Toxicology, 2003, 45(3): 350-356.
(  0) 0) |
| [12] |
Xing J, Lin T, Zhan W. Variations of enzyme activities in the haemocytes of scallop Chlamys farreri after infection with the acute virus necrobiotic virus (AVNV)[J]. Fish & Shellfish Immunology, 2008, 25(6): 847-852.
(  0) 0) |
| [13] |
Orun I, Talas Z S, Ozdemir I, et al. Antioxidative role of selenium on some tissues of (Cd2+, Cr3+)-induced rainbow trout[J]. Ecotoxicology and Environmental Safety, 2008, 71(1): 71-75. DOI:10.1016/j.ecoenv.2007.07.008
(  0) 0) |
| [14] |
Beydemr Ş, Hsar O. Effect of α-tocopherol on antioxidant enzyme activities and lipid peroxidation in rainbow trout (Oncorhynchus mykiss)[J]. Acta Veterinaria Hungarica, 2005, 53(4): 425-433. DOI:10.1556/AVet.53.2005.4.3
(  0) 0) |
| [15] |
Pipe R, Porte C, Livingstone D. Antioxidant enzymes associated with the blood cells and haemolymph of the mussel Mytilus edulis[J]. Fish & Shellfish Immunology, 1993, 3(3): 221-233.
(  0) 0) |
| [16] |
Aliko V, Qirjo M, Sula E, et al. Antioxidant defense system, immune response and erythron profile modulation in gold fish, Carassius auratus, after acute manganese treatment[J]. Fish & Shellfish Immunology, 2018, 76: 101-109.
(  0) 0) |
| [17] |
杨静雯, 周演根, 黄铭, 等. 盐度对虹鳟和硬头鳟幼鱼消化酶和抗氧化酶活性的比较研究[J]. 中国海洋大学学报(自然科学版), 2019, 49(3): 119-128. Yang J W, Zhou Y G, Huang M, et al. Comparative studies on digestive and antioxidant enzyme activities between juvenile rainbow(Oncorhynchus mykiss) and steelhead trout(O. mykiss)[J]. Periodical of Ocean Univerity of China, 2019, 49(3): 119-128. (  0) 0) |
| [18] |
Fevolden S-E, Røed K H, Fjalestad K. A combined salt and confinement stress enhances mortality in rainbow trout(Oncorhynchus mykiss) selected for high stress responsiveness[J]. Aquaculture, 2003, 216(1-4): 67-76. DOI:10.1016/S0044-8486(02)00131-X
(  0) 0) |
| [19] |
Steel R, Torrie J H. Principles and Procedures of Statistics: A Biometrical Approach[M]. New York, USA: McGraw-Hill, 1980.
(  0) 0) |
| [20] |
Boeuf G, Payan P. How should salinity influence fish growth?[J]. Comparative Biochemistry Physiology Part C: Toxicology Pharmacology, 2001, 130(4): 411-423. DOI:10.1016/S1532-0456(01)00268-X
(  0) 0) |
| [21] |
Ye L, Jiang S, Zhu X, et al. Effects of salinity on growth and energy budget of juvenile Penaeus monodon[J]. Aquaculture, 2009, 290(1-2): 140-144. DOI:10.1016/j.aquaculture.2009.01.028
(  0) 0) |
| [22] |
Cooper R U, Clough L M, Farwell M A, et al. Hypoxia-induced metabolic and antioxidant enzymatic activities in the estuarine fish Leiostomus xanthurus[J]. Journal of Experimental Marine Biology and Ecology, 2002, 279(1-2): 1-20. DOI:10.1016/S0022-0981(02)00329-5
(  0) 0) |
| [23] |
郭黎, 马爱军, 王新安, 等. 盐度和温度对大菱鲆幼鱼抗氧化酶活性的影响[J]. 大连海洋大学学报, 2012, 27(5): 422-428. Guo L, Ma A J, Wang X A, et al. Effects of temperature and salinity on the activities of antioxidant enzymes of juvenile turbot Scophthalmus maximus[J]. Journal of Dalian Ocean University, 2012, 27(5): 422-428. DOI:10.3969/j.issn.2095-1388.2012.05.008 (  0) 0) |
| [24] |
Rudneva I. Blood antioxidant system of Black Sea elasmobranch and teleosts[J]. Comparative Biochemistry and Physiology Part C: Pharmacology, Toxicology and Endocrinology, 1997, 118(2): 255-260. DOI:10.1016/S0742-8413(97)00111-4
(  0) 0) |
| [25] |
孙鹏, 尹飞, 彭士明, 等. 盐度对条石鲷幼鱼肝脏抗氧化酶活力的影响[J]. 海洋渔业, 2010, 32(2): 154-159. Sun P, Yin F, Peng S M, et al. Effects of salinity on the activity of antioxidant enzymes in livers of juvenile Oplegnathus fasciatus[J]. Marine Fisheries, 2010, 32(2): 154-159. DOI:10.3969/j.issn.1004-2490.2010.02.007 (  0) 0) |
| [26] |
Yin F, Peng S, Sun P, et al. Effects of low salinity on antioxidant enzymes activities in kidney and muscle of juvenile silver pomfret Pampus argenteus[J]. Acta Ecologica Sinica, 2011, 31(1): 55-60. DOI:10.1016/j.chnaes.2010.11.009
(  0) 0) |
| [27] |
Zhao F, Zhuang P, Zhang L, et al. Responses of antioxidases in different tissues of Acipenser schrenckii to increased salinity in water[J]. Marine Fisheries Research, 2008, 29(5): 65-69.
(  0) 0) |
| [28] |
董双林. 黄海冷水团大型鲑科鱼类养殖研究进展与展望[J]. 中国海洋大学学报(自然科学版), 2019, 49(3): 1-6. Dong S L, et al. Researching progresses and prospects in large salmonidae farming in cold water mass of yellow sea[J]. Periodocal of Ocean University of China, 2019, 49(3): 1-6. (  0) 0) |
| [29] |
Xiong Y H, Dong S L, Huang M, et al. Growth, osmoregulatory response, adenine nucleotide contents, and liver transcriptome analysis of steelhead trout(Oncorhynchus mykiss) under different salinity acclimation methods[J]. Aquaculture, 2020, 520: 734937. DOI:10.1016/j.aquaculture.2020.734937
(  0) 0) |
| [30] |
张琴星, 张涛, 侯俊利, 等. 盐度变化对多鳞四指马鲅幼鱼鳃丝Na+/K+-ATP酶及肝脏抗氧化酶活性的影响[J]. 海洋渔业, 2013, 35(3): 324-330. Zhang Q X, Zhang T, Hou J L, et al. Effects of salinity on activities of gill Na+/K+-ATPase and liver antioxidase in juvenile Eleutheronema rhadinum[J]. Marine Fisheries, 2013, 35(3): 324-330. DOI:10.3969/j.issn.1004-2490.2013.03.010 (  0) 0) |
| [31] |
Martinez Alvarez R, Hidalgo M, Domezain A, et al. Physiological changes of sturgeon Acipenser naccarii caused by increasing environmental salinity[J]. Journal of Experimental Biology, 2002, 205(23): 3699-3706.
(  0) 0) |
| [32] |
Xu Y J, Sun B. Effect of salinity stress on the growth, body composition and enzyme activities of juvenile hippocampus kuda[J]. Oceanologia et Limnologia Sinica, 2012, 6(43): 1279-1285.
(  0) 0) |
2. Function Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China
 2021, Vol. 51
2021, Vol. 51


