2. 中国水产科学研究院黄海水产研究所,山东 青岛 266071
目前,中国城镇污水处理厂(STPs)采用的二级处理工艺大多能使废水中污染物浓度降至《城镇污水处理厂污染物排放标准(GB18918—2002)》[1]规定的标准值以下。但是,由于出水排放量较大,随之外排的营养盐(N和P)数量依然较大。假定所有二级处理的出水水质均达到GB18918—2002[1]的一级A标准(总氮T-N 15 mg·L-1、氨氮NH4+-N 5或8 mg·L-1、总磷T-P 1 mg·L-1),按2015年全国城镇污水处理厂处理的污水总量为428亿m3计[2],那么每年向外部水环境排放的T-N为642 000 t、氨氮为214 000或342 400 t、T-P为42 800 t。这些氮磷营养盐排入江河湖海后,会刺激浮游植物生长,导致水体富营养化。此外,氨氮即使在低浓度时也会对鱼类和水生生物产生毒性[3]。因此,如何在现有二级处理工艺基础上进一步削减氮磷营养盐的外排量非常必要。但是,以营养盐为目标的深度处理技术存在以下问题[3]:操作成本高,需要技术熟练的人员;采用好氧生物过程时需要曝气,从而增加能耗;采用化学处理过程则需要使用大量化学物质,而且会生成大量污泥。因此,必须寻找一种简单、有效和可持续的方法以达到深度脱氮除磷的效果。
微藻是一类单细胞光合自养生物,具有生长速度快、油脂含量高的优点,能够通过光合作用吸收利用氮磷营养盐和无机碳,并转化为糖类、蛋白质和脂质,而其中的脂质又可作为生产生物柴油的原料,因此,藻基生物柴油被认为是生物能源中最具发展潜力的一种新型能源[4]。但是,传统的微藻培养方式需要消耗大量的氮磷营养盐。有研究估计[5-6],在藻基生物柴油的生产过程(微藻养殖→收获→油脂提取→转酯化)中,微藻养殖成本约占生物柴油总生产成本的70%,其中40%来自养殖过程中对水和养分的消耗。过高的生产成本已成为制约藻基生物柴油商业化生产的主要瓶颈[7]。有报道认为,只有当第三代生物柴油(即藻基生物柴油)的生产成本降低10倍,才能在价格上与原油竞争[8]。因此,利用廉价的水资源和营养物质培育微藻,成为促进微藻生物能源技术实际应用的最直接、最有效的途径。从理论上讲,将污水处理厂的尾水深度净化与微藻培养相结合,不仅可以进一步去除尾水中的营养物质,而且还能利用这些营养物质生产藻生物质进而用于制备生物柴油,大大降低藻基生物柴油的生产成本,因而是一种环境效益显著、可持续性强的发展理念。在将这种理念成功应用之前,尚需解决以下问题:来自不同STPs的尾水是否均适于微藻培养、将尾水稀释后能否促进微藻油脂积累、利用尾水培养微藻时氮磷营养盐的浓度能被削减到何种程度。
微拟球藻属(Nannochloropsis)在分类学上属于真眼点藻纲(Eustigmatophyceae),该属微藻不仅生长速度快、光合效率高,而且油脂含量高,因而被认为是一类富油的模式微藻[9]。目前,国外已建立了基于微拟球藻的多种封闭式光生物反应器和室外开放池培养体系[10-11]。该属已定种的微藻(N. gaditana, N. salina, N. granulata, N. oceanica和N. oculata)均为海洋微藻[12]。考虑到污水处理厂所排尾水的盐度较低,较适于淡水微藻培养。本研究将1种淡水微拟球藻(Nannochloropsis sp. MASCC 11)引入青岛市2家STPs的尾水中进行培养,根据培养期间的微藻生长速率、油脂产率等相关指标回答上述问题,为实现微藻的高效低耗培养提供理论依据。
1 材料与方法 1.1 试验材料 1.1.1 试验藻种淡水微拟球藻(Nannochloropsis sp. MASCC 11)由中国科学院青岛海洋研究所提供。其细胞为圆形或椭圆形。试验前将微藻接种到BG11培养基中[13],在温度(25±1) ℃、光强60 μmol photons·(m2·s)-1、光暗周期24 h∶ 0 h条件下预培养至指数生长期,备用。
1.1.2 试验尾水取自青岛市的团岛污水处理厂(TD-STP)和李村河污水处理厂(LC-STP)。试验前一天,分别于1:00、7:00、13:00、19:00采集每座污水处理厂的二沉池出水,按等体积比混合后,沉淀24 h,于121 ℃高压灭菌20 min后备用。尾水的水质(见表 1)符合GB 18918—2002[1]的一级A标准(pH=6~9;CODCr 50 mg·L-1;T-N 15 mg·L-1;T-P 0.5 mg·L-1)。
1.1.3 仪器TU-1810型紫外可见分光光度计(北京普析通用仪器有限公司);血球计数板(Nikon公司);YS2-H型光学显微镜(日本尼康公司);JY92-II型超声波细胞粉碎仪(宁波新芝生物科技有限公司);PGX-250D型智能光照培养箱(江苏艾利森仪器制造有限公司);7670530型真空冷冻干燥仪(美国Labconco公司);YXQ-LS-50S型高压蒸汽灭菌锅(上海博迅实业有限公司医疗器械厂)。
1.2 STPs尾水培养微藻用自来水将尾水稀释,稀释比(EDR = V尾水/V尾水+自来水)分别为20%、40%、60%、80%和100%,灭菌后用于微藻培养。将15只1 000 mL锥形瓶分为5组,每组的瓶中各加入一种EDR的稀释尾水400 mL,接种指数生长期的微藻(初始藻细胞密度约1.3×106 cells·mL-1)。将所有锥形瓶置于智能光照培养箱的摇床(150 r/m)中,连续培养8 d(基本到达平台期),培养条件同1.1.1节。培养期间,每天测定藻细胞密度,培养结束时测定藻生物量和油脂含量。培养前、后,分别测定各处理组的无机氮、磷酸盐浓度。
|
|
表 1 两家STPs的尾水水质分析 Table 1 Characteristics of the effluents from two STPs used for microalgae cultivation |
取少量藻液在显微镜下观察,用血球计数板计数,计算藻细胞密度(N),单位为104 cells·mL-1。
1.3.2 比生长速率比生长速率(r,d-1)是指一定时间内微藻的生长速率,按式(1)计算:
| $ r = \frac{{{\rm{ln}}{N_2}{\rm{ - ln}}{N_1}}}{t}。$ | (1) |
式中:N2、N1分别为t2、t1时刻的藻细胞密度(cells·mL-1);t为t2、t1之间的时间(d)。
1.3.3 生物量参照Ho等[14]的重量法。量取藻液10 mL,经烘至恒重的滤膜过滤。将滤膜在40~50 ℃下烘干(6~8 h),于干燥器中冷却后,称重。按下式计算:
| $ \rho = \frac{{{W_2} - {W_1}}}{V}。$ | (2) |
式中:ρ为藻生物量(g·L-1);W1为滤膜重量(g);W2为藻和滤膜的重量(g);V为量取的藻液体积(L)。
1.3.4 油脂含量采用改良的氯仿甲醇法[15]。将藻液离心(4 000 g,4 ℃,10 min)、冷冻干燥(-50 ℃)制得藻粉。准确称取0.100 0 g,置于10 mL具塞玻璃离心管中,加入CHCl3-CH3OH混合液(2∶1 v∶v)7.5 mL,漩涡混合1 min后,在冰浴中超声破碎3 min(功率700 W,间隔5 s,工作5 s),再加入CHCl3-CH3OH混合液(2∶1 v∶v)3 mL,漩涡混合1 min,静置过夜,5 000 g离心10 min,将有机相转移到已称重的烧杯中,再向原试管中加入CHCl3-CH3OH混合液(2∶1 v∶v)3 mL,按前述方法重复提取2次,有机相均合并到上述烧杯中,用高纯N2吹至恒重。按式(3)计算总脂含量:
| $ \omega = \frac{{{M_1}}}{{{M_0}}} \times 100\% 。$ | (3) |
式中:ω为总脂的百分含量(%);M0为藻粉干重(g);M1为粗脂重(g)。
1.3.5 油脂产率(LP)计算| $ LP = \frac{{\left( {{D_t} - {D_0}} \right)\cdot\omega }}{t}。$ | (4) |
式中:Dt、D0为培养开始和结束时的藻生物量(g·L-1);ω为油脂百分含量(%)。
1.4 化学指标测定无机氮:分别采用纳氏试剂分光光度法[16]、紫外分光光度法[17]、萘乙二胺分光光度法[18]测定氨氮、硝态氮、亚硝态氮的浓度,三者之和为无机氮浓度。
磷酸盐:样品不进行消解,直接采用钼酸铵分光光度法[19]测定。
1.5 营养盐的去除量(△C)和去除率(η)分别按式(5)和式(6)计算:
| $ \Delta C = {C_0} - {C_t},$ | (5) |
| $ \eta = \frac{{\Delta C}}{{{C_0}}} \times 100\% 。$ | (6) |
式中C0和Ct分别为培养前和培养结束后营养盐的浓度(mg·L-1)。
1.6 数据统计与分析各指标测定的结果均以3次重复测定值的“平均值±标准差”(mean±SD)表示。使用Origin9.0绘图。使用SPSS17.0软件进行数据分析。采用双变量Pearson相关性分析,探究藻生物量、总脂含量与营养盐初始浓度、去除量之间的关系,统计显著性水平为P < 0.05和P < 0.01。
2 结果 2.1 淡水微拟球藻在不同EDR尾水中的生长和生物量由图 1可见,淡水微拟球藻在两家STP的尾水中均可生长,各处理组的藻细胞密度随时间延长不断增加,未出现延滞期,但是变化幅度因尾水来源和EDR的不同而异:在TD-STP尾水的5个处理组中(见图 1(a)),微藻生长较快,培养结束时的藻细胞密度在(475.9~598.6)×104 cells·mL-1之间,比生长速率(r)总体上随着稀释程度的增大(即EDR减小)而降低,最大值(0.191 d-1)出现在EDR100%(即未经稀释的尾水)处理组中(见表 2)。在LC-STP尾水的5个处理组中,微藻生长较慢,培养结束时的藻细胞密度在(323.2~488.5)×104 cells·mL-1之间,只有EDR100%处理组的r值(0.165 d-1)较大,为TD-STP尾水相应EDR处理组的86.4%,随着EDR减小,r值总体上呈降低态势(P < 0.05)(见图 1(b)和表 2)。
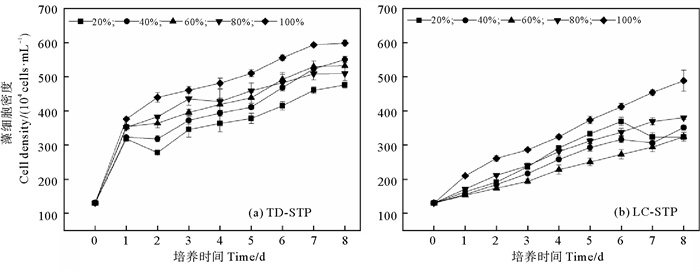
|
图 1 淡水微拟球藻在不同稀释比尾水中的生长曲线 Fig. 1 Growth curves of Nannochloropsis sp. MASCC 11 in effluents with different EDRs |
|
|
表 2 不同EDR尾水中淡水微拟球藻的比生长速率 Table 2 Specific growth rates (r) of Nannochloropsis sp. MASCC 11 in effluents with different EDRs |
根据图 2,在5种EDR的TD-STP尾水中培养8 d后,淡水微拟球藻的生物量在0.161~0.287 g·L-1之间,最大值仍出现在EDR100%处理组中,显著高于其它EDR处理组(P < 0.05)。同样,在LC-STP尾水培养体系中,EDR100%处理组的藻生物量最大(0.197 g·L-1),而且显著大于其它处理组。当EDR相等时,LC-STP尾水处理组的藻生物量总是低于TD-STP尾水处理组,差值在0.041~0.103 g·L-1之间。
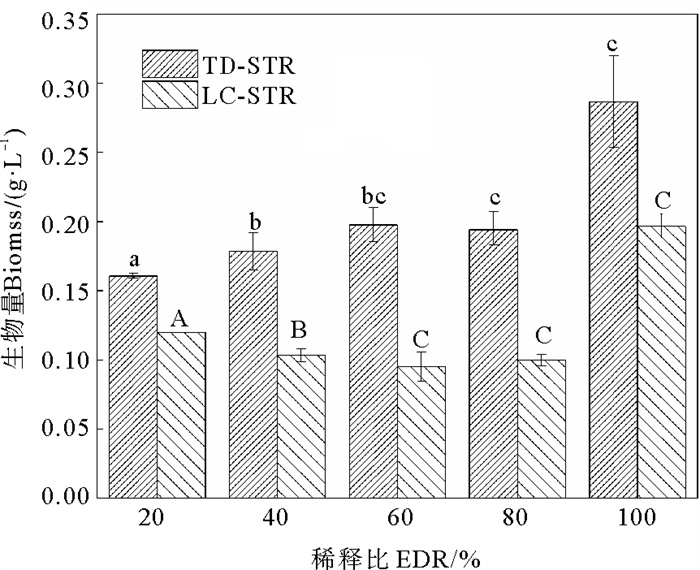
|
( 不同字母表示差异显著(P < 0.05)。Different letters indicate statistically significant differences (P < 0.05). ) 图 2 淡水微拟球藻在不同EDR尾水中培养8 d后的生物量 Fig. 2 Biomass of Nannochloropsis sp. MASCC 11 cultured in effluents with different EDRs for 8 days |
由表 3可见,TD-STP尾水培养的微藻中,油脂含量总体上随着EDR的增大而降低,最低值(29.30%)出现在EDR100%处理组,最高值出现在EDR20%处理组(41.35%)。LC-STP尾水各处理组的微藻油脂含量之间无显著差异(P>0.05)。但是,从微藻的油脂产率看,最大值均出现在2种尾水的EDR100%处理组中,且TD-STP尾水中的油脂产率(10.50 mg·L-1·d-1)为LC-STP尾水的1.37倍。
|
|
表 3 淡水微拟球藻的油脂含量和油脂产率随EDR的变化 Table 3 Lipid contents and lipid productivities of Nannochloropsis sp. MASCC 11 cultivated in effluents as a function of EDRs |
图 3显示了微藻接种于各尾水处理组中培养8 d后的无机氮剩余浓度和去除量。从图中可见,无机氮去除量总体上随EDR的增大而增多,其去除率在TD-STP尾水中基本保持在60%左右,而LC-STP尾水EDR较小的处理组中无机氮去除率较高(66.7%~70.1%),在EDR较大的处理组中则明显偏低(35.8%~45.4%)。
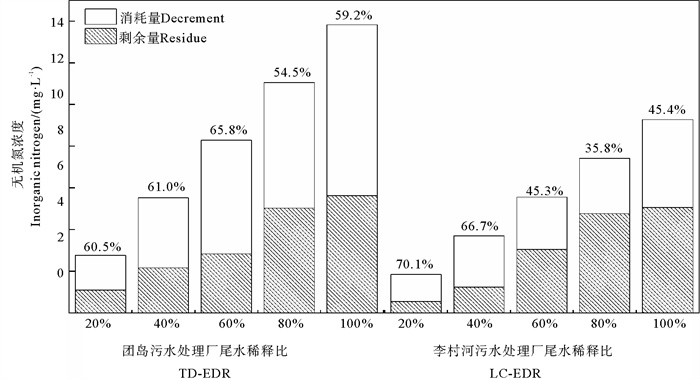
|
( 百分数代表无机氮的去除率。Percentages represent the removal rates of inorganic nitrogen by microalgae. ) 图 3 淡水微拟球藻对TD-STP(左)和LC-STP(右)尾水中无机氮的去除 Fig. 3 Removal of inorganic nitrogen from TD-STP (left) and LC-STP (right) by Nannochloropsis sp. MASCC 11 |
根据图 4,培养8 d后,LC-STP尾水各处理组的无机磷均未检出(即:去除率均达到100%);TD-STP尾水各处理组的无机磷去除率均高于80%,在EDR80%处理组中甚至达到99.4%。
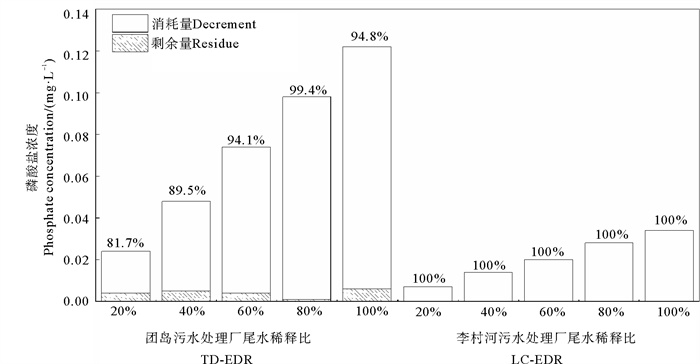
|
( 百分数代表磷酸盐的去除率。Percentages represent the removal rates of phosphate by microalgae. ) 图 4 淡水微拟球藻对TD-STP(左)和LC-STP(右)尾水中磷酸盐的去除 Fig. 4 Removal of phosphate from TD-STP (left) and LC-STP (right) by Nannochloropsis sp. MASCC 11 |
根据上述结果进行的相关性分析发现(见表 4),每种尾水中无机氮、磷的初始浓度均与藻生物量呈显著正相关(P < 0.01或P < 0.05),而与微藻油脂含量呈负相关(在TD-STP尾水中达到显著水平,P < 0.01)。同样,无机氮、磷的去除量与藻生物量、油脂含量之间也存在类似相关性。与LC-STP尾水相比,TD-STP尾水中氮磷指标与生物学指标之间具有较好的相关性。
|
|
表 4 尾水中营养盐初始浓度、利用量与微藻生物量、油脂含量的相关性 Table 4 Correlations between the initial concentration and utilization quantity of nutrients with microalgal biomass and lipid content |
氮和磷均为微藻生长的必需营养物质[20],相应的,配制微藻培养基(BG11[13]、BBM[21]等)时,必须加入氮盐(多为硝酸盐)和磷盐(多为磷酸氢盐)。例如,在BG11培养基中,NO3- -N的浓度为247.1 mg·L-1,PO43- -P的浓度为9.2 mg·L-1,二者的比值(N/P)为26.9。根据之前的研究[22],将该微藻(初始密度为1.5×106 cells·mL-1,与本研究的1.3×106 cells·mL-1十分接近)接种于BG11培养基中,在同样的培养条件下培养10 d,测得生物量为0.44 g·L-1,r值为0.27 d-1。
本研究所用的STP尾水中氮磷营养盐浓度(TD-STP尾水含无机氮13.83 mg·L-1、PO43- -P 0.122 mg·L-1;LC-STP尾水中二者浓度分别为9.27和0.034 mg·L-1,大大低于BG11培养基(相差1~2个数量级)。即便如此,淡水微拟球藻仍可在2种尾水中生长(见图 1),而且在未经稀释的尾水(EDR=100%)中生长较快,培养8 d后的生物量分别达到上述BG11培养基中藻生物量[22]的65.23%和44.77%,r值分别为70.74%和61.11%。换言之,这些STP尾水可以替代传统培养基用于微藻培养。
微藻在LC-STP尾水中生长较慢(见图 1、2和表 2),原因有两个:①该尾水中无机氮、磷酸盐的初始浓度较低,而这两种营养盐的初始浓度均与藻生物量呈显著正相关(见表 4)。特别是,该尾水中浓度过低的磷酸盐(仅约为TD-STP尾水的1/4)在培养期间会很快被微藻吸收而耗尽。这从图 4可清晰看到:培养结束时,各EDR处理组中的磷酸盐均未被检出,而TD-STP尾水各EDR处理组中尚残存少量磷酸盐。由此推测,LC-STP尾水中磷酸盐在培养结束前已不存在,使微藻处于磷饥饿状态。已有研究证明[23],与氮饥饿相比,磷饥饿对微藻生长的抑制作用更大。这是因为,磷不仅参与碳水化合物在藻细胞内不同细胞器之间的转运,更重要的是直接参与能量(如ATP)的代谢。②两家STP所接纳处理的废水种类不同。据调查,TD-STP主要处理生活污水,而LC-STP主要处理工业废水。虽然两厂均采用二级处理工艺,但是尾水中有害物质的残余浓度可能存在很大差异。众所周知,与生活污水相比,工业废水中一般含有较多的重金属和难降解有机污染物。我国现行的《城镇污水处理厂污染物排放标准》(GB18918—2002)[1]中的基本控制项目并未包括重金属和有机污染物指标,而大多数集中式污水处理厂在设计污水处理工艺时也未将重金属作为进出水的水质指标[24]。这就使得以处理工业废水为主的STP尾水中有毒物质浓度较高。有关重金属、有机污染物对微藻生长的不利影响已有很多报道[25],例如,Cd2+能抑制叶绿素合成、引起藻细胞内活性氧(ROS)积累进而造成细胞氧化损伤等。再如,前期研究发现[26],当STP尾水中红霉素(一种抗生素)浓度达到100 μg·L-1时,斜生栅藻(Tetradesmus obliquus)的生长会受到明显抑制。因此,微藻在LC-STP尾水中生长缓慢和生物量较低,可能是磷饥饿和有毒物质共同作用的结果。今后的研究应加强2种尾水中有毒物质种类、浓度的比较,以确定影响微藻油脂合成的污染因子。
3.2 STP尾水的来源及其稀释比对淡水微拟球藻油脂合成影响很大对于TD-STP尾水,EDR较低(20%、40%)的处理组中微藻的油脂含量较高。这主要是因为,较大程度的稀释造成尾水中营养盐初始浓度降低。表 4的结果支持这种判断:该尾水的初始氮、磷浓度均与微藻的油脂含量呈显著负相关(P < 0.05)。很多研究已证实[23, 27-28],氮、磷缺乏造成的胁迫会促进藻细胞中的脂质积累。而且氮、磷的缺乏程度越大,微藻越容易积累油脂[27],严重逆境胁迫下微藻将以脂质(而非淀粉)作为主要储能物质,这有利于抵御外界环境变化,实现机体自我保护[22]。但是,在LC-STP尾水的各处理组中,这种负相关性并不显著(即:油脂含量并未随着EDR降低而明显增加)。这是因为,虽然LC-STP尾水中初始浓度较低的营养盐有利于油脂积累,但是尾水中较多的有害物质(见3.1节的分析)可能会抑制油脂合成。有研究指出[25],某些重金属在中、低浓度时能够促进微藻合成油脂,而过高浓度的重金属反而抑制油脂合成。例如,杨金水等[25]报道,将产油微藻(Auxenochlorella protothecoides UTEX 2341)在含Cd2+的IM培养基中培养7 d,当Cd2+浓度在0.6~3 mmol/L(即0.067~0.336 mg·L-1)的范围内时,微藻的油脂产量随Cd2+浓度增大逐渐增加,但是当Cd2+浓度继续增大时,油脂产量显著降低。至于LC-STP尾水中哪些有毒物质能够抑制微藻中油脂的合成,则需要通过全面的水质监测确定浓度较高的有毒成分,进而逐一进行它们对微藻油脂合成的影响试验才能确定。
Li等[29]将养猪废水(NH4+-N:(477±3) mg·L-1、TN:(519±7) mg·L-1、PO43--P:(31±1) mg·L-1)与厌氧消化后的养猪废水(NH4+-N:(720±6)mg·L-1、TN:(792±4)mg·L-1、PO43--P:(33±0.1) mg·L-1)分别按不同比例(5%~20%和2.5%~10%)稀释后,用于培养链带藻(Desmodesmus sp. EJ8-10),14 d后,各处理组的油脂含量在18.7%~28%左右,油脂产率在2.9~5.7 mg·L-1·d-1。与之相比,本研究使用的STP尾水中氮磷浓度远低于上述文献中的养殖废水,但是接种淡水微拟球藻培养8 d后能够获得更高的油脂含量与油脂产率。这表明STP尾水比养殖废水更适于产油微藻培养,而且,培养周期缩短意味着培养装置体积和占地面积的减少,有利于降低基建投资。还有学者[30]在TAP培养基中额外添加甲醇与乙醇(各10 g·L-1),进行异养微藻培养,18 d后,两个试验组的油脂产率分别为9.4与8.9 mg·L-1·d-1,低于本研究中未经稀释的TD-STP尾水处理组水平(10.5 mg·L-1·d-1)。这也说明廉价的STP尾水在培养产油微藻方面具有较大优势。在TD-STP尾水各处理组中,虽然EDR 100%处理组的微藻油脂含量最低,但是油脂产率却最大,这是由于该处理组的藻生物量最高所致。另外注意到,与之前采用BG11培养基培养同种微藻时的油脂含量(20.58%)[22]相比,所有尾水处理组的微藻油脂含量(29.30%~41.35%)均明显提高。可见,利用尾水替代传统培养基培养微藻,能够促进油脂合成。这其中固然有氮磷营养盐缺乏的贡献,但是与氮磷共存的成分也可能影响到油脂的合成,需要进一步研究才能明确。
3.3 微藻作用下STP尾水中氮磷的去除在未经稀释(即EDR=100%)情况下,TD-STP尾水中的无机氮、磷浓度分别为13.83和0.12 mg·L-1,LC-STP尾水中无机氮、磷浓度分别为9.04和0.03 mg·L-1,其它EDR处理组中无机氮、磷的初始浓度随EDR减小而相应降低。接种微藻8 d后,各处理组的无机氮、磷均有明显去除。营养盐去除的机制包括微藻同化作用及其介导的物理化学过程两方面[31]:①微藻可以直接吸收尾水中的NH4+-N(含NO2- -N和NO3--N转化生成的NH4+ -N)和正磷酸盐(磷在污水中的存在形式之一[32]),并利用外部光照和空气中CO2进行光合作用,合成微藻自身的生物质。②光合过程必然伴随着体系pH的升高[33],当pH值大于9时,氨挥发和磷酸盐沉淀等过程会对营养盐去除产生较大影响[34-35]。有研究认为,氨挥发可造成废水中高达32%的无机氮去除[36]。Wang和Lan[37]认为,废水中初始浓度高的NH4+有利于pH值稳定,因为微藻对NH4+的吸收会引起pH值下降,从而阻止pH值上升。但是,本研究所用的STP尾水中NH4+ -N浓度不足4 mg·L-1,在微藻培养1 d后即观察到pH上升,第2天以后基本维持在pH=10.5(TD-STP尾水)和pH=10.0(LC-STP尾水)左右(数据未列出)。因此认为,微藻对NH4+ -N的吸收利用和氨挥发共同造成尾水中无机氮的去除。至于培养结束后EDR100%的处理组中无机氮尚有一定剩余、而磷酸盐已基本耗尽,主要是由于尾水中的初始N/P比(质量浓度比:TD-STP 115.3、LC-STP 265.9)过高所致。Zhang等[38]利用人工配制的模拟尾水培养小球藻(Chlorella sp. HQ)30 d发现,最适于尾水中营养盐去除的初始N/P范围为8~20;当控制N的初始浓度为15 mg·L-1、而P的浓度由1.3 mg·L-1逐渐降为0.3 mg·L-1时,N的去除率将由90.7%减少为72.4%。由此可见,在利用STP尾水培养微藻时,通过调整污水处理工艺,优化STP尾水中的氮磷含量及比例,将降低初始N/P比而使无机氮去除效果得到明显改善。此外,培养期间并未观察到体系中生成沉淀物,这与Diniz等[33]的试验结果相同,可能是由于尾水中磷酸盐初始浓度较低以及微藻的快速吸收所致。
3.4 利用STP尾水培养产油微藻与深度净化尾水的可行性在以处理生活污水为主的STP所排尾水中,产油微藻可以快速生长并获得较高油脂产率。利用这种培养介质替代传统培养基,能够大大降低产油微藻的养殖耗费(因为无需专门提供水源和投入养分),由此可使藻基生物柴油的生产成本降低40%左右[7],有利于缩小藻基生物柴油与石油来源的柴油在价格上的差距,加快实现其商业化生产的目标。此外,这种举措能够在不改变污水处理厂现有工艺流程(只需将尾水转入含微藻的反应器中即可)的基础上,进一步去除尾水中的氮磷营养盐,降低尾水受纳水域的污染负荷,获得经济和环境的双赢效果。今后应在适当增大培养规模的基础上,通过微藻收获、油脂提取、转酯化过程,获得生物柴油成品,进而根据整个过程中的原材料消耗量、产品生成量以及市场价格,进行效费分析,以系统评价STP尾水替代传统培养基的经济效益和环境效益。
4 结论(1) STP尾水中无机氮、磷酸盐的浓度虽然远低于BG11培养基,但仍能支持淡水微拟球藻的生长,而且微藻在未经稀释的尾水中更具生长优势,在相似的培养条件下,TD-STP和LC-STP尾水中的藻生物量可分别达到BG11培养基的65.23%和44.77%。
(2) 在稀释后的STP尾水中,营养盐较为缺乏,有利于微藻细胞中脂质的积累,但是油脂产率仍以未经稀释的尾水处理组最高,其中,微藻在TD-STP尾水中的油脂产率达到LC-STP尾水的1.37倍。
(3) 在微藻作用下,未经稀释TD-STP和LC-STP尾水中磷酸盐的去除率达到94.8%以上,而无机氮去除率较低(59.2%和45.4%),这可能与尾水的初始N/P较高有关。
| [1] |
国家环境保护总局, 国家质量监督检验检疫总局. GB18918—2002城镇污水处理厂污染物排放标准[S]. 北京: 中国环境科学出版社, 2002. State Environmental Protection Administration, General Administration of Quality Supervision, Inspection and Qurantine of the People's Republic of China. GB18918—2002 Discharge Standard of Pollutants for Municipal Wastewater Treatment Plant[S]. Beijing: China Environmental Science Press, 2002. (  0) 0) |
| [2] |
中国产业信息网. 2017年中国污水处理行业发展趋势分析[EB/OL].
https://www.sohu.com/a/208688936_698856.2020. China Industry Information Network. Analysis on the Development Status and Trend of China's Sewage Treatment Industry in 2017[EB/OL]. https://www.sohu.com/a/208688936_698856.2020. (  0) 0) |
| [3] |
Almomany F A, Örmeci B. Performance of Chlorella vulgaris, Neochloris oleoabundans, and mixed indigenous microalgae for treatment of primary effluent, secondary effluent and centrate[J]. Ecological Engineering, 2016, 95: 280-289. DOI:10.1016/j.ecoleng.2016.06.038
(  0) 0) |
| [4] |
Singh J, Gu S. Commercialization potential of microalgae for biofuels production[J]. Renewable and Sustainable Energy Reviews, 2010, 14: 2596-2610. DOI:10.1016/j.rser.2010.06.014
(  0) 0) |
| [5] |
Behzadi S, Farid M M. Review: Examining the use of different feedstock for the production of biodiesel[J]. Asia-Pacific Journal of Chemical Engineering, 2007, 2(5): 480-486. DOI:10.1002/apj.85
(  0) 0) |
| [6] |
Ji F, Liu Y, Hao R, et al. Biomass production and nutrients removal by a new microalgae strain Desmodesmus sp. in anaerobic digestion wastewate[J]. Bioresource Technology, 2014, 161: 200-207. DOI:10.1016/j.biortech.2014.03.034
(  0) 0) |
| [7] |
Gouveia L, Oliveira A C. Microalgae as a raw material for biofuels production[J]. Journal of Industrial Microbiology & Biotechnology, 2009, 36(2): 269-274.
(  0) 0) |
| [8] |
Chisti Y. Biodiesel from microalgae beats bioethanol[J]. Trends in Biotechnology, 2008, 26(3): 126-131. DOI:10.1016/j.tibtech.2007.12.002
(  0) 0) |
| [9] |
Jinkerson R E, Radakovits R, Posewitz M C. Genomic insights from the oleaginous model alga Nannochloropsis gaditana[J]. Bioengineered, 2013, 4: 37-43. DOI:10.4161/bioe.21880
(  0) 0) |
| [10] |
Rodolfi L, Zittelli G C, Bassi N, et al. Microalgae for Oil: Strain selection, induction of lipid synthesis and outdoor mass cultivation in a low-cost photobioreactor[J]. Biotechnology and Bioengineering, 2009, 102: 100-112. DOI:10.1002/bit.22033
(  0) 0) |
| [11] |
Nogueira N, Nascimento F J A, Cunha C, et al. Nannochloropsis gaditana grown outdoors in annular photobioreactors: Operation strategies[J]. Algal Research, 2020, 48: 101913. DOI:10.1016/j.algal.2020.101913
(  0) 0) |
| [12] |
Fawley K P, Fawley M W. Observations on the diversity and ecology of freshwater Nannochloropsis (Eustigmatophyceae), with descriptions of new taxa[J]. Protist, 2007, 158: 325-336. DOI:10.1016/j.protis.2007.03.003
(  0) 0) |
| [13] |
Gang L, Fang J, Shunan X, et al. Analytical study on pyrolyzed products of Desmodesmus spcultivated in BG11[J]. International Journal of Agricultural and Biological Engineering, 2017, 10(3): 218-226.
(  0) 0) |
| [14] |
Ho S, Chen C, Chang J. Effect of light intensity and nitrogen starvation on CO2 fixation and lipid/carbohydrate production of an indigenous microalga Scenedesmus obliquus chw-n[J]. Bioresource Technology, 2012, 113: 244-252. DOI:10.1016/j.biortech.2011.11.133
(  0) 0) |
| [15] |
Dyer W J, Bligh E G. A rapid method of total lipid extraction and purification[J]. Canadian Journal of Biochemistry and Physiology, 1959, 37(8): 911-917. DOI:10.1139/o59-099
(  0) 0) |
| [16] |
环境保护部. HJ 535-2009水质氨氮的测定纳氏试剂分光光度法[S]. 北京: 中国环境科学出版社, 2009. Ministry of Environmental Protection of the People's Republic of China. HJ 535-2009 Water Quality-Determination of Ammonia Nitrogen-Nessler's Reagent Spectrophotometry[S]. Beijing: China Environmental Science Press, 2009. (  0) 0) |
| [17] |
国家环境保护局. GB 7493-87水质亚硝酸盐氮的测定分光光度法[S]. 北京: 中国环境科学出版社, 1987. State Bueau of Environmental Protection. GB 7493-87 Water quality-determination of nitrogen(nitrite)-spectrophotometric method[S]. Beijing: China Environmental Science Press, 1987. (  0) 0) |
| [18] |
国家环境保护总局. HJ/T 346-2007水质硝酸盐氮的测定紫外分光光度法[S]. 北京: 中国环境科学出版社, 2007. State Environmental Protection Administration. HJ/T 346-2007 Water Quality-Determination of Nitrate-Nitrogen-Ultraviolet Spectrophotometry[S]. Beijing: China Environmental Science Press, 2007. (  0) 0) |
| [19] |
国家环境保护局. GB 11893-89水质总磷的测定钼酸铵分光光度法[S]. 北京: 中国环境科学出版社, 1989. State Bueau of Environmental Protection. GB 11893-89 Water Quality-Determination of Total Phosphorus-Ammonium Molybdate Spectrophotometric Method[S]. Beijing: China Environmental Science Press, 1989. (  0) 0) |
| [20] |
姜登岭, 马轩凯, 倪国蒇. 氮磷对陡河水库藻类生长的影响[J]. 河北理工大学学报(自然科学版), 2010, 31(1): 98-101. Jiang D L, Ma X K, Ni G C. Effect on algae growth in Douhe Reservoir[J]. Journal of Hebei Polytechnic University(Natural Science Edition), 2010, 31(1): 98-101. DOI:10.3969/j.issn.1674-0262.2010.01.022 (  0) 0) |
| [21] |
Minyuk G, Sidorov R, Solovchenko A. Effect of nitrogen source on the growth, lipid and valuable carotenoid production in the green microalga Chromochloris zofingiensis[J]. Journal of Applied Phycology, 2020, 32: 923-935. DOI:10.1007/s10811-020-02060-0
(  0) 0) |
| [22] |
彭晓玲, 孟范平, 张倩, 等. 氧化石墨烯对淡水微藻生长及生物活性物质的影响[J]. 中国环境科学, 2019, 39(11): 4849-4857. Peng X L, Meng F P, Zhang Q, et al. Effects of graphene oxide on the growth and bioactive compounds in freshwater microalgae[J]. China Environmental Science, 2019, 39(11): 4849-4857. DOI:10.3969/j.issn.1000-6923.2019.11.045 (  0) 0) |
| [23] |
童牧, 于水燕, 欧阳珑玲, 等. 氮饥饿与磷饥饿促使缺刻缘绿藻花生四烯酸含量增加的比较[J]. 水产学报, 2011, 35(5): 763-773. Tong M, Yu S Y, Ouyang L L, et al. Comparison of increased arachidonic acid content in Myrmecia incisa cultured during the course of nitrogen or phosphorus starvation[J]. Journal of Fisheries of China, 2011, 35(5): 763-773. (  0) 0) |
| [24] |
刘书谐, 叶佳颖, 王方园, 等. 集中式污水厂重金属排放限值及其控制进展研究[J]. 环境科学与管理, 2017, 42(8): 67-71. Liu S X, Ye J Y, Wang F Y, et al. Research on heavy metal emission limits andIts control in centralized wastewater treatment plant[J]. Environmental Science and Management, 2017, 42(8): 67-71. DOI:10.3969/j.issn.1673-1212.2017.08.015 (  0) 0) |
| [25] |
杨金水, 孔祥雪, 李金玉, 等. 产油微藻Auxenochlorella protothecoides utex 2341对镉胁迫的生理响应及抗性机理[J]. 微生物学通报, 2019, 46(10): 2504-2511. Yang J S, Kong X X, Li J Y, et al. Physiological response and resistance mechanism of oleaginous microalgae Auxenochlorella protothecoides utex 2341 under cadmium treatment[J]. Microbiology China, 2019, 46(10): 2504-2511. (  0) 0) |
| [26] |
Du S, Dou X, Meng F, et al. Effects of two common antibiotics on the growth and lipid production of Tetradesmus obliquus cultivated in the effluent of municipal wastewater treatment plant[J]. Journal of Applied Phycology, 2020, 32: 389-397. DOI:10.1007/s10811-019-01945-z
(  0) 0) |
| [27] |
Li X, Hu H Y, Gan K, et al. Effects of different nitrogen and phosphorus concentrations on the growth, nutrient uptake, and lipid accumulation of a freshwater microalga Scenedesmus sp[J]. Bioresource Technology, 2010, 101: 5494-5500. DOI:10.1016/j.biortech.2010.02.016
(  0) 0) |
| [28] |
Singh B, Guldhe A, Rawat I, et al. Towards a sustainable approach for development of biodiesel from plant and microalgae[J]. Renewable and Sustainable Energy Reviews, 2014, 29: 216-245. DOI:10.1016/j.rser.2013.08.067
(  0) 0) |
| [29] |
Li G, Zhang J, Li H, et al. Towards high-quality biodiesel production from microalgae using original and anaerobically-digested livestock wastewater[J]. Chemosphere, 2021, 273: 128578. DOI:10.1016/j.chemosphere.2020.128578
(  0) 0) |
| [30] |
崔伟, 徐晶萍, 芦文城, 等. 异养产油微藻筛选及其在盐胁迫下的油脂累积特性研究[J]. 浙江海洋大学学报(自然科学版), 2018, 37(6): 505-508. Cui Wei, Xu Jingping, Lu Wencheng, et al. Characteristic stady on screening of heterotrophic oil prodacing microalgae and their oil accumulation under salt stress[J]. Zhejiang Ocean University(Natural Science Edition), 2018, 37(6): 505-508. DOI:10.3969/j.issn.1008-830X.2018.06.006 (  0) 0) |
| [31] |
Sutherland D L, Howard-Williams C, Turnbull M H, et al. The effects of CO2 addition along a pH gradient on wastewater microalgal photo-physiology, biomass production and nutrient removal[J]. Water Research, 2015, 70: 9-26. DOI:10.1016/j.watres.2014.10.064
(  0) 0) |
| [32] |
Gupta S K, Ansari F A, Shriwastav A, et al. Dual role of Chlorella sorokiniana and Scenedesmus obliquus for comprehensive wastewater treatment and biomass production for bio-fuels[J]. Journal of Cleaner Production, 2016, 115: 255-264. DOI:10.1016/j.jclepro.2015.12.040
(  0) 0) |
| [33] |
Diniz G S, Silva A F, Araujo O Q F, et al. The potential of microalgal biomass production for biotechnological purposes using wastewater resources[J]. Journal of Applied Phycology, 2017, 29: 821-832. DOI:10.1007/s10811-016-0976-3
(  0) 0) |
| [34] |
Azov Y, Goldman J C. Free ammonia inhibition of algal photosynthesis in intensive cultures[J]. Applied and Environmental Microbiology, 1982, 43: 735-739. DOI:10.1128/aem.43.4.735-739.1982
(  0) 0) |
| [35] |
Park J B K, Craggs R J. Wastewater treatment and algal production in high rate algal ponds with carbon dioxide addition[J]. Water Science and Technology, 2010, 61(3): 633-639. DOI:10.2166/wst.2010.951
(  0) 0) |
| [36] |
Garcia J, Mujeriego R, Hernandez-Marine M. High rate algal pond operating strategies for urban wastewater nitrogen removal[J]. Journal of Applied Phycology, 2000, 12: 331-339. DOI:10.1023/A:1008146421368
(  0) 0) |
| [37] |
Wang B, Lan C Q. Biomass production and nitrogen and phosphorus removal by the green alga Neochloris oleoabundans in simulated wastewater and secondary municipal wastewater effluent[J]. Bioresource Technology, 2011, 102: 5639-5644. DOI:10.1016/j.biortech.2011.02.054
(  0) 0) |
| [38] |
Zhang Q, Hong Y. Effects of stationary phase elongation and initial nitrogen and phosphorus concentrations on the growth and lipid-producing potential of Chlorella sp. HQ[J]. Journal of Applied Phycology, 2014, 26: 141-149. DOI:10.1007/s10811-013-0091-7
(  0) 0) |
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China
 2022, Vol. 52
2022, Vol. 52


