2. 唐山学院基础教学部,河北 唐山 063000
河流是海洋污染的主要来源。最近几十年来,沿海和河口地区的工业化使得进入河流和海洋的污染物数量大大增加。许多污染物因其毒性、持久性、生物蓄积性以及在食物链中的生物放大作用,会造成较大的健康风险[1]。重金属因其不可降解性而受到人们关注,海洋生物吸收的重金属进一步向高营养级生物转移,并通过受污染的海产品进入人体而产生毒害[2-4]。东营市位于山东省东北部,是中国一座典型的石油化工城市。境内有30条骨干排水河道,对于城市景观水系供排水、城市防洪排涝和改善河道两岸生态环境十分重要[5],但是,也会将城市的工业废水和生活污水输送入海。广利河、神仙沟河和挑河均为省控重点河流,其中,广利河入海口位于东营市东营区,属于向海排放生活污水的市政类入海排污口;神仙沟河入海口位于东营市河口区,属于向海排放工业废水的工业类入海排污口;挑河入海口位于利津县刁口乡,属于向海排放化工、石油炼制等废水的工业入海排污口[6]。三条河流的河口海域均有海水养殖和增养殖区分布,因此这些区域的海水水质直接影响到海产品的品质,并最终影响到消费者的身体健康。虽然有文献报道过2005—2008年这些河流入海排污口的水质状况[6],但是,有关其河口区域海水重金属污染特征的研究未见报道。
目前对于水体中重金属的风险评价主要是各种指数方法,如单因子污染指数法和内梅罗指数法[7]。近年来随着物种敏感度分布(SSDs)理论的发展,许多学者开始采用SSD与实测数据相结合的概率方法评价水体中重金属的生态危害[8]。这种基于SSD理论的生态风险主要是通过比较暴露数据与毒性数据进行表征的,表征的方法包括简单的风险商HQs法[9]和相对复杂的概率生态风险评价法,如联合概率曲线法(JPCs)[10-11]。HQs通常用于污染物生态风险评价的初级筛序阶段,而JPCs被认为是细化HQs的高层次方法[10, 12]。Chen[13]分别采用急性和慢性毒性数据,构建了9种污染物(7种金属和2种非金属)的SSDs曲线,并结合实测浓度构建JPCs评价了中国台湾北部基隆河中污染物的生态风险,发现Zn和Cu的风险最高,有机物的风险可忽略。Mu等[14]采用HQ、概率风险商和JPCs评价了渤海湾表层水中Cd的生态风险,结果表明Cd对3个主要海湾生态风险大小顺序为辽东湾>渤海湾>莱州湾,总体上整个渤海的生态风险水平可接受。
本研究于2015年8月监测了东营市广利河、神仙沟河、挑河三个河口表层海水中重金属As, Cd, Cr6+, Cu, Hg, Pb, Zn的含量,利用重金属的暴露数据和生物毒性数据,采用HQs和JPCs方法相结合,评价了7种重金属对三个河口附近海域的生态风险,为这3个河口区域的生态治理提供了科学依据。同时本研究对重金属污染来源进行了分析,提供了防治建议。
1 材料与方法 1.1 采样站位布设根据国家海洋局2002年4月发布的《江河入海污染物总量及河口区环境质量监测技术规程》规定,在每条河流的河口区域,平行于河流方向分别布设3个断面,每个断面自岸向海依次设置4个站位,即每个河口12个站位(广利河口海域采样站位编号为G01~G12;挑河河口海域采样站位编号为T01~T02;神仙沟河河口海域采样站位编号为S01~S02),总站位数为36个。具体站位分布见图 1。
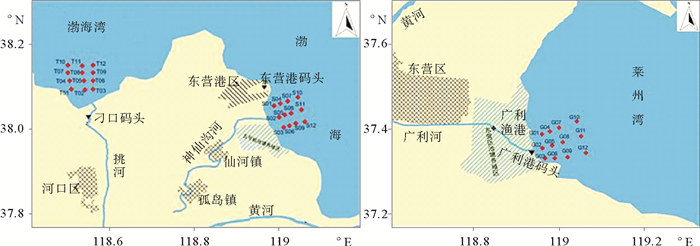
|
图 1 挑河、神仙沟河和广利河河口海水采样站位布设图 Fig. 1 Sample location map of Tiaohe, Shenxiangouhe and Guanglihe |
2015年8月,在设定的36个站位采集表层(海面下0.1~1.0 m)水样,每个站位设置3个平行样,并取其平均值作为该站位浓度值。按照《海洋监测规范第4部分:海水分析》(GB17378.4-2007),测定Hg的水样用H2SO4调pH<2后,装于硬质细口瓶中;测定其它重金属的水样经过滤后调节pH<2,装于聚乙烯瓶中。
1.3 海水分析方法与质量控制根据《海洋监测规范第4部分:海水分析》(GB17378.4-2007)的规定,As、Hg采用原子荧光法测定;Zn采用火焰原子吸收分光光度法测定;Pb、Cd和Cu采用无火焰原子吸收分光光度法测定;Cr6+采用二苯碳酰二肼分光光度法测定。使用的仪器包括:AFS-920型原子荧光分光光度计(北京吉天仪器有限公司)、M6型原子吸收分光光度计(美国热电公司)、TU-1810D型紫外-可见分光光度计(北京普析通用)。
样品测定同时,分别采用国家标准物质研究中心生产的标准物质(As:GBW08611;Hg:GBW08617;Pb:GBW08619;Cd:GBW08612;Cu:GBW08615;Zn:GBW08620;Cr: GBW08614)进行海水样品的加标分析,平行样的相对误差<5%,各标准物的加标回收率在92%~105%之间,表明分析方法的准确性和精度较好。另外,实验过程中每批样品均做全程空白,以消除在样品处理及测定过程中可能引入的污染。
1.4 毒性数据的收集7种重金属对不同营养级海洋生物的慢性毒性数据均来源于水生毒性数据库(http://cfpub.epa.gov/ecotox/)。数据筛选按照Klimisch[15]给出的可靠性、相关性和适当性原则,只选用暴露恰当时间的毒性数据。慢性毒性数据的终点指标选用无观测效应浓度(NOEC),在各个营养级中的暴露时间为:藻类和无脊椎动物≥1 d,甲壳类、鱼类、软体动物和蠕虫≥4 d。由于慢性毒性数据较少,本研究同时考虑了最大可接受毒物浓度(MATC)、最低观测效应浓度/水平(LOEC/LOEL)或无观测效应水平(NOEL)作为慢性毒性数据的候选终点指标。当同一物种,相同暴露终点、相同暴露时间具有多个数据可用时,则采用其几何均值[16]。
1.5 评价方法 1.5.1 风险商(HQ)HQ是污染物的环境暴露值和毒性值之比。HQ>1时,认为该污染物有潜在的生态风险,需进一步评价或采取风险减缓措施。HQ<1则认为其风险可接受[17-18]。计算公式如下:
| $ {\rm{HQ = EEC/PNEC}}。$ | (1) |
其中EEC为环境暴露数据。本文使用重金属暴露数据的平均值和最大值作为EEC,以表征平均情况和最不利情况下的生态风险。PNEC为预测无效应浓度,其计算公式如下:
| $ {\rm{PNEC = H}}{{\rm{C}}_{\rm{5}}}{\rm{/SF}}。$ | (2) |
其中:HC5为SSD的5%分位数; SSDs是通过拟合生物毒性数据的累计概率分布,来表征生物对污染物的敏感性[19-20]; SF为安全因子,本研究利用慢性毒性数据计算PNEC时SF取保守值5[11, 17]。
1.5.2 联合概率曲线(JPCs)JPCs以毒性数据的累积概率为自变量(即效应的强度),以暴露数据的反累积概率(即发生该效应的概率)为因变量,曲线上的点表示导致不同物种损害水平的概率[9-10]。曲线距离两坐标轴的距离大小能够反映出其风险的高低,距离越大表明其生态风险越高,曲线与两坐标轴围成的面积表征发生有害生物效应的总体风险概率(ORP),其计算公式如下[18, 21]:
| $ {\rm{ORP = }}\int_0^1 {{\rm{EXP}}\left( x \right)} {\rm{d}}x。$ | (3) |
其中:x为生物损害水平,即有100x%的物种发生有害效应; EXP(x)为发生相应有害效应的概率。
1.6 数据统计分析本研究基于Log-normal、Log-logistic、Burr Ⅲ和Weibull四种统计模型,分别对7种重金属的毒性数据和环境检测数据进行分布拟合,所有参数均采用极大似然估计。Anderson-Darling (A-D)检验用于模型的拟合优度检验[22]。SSD的拟合以及JPCs的构建均采用软件matlab(2012b)进行。
2 结果与讨论 2.1 海水中重金属的浓度范围3个河口海域的海水样品中重金属污染物浓度分布范围如图 2所示。图中每类污染物所在区域从左到右依次为广利河口、神仙沟河河口、挑河河口。图中虚线表示相应重金属污染物对应的国家二类海水水质标准。7类重金属中,Zn、Cd、As、Cr6+、Pb在3个河口均不超标;Hg在广利河口的全部站位都超标,在挑河河口和神仙沟河河口各有一个站位超标;Cu在挑河河口的全部站位超标,在广利河河口和神仙沟河河口有3个站位超标。从浓度分布的中值来看,Zn和Cd具有区域相似性,其浓度的区域分布特征为:广利河河口>神仙沟河河口>挑河河口;Hg和As具有区域相似性,其浓度的区域分布特征为:广利河河口>挑河河口>神仙沟河河口;Cr6+和Pb具有区域相似性,其浓度的区域分布特征为:挑河河口>广利河河口>神仙沟河河口。Cu具有独立的区域分布特征:挑河河口>神仙沟河河口>广利河河口。
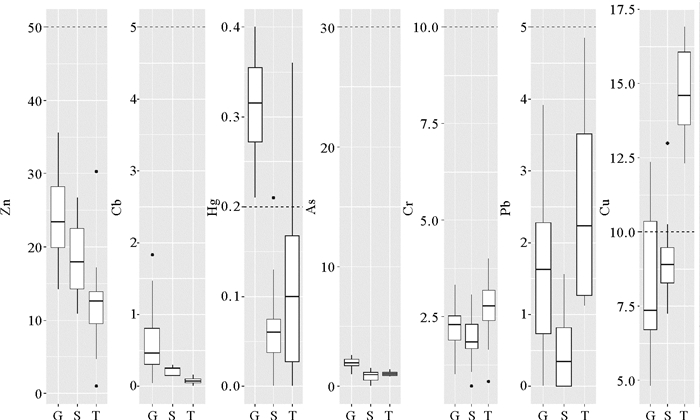
|
G:广利河河口;S:神仙沟河河口;T:挑河河口;虚线表示相应重金属对应的《海水水质标准》(GB3097-1997)第二类标准值。 G: Estuary of Guanglihe; S: Estuary of Shenxiangou; T: Estuary of Tiaohe; The dashline represents Standard Ⅱ limit of the sea water quality standard in china. 图 2 3个河口海水重金属浓度分布箱线图 Fig. 2 The concentrations of heavy metals in three estuaries |
与不同海域的海水监测结果(见表 1,除Cr6+外)相比,东营市3个河口Hg浓度处于最高污染水平,最大值分别为长江口、黄河口的2~3倍和4~5倍;As浓度与长江口、黄河口、珠江口、西班牙Huelva河口处于同一数量级,但明显低于我国大辽河河口、五里河河口和尼日利亚Ondo河口;Zn浓度与长江口、黄河口、珠江口相当,但明显低于大辽河河口、五里河河口以及国外的河口污染水平;Pb浓度为长江口、珠江口的2~4倍,与黄河口污染水平接近,但明显低于五里河河口以及国外的河口污染水平;东营市河口海水的Cd浓度总体上与国内主要河口污染水平相当(五里河河口除外),但是低于西班牙、马来西亚、尼日利亚等国家的河口污染程度;Cu浓度与长江口、马来西亚Kota Belud河口相近,但高于黄河口、珠江口、大辽河河口、五里河河口,低于国外其它河口污染水平。总体上,东营市河口海域的Hg浓度在国内居于较高水平(缺少国外的相关文献),其它污染物则处于中等水平。
|
|
表 1 本研究区域与国内外其它河口的海水重金属浓度比较 Table 1 The concentrations of heavy metals in our study contrast with other estuaries spaces |
根据1.4的筛选原则共获得7种重金属对海洋生物的慢性毒性数据336个,其中As, Cd, Cr6+, Cu, Hg, Pb和Zn分别为23, 51, 38, 123, 20, 29和52个。每种重金属的毒性数据集基本上都涵盖了海洋生态系统的6个主要功能群:藻类、甲壳类、无脊椎动物、鱼类、软体动物和蠕虫类(见表 2),均满足USEPA(1985)[29]规定的“3门8科”的要求。A~D检验的结果显示,相较于其它三种分布,Log-logistic分布均能较好地拟合7种重金属的慢性毒性数据以及环境检测数据,其A-D检验的P值均大于0.05,拟合效果良好[17]。
|
|
表 2 重金属毒性数据在不同类群海洋生物中的样本量 Table 2 Data size of available toxicity in different taxonomic categories for heavy metals |
3个河口重金属区域表层海水中重金属的风险商及其相关参数见表 3。在广利河河口,除Pb的HQM<1外,其它6种重金属均大于1,尤其是Cu的HQM达到了48.08,表明平均情况下Pb的生态风险可接受,其余6种重金属均具有潜在生态风险,尤其是Cu。在挑河河口,As和Cd的HQmax均小于1,表明即使在最不利情况下,其对海洋生态系统的风险都可接受。Hg在平均情况下其生态风险可接受(HQM=0.52),而在最不利情况下具有潜在生态风险(HQmax=1.67)。Cr6+, Cu, Pb和Zn的HQM的范围为1.26~84.63,表明平均情况下具有一定的生态风险。在神仙沟河河口,As, Cd, Hg和Pb的HQmax范围为0.58~0.97,表明即使在最不利情况下其生态风险都可接受。
|
|
表 3 三个河口区域表层海水中重金属的风险商及其相关参数 Table 3 HQs and associated parameters for heavy metals in the surface seawater near the three estuaries |
其余三种重金属的HQM范围为3.13~52.30,表明平均情况下Cr6+, Cu和Zn具有一定的潜在生态风险。总体上,根据平均情况下具有潜在生态风险(HQM>1)的重金属个数可见,三个河口的总体污染水平由高到低依次为:广利河河口>挑河河口>神仙沟河河口。Cu的潜在生态风险最大,其次为Cr6+和Zn。
HQs法具有计算简单、对数据要求低等优势,通常用于污染物生态风险评价的初级筛序阶段[10]。然而本研究HQ的计算只用到了暴露数据的平均值和最大值,以及由毒性数据所得的PNEC,忽略了环境暴露数据和生物毒性数据的实际分布特征,无法定量表征产生有害生物效应的概率。另一方面PNEC的计算一般采用保守的安全系数SF(本研究SF=5),其结果存在“过保护”倾向,HQ>1并不一定表明具有真正的生态风险[10]。因此需要采用JPCs方法来细化生态风险。
图 3列出了3个河口区域海水重金属的JPCs。由图可知对于HQ结果中风险较大的Cu, Cr6+和Zn来说,其在3个河口的JPC相对于坐标的距离也大于其它四种重金属,表明其生态风险相对较大。美国、荷兰等国家通常将环境生物保护水平定为95%,即当污染物对生物群落的总体风险不高于0.05时是可以接受的,反之则不可接受[30]。Cu和Cr6+在3个河口区域的ORPs范围分别为0.183~0.247和0.061~0.070,均超过了0.05的保护水平,具有一定的生态风险(见表 4)。Zn在广利河和神仙沟河河口的ORPs分别为0.093和0.087,具有一定的生态风险,而在挑河河口的生态风险可接受(ORP=0.022)。对于HQ结果中风险较小的As, Cd, Hg和Pb,其在3个河口区域的ORP均小于0.05的管理水平,生态风险可接受。
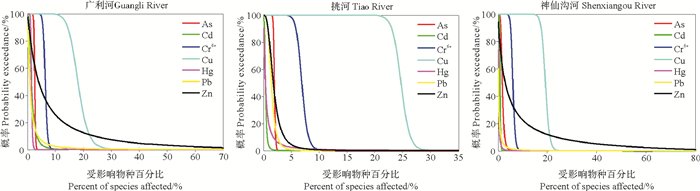
|
图 3 3个河口海水重金属的联合概率曲线(JPCs) Fig. 3 The JPCs of heavy metals in three estuaries |
|
|
表 4 三个河口海域表层海水中重金属的总体风险概率(ORPs) Table 4 The overall risk probability (ORP) calculated from JPCs for heavy metals near the three estuaries |
综合HQs和JPCs的结果,As, Cd, Hg和Pb对3个河口海域的生态风险可接受,Cu, Cr6+和Zn不可接受。Cu, Cr6+和Zn对广利河和神仙沟河河口海域的生态风险大小顺序均为Cu>Zn>Cr6+,对挑河河口为Cu>Cr6+>Zn,其中Cu为3个河口海域的主要污染物。
即使采用高层次的概率方法对生态风险进行细化,其结果也会存在一定的不确定性[20]。首先,海水的一些物理化学参数(如pH,硬度,溶解有机碳以及悬浮颗粒物含量等)都会影响重金属在水环境中分布、生物可利用度,并最终影响其对水生生物的毒性[31]。本研究在评价表层海水中重金属的生态风险时,并未考虑上述环境指标的影响,致使评价结果具有一定的不确定性。其次,不同生态系统的生物组成不同,其对化学物质的敏感性也有所差异[32-33],许多国家和学者都推荐使用本地种的生物毒性数据建立环境保护阈值(如PNEC),并据此进行生态风险评价[14, 34]。而本研究采用的毒性数据包含了世界各地的海洋生物,将其用于东营市三个河口区海域的生态风险评价,其结果会有一定的不确定性。
3 主要重金属污染物来源分析及防治建议以二类海水水质标准来看,3个河口的主要重金属污染物为铜和汞,而以HQs和JPCs的结果来看,铜对3个河口海域的生态风险最大,汞的生态风险可接受。7种重金属在一定程度上表现出了近岸浓度高的特征,充分说明陆域排污对海水水质有显著影响。
汞作为毒性最强的金属元素之一,在大气、土壤和水体等介质中普遍存在[35]。许多研究表明,河口潮滩能够大量吸收径流输入和大气沉降的汞,是汞的一个有效的汇[36]。汞是能源燃烧产生的污染物之一,已成为工业化进程对环境影响的指示物。随着信息、家电产业的发展,近年来城市垃圾填埋厂和焚烧炉等新污染源对城市的汞污染也日益显现[37]。有模拟试验表明,渤海湾表层底质中汞基本不溶出,不致对海水产生二次污染[38]。因此,海水中的汞应该主要受到陆域河流排污的影响。本研究中的3个河口,汞浓度超过二类海水水质标准的站位以广利河口最多,最高浓度的站位也出现在于广利河口。广利河流经东营市主城区,且其入海口附近海域功能区为工业与城镇用海,因此可以基本判定汞的来源是城市的工业与生活污水。
海水中的溶解态铜或以自由离子存在,或与有机配体(如溶解有机碳,腐植酸等)或无机配体(OH-,Cl-,SO42-,HCO3-)结合[39]。其中自由铜离子的生物有效性最强,也是决定铜毒性的最主要的形态。一般而言,大洋中的溶解态铜的浓度(指总溶解态铜浓度,包含自由离子和螯合态铜)约为0.03~0.4 μg/L;而近岸海域溶解态铜的浓度受陆源输入和人为污染源的影响而变化非常大。污染程度较小的海域中,溶解态铜浓度以0.1~0.5 μg/L较为常见[40-41]。本研究中的3个河口铜浓度超过二类海水水质标准的站位以挑河口最多,最高浓度的站位也出现在于挑河河口。由于挑河河口所处海域功能区为养殖区,因此有理由推断海水中的重金属铜是海水养殖业所用的鱼饵[42]、鱼药[43]以及养殖设施[44]所附带的污染。
由于城市化进程的发展,流域内的城市生活污水排放量逐年增加,但受污水处理厂处理能力及其配套管网建设的限制,生活污水不能全部进入污水处理厂,导致部分污水未经处理直接排放,对环境造成污染[45]。因此加快城市污水处理厂及其配套管网建设,改进污水处理设施是削减整个流域污染负荷的重要手段。
对于工业污水,将总量控制目标以排污许可证的形式落实到每一个污染源,逐步实行污染物排放总量收费制度,加大污染治理力度,实施污染治理再提高工程,提高监管力度将有效削减企业的污水排放。
对河口附近的海水养殖区推广生态养殖技术,选择合适的鱼饵、鱼药,并确定施用剂量、次数和方法,可以有效降低海水养殖业带来的环境污染。
| [1] |
Apeti D A, Lauenstein G G, Christensen J D, et al. A historical assessment of coastal contamination in Birch Harbor, Maine based on the analysis of mussels collected in the 1940s and the Mussel Watch Program[J]. Marine Pollution Bulletin, 2010, 60(5): 732-742. DOI:10.1016/j.marpolbul.2009.11.021
(  0) 0) |
| [2] |
Cobelo-García A, Neira P, Mil-Homens M, et al. Evaluation of the contamination of platinum in estuarine and coastal sediments(Tagus Estuary and Prodelta, Portugal)[J]. Marine Pollution Bulletin, 2011, 62(3): 646-650. DOI:10.1016/j.marpolbul.2010.12.018
(  0) 0) |
| [3] |
El Zrelli R, Courjault-Radé P, Rabaoui L, et al. Heavy metal contamination and ecological risk assessment in the surface sediments of the coastal area surrounding the industrial complex of Gabes city, Gulf of Gabes, SE Tunisia[J]. Marine Pollution Bulletin, 2015, 101(2): 922-929. DOI:10.1016/j.marpolbul.2015.10.047
(  0) 0) |
| [4] |
El-Sorogy A S, Attiah A. Assessment of metal contamination in coastal sediments, seawaters and bivalves of the Mediterranean Sea coast, Egypt[J]. Marine Pollution Bulletin, 2015, 101(2): 867-871. DOI:10.1016/j.marpolbul.2015.11.017
(  0) 0) |
| [5] |
王海瑞. 东营市广利河整治途径及效益分析[J]. 山东水利, 2014(1): 9-10. Wang H R. Harnessing approaches and benefits analysis of Guangli river in Dongying city[J]. Shandong Water Resources, 2014(1): 9-10. DOI:10.3969/j.issn.1009-6159.2014.01.003 (  0) 0) |
| [6] |
曲玉环.东营市陆源入海污染物调查与评价[D].青岛: 中国海洋大学, 2009. Qu Y H. The Investigation and Evaluation of Land-Based Pollutant Poured Into the Sea in Dongying City[D]. Qingdao: Ocean University of China, 2009. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1828278 (  0) 0) |
| [7] |
王云鹏, 纪良, 时国梁, 等. 脱硫海水排放对附近海域的生态环境影响初步研究[J]. 中国海洋大学学报(自然科学版), 2014, 44(5): 61-68. Wang Y P, Ji L, Shi G L, et al. A preliminary study of the impact of discharge water from seawater flue gas desulphurization on the ecological environment of surrounding sea area[J]. Periodical of Ocean University of China, 2014, 44(5): 61-68. (  0) 0) |
| [8] |
Jin X, Liu F, Wang Y, et al. Probabilistic ecological risk assessment of copper in Chinese offshore marine environments from 2005 to 2012[J]. Marine Pollution Bulletin, 2015, 94(1): 96-102.
(  0) 0) |
| [9] |
Solomon K, Giesy J, Jones P. Probabilistic risk assessment of agrochemicals in the environment[J]. Crop Protection, 2000, 19(8): 649-655.
(  0) 0) |
| [10] |
Zolezzi M, Cattaneo C, Tarazona J V. Probabilistic ecological risk assessment of 1, 2, 4-trichlorobenzene at a former industrial contaminated site[J]. Environ Sci Technol, 2005, 39(9): 2920-2926. DOI:10.1021/es049214x
(  0) 0) |
| [11] |
Wang B, Yu G, Huang J, et al. Tiered aquatic ecological risk assessment of organochlorine pesticides and their mixture in Jiangsu reach of Huaihe River, China[J]. Environmental Monitoring and Assessment, 2009, 157(1-4): 29-42. DOI:10.1007/s10661-008-0512-2
(  0) 0) |
| [12] |
Jin X, Gao J, Zha J, et al. A tiered ecological risk assessment of three chlorophenols in Chinese surface waters[J]. Environmental Science and Pollution Research, 2012, 19(5): 1544-1554. DOI:10.1007/s11356-011-0660-8
(  0) 0) |
| [13] |
Chen C S. Ecological risk assessment for aquatic species exposed to contaminants in Keelung River, Taiwan[J]. Chemosphere, 2005, 61(8): 1142-1158. DOI:10.1016/j.chemosphere.2005.02.077
(  0) 0) |
| [14] |
Mu J, Wang J, Wang Y, et al. Probabilistic ecological risk assessment of cadmium in the Bohai Sea using native saltwater species[J]. Acta Oceanologica Sinica, 2014, 33(12): 212-221. DOI:10.1007/s13131-014-0575-6
(  0) 0) |
| [15] |
Klimisch H J, Andreae M, Tillmann U. A systematic approach for evaluating the quality of experimental toxicological and ecotoxicological data[J]. Regulatory Toxicology and Pharmacology, 1997, 25(1): 1-5. DOI:10.1006/rtph.1996.1076
(  0) 0) |
| [16] |
Duboudin C, Ciffroy P, Magaud H. Acute-to-chronic species sensitivity distribution extrapolation[J]. Environmental Toxicology and Chemistry, 2004, 23(7): 1774-1785. DOI:10.1002/etc.v23:7
(  0) 0) |
| [17] |
EC (European Commission). Technical Guidance Document on Risk Assessment[M]. Luxembourg: Office for Official Publications of the European Communities, 2003: 149-150.
(  0) 0) |
| [18] |
Hu Y, Sun S, Song X, et al. Distribution and ecological risk assessment of HCHs and DDTs in surface seawater and sediment of the mariculture area of Jincheng Bay, China[J]. Journal of Ocean University of China, 2015, 14(2): 301-308. DOI:10.1007/s11802-015-2303-z
(  0) 0) |
| [19] |
Aldenberg T, Slob W. Confidence limits for hazardous concentrations based on logistically distributed NOEC toxicity data[J]. Ecotoxicology and Environmental Safety, 1993, 25(1): 48-63. DOI:10.1006/eesa.1993.1006
(  0) 0) |
| [20] |
Jin X, Wang Y, Jin W, et al. Ecological risk of nonylphenol in China surface waters based on reproductive fitness[J]. Environmental Science & Technology, 2013, 48(2): 1256-1262.
(  0) 0) |
| [21] |
Feng Y, Chen Y, Wang J, et al. Ecological risk assessment of heavy metals in surface seawater and sediment near the outlet of a zinc factory in Huludao City, Liaoning Province, China[J]. Chinese Journal of Oceanology and Limnology, 2016, 34(6): 1320-1331. DOI:10.1007/s00343-016-5112-3
(  0) 0) |
| [22] |
Caldwell D J, Mastrocco F, Hutchinson T H, et al. Derivation of an aquatic predicted no-effect concentration for the synthetic hormone, 17α-ethinyl estradiol[J]. Environmental Science & Technology, 2008, 42(19): 7046-7054.
(  0) 0) |
| [23] |
黄厚见, 平仙隐, 李磊, 等. 春, 夏季长江口海水, 沉积物及生物体中重金属含量及其评价[J]. 生态环境学报, 2011, 20(5): 898-903. Huang H J, Ping X Y, Li L, et al. Concentrations and assessment of heavy metals in seawater, sediments and aquatic organisms at the Yangtze River estuary in spring and summer[J]. Ecology and Environmental Sciences, 2011, 20(5): 898-903. DOI:10.3969/j.issn.1674-5906.2011.05.020 (  0) 0) |
| [24] |
张雷, 秦延文, 马迎群, 等. 大辽河感潮段及其近海河口重金属空间分布及污染评价[J]. 环境科学, 2014, 35(9): 3336-3345. Zhang L, Qin Y W, Ma Y Q, et al. Spatial distribution and pollution assessment of heavy metals in the tidal reach and its adjacent sea estuary of Daliaohe Area, China[J]. Environmental Science, 2014, 35(9): 3336-3345. (  0) 0) |
| [25] |
张亚南.黄河口, 长江口, 珠江口及其邻近海域重金属的河口过程和沉积物污染风险评价[D].厦门: 国家海洋局第三海洋研究所, 2013. Zhang Y N. Heavy Metals' Process in Water and Pollution Risk Assessment in Surface Sediments of the Yellow River Estuary, Yangtze River Estuary and Pearl River Estuary[D]. Xiamen: Third Institute of Oceanography, State Oceanic Administration, 2013. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=hyxb201302019 (  0) 0) |
| [26] |
Oliva M, Vicente J J, Gravato C, et al. Oxidative stress biomarkers in Senegal sole, Solea senegalensis, to assess the impact of heavy metal pollution in a Huelva estuary (SW Spain): Seasonal and spatial variation[J]. Ecotoxicology and Environmental Safety, 2012, 75: 151-162. DOI:10.1016/j.ecoenv.2011.08.017
(  0) 0) |
| [27] |
Abdullah M, Sidi J, Aris A Z. Heavy metals (Cd, Cu, Cr, Pb and Zn) in meretrix meretrix roding, water and sediments from Estuaries in Sabah, North Borneo[J]. International Journal of Environmental and Science Education, 2007, 2(3): 69-74.
(  0) 0) |
| [28] |
Adebowale K O, Agunbiade F O, Olu-Owolabi B I. Fuzzy comprehensive assessment of metal contamination of water and sediments in Ondo Estuary, Nigeria[J]. Chemistry and Ecology, 2008, 24(4): 269-283. DOI:10.1080/02757540802255600
(  0) 0) |
| [29] |
USEPA. Guidelines for Deriving Numerical National Water Quality Criteria for the Protection of Aquatic Organisms and Their Uses. National Technical Information Service Accession Number PB85-227049[R]. Washington D C: US Environmental Protection Agency, 1985 https://www.researchgate.net/publication/266053308_Guidelines_for_Deriving_Numerical_National_Water_Quality_Criteria_for_the_Protection_Of_Aquatic_Organisms_and_Their_Uses
(  0) 0) |
| [30] |
Posthuma L, Suter Ⅱ G W, Traas T. Species Sensitivity Distributions in Ecotoxicology[M]. Boca Paton: CRC Press, 2001.
(  0) 0) |
| [31] |
Feng C, Wu F, Zheng B, et al. Biotic ligand models for metals: a practical application in the revision of water quality standards in China[J]. Environmental Science & Technology, 2012, 46(20): 10877-10878.
(  0) 0) |
| [32] |
Jin X, Zha J, Xu Y, et al. Derivation of predicted no effect concentrations (PNEC) for 2, 4, 6-trichlorophenol based on Chinese resident species[J]. Chemosphere, 2012, 86(1): 17-23. DOI:10.1016/j.chemosphere.2011.08.040
(  0) 0) |
| [33] |
Jin X, Wang Z, Wang Y, et al. Do water quality criteria based on nonnative species provide appropriate protection for native species?[J]. Environmental Toxicology and Chemistry, 2015, 34(8): 1793-1798. DOI:10.1002/etc.v34.8
(  0) 0) |
| [34] |
Jin X, Zha J, Xu Y, et al. Derivation of aquatic predicted no-effect concentration (PNEC) for 2, 4-dichlorophenol: Comparing native species data with non-native species data[J]. Chemosphere, 2011, 84(10): 1506-1511. DOI:10.1016/j.chemosphere.2011.04.033
(  0) 0) |
| [35] |
冯新斌, 陈玖斌, 付学吾, 等. 汞的环境地球化学研究进展[J]. 矿物岩石地球化学通报, 2013, 32(5): 503-530. Feng X B, Chen J B, Fu X W, et al. Progresses on environmental geochemistry of mercury[J]. Bulletin of Mineralogy, Petrology and Geochemistry, 2013, 32(5): 503-530. (  0) 0) |
| [36] |
王起超, 刘汝海, 吕宪国, 等. 湿地汞环境过程研究进展[J]. 地球科学进展, 2002, 17(6): 881-885. Wang Q C, Liu R H, Lv X G, et al. Progress of study on the mercury process in the wetland environment[J]. Advance in Earth Sciences, 2002, 17(6): 881-885. DOI:10.3321/j.issn:1001-8166.2002.06.013 (  0) 0) |
| [37] |
Domagalski J. Occurrence and transport of total mercury and methyl mercury in the Sacramento River Basin, California[J]. Journal of Geochemical Exploration, 1998, 64(1): 277-291.
(  0) 0) |
| [38] |
陈甫华, 王世柏, 金朝晖, 等. 汞在渤海湾近海表层海水和底质中的含量分布及在两者间迁移的初步探讨[J]. 海洋环境科学, 1984(2): 5-11. Chen F H, Wang S B, Jin Z H, et al. Mercury content distribution in offshore surface seawater and bottom of the Bohai Bay and preliminary study of the migration between the two media[J]. Marine Environmental Science, 1984(2): 5-11. (  0) 0) |
| [39] |
Sadiq M. Toxic Metal Chemistry in Marine Environments[M]. Marcel Dekker: Incorporated, 1992.
(  0) 0) |
| [40] |
Luoma S N, Rainbow P S. Metal Contamination in Aquatic Environments: Science and Lateral Management[M]. Cambridge: Cambridge University Press, 2008.
(  0) 0) |
| [41] |
刘发义, 梁德海, 孙凤, 等. 饵料中的铜对中国对虾的影响[J]. 海洋与湖沼, 1990, 21(5): 404-410. Liu Y F, Liang D H, Sun F, et al. Effects of dietary copper on the prawn Penaeus orientalis[J]. Oceanologia Et Limnologia Sinica, 1990, 21(5): 404-410. (  0) 0) |
| [42] |
刘伟, 文华, 吴建开, 等. 高铜饲料对凡纳滨对虾生长, 肌肉和肝胰脏铜积累的影响[J]. 淡水漁業, 2008, 38(2): 12-16. Liu W, Wen H, Wu J K, et al. Effects of high-level dietary copper on growth, muscle and hepatopancreas copper accumulation of litopenaeus vannamei[J]. Freshwater Fisheries, 2008, 38(2): 12-16. (  0) 0) |
| [43] |
李辉华, 王广军. 常用鱼药的分类及在使用中存在的问题[J]. 水利渔业, 2001, 21(2): 44-45. Li H H, Wang G J. Classification and problems in application of common fish medicaments[J]. Reservoir Fisheries, 2001, 21(2): 44-45. DOI:10.3969/j.issn.1003-1278.2001.02.023 (  0) 0) |
| [44] |
梅承芳, 梁慧君, 周小翠, 等. 国产防污漆中铜的海洋环境风险评估[J]. 生态毒理学报, 2016, 11(1): 182-193. Mei C F, Liang H J, Zhou X C, et al. Marine environment risk assessment of copper in Chinese antifouling paints[J]. Asian Journal of Ecotoxicology, 2016, 11(1): 182-193. (  0) 0) |
| [45] |
阎冬, 张建强, 杨开明. 乐山市茫溪河流域水环境污染及防治对策[J]. 工业安全与环保, 2006, 32(2): 37-38. Yan D, Zhang J Q, Yang K M. Water environment pollution of Mangxi River of Leshan city and the countermeasures[J]. Industrial Safety and Environmental Protection, 2006, 32(2): 37-38. DOI:10.3969/j.issn.1001-425X.2006.02.016 (  0) 0) |
2. Foundation Department of Tangshan College, Tangshan 063000, China
 2019, Vol. 49
2019, Vol. 49


