2. 青岛农业大学,山东 青岛 266109;
3. 滨州市渔业技术推广站,山东 滨州 256616;
4. 山东省友发水产有限公司,山东 滨州 251900
金刚虾,又名南非斑节对虾、金虎虾,原产于南非莫桑比克,近几年在我国的南方地区实现了规模化养殖,之后河北地区也开始高位池、车间工厂化养殖,而山东省内海水工厂化养殖未见报道。金刚虾与国内的斑节对虾外形相似,对盐度、温度、pH等方面要求基本相同,并且具有生长快、成活率高、抗病性强,个体大,熟虾颜色鲜红,肉质结实,深受广大消费者的喜爱。
随着对虾养殖集约化程度的提高,同时面临养殖废水污染严重,流行病害频发等问题[1-2]。1970年代中期,以色列人成功的将微生物絮团应用于水产养殖领域,并称之为“生物絮团技术”。生物絮团技术通过调控C/N比,添加微生物菌,经絮凝作用形成絮状物,不仅能够调控养殖水环境,还能提高对虾的生长、存活率,更符合节能减排的生态养殖要求[3-6]。目前,对于金刚虾的养殖技术实验报道比较少,对于工厂化养殖生物絮团养殖金刚虾的实验更少。因此本实验以生物絮团技术养殖金刚对虾,探讨对其生长、非特异性免疫和水质的影响,为生物絮团技术能应用与工厂化养殖车间养殖金刚对虾的可行性提供理论性依据。
1 材料和方法 1.1 实验材料2017年12月10日—2018年3月13日,在山东省滨州市友发水产有限公司工厂化车间进行金刚对虾养殖实验。金刚虾初始体长L1=(40.8±5.381)mm,体重W1=(0.112±0.026)g,经过PCR检测方法测定实验用虾苗未携带白斑症病毒(WSSV)、传染性皮下及造血器官坏死病毒(IHHNV)、肝肠孢虫(EHP)、急性肝胰腺坏死综合症(EMS),放养密度300尾/m2。实验用水经漂白粉消毒10 d后,曝气,沉淀,沙滤,地热升温,最后输入养殖池。实验所用微生态制剂为金贝斯2号,主要成分是干酪乳杆菌(Lactobacillus casei)(≥2×107 cfu/g)、酿酒酵母菌(Saccharomyces Cerevisiae)(≥2×107 cfu/g),经过红糖活化14 h后,全池泼洒;金刚虾所用饲料为凡纳滨对虾幼虾0号饲料。
1.2 实验设计方法养殖池体积5 m×8 m×1.2 m,养殖水温28~29 ℃,pH=8.01~8.76,盐度36.8;养殖池采用直径75 cm的纳米氧气盘充氧,溶解氧含量为7.56~7.77 mg/L;实验设置为一个实验组和一个对照组,每组设3个重复。养殖开始后,实验组每日向池内泼洒提前活化好的金贝斯2号微生物菌,并泼洒红糖50 g/池;对照组采用普通的养殖方法:不做泼菌处理,前15 d内每日定期2次排污,后期根据养殖水质每隔1 d换水1次,换水量为60%。每日6:00、10:00、14:00、18:00、22:00投喂饵料,保证在1 h内摄食完毕。
1.3 水质样品采集与测定2017-12-10—2018-01-10,30 d的取样周期内,每3 d早上8:00从对照组和实验组中随机取100 mL水样,抽滤后进行氨氮和亚硝酸氮等指标测定;氨氮的测定采用次溴酸盐氧化法,亚硝酸氮的测定采用盐酸萘乙二胺分光光度法;测定方法按照国家海洋渔业局《海洋监测规范第4部分:海水分析》。
1.4 样品采集免疫酶活性分析样品采集从2017-12-10—2018-01-10,周期为30 d;第15、30天,全池随机捞取30尾金刚虾取血样测定金刚虾免疫酶活性;第30天,随机捞取30尾金刚虾,用游标卡尺和电子天平(精确度0.01 g)分别测量金刚虾的生物学体长L2和体重W2,并计算增重率(WGR)和特定生长率(SGR)。2018年3月13日养殖结束时,测量金刚虾的体长L3、体重W3和产量并计算成活率。免疫酶活性测定方法根据李玉全[7]等试验方法抽取血淋巴混合约1.0 mL置于1.5 mL离心管中,4 ℃冰箱中过夜,5 000 r/min离心10 min取上清液放入-20 ℃冰箱中保存以备酶活测定用。本试验共测定4种相关酶活力:酚氧化酶、超氧化物歧化酶、溶菌酶、酸性磷酸酶。酶活力测定采用南京建成科技有限公司生产的相应酶试剂盒,按说明书描述的步骤进行。
1.5 数据分析最终所有数据采用Microsoft Excel 2013软件进行数据处理和绘图。采用SPSS 18.0统计分析软件对数据进行差异显著性检验,所有数据用3个重复组平均值±标准差来表示。增重率(WGR)计算公式:WGR=(末称重-初始称重)/初始体重×100%;特定生长率(SGR)计算公式为:SGR(%/d)=(ln末体重-ln初始体重)×100%/实验天数。
2 实验结果 2.1 生物絮团的形成和对养殖水质的影响实验开始第7天,实验组水颜色加深,呈黄褐色,水中有微小悬浮絮状物,标志养殖水体中的生物续团已经形成;实验第15天,水中的絮状物增多,之后,实验组水色一直保持黄褐色,每日观察,水色起伏变化不大。对照组开始水呈黄绿色,到实验第10天水色加深,到第16天水色呈现红褐色;氨氮、亚盐含量升高,对照组显色较实验组深,加大了对实验组的换水量后,水色每日起伏变化较大。
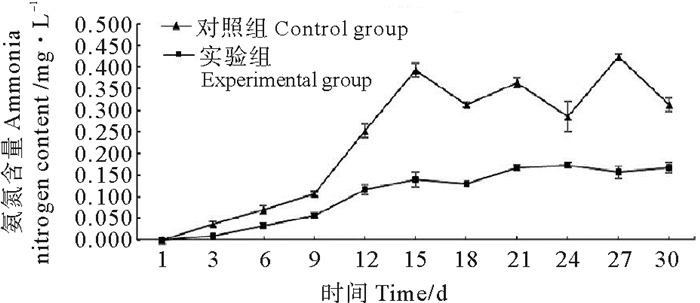
由图 1可知,对照组实验第9天起,养殖水体中氨氮含量快速增加,到实验第15天氨氮含量到达高峰,为(0.44±0.012)mg/L,随后由于每隔1 d大换水60%,因此氨氮含量时高时低,起伏变化。而实验组的氨氮含量最高值为(0.157±0.021)mg/L,整个实验过程中,实验组氨氮含量相对增长缓慢,没有起伏变化,显著低于对照组(P<0.05)。
|
图 1 氨氮的变化规律 Fig. 1 Changes of ammonia nitrogen during 30 days treatment |
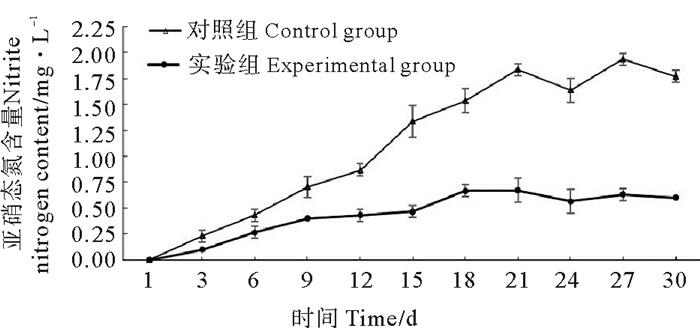
由图 2可知,实验开始阶段,对照组和实验组水体中的亚硝态氮增长快速,至实验的第18天,对照组中亚硝态氮含量为(1.61±0.063)mg/L,随后也是高低起伏变化。实验组的亚硝态氮实验过程中增长缓慢,最大值为(0.59±0.05)mg/L,整个实验过程中显著的低于对照组(P<0.05)。
|
图 2 亚硝态氮变化规律 Fig. 2 Changes of nitrite nitrogen during 30 days treatment |
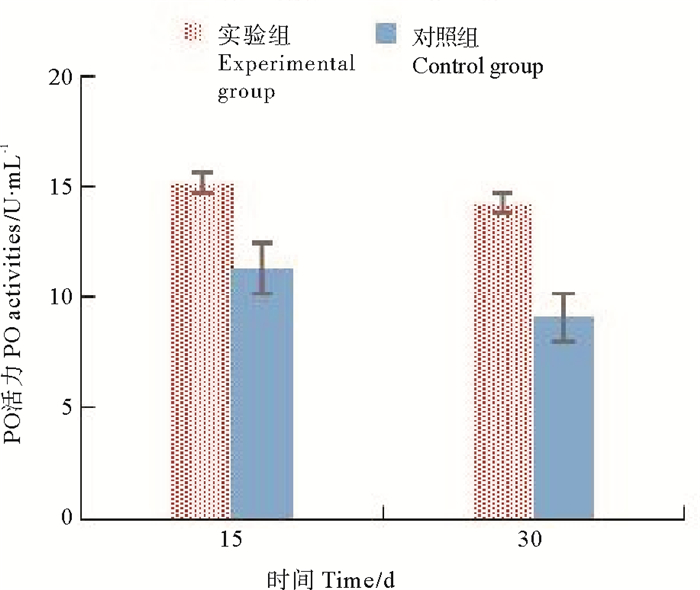
由图 3、表 1可知,实验期间,对照组的多酚氧化酶活力基本维持恒定;实验组多酚氧化酶活力始终高于对照组差异性显著(P<0.05),实验前15天,多酚氧化酶活力明显增加,至实验30 d时,多酚氧化酶活力略有下降。
|
图 3 不同时期金刚虾PO活性比较 Fig. 3 Comparison of PO activities of Penaeus Monodon in different stage |
|
|
表 1 生物絮团养殖技术对金刚虾非特异性免疫因子相关指标的影响 Table 1 Effect of BFT on enzyme activities of Penaeus monodon |
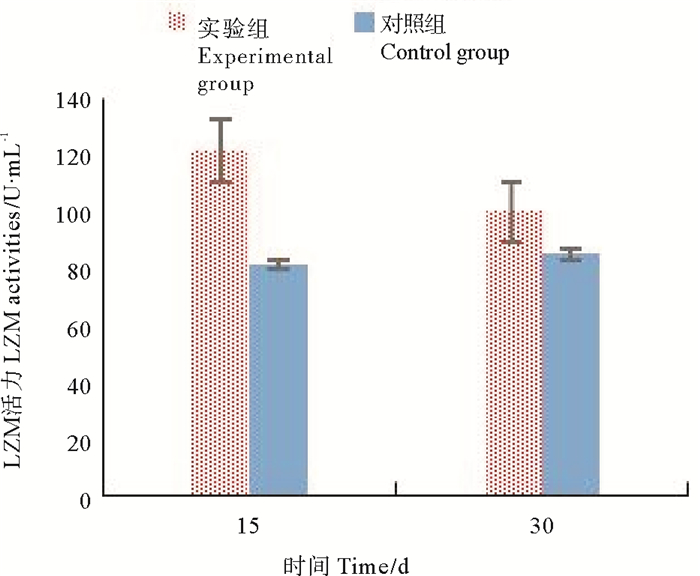
由图 4、表 1可知,实验期间,对照组的溶菌酶活力基本维持不变;实验组溶菌酶活力明显高于对照组,差异性显著(P<0.05)。在整个实验过程中,实验组溶菌酶变化趋势类似于多酚氧化酶,而对照组的溶菌酶活力在第30天检测时略有升高。
|
图 4 不同时期金刚虾LZM活性的比较 Fig. 4 Comparison of LZM activities of Penaeus Monodon in different stage |
由表 1、图 5可知,实验中,对照组的酸性磷酸酶活力几乎维持恒定(P>0.05),显著低于实验组(P<0.05);金刚虾酸性磷酸酶活力在实验期间的变化与多酚氧化酶、溶菌酶的变化趋势也基本相似,实验开始至第15天,酶活力不断的增长,之后至第30天,酶活力在此期间略有下降。
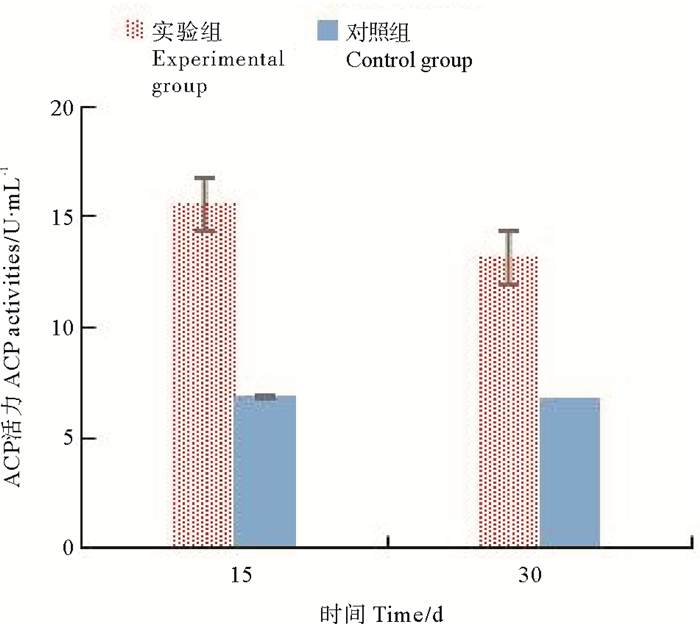
|
图 5 不同时期金刚虾ACP的活性比较 Fig. 5 Comparison of ACP activities of Penaeus Monodon in different stage |
由表 1、图 6可知,在实验中,对照组金刚虾血清中SOD基本恒定,实验组中SOD显著的高于对照组(P<0.05);而实验组中SOD在实验在第30天时,明显的高于第15天(P<0.05)。
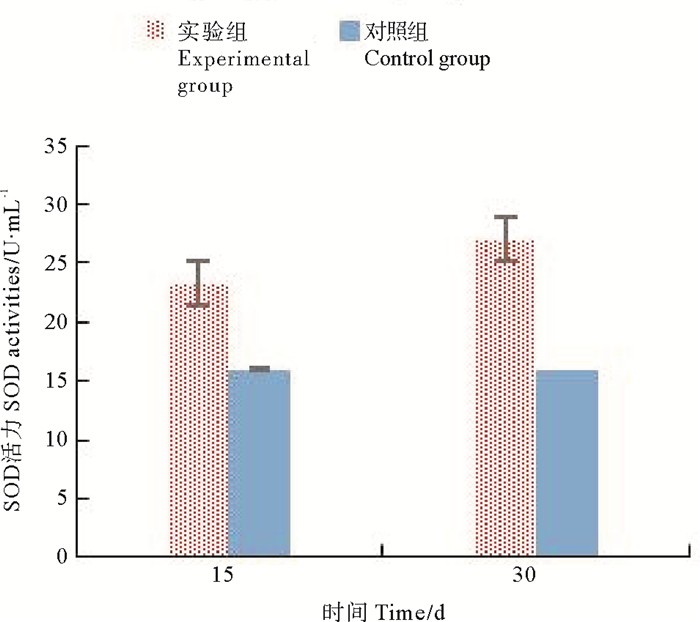
|
图 6 不同时期金刚虾SOD的活性比较 Fig. 6 Comparison of SOD activities of Penaeus Monodon in different stage |
由表 2可知,实验组金刚虾对虾的在实验结束时的生物学体长,湿体重比对照组增长显著(P<0.05);实验组的WGR(218.96±71.050)高于对照组(181.49±63.038)(P<0.05);实验组SGR(3.98±0.563)高于对照组(3.37±0.735)(P<0.05)。
|
|
表 2 生物絮团养殖技术对金刚虾生长的影响 Table 2 Effect of BFT on growth of Penaeus monodon |
经过93 d养殖,实验组金刚虾最终的平均体长(10.65±0.61)cm,平均体重为(17.9±2.91)g,共收获了143.5 kg/池,成活率为64.6%;由于养殖过程中,对照组其中一个对照组爆发了一次疾病,大量死亡,剩余的两个重复,最终池106 kg/池,平均生物学体长为(9.26±1.43)cm,平均体重(15.4±4.21)g,成活率为56.8%,显著的低于对照组(P<0.05)。
3 讨论金刚虾与斑节对虾的外形相似,体表光滑,壳较厚,有黄绿色和深棕色的环状色带[8]。在工厂化养殖过程中,金刚虾生物学体长在5~6 cm以前,生长缓慢,随后,金刚虾进入快速生长期,养殖周期为90~110 d,金刚虾长至27尾/斤左右,养殖成效显著。
生物絮团是以异养生物为主体,经絮凝作用结合水体中有机物质、藻类、原生动物和丝状菌等形成的絮状物[9]。其营养丰富是养殖生物较好的饵料,有关研究报道生物絮团的干物质中,粗蛋白含量超过50%,粗脂肪2.5%,纤维4%,灰分7%[10]。生物絮团是以异样菌为主体,而国内外关于异样菌能够提高凡纳滨对虾[5]、斑节对虾[11]、罗氏沼虾[12]以及很多鱼类[13-14]对饵料的利用率,促进其生长的报道很多。本文研究的生物絮团主要成分是干酪乳杆菌和酿酒酵母菌,实验结果表明,生物絮团养殖金刚虾对虾的WGR和SGR,有显著的促进作用。因此,本试验证明了生物絮团技术对金刚虾生长有很好的效果,在养殖实践中具有重大的意义。
对虾的健康养殖很大程度上依赖于对疾病的控制,免疫是评价对虾健康的一重要工具[15],而非特异性免疫因子的变化常被用来衡量对虾免疫活性的大小[16]。目前,关于生物絮团技术、生物菌调控能显著提高养殖生物非特异性免疫的研究很多,暨通过微生物菌的调控,能够显著的增加养殖生物体内血清酚氧化酶、酸性磷酸酶、碱性磷酸酶、溶菌酶、超氧化物歧化酶等[17-20]。本实验中,以生物絮团技术养殖金刚虾的实验组血清中的酚氧化酶、酸性磷酸酶、超氧化物歧化酶、溶菌酶的活力显著的高于对照组的酶活力。在很多微生态制剂对非特异性免疫影响的实验中,都表明微生态制剂在一定的时间内能够快速的提高免疫酶的活性,之后酶活性逐渐下降至对照组酶活性水平:隋大鹏[21]等对微生态制剂对南美白对虾生长和非特异性免疫实验的研究中指出这一现象是由于微生物菌激活了血细胞中的非特异性免疫酶原系统,使得酶原转化为由活性的酶,并排入血液,使血清酶的活力增加,增加到最大时自身的反馈抑制系统启动,抑制增加,酶活力开始下降。在本试验中,PO、ACP、LZM、酶的活性在实验第30天时的活力要要小于第15天;SOD活性在实验的第30天大于第15天时,因此表明微生态制剂能够促进SOD活性在较长的时间内能够持续的增加。
目前有实验研究显示,生物絮团能够净化水质,重新利用水中氨氮,以达到去除效果[22-25]。在本实验中,无论实验组还是对照组氨氮和亚硝态氮的含量都在增加,而以生物絮团技术养殖的实验组,其氨氮和亚硝态氮增加缓慢,在整个过程氨氮和亚硝态氮含量显著的低于对照组(P<0.05),足以说明生物絮团技术对氨氮和亚硝态氮有很好的去除作用。氨氮和亚硝态氮在其他水生生物养殖实验研究中表明,在安全浓度的范围内,具有提高水生生物非特异性免疫酶的活性,但是如果长时间处于高浓度的氨氮和亚硝态氮的水体中,会降低水生生物非特异性免疫酶的活性[26-27]。而对虾对氨氮和亚硝态氮的耐受性很强,本实验中,对照组氨氮最高浓度(0.44±0.012)mg/L,亚硝酸氮最高浓度为(1.61±0.063)mg/L,实验组氨氮最高浓度(0.157±0.021)mg/L亚硝酸氮(0.59±0.05)mg/L,都属于安全浓度范围内[28-29]。在实验过程中水体中的氨氮和亚硝态氮在一定程度上也提高金刚虾酶的免疫活性,所有的免疫活性酶数值表明,对照组的酶活性显著低于实验组,因此也可以证明氨氮在本试验中对实验数据的影响不是太,进一步证明生物絮团能够提高金刚虾的非特异性免疫活性酶。
因此,在以生物絮团技术养殖金刚虾的实验中,生物絮团技术能够显著的促进金刚虾的生长,提高金刚虾非特异性免疫酶的活性。这为生物絮团技术养殖金刚虾的实际生产提供了可行的理论依据。
致谢 本次实验要衷心的感谢山东省海洋生物研究院的老师和同事给提供了实验的指导和帮助,也要感谢滨州市渔业技术推广站的领导给予的帮助,同时还有山东友发水产有限公司的领导和工人师傅。
| [1] |
李谷, 吴振斌, 侯燕松, 等. 养殖水体氨氮污染生物修复技术研究[J]. 大连水产学院学报, 2004, 19(4): 281-286. Li G, Wu Z B, Hou Y S, et al. Perspective of bio-eco remediation technology for ammonia removal from intensive aquaculture waters[J]. Journal of DaLian Fisheries University, 2004, 19(4): 281-286. DOI:10.3969/j.issn.1000-9957.2004.04.010 (  0) 0) |
| [2] |
夏耘, 郁二蒙, 谢俊, 等. 基于PCR-DGGE技术分析生物絮团的细菌群落结构[J]. 水产学报, 2012, 36(10): 1563-1571. Xia Y, Yu E M, Xie J, et al. Analysis of bacterial community structure of bio-floc by PCR-DGGE[J]. Journal of Fisheries of China, 2012, 36(10): 1563-1571. (  0) 0) |
| [3] |
Zhao P, Huang J, Wang X H, et al. The application of bioflocs technology in high-intensive, zero exchange farming systems of Marsupenaeus japonicus[J]. Aquaculture, 2012, 354(355): 97-106.
(  0) 0) |
| [4] |
Xu W J, Pan L Q. Effects of bioflocs on growth performance, digestive enzyme activity and body composition of juvenile Litopenaeus vannamei in zero-water exchange tanks manipulating C/N ratioin feed[J]. Aquaculture, 2012, 356/357: 147-152. DOI:10.1016/j.aquaculture.2012.05.022
(  0) 0) |
| [5] |
邓应能, 赵培, 孙运忠, 等. 生物絮团在凡纳滨对虾封闭养殖试验中的形成条件及作用效果[J]. 渔业科学进展, 2012, 33(2): 69-75. Deng Y N, Zhao P, Sun Y Z, et al. Conditions for biofloc formation and its effects in closed culture system of Litopenaeus vannamei[J]. Progress in Fishery Sciences, 2012, 33(2): 69-75. DOI:10.3969/j.issn.1000-7075.2012.02.011 (  0) 0) |
| [6] |
Harib, Kurupbm, Varghesejt, et al. The effect of carbohydrate addition on water quality and the nitrogen budget in extensive shrimp culture systems[J]. Aquaculture, 2006, 252(2/3/4): 248-263.
(  0) 0) |
| [7] |
李玉全, 李永生, 赵法箴. 盐度渐变与骤变对脊尾白虾渗透、代谢免疫相关酶活力的影响[J]. 生态学报, 2015, 35(21): 7229-7235. Li Y Q, Li Y S, Zhao F Z. Effect of salinity changes on osmotic-, metabolic-, and immune-related enzyme activities in Exopalaemon carinicauda[J]. Acta Ecologica Sinica, 2015, 35(21): 7229-7235. (  0) 0) |
| [8] |
王克行, 等. 虾蟹类增养殖学[M]. 北京: 中国农业出版社, 1997. Wang K X. Shrimp, Crab Aquaculture[M]. Beijing: China Agriculture Press, 1997. (  0) 0) |
| [9] |
Azim ME, Little DC, Bron J E. Microbial protein production in activated suspension tanks manipulating C: N ratio in feed and the implications for fish culture[J]. Bioresource Technology, 2007, 99(9): 3590-3599.
(  0) 0) |
| [10] |
Azim M E, Verdegem M C J, Singh M, et al. The effects of periphyton substrate and fish stocking density on water quality, phytoplankton, periphyton and fish growth[J]. Aquaculture Research, 2003, 34(9): 685-695. DOI:10.1046/j.1365-2109.2003.00867.x
(  0) 0) |
| [11] |
邓吉朋, 黄建华, 谢世贵, 等. 生物絮团在斑节对虾养殖系统中的形成条件及作用效果[J]. 南方水产科学, 2014, 10(3): 29-37. Deng J P, Huang J H, Xie S G, et al. Conditions for bio-floc formation and its effects on Penaeus monodon culture system[J]. South China Fisheries Science, 2014, 10(3): 29-37. DOI:10.3969/j.issn.2095-0780.2014.03.005 (  0) 0) |
| [12] |
刘杜娟, 潘晓艺, 尹文林, 等. 生物絮团在罗氏沼虾育苗中的应用[J]. 上海海洋大学学报, 2013, 22(1): 47-53. Liu D J, Pan X Y, Yi W L, et al. Bio-flocs technology application in breeding of Macrobrachium rosenbergii[J]. Journal of ShangHai Ocean University, 2013, 22(1): 47-53. (  0) 0) |
| [13] |
Megahed M E. The effect of microbial biofloc on water quality, survival and growth of the green tiger shrimp (Penaeus Semisulcatus) fed with different crude protein levels[J]. Journal of the Arabian Aquaculture Society, 2010, 5: 119-142.
(  0) 0) |
| [14] |
孙盛明, 戈贤平, 朱健, 等. 生物絮团对鲂(Megalobrama amblycephala)生长、消化酶和免疫相关酶活性的影响[J]. 渔业科学进展, 2016, 37(2): 49-55. Sun S M, Ge X P, Zhu J, et al. Effects of bioflocs on growth performance, digestive enzyme and immunity enzyme activities in juvenile blunt snout bream (Megalobrama amblycephala)[J]. Progress in Fishery Sciences, 2016, 37(2): 49-55. (  0) 0) |
| [15] |
Bachere E, Mialhe E, Noel T, et al. Knowledge and research prospect in marine mollusk and crustacean immunology[J]. Aquaculture, 1995, 132: 17-32. DOI:10.1016/0044-8486(94)00389-6
(  0) 0) |
| [16] |
张喆, 李健, 冯伟, 等. 不同浓度的诺氟沙星对中国对虾非特异性免疫酶活性的影响[J]. 渔业科学进展, 2011, 32(2): 53-59. Zhang Z, Li J, Feng W, et al. Effects of norfloxacin on the non-specific immune response of Fenneropenaeus chinensis[J]. Progress in Fishery Sciences, 2011, 32(2): 53-59. DOI:10.3969/j.issn.1000-7075.2011.02.009 (  0) 0) |
| [17] |
马元庆, 李斌, 张秀珍, 等. 生物絮团对仿刺参幼参消化与免疫酶活性的影响[J]. 水生态学杂志, 2013, 34(6): 91-95. Ma Y Q, Li B, Zhang X Z, et al. The effect of bio-floc on digestive and immune enzymes activity in juvenile sea cucumber Apostichopus japonicus[J]. Journal of Hydroecology, 2013, 34(6): 91-95. (  0) 0) |
| [18] |
张秀珍, 李斌, 白艳艳, 等. 生物絮团对仿刺参幼参生长与酶活性的影响[J]. 中国水产科学, 2014, 21(4): 793-799. Zhang X Z, Li B, Bai Y Y, et al. Effect of bioflocs on enzyme activities and growth performance of juvenile sea cucumber Apostichopus japonicus[J]. Journal of Fishery Sciences of China, 2014, 21(4): 793-799. (  0) 0) |
| [19] |
Anand PSS, Kohli MPS, Kumar S, et al. Effect of dietary supplementation of bioflocon growth performance and digestive enzyme activities in Penaeus monodon[J]. Aquaculture, 2014, 418-419: 108-115. DOI:10.1016/j.aquaculture.2013.09.051
(  0) 0) |
| [20] |
Zhou X, Tian Z, Wang Y, et al. Effect of treatment with probiotics as water additives on tiapia (Oreochomis niloticus) growth performance and immune response[J]. Fish Physiol Biochem, 2010, 36(3): 501-509. DOI:10.1007/s10695-009-9320-z
(  0) 0) |
| [21] |
隋大鹏.微生态制剂对南美白对虾生长和非特异性免疫因子影响的研究[D].青岛: 中国海洋大学, 2003. Sui D P. The Research of Effects of Microecologics on the Growth and Non-Special Immunity Factors of Litopenaeus vannamei Boone[D]. Qingdao: Ocean University of China, 2003. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y522795 (  0) 0) |
| [22] |
Hargreaves J A. Photosynthetic suspended-growthsystems in aquaculture[J]. Aquacultural Engineering, 2006, 34(3): 344-363. DOI:10.1016/j.aquaeng.2005.08.009
(  0) 0) |
| [23] |
Crab R, Defoirdt T, Bossier P, et al. Biofloc technologyin aquaculture: Beneficial effects and future challenges[J]. Aquaculture, 2012, 356-357.
(  0) 0) |
| [24] |
Zhao P, Huang J, Wang X H, et al. The application of bioflocs technology in high-intensive, zero exchange farming systems of Marsupenaeus japonicus[J]. Aquaculture, 2012, 354-355.
(  0) 0) |
| [25] |
李晓梅, 郭体环. 生物絮团对凡纳滨对虾养殖过程中氨氮和亚硝酸氮含量的影响[J]. 渔业研究, 2017, 39(4): 283-286. Li X M, Guo T H. Impact of biological floc on ammonia nitrogen and nitrite nitrogen content in the process of Litopenaeus vannamei culture[J]. Journal of Fisheries Research, 2017, 39(4): 283-286. (  0) 0) |
| [26] |
徐松涛, 赵斌, 李成林, 等. 氨氮胁迫对不同规格刺参存活及非特异免疫活性酶的影响[J]. E渔业科学进展, 2017, 38(3): 172-179. Xu S T, Zhao B, Li C L, et al. Effects of ammonia nitrogen stress on the survival and activities of non-specific immune enzymes of different-sized sea cucumber (Apostichopus japonicus)[J]. Progress in Fishery Sciences, 2017, 38(3): 172-179. (  0) 0) |
| [27] |
包杰, 姜宏波, 程慧, 等. 氨氮对中华小长臂虾的急性毒性和非特异性免疫指标的影响[J]. 水生生物学报, 2017, 41(3): 516-522. Bao J, Jiang H B, Cheng H, et al. Effect of ammonia nitrogen on acute toxicity and non-specific immune parameters of palaemonetes sinensis[J]. Acta Hydrobiologica Sinica, 2017, 41(3): 516-522. (  0) 0) |
| [28] |
葛红星, 李健, 陈萍, 等. 氨氮胁迫下凡纳滨对虾对副溶血弧菌的易感性[J]. 渔业科学进展, 2014, 35(6): 76-82. Ge H X, Li J, Chen P, et al. The immune response of Litopenaeus vannamei and its susceptibility to Vibrio parahaemolyticus under stress caused by ammonia nitrogen at different concentrations[J]. Progress in Fishery Sciences, 2014, 35(6): 76-82. (  0) 0) |
| [29] |
孙国铭, 汤建华, 仲霞铭. 氨氮和亚硝酸氮对南美白对虾的毒性研究[J]. 水产养殖, 2002, 1: 22-24. Sun G M, Tang J H, Zhong X M, et al. Ammonia nitrogen and nitrite nitrogen toxicity studies of Litopenaeus vannamei[J]. Aquaculture, 2002, 1: 22-24. (  0) 0) |
2. Qingdao Agricultural University, College of Ocean Science and Engineering, Qingdao 266109, China;
3. Fishery Technology Promotion Station of Binzhou, Binzhou 256616, China;
4. Aquatic Products Co, LTD of Shandong Youfa. Binzhou 251900, China
 2018, Vol. 48
2018, Vol. 48


