2. 东京大学大气与海洋研究所, 日本 东京 277-8564;
3. 上海海洋大学海洋科学学院, 上海 201306;
4. 国家远洋渔业工程技术研究中心, 上海 201306;
5. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室, 山东 青岛 266071;
6. 山东省水生生物资源养护管理中心, 山东 烟台 264003
山东近海海域有多条河流注入,营养盐丰富,生产力高,成为众多分布于黄、渤海的重要鱼种的产卵场和索饵场[1]。近年来,受持续捕捞压力和气候环境变化的影响,山东近海渔业资源的种类组成发生了显著变化,以大型、底层鱼类为主的传统经济鱼种的数量日渐减少,并逐渐被小型中上层鱼类和头足类所取代[2-3]。中国近海的头足类,因生活史不同而对捕捞和气候变化表现出不同的响应[4]。在山东省的头足类渔获物中,鱿鱼(枪乌贼和柔鱼)产量持续增加并在21世纪初期达到近16万t的峰值,近年来平均年产量维持在14万t左右[5]。相关研究以及渔获物组成表明,鱿鱼类群中的枪乌贼类(Loligo spp.)正成为莱州湾、海州湾甚至是山东近海的重要优势种之一[6-7],尤以日本枪乌贼(L. japonica)和火枪乌贼(L. beka)的分布最为广泛,而柔鱼类所占比重下降。枪乌贼类作为山东近海的主要经济种类,具有生命周期短、繁殖速度快等特点;其繁殖高峰期集中在春季和夏初,单次繁殖过后亲体相继死亡;常栖息于沿岸浅水水域;除此之外,枪乌贼类还具有明显的洄游特性,繁殖季节从外海迁移到近海生殖,随着幼体生长发育,这些新生群体再洄游到外海区域[8]。上述生物学特征表明枪乌贼类为典型的r生活史对策者,其分布和产量变动情况极易受到外界环境因素的影响[9-10]。
目前关于枪乌贼类的研究主要集中在个体的生物学特征、种群动态和栖息地分布等方面。邱显寅等[11]发现黄海日本枪乌贼的繁殖高峰期在4—6月,并且年间世代生长存在明显差异。Takechi和Kawasaki[12]分析发现日本仙台湾的日本枪乌贼可分为三个群体,群体间生物学特点略有差异。董正之[13]和都煜[14]等探究了枪乌贼类在中国近海和海州湾的分布特征,发现日本枪乌贼和火枪乌贼是分布于黄渤海的区域性种类,且其在海州湾的分布存在时空异质性。除此之外,广义加性模型被用来探究影响大洋性头足类时空分布的环境因子的研究,研究对象主要是科氏滑柔鱼(Illex coindetii) [15]和乳光枪乌贼(Ommastrephes bartrami)[16]等。以上研究结果虽然明确了枪乌贼类的部分生物学特征及其在时空尺度上的分布特点,也探究了环境因素对大洋性头足类分布的影响;但目前针对山东近海枪乌贼类资源丰度和时空分布的系统性研究不多,缺乏对近海性种类的分布及产量变动受环境因素影响的探究。本研究依据山东近海2016—2017年度春、夏、秋、冬四个季节的渔业资源底拖网调查,探究枪乌贼类资源丰度的时空分布特征以及环境因子的影响,以期为该海域枪乌贼类资源的可持续利用和科学管理提供依据。
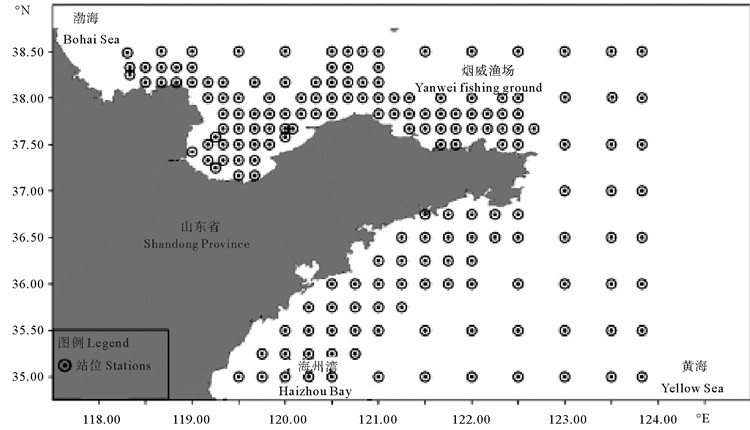
1 材料与方法 1.1 样品采集与统计数据枪乌贼数据来源于2016年10月(秋季)和2017年1月(冬季)、5月(春季)和8月(夏季)在山东近海海域进行的渔业资源底拖网调查,调查海域为118°20′E~123°50′E,35°00′N~38°30′N,共设置调查站位178个(见图 1)。调查渔船为220 kW的单拖渔船,拖速为2~3 kn,每站的拖网时间为1 h。调查网具的上口门为5.0 m,底口门为4.0 m;拖网网口高度约7.5 m,网口水平扩张约15.0 m。在每个调查站位用CTD同步记录海水深度(Depth)、表层温度(SST)和表层盐度(SSS)等环境数据。本次调查共捕获枪乌贼类178 410尾,总计782.5 kg。
|
图 1 山东近海资源调查站位图 Fig. 1 Survey stations in Shandong coastal waters |
枪乌贼胴长和体重数据分别精确至1 mm和0.01 g。本次调查捕获的日本枪乌贼和火枪乌贼未进行详细分类,均按枪乌贼类进行计数和测量;但在最后的抽样调查中发现,日本枪乌贼数量占60%以上,明显多于火枪乌贼。
另外,为了掌握枪乌贼类的渔获量变动状况,分析整理了山东渔业统计年鉴(2003—2017年)[5]中头足类的数据。
1.2 资源丰度指数及肥满度计算本研究用单位捕捞努力量渔获量(Catch per unit effort,CPUE)来表示资源丰度指标,CPUE的计算公式如下:
| $ {\rm{CPUE = }}\frac{{\sum {{\rm{catch}}} }}{{\sum {t} }} \circ $ | (1) |
式中:CPUE表示单位捕捞努力量渔获量,表征单位时间内的平均渔获量,单位为kg/h;∑catch表示某站位的渔获量(kg);∑t表示在某站位的作业时间(h)。
采用Fulton状态指数K计算枪乌贼的肥满度[17]:
| $ K = 100W/{L^3} \circ $ | (2) |
式中:K表示肥满度;W表示体重(g);L表示胴长(cm);常数100为固定系数。
1.3 统计分析本研究采用广义加性模型(Generalized additive model,GAM)来分析环境等因子对资源丰度的影响。
| $ Y = \alpha + \sum\limits_{j = 1}^n {{f_i}\left( {{x_j}} \right) + {\rm{ \mathsf{ ε} }}} \circ $ | (3) |
式中:α为截距;fi(xj)为样条平滑函数;xj为解释变量,包括时空及环境因子;ε为残差。
本研究选取月份、经度、纬度、水深、海水表层温度(SST)和海水表层盐度(SSS)等因子进行分析。使用AIC(Akaike information criterion)准则检验模型的拟合程度,选择AIC值最小的模型作为最优模型[18]。将这些因子代入模型前,先进行Pearson相关性分析,有显著相关性的两因子不同时加入模型中(其中月份作为分类变量,不进行相关性分析)。因为水深和经纬度之间均存在显著相关关系,故舍弃经、纬度变量,选取与CPUE最相关的水深因素加入模型中。最后,用F检验来评估因子的显著性。GAM运用R.3.4.3中的“mgcv”软件包来进行计算[19]。
采用SPSS20.0中的独立样本T检验进行胴长和体重的差异性比较;枪乌贼类资源丰度的空间分布图运用surfer13.0软件进行绘制。
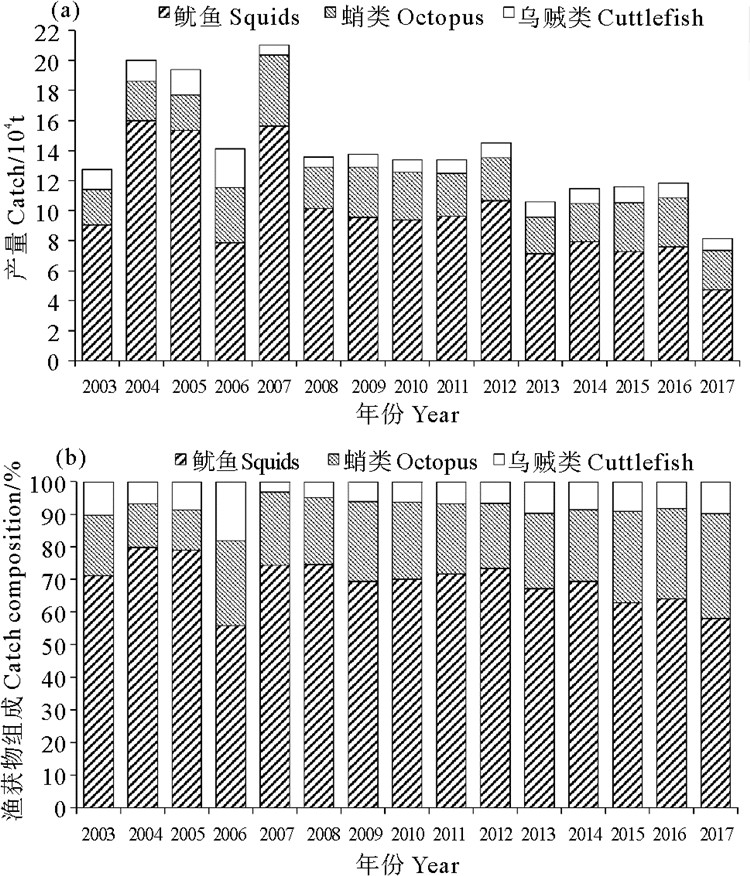
2 结果 2.1 山东省头足类概况山东省头足类整体产量的波动较大,2003—2017年间的产量为8.2万~21.0万t,平均年产量约为14.0万t。在头足类物种中,以鱿鱼(包括枪乌贼和柔鱼)所占比重最大,其年产量比例均达55.9%以上,平均年产量在9.9万t以上;其次是蛸类,其年产量比例在12.3%以上,平均年产量为2.9万t;乌贼类所占比重最小,平均年产量为1.2万t(见图 2)。
|
图 2 山东省头足类各物种产量及其比例 Fig. 2 The catch and ratio of each species of cephalopods in Shandong province |
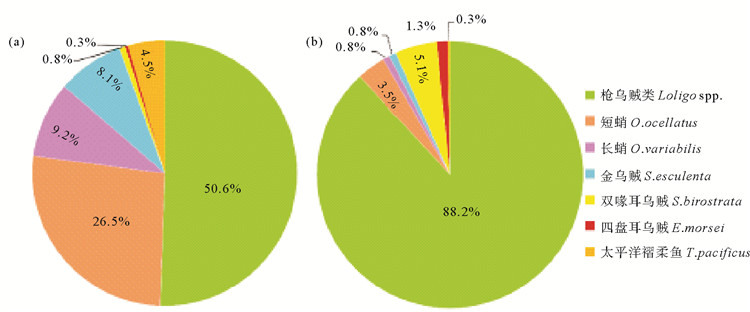
山东近海调查共捕获枪乌贼类782.5 kg,占头足类总渔获量的50.6%;共计178 410尾,占头足类总渔获尾数的88.2%。其次是长蛸(Octopus variabilis)和短蛸(Octopus ocellatus),其渔获量占比为35.7%,占总渔获尾数的4.3%。太平洋褶柔鱼(Todarodes pacificus)和金乌贼(Sepia esculenta)等种类合计占总渔获量的13.7%,占总数量的7.5%(见图 3)。综上所述,鱿鱼在山东省头足类调查中占据重要地位;尤其是在本次调查中枪乌贼类占据优势地位,所占比重远大于太平洋褶柔鱼,故以枪乌贼类作为分析重点开展本次研究。
|
( (a)渔获量比例 The ratio of catch;(b)渔获尾数比例 The ratio of individuals. ) 图 3 山东近海头足类种类组成 Fig. 3 The composition of cephalopods in Shandong coastal waters |
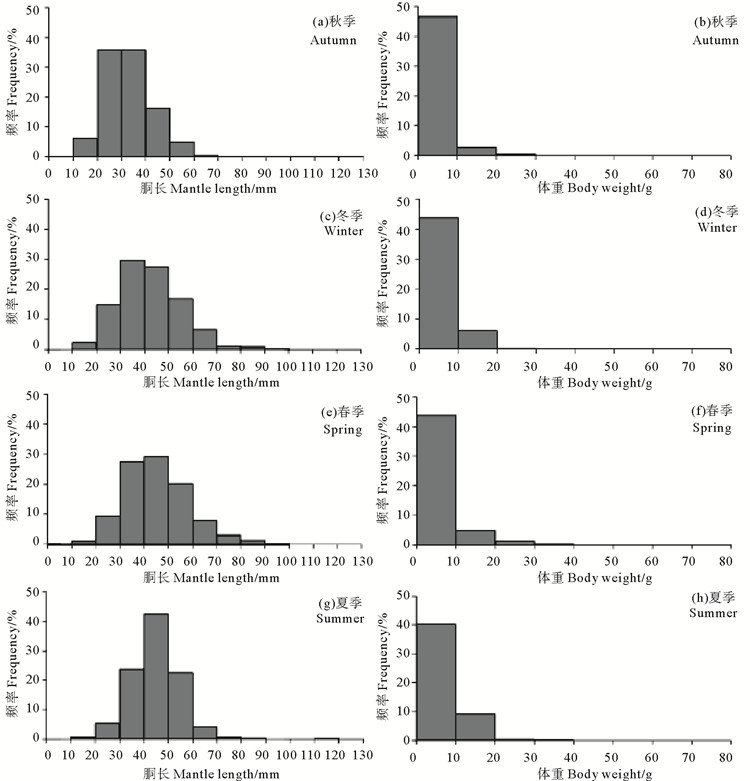
枪乌贼类全年的胴长范围为6~127 mm,平均胴长为40.14 mm;春季的平均胴长最大,为45.81 mm;夏季和冬季居中,分别为44.62和41.34 mm;秋季最小,为33.91 mm。枪乌贼类全年的优势胴长为20~50 mm,占总尾数的77.44%;秋季的优势胴长为20~40 mm,占总尾数的71.65%,个体偏小但胴长分布较为集中;冬季、春季和夏季的优势胴长均为30~50 mm,分别占总尾数的57.10%、56.62%和66.35%(见图 4)。经独立样本T检验显示,春季和夏季的胴长组成差异不显著(t=0.890,P=0.374),其他季节间的胴长组成均呈显著性差异(P < 0.01)。
|
( (a)(c)(e)(g):胴长频率;(b)(d)(f)(h):体重频率。The frequency of (a) (c) (e) (g) mantle length and (b) (d) (f) (h) body weight. ) 图 4 山东近海枪乌贼类胴长及体重频率分布 Fig. 4 The frequency of loligo squids mantel length and body weight in Shandong coastal waters |
枪乌贼类全年的体重范围为0.48~73.83 g,平均体重为5.01 g;夏季的平均体重最大,为7.21 g;冬季和春季居中,分别为5.29和5.82 g;秋季最小,为3.20 g;枪乌贼类的平均体重的变化趋势是秋季 < 冬季 < 春季 < 夏季。枪乌贼类全年的优势体重为0~10 g,占总尾数的92.84%;秋季、冬季、春季、夏季的优势体重均为0~10 g,分别占总尾数的93.40%、87.32%、87.47%和80.69%(见图 4)。经独立样本T检验显示,各季节间的体重组成均存在显著性差异(P < 0.01)。
枪乌贼的肥满度在夏季和冬季均较高,分别为7.93和7.60;但春季的肥满度较小,仅为5.77。全年的雌性数量远多于雄性(雌:雄≈2:1),雌雄比例差异较大;除秋季未进行性别鉴定外,雌雄性比的最大差异出现在春季,约为4:1。性腺成熟度Ⅰ-Ⅳ期的个体全年均有出现,但未发现产卵后个体。冬季枪乌贼类的性腺成熟度以I期为主;春季性腺成熟度也以I期为主,但是Ⅱ期以上个体所占比重明显增加;夏季则以Ⅲ期以上个体为主。性腺成熟度为Ⅲ期以上的个体在春季和夏季均有出现,冬季尚未发现。全年枪乌贼类的性腺成熟度以I期和Ⅲ期以上个体数量占据优势(见表 1)。
|
|
表 1 枪乌贼类的肥满度、性别及性腺成熟度的季节变化 Table 1 Seasonal variations in fatness, sex and gonadal maturity of loligo squids |
在2016—2017年的山东近海航次调查中,枪乌贼类在总站位中的出现频率为70.85%,各季节的出现频率为秋季(78.88%)>夏季(76.92%)>春季(70.89%)>冬季(63.19%)。资源丰度秋季最高,为456.15 kg/h;其次是夏季,为157.61 kg/h;冬季和春季均较低,分别为88.88和79.84 kg/h(见表 2)。
|
|
表 2 山东近海枪乌贼类资源丰度的季节变化 Table 2 Seasonal variations of loligo squids abundance in Shandong coastal waters |
葛允聪等[20]研究表明,枪乌贼类在黄渤海海域存在明显的季节性洄游现象。为了详细探究枪乌贼类在该海域的空间分布特征及其洄游路线之间的关系,现分成莱州湾、烟威渔场、南黄海近海海域(122°E以西,37°N以南海域)和南黄海外海海域(122°E~124°E,37°N以南海域,即枪乌贼类越冬区[20])四个区域。在不同的季节,莱州湾海域秋季资源丰度最高为76.64 kg/h,其它三个季节较低。在烟威渔场海域,秋季资源丰度最高为75.95 kg/h,其次是夏季,冬季最低仅为5.93 kg/h。南黄海近海海域秋季资源丰度最高,为299.27 kg/h,其次是夏季为87.53 kg,春季和冬季均较低约为55.00 kg/h。在南黄海外海海域(即越冬区),冬季枪乌贼资源丰度最高为28.36 kg/h,其它三个季节均较低,约为4.00 kg/h(见图 5)。经单因素方差分析显示,除南黄海近海海域(P < 0.01)外,其它海域均无显著的季节差异(P>0.05)。
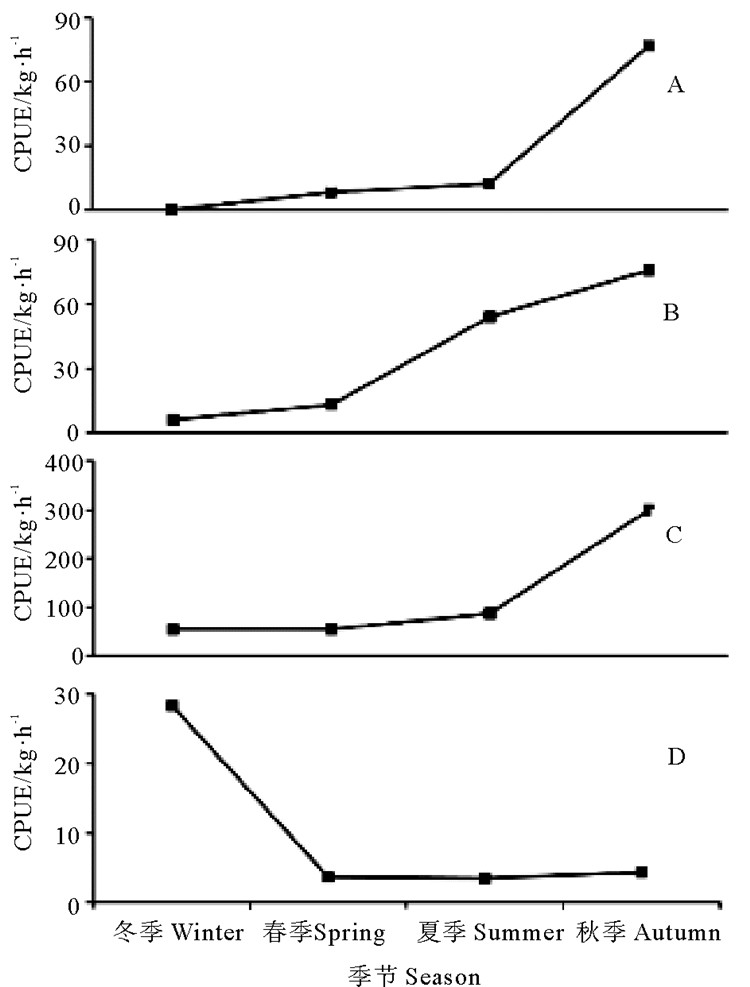
|
( A代表莱州湾;B代表烟威渔场;C代表南黄海近海海域;D代表南黄海外海海域。A is the Laizhou Bay; B is the Yanwei Fishing Ground; C is the inshore waters in Southern Yellow Sea; D is the offshore waters in Southern Yellow Sea. ) 图 5 山东近海四个区域枪乌贼资源丰度的季节性变化 Fig. 5 Seasonal variations of abundance of loligo squids in four regions of Shandong coastal waters |
秋季,南黄海近海海域枪乌贼类资源丰度最高;其次是莱州湾和烟威渔场附近海域,南黄海外海海域最低。冬季,南黄海近海海域枪乌贼类资源丰度最高,南黄海外海海域的资源丰度上升,莱州湾及烟威渔场海域降低。春季,枪乌贼类的资源丰度整体下降,但分布在南黄海近海海域的资源丰度较高,主要是海州湾渔场及邻近海域;其次是莱州湾及烟威渔场附近海域,南黄海外海海域枪乌贼的资源丰度下降。夏季,南黄海近海海域枪乌贼类资源丰度最高,其次是莱州湾和烟威渔场海域,南黄海外海海域最低(见图 6)。综上所述,枪乌贼类集中分布在南黄海近海海域,尤其是海州湾产卵场附近。
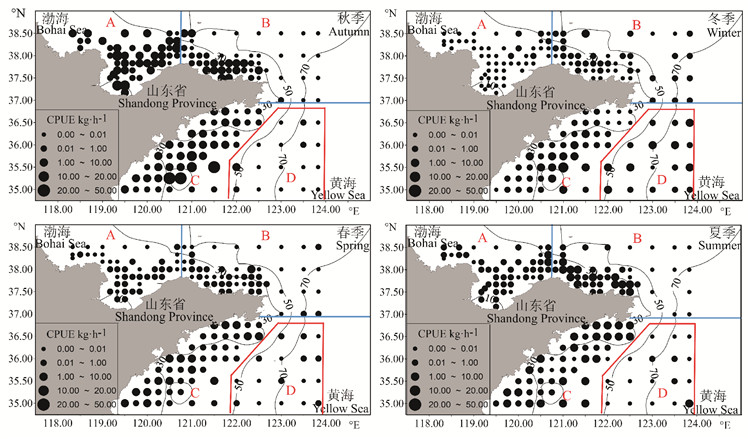
|
( A区代表莱州湾;B区代表烟威渔场;C区代表南黄海近海海域;D区代表南黄海外海海域。A is the Laizhou Bay; B is the Yanwei Fishing Ground; C is the inshore waters in Southern Yellow Sea; D is the offshore waters in Southern Yellow Sea. ) 图 6 山东近海枪乌贼类资源丰度的空间分布 Fig. 6 Spatial distribution of abundance of loligo squids in Shandong coastal waters |
根据AIC值最小的原则,筛选出的最优模型是:
| $ \begin{array}{l} \ln \left( {{\rm{CPUE}} + 0.01} \right) = \alpha + {\rm{Month + }}\\ {f_1}\left( {{\rm{SST}}} \right) + {f_2}\left( {{\rm{Depth}}} \right) + {f_3}\left( {{\rm{SSS}}} \right) + {\rm{ \mathsf{ ε} }} \circ \end{array} $ | (4) |
式中α、fi(xj)、ε含义同公式(3)。
GAM模型的方差分析表明,海水深度、表层温度和表层盐度均对山东近海枪乌贼类的资源丰度具有显著影响(P < 0.01)(见表 3)。
|
|
表 3 GAM模型的因子拟合及方差分析 Table 3 Fitting process of factors and the analysis of variance in GAM model |
山东近海枪乌贼类的资源丰度在不同月份存在明显差异:10月(秋季)最高,1月(冬季)和5月(春季)均较低。枪乌贼类资源丰度随SST的增加呈现先上升后下降的趋势:在5~16 ℃范围内随SST的增加资源丰度上升,在SST为16 ℃时出现峰值,之后随SST的增加呈缓慢下降趋势。枪乌贼类资源丰度随水深的增加变化较不明显,在水深40 m以内枪乌贼类的资源丰度较大,之后随水深的增加呈现先下降后缓慢上升的状态。枪乌贼类资源丰度和SSS之间的关系表现为:当SSS < 31.2时,枪乌贼类资源丰度变化趋势较为平缓;当SSS>31.2时,其资源丰度随盐度的增加呈上升趋势。综上所述,山东近海枪乌贼类的分布具有明显的季节变化,且集中分布在海水表温为16 ℃、海水表盐为31.2~32.5和水深40 m以内的海域(见图 7)。
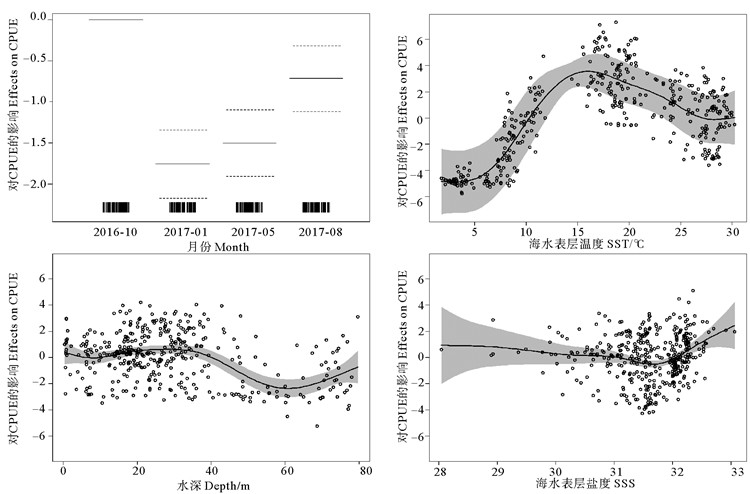
|
图 7 不同因子对枪乌贼类CPUE的影响 Fig. 7 Effects of explanatory variables on loligo squids CPUE |
山东近海枪乌贼类的平均胴长和体重的季节间差异较大,其中平均胴长和体重分别是春季和夏季最大,秋季均最小;另外,枪乌贼的雌雄性别差异也较大,且春季和夏季的性腺成熟度远比冬季的高。这是因为枪乌贼类的繁殖高峰期是在春季或夏初,交配产卵后雄性和雌性亲体相继死亡,秋季和冬季只剩下补充群体。而春夏两个季节由新生群体和产卵亲体组成[14],相比其它季节该时期枪乌贼类的平均胴长和体重均较大,性腺发育程度也较高;秋季则以新生群体居多,故该季节枪乌贼类的胴长和体重均较小。结合钟亚丁[21]的研究,将枪乌贼类的生长发育定义为卵期、稚仔期、幼体期、未成体期和成体期;在成体期枪乌贼类的胴长生长速度减慢,性腺发育明显,体重增加,与本文中春夏季节个体较大、性腺成熟度高的结果一致。本研究发现枪乌贼类的肥满度也存在较大季节差异,这主要是不同季节环境因子及饵料丰欠程度,导致了枪乌贼类个体生长的差异[22]。
枪乌贼类全年的优势胴长范围均集中在30~50 mm之间,通过比较调查资料可知,日本枪乌贼亲体的胴长范围一般为90~125 mm[23](对火枪乌贼的研究偏少),因此这次调查捕获的多为幼体。造成这种现象的原因:①亲体的产卵行为多在产卵场的沿岸发生,由于调查时期和区域往往偏离枪乌贼的产卵场,因此无法捕获到足量的亲体。②由于本次调查为多鱼种综合调查,所以调查网具为底拖网,拖网时间在白天。一方面,枪乌贼类具有昼夜垂直移动特性,白天栖于近底层水域,夜间潜入上层水体中[8];另一方面,幼体初具游泳能力,垂直活动性较差[14],所以白天进行底拖网捕捞会捕获到更多幼体,而对亲体的捕获率降低。
3.2 枪乌贼类的时空变动特征本研究结果显示,山东近海枪乌贼类的资源丰度,秋季>夏季>冬季>春季,存在明显的季节差异。都煜等[18]经过研究海州湾2011年春季、秋季和冬季的枪乌贼类发现其资源密度也存在同样的季节差异;吴强[7]通过比较莱州湾头足类的月间变化发现,秋季枪乌贼类的渔获量最高,春季的渔获量较低,与本文的研究结论一致。枪乌贼类的资源丰度除存在季节性差异外,在空间分布上也同样具有明显的变化。这是由两方面原因造成的:①因枪乌贼类生命周期短(通常为一年),生长迅速,故其渔获量易受到环境变动(如海况、气候)和人为捕捞的影响[10];②枪乌贼类具有明显的洄游习性,在繁殖季节从外海迁移到近海生殖,随着幼体生长发育,幼体的生活区域再逐步向外海迁徙。葛允聪等[20]经研究发现日本枪乌贼在黄渤海的洄游路线(火枪乌贼相近)大致为:从3月中下旬开始向沿岸水域作生殖洄游;分别于5月上中旬到达海州湾、海洋岛和渤海三个产卵场产卵,至5、6月时群体可遍布整个渤海;7、8月时新生群体及产卵群体洄游渤海,使枪乌贼在渤海的数量增加;9、10月后,随着水温的下降枪乌贼开始向深水区移动,新生群体在海洋岛渔场西南部和烟威渔场中南部集群;12月份,调查区域内的渔获量下降,集群后的群体及乳山外泛群体汇集于石岛外海后,缓缓南移至越冬场越冬,其越冬场在黄海中部(34°N~37°N,122°E~124°E)深水区(见图 8)。朱文斌等[24]通过分析东海区头足类群落结构的时空变动情况也得出洄游是影响空间分布的重要因素。
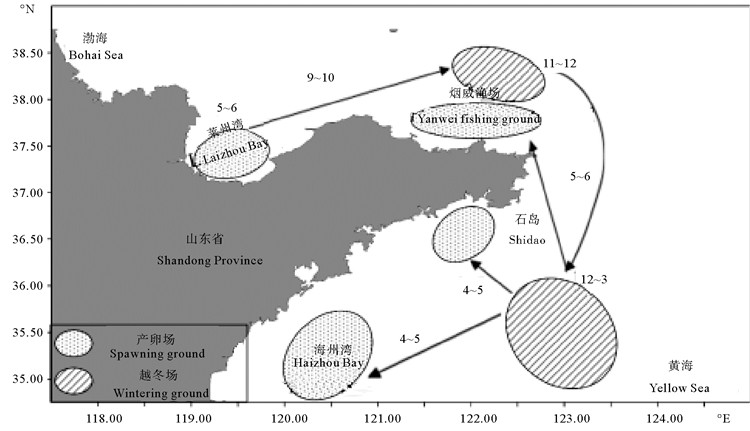
|
(位置数据引自葛允聪[20]的日本枪乌贼洄游分布图。The location data is derived from the distribution map of Japanese squid of Ge Yuncong[20]. ) 图 8 日本枪乌贼的洄游分布 Fig. 8 Migration patterns of Loligo japonica |
GAM模型的方差分析表明,海水深度、表层温度和表层盐度对山东近海枪乌贼类资源丰度的分布具有显著影响。水深对资源丰度的影响主要表现在:①枪乌贼类多栖息于沿岸浅水水域,其亲体产卵水深也仅为数米至十余米;②由于本次调查捕获的枪乌贼类多处于幼体期[21],幼体的游泳能力较弱,多位于较浅水域,所以水深会成为捕捞的限制性因素。日本枪乌贼产卵期的适宜水温范围狭窄,其产卵温度在13~16 ℃,适宜盐度在27以上[13, 25],其它时期对温度和盐度的适应范围较广,但在枪乌贼类向深水区越冬场洄游的过程中,水温也是影响洄游的重要因素,温度降低的快慢常会影响越冬洄游开始的早晚[24, 26]。Agnew[27]和Challier[28]等也经过研究发现枪乌贼类的分布情况与海水表温密切相关。相较于水深和海水表温,海水表层盐度对枪乌贼类甚至是整个头足类的影响较小[7]。山东近海在不同季节中主要受黄海冷水团和黄海暖流的影响:初春至盛夏,黄海冷水团在深水区形成的过程中,水团内外的温、盐性质产生差异[29],改变枪乌贼类栖息水域的理化环境,影响其在该海域的分布;另外冬季黄海暖流由南向北绕过山东半岛到达渤海的过程中,具有高温高盐的特点[30],从而对该海区夏季和冬季枪乌贼类的分布造成影响。
4 结语本研究表明,山东近海枪乌贼的胴长及体重组成存在明显的季节差异,肥满度在春季最低,春季和夏季枪乌贼群体的性腺发育程度较高。在时间分布上,秋季枪乌贼的资源丰度最高,春季最低;在空间分布上,枪乌贼集中分布于山东半岛南部的海州湾产卵场附近,但在冬季南黄海外海海域枪乌贼的分布数量上升,其时空分布差异与枪乌贼在黄渤海的洄游趋势一致。另外,海水深度、表层温度和表层盐度均对该海域枪乌贼的分布具有明显影响;在海水表层温度为16 ℃,表层盐度为31.2~32.5和水深40 m以内的水域,枪乌贼类的资源丰度较大。该研究结果可以合理解释山东近海枪乌贼类的时空变动情况,以便适时调整捕捞策略,维护该资源的可持续发展。
| [1] |
山东省海洋与渔业厅.山东近海经济生物资源调查与评价[M].北京: 海洋出版社, 2010: 1-3. Shandong Provincial Oceanic and Fishery Department. Investigation and Evaluation of the Economic Species in Shandong Offshore[M]. Beijing: Ocean Press, 2010: 1-3. (  0) 0) |
| [2] |
金显仕, 程济生, 邱盛尧.黄渤海渔业资源综合研究与评价[M].北京: 海洋出版社, 2006: 81-126. Jin X S, Cheng J S, Qiu S Y. Comprehensive Research and Evaluation of Fishery Resources in the Yellow Sea and Bohai Sea[M]. Beijing: Ocean Press, 2006: 81-126. (  0) 0) |
| [3] |
李涛, 张秀梅, 张沛东, 等. 山东半岛南部近岸海域渔业资源群落结构的季节变化[J]. 中国海洋大学学报(自然科学版), 2011, 41(Z1): 41-50. Li T, Zhang X M, Zhang P D, et al. Seasonal variation on community structure of fishery resources in the coastal waters of southern Shandong Peninsular[J]. Periodical of Ocean University of China, 2011, 41(Z1): 41-50. (  0) 0) |
| [4] |
Pang Y M, Tian Y J, Fu C H, et al. Variability of coastal cephalopods in overexploited China Seas under climate change with implications on fisheries management[J]. Fisheries Research, 2018, 208: 22-33. DOI:10.1016/j.fishres.2018.07.004
(  0) 0) |
| [5] |
山东省海洋与渔业厅.山东渔业统计年鉴[M].济南: 山东省海洋与渔业厅, 2003-2017. Shandong Provincial Oceanic and Fishery Department. Shandong Fisheries Statistical Yearbook[M]. Jinan: Shandong Provincial Oceanic and Fishery Department, 2003-2017. (  0) 0) |
| [6] |
都煜.山东近海日本枪乌贼空间分布特征的研究[D].青岛: 中国海洋大学, 2018: 1-50. Du Y. The Study of Spatial Distribution Characteristics of Japanese Squid (Loligo japonica) in Shandong Coastal Waters[D]. Qingdao: Ocean University of China, 2018: 1-50. (  0) 0) |
| [7] |
吴强, 陈瑞盛, 左涛, 等. 莱州湾头足类的群落结构及其与环境因子的关系[J]. 水产学报, 2018, 42(5): 684-693. Wu Q, Chen R S, Zuo T, et al. Community structure of cephalopods and its relationships with environmental factors in Laizhou Bay, Bohai Sea[J]. Journal of Fisheries of China, 2018, 42(5): 684-693. (  0) 0) |
| [8] |
陈新军, 刘必林, 王尧耕.世界头足类[M].北京: 海洋出版社, 2009: 379-382. Chen X J, Liu B L, Wang Y G. Cephalopods in the World[M]. Beijing: Ocean Press, 2009: 379-382. (  0) 0) |
| [9] |
Postuma F A, Gasalla M A. On the relationship between squid and the environment:Artisanal jigging for Loligo plei at S o Sebasti o Island (24°S), southeastern Brazil[J]. ICES Journal of Marine Science, 2010, 67(7): 1353-1362. DOI:10.1093/icesjms/fsq105
(  0) 0) |
| [10] |
杜腾飞, 李昂, 戴芳群, 等. 2006-2013年黄海秋季头足类资源状况调查与分析[J]. 中国水产科学, 2016, 23(4): 955-964. Du T F, Li A, Dai F Q, et al. Survey and analysis of the autumnal Cephalopod distribution in the Yellow Sea during 2006-2013[J]. Journal of Fishery Sciences of China, 2016, 23(4): 955-964. (  0) 0) |
| [11] |
邱显寅. 黄海日本枪乌贼的生物学特性和资源状况的初步研究[J]. 海洋水产研究, 1986(7): 109-120. Qiu X Y. Biological characteristics and stock changes of Loligo japonica in the Yellow Sea[J]. Marine Fisheries Research, 1986(7): 109-120. (  0) 0) |
| [12] |
Takechi H, Kawasaki T. Population structure of the squid, Loligo japonica, distributed in Sendal Bay[J]. Tohoku Journal of Agricultural Research, 1981, 32(3): 122-137.
(  0) 0) |
| [13] |
董正之. 中国近海头足类的地理分布[J]. 海洋与湖沼, 1978(1): 108-118. Dong Z Z. On the geographical distribution of the cephalopods in the Chinese waters[J]. Oceanologia Et Limnologia Sinica, 1978(1): 108-118. (  0) 0) |
| [14] |
都煜, 徐宾铎, 薛莹, 等. 海州湾及邻近海域日本枪乌贼时空分布的异质性[J]. 中国水产科学, 2017, 24(3): 558-565. Du Y, Xu B D, Xue Y, et al. Analysis of temporal and spatial heterogeneity of Japanese squid (Loligo japonica) in Haizhou Bay and adjacent waters[J]. Journal of Fisheries Sciences of China, 2017, 24(3): 558-565. (  0) 0) |
| [15] |
Lefkaditou E, Politou C Y, Palialexis A, et al. Influences of environmental variability on the population structure and distribution patterns of the short-fin squid Illex coindetii (Cephalopoda:Ommastrephidae) in the Eastern Indian Sea[J]. Hydrobiologia, 2008, 612(1): 1-71. DOI:10.1007/s10750-008-9494-x
(  0) 0) |
| [16] |
Yu W, Chen X J, Yi Q. Interannual and seasonal variability of winter-spring cohort of neon flying squid abundance in the northwest pacific ocean during 1995-2011[J]. Ocean and Coastal Sea Research, 2016, 15(3): 480-488.
(  0) 0) |
| [17] |
栾静, 徐宾铎, 薛莹, 等. 海州湾方氏云鳚体长与体重分布特征及其关系[J]. 中国水产科学, 2017, 24(6): 1323-1331. Luan J, Xu B D, Xue Y, et al. Size distribution and length-weight relationships in Pholis fangi in Haizhou Bay[J]. Journal of Fisheries Sciences of China, 2017, 24(6): 1323-1331. (  0) 0) |
| [18] |
Hastie T J, Tibshirani R J. Generalized Additive Models[M]. London and New York: Chapman and Hall, 1990.
(  0) 0) |
| [19] |
方舟.基于角质颚的北太平洋柔鱼渔业生态学研究[D].上海: 上海海洋大学, 2016: 1-170. Fang Z. Fisheries Ecology of Neon Flying Squid Ommastrephes bartramii in North Pacific Ocean Based on Beak[D]. Shanghai: Shanghai Ocean University, 2016: 1-170. (  0) 0) |
| [20] |
葛允聪, 邱盛尧. 黄渤海区日本枪乌贼渔获量预报方法初探[J]. 海洋渔业, 1991(2): 56-60. Ge Y C, Qiu S Y. A preliminary study on the forecast method of catches of Japanese squid (Loligo japonica) in the Yellow Sea and Bohai Sea[J]. Marine Fisheries, 1991(2): 56-60. (  0) 0) |
| [21] |
钟亚丁. 日本海枪乌贼资源与近年渔业动态和预测[J]. 现代渔业信息, 1991, 6(8): 15-19. Zhong Y D. Study on the resources of squid and fisheries dynamic and prediction in the Japan Sea[J]. Modern Fisheries Information, 1991, 6(8): 15-19. (  0) 0) |
| [22] |
李渊, 孙典荣. 北部湾中国枪乌贼生物学特征及资源状况变化的初步研究[J]. 湖北农业科学, 2011, 50(13): 2716-2719. Li Y, Sun D R. Biological characteristics and stock changes of Loligo chinensis Gray in Beibu Gulf, South China Sea[J]. Hubei Agricultural Sciences, 2011, 50(13): 2716-2719. DOI:10.3969/j.issn.0439-8114.2011.13.038 (  0) 0) |
| [23] |
邱显寅. 海州湾日本枪乌贼的怀卵量及生殖力[J]. 海洋水产研究丛刊, 1982(28): 41-47. Qiu X Y. The brood amount and fecundity of Loligo japonica in Haizhou Bay[J]. Marine Fisheries Research Series, 1982(28): 41-47. (  0) 0) |
| [24] |
朱文斌, 薛利建, 卢占晖, 等. 东海南部海域头足类群落结构特征及其与环境关系[J]. 海洋与湖沼, 2014, 45(2): 436-442. Zhu W B, Xue L J, Lu Z H, et al. Cephalopod community structure and its relationship with environmental factors in the Southern East China Sea[J]. Oceanologia et Limnologia Sinica, 2014, 45(2): 436-442. (  0) 0) |
| [25] |
吕国敏, 吴进锋, 陈利雄. 我国头足类增养殖研究现状及开发前景[J]. 南方水产, 2007, 3(3): 61-66. Lv G M, Wu J F, Chen L X. Research achievements and exploitation prospect of cephalopoda aquaculture in China[J]. South China Fisheries Science, 2007, 3(3): 61-66. DOI:10.3969/j.issn.2095-0780.2007.03.012 (  0) 0) |
| [26] |
董正之.世界大洋经济头足类生物学[M].济南: 山东科学技术出版社, 1991: 147-171. Dong Z Z. The Biology of Oceanic and Economical Cephalopods in the World[M]. Jinan: Shandong Science and Technology Press, 1991: 147-171. (  0) 0) |
| [27] |
Agnew D J, Hill S, Beddington J R. Predicting the recruitment strength of an annual squid stock:Loligo gahi around the Falkland Islands[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2000, 57(12): 2479-2487. DOI:10.1139/f00-240
(  0) 0) |
| [28] |
Challier L, Royer J, Pierce G J, et al. Environmental and stock effects on recruitment variability in the English Channel squid Loligo forbesi[J]. Aquatic Living Resources, 2005, 18(4): 353-360. DOI:10.1051/alr:2005024
(  0) 0) |
| [29] |
李昂.黄海冷水团年际变化研究[D].青岛: 中国科学院研究生院(海洋研究所), 2016: 1-98. Li A. The Study on Interannual Variability of Yellow Sea Cold Water Mass[D]. Qingdao: Institute of Oceanology of Chinese Academy of Sciences, 2016: 1-98. (  0) 0) |
| [30] |
李敏, 李增光, 徐宾铎, 等. 时空和环境因子对海州湾方氏云鳚资源丰度分布的影响[J]. 中国水产科学, 2015, 22(4): 812-819. Li M, Li Z G, Xu B D, et al. Effects of spatiotemporal and environmental factors on the distribution and abundance of Pholis fangi in Haizhou Bay using a generalized additive model[J]. Journal of Fisheries Sciences of China, 2015, 22(4): 812-819. (  0) 0) |
2. Atmosphere and Ocean Research Institute, University of Tokyo, Tokyo 277-8564, Japan;
3. College of Marine Sciences, Shanghai Ocean University, Shanghai 201306, China;
4. National Engineering Research Center for Oceanic Fisheries, Shanghai 201306, China;
5. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266071, China;
6. Shandong Hydrobios Resources Conservation and Management Center, Yantai, 264003, China
 2020, Vol. 50
2020, Vol. 50


