2. 中国海洋大学海洋环境与生态教育部重点实验室,山东 青岛 266100
自1950年代塑料产业迅猛发展以来,其在环境中的含量持续增加。大型塑料垃圾被排放进入水体后,经由物理、化学和生物作用逐渐分解成不同尺寸的塑料碎片,学术界通常将粒径在5 mm以下的塑料碎片称为微塑料[1-3]。微塑料在水环境中广泛分布,目前水环境中常见的微塑料类型主要包括聚乙烯(Polyethylene, PE)、聚丙烯(Polypropylene, PP)、聚氯乙烯(Polyvinyl chloride, PVC)、聚苯乙烯(Polystyrene, PS)等。从滨海沙滩到开阔大洋、从表层海水到海底、深海沉积物及海洋生物体内均有不同类型的微塑料检出。微塑料污染主要集中在沿海地区和亚热带环流区,但即使在远离污染源的极地地区也有微塑料的存在。由于其具有体积小、疏水性强、不易被生物降解的特点,可以在环境中长期存在。微塑料进入贻贝(Mytilus edulis)体内后可诱导溶酶体膜的稳态失衡并形成粒细胞瘤,且随着暴露时间的延长炎症反应加剧[4]。这表明微塑料可以进入细胞内,并在组织和细胞水平上对生物产生毒害作用。尽管大粒径塑料的研究最为广泛,但纳米塑料在海洋环境中的数量可能更为庞大[5]。大粒径塑料的进一步碎片化是水环境中纳米塑料的重要来源之一,纳米塑料颗粒能降低蛋白核小球藻细胞叶绿素a含量,并增加细胞内活性氧(Reactive oxygen species, ROS)水平[6];纳米塑料还具有生物积累和生物放大的潜力[7],已有研究证明其可沿食物网从藻类向浮游动物和鱼类传递。纳米塑料是微塑料相关研究中报道最少的一种塑料类型,目前对其环境浓度、生物积累潜力和毒性知之甚少。
多溴联苯(Polybrominated diphenyl ethers, PBDEs)是一类溴化阻燃剂,稳定性强且价格低廉,因此被广泛应用于电子电器、建筑材料以及塑料的加工过程中。溴化程度较低的溴化二苯醚(主要是BDE-47、-99、-100)是生物样品中检测到的主要同系物,其中BDE-47占PBDEs总量的70%左右。BDE-47的高度亲脂性(log Kow=6.67)使其容易在生物体内积累[8],因此,其对水生生物的毒性效应已引起学术界和民众的高度关注。Jiang等[9]研究发现,暴露于BDE-47溶液中的贻贝(Mytilus edulis)血细胞死亡率和微核率均增加,溶酶体的吞噬能力显著降低。此外,BDE-47暴露显著增加了鲑鱼头肾巨噬细胞中超氧阴离子的产生量,并使鲑鱼在鳗利斯顿氏菌(Listonella anguillarum)攻击下的存活率降低,这表明BDE-47暴露可改变鲑鱼的先天免疫应答和疾病易感性[10]。但在自然环境中,海洋往往受到多种化学污染物的共同作用,Oliveira等[11-12]研究发现,在PS与芘的联合暴露组中,鰕虎鱼(Pomatoschistus microps)体内乙酰胆碱酯酶(Acetylcholinesterase, AChE)和异柠檬酸脱氢酶(Isocitrate dehydrogenase, IDH)活性显著降低。PS和PAHs复合暴露可在细胞和基因水平上干扰日本青鳉(Oryzias latipes)内分泌系统的正常功能。已有研究表明[13],与BDE-47单独暴露相比,PS和BDE-47联合暴露显著提高了贻贝(Mytilus edulis)的呼吸速率和体内丙二醛(Malondialdehyde, MDA)含量。因此,微塑料与其他环境污染物复合污染的潜在风险值得进一步研究,以期更深入地了解微塑料对海洋生物的生态毒性。
生物标志物是反映环境污染状况的毒理学指标,可通过监测其变化情况来评估污染物的毒性效应[14]。但不同生物标志物对污染物的响应强度及变化各异,孤立使用单一生物标志物无法全面准确评估某一种环境污染物的毒性效应。而综合生物标志物响应(Integrated Biomarker Response, IBR)则可以定量评估一系列生物标志物对环境污染物的综合响应情况。李传慧[15]通过检测几种抗氧化酶和免疫酶的含量来探究原油污染对半滑舌鳎幼鱼(Cynoglossus semilaevis)的毒性效应,IBR分析结果表明,溶菌酶(Lysozyme,LSZ)和Na+-K+-ATPase对石油污染更敏感,适合作为石油类污染的生物标志物。李志华等[16]以鳟鱼为受试生物,运用IBR指数分析污水排放对河流上、下游环境的影响,结果表明水体中39种污染物对下游的污染均显著强于上游。除上述应用外,国内外其他学者也运用该方法对不同水体的污染程度进行了一系列评估[17-19]。
黑褐新糠虾(Neomysis awatschensis)是一种较小的甲壳类浮游动物,常见于河口近岸水域。由于其具有易于培养和操作、生命周期短等优点,被认为是生态毒理学研究很有前景的模式生物。纳米塑料具有更大的比表面积和强疏水性,可吸附海洋环境中其他化学污染物,形成“外源污染物+纳米塑料”的复合污染模式。已有研究报道了微塑料和BDE-47单独暴露下的毒性效应,但2种污染物联合暴露下的复合效应目前尚不明确。为了探究微塑料和BDE-47对黑褐新糠虾的毒性效应,本研究选择PS和BDE-47作为胁迫因子,通过测定黑褐新糠虾体内过氧化氢酶(Catalase, CAT)、超氧化物歧化酶(Superoxide dismutase, SOD)、谷胱甘肽过氧化物酶(Glutathione peroxidase, GPX)、谷胱甘肽硫转移酶(Glutathione S-transferase, GST)、谷胱甘肽(Glutathione, GSH)和MDA的活性水平,并结合IBR指数定量评估PS和BDE-47单独及联合暴露下的毒性效应,研究结果可为评估PS和BDE-47共存条件下的海洋环境健康风险提供一定的科学依据。
1 材料与方法 1.1 实验材料实验用海水来自青岛市近岸洁净海区,经过滤、消毒后使用;黑褐新糠虾(Neomysis awatschensis)由中国海洋大学海洋生物博物馆提供。实验前室内驯养一周:盐度为21±0.6;温度为(22.6±0.6) ℃;pH为8.1±0.1,每天以新孵化的卤虫(Artemia franciscana)为饵料投喂两次(上午8:00,下午17:00)。每48 h更换新鲜海水,并及时清理排泄物、残饵和死亡个体。2.5%(W∶V)的聚苯乙烯微球购自天津倍思乐色谱技术开发中心(90 nm,10 mL);2, 2′, 4, 4′-四溴联苯醚(BDE-47,纯度95%, 购自上海源叶生物科技有限公司),用二甲亚砜(DMSO,分析纯,购自科密欧化学试剂有限公司)作为助溶剂配置1.5 g·L-1的母液。
1.2 实验方法 1.2.1 暴露浓度设计根据研究报道[20],目前微塑料丰度最高值(102 000个/L)出现在瑞典沿海水域。根据Lenz等的估计,塑料微球直径每减少10倍,其环境丰度将增加1 000倍[21]。基于文献报道的海洋环境中微塑料丰度和水生生物毒性试验浓度设置[18, 22],本研究中微塑料暴露设置4个浓度:9.74、97.4、974和9 740 μg·L-1,另设一个空白对照组,每组三个重复。
BDE-47溶解度较低,在自然海水中的环境浓度一般在1 μg·L-1左右[23]。目前已有相关研究表明1~15 μg·L-1的BDE-47暴露对海洋生物有显著毒性[24-25]。基于海水中BDE-47的环境浓度和已有报道中海洋生物毒性试验的浓度设置,本研究将BDE-47的暴露浓度设为1.5、15和150 μg·L-1。另设一个空白对照组,一个溶剂对照组(0.002% DMSO),每组三个重复。
联合暴露组:9.74 μg·L-1 PS+1.5 μg·L-1 BDE-47,9.74 μg·L-1 PS+150 μg·L-1 BDE-47,9 740 μg·L-1 PS+1.5 μg·L-1 BDE-47,9 740 μg·L-1 PS+150 μg·L-1 BDE-47;另设一个空白对照组,一个溶剂对照组(0.002% DMSO),每组三个平行。分别记为LP+LB组,LP+HB组,HP+LB组,HP+HB组,CK组和SOLVENT组。
1.2.2 染毒实验与样品制备选择驯化后体长相近(5±0.5) mm、健康活泼的黑褐新糠虾,随机将其分配到20 L玻璃缸中(加入15 L海水),每缸放入80只糠虾,连续曝气培养,每48 h更换全部溶液,其他实验条件与驯养期相同。每天定时投喂并清理玻璃缸,于第21天收集受试生物用于各项生物标志物测定。用去离子水冲洗掉样本体表粘附的溶液,并用滤纸拭干多余水分,取10只糠虾置于Eppendorf管中,在冰水浴条件下,以PBS缓冲液作为匀浆介质,采用电动生物组织研磨器(G10,生工生物工程股份有限公司,上海)将样品制成质量分数为10%的组织匀浆液。经4 ℃、8 000 r·min-1低温离心10 min,取上清液用于各项指标的测定。
1.2.3 实验指标测定蛋白质含量测定采用考马斯亮蓝法;SOD、CAT、MDA、GST、GSH和GPX的活性均采用南京建成生物工程研究所提供的试剂盒测定,具体操作按照说明书进行,并借助酶标仪(SP-Max 2300A,上海闪谱生物科技有限公司,上海)及紫外分光光度计(UV754N,青岛路博建业环保科技有限公司,青岛)测定吸光度。
IBR数值的具体计算过程主要包括以下步骤[26]:
首先计算各个生物标志物在每个实验水平三个重复的平均值xi;每个生物标志物在全部实验水平下的总体平均值x和标准差s。按以下公式对每种生物标志物在所有实验水平下的数据均一化:
| $ Y_{i}=\left(\bar{x}_{i}-\bar{x}\right) / s_{\circ} $ | (1) |
式中Yi是xi均一化后的值。
各生物标志物在每个实验水平下的得分情况按下式计算:
| $ S_{i}=Z+|{Min}|。$ | (2) |
式中:|Min|是各生物标志物在所有实验水平下的Zi最小值的绝对值;Z由上一步均一化数值推导而来,若生物标志物受到激活,则令Z=+ Yi;若生物标志物受抑制,则令Z=-Yi。
其次绘制星状图并计算面积:星状图中每条辐射线的长度分别表示某一实验水平下一种生物标志物的得分Si。按照以下公式计算面积:
| $ A_{i}=0.5 \times S_{i} \times \sin \beta \times\left(S_{i} \times \cos \beta+S_{i+1} \times \sin \beta\right) 。$ | (3) |
式中:Si和Si+1分别表示星状图中顺时针方向连续两个得分;n表示所测定的生物标志物的数目;Ai表示第i条和第i+1条辐射线所围成的三角形的面积。
| $ \beta=\arctan \left(\frac{S_{i} \sin \alpha}{\left.S_{i}-S_{i+1} \cdot \cos \alpha\right)}, \alpha=\frac{2 {\rm{ \mathsf{ π} }}}{n} 。\right. $ | (4) |
式中α为相邻两条辐射线之间的夹角。
综合生物标志物响应(IBR)即是星状图的总面积,计算公式为:IBR=∑i=1nAi。IBR数值越大表明生物受环境污染物的影响越大。
1.3 数据处理数据以平均值(标准差(Mean±SD)表示,并借助SPSS 25.0对各组数据进行单因素方差分析(One-way ANOVA),采用最小显著差数法(LSD法)检验组内及组间的显著性差异(P < 0.05差异显著,P < 0.01差异极显著)。采用Origin 2018进行绘图。
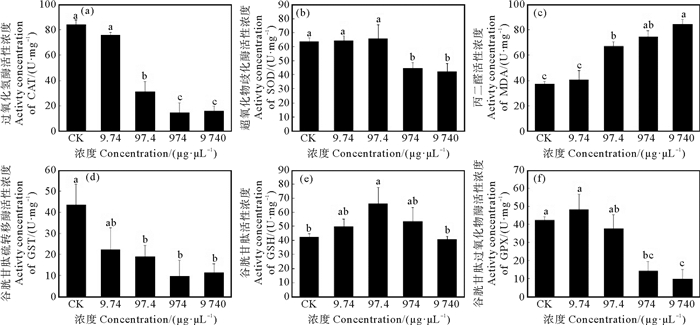
2 结果 2.1 PS单独暴露对黑褐新糠虾体内生物标志物的影响所有PS暴露浓度下的CAT活性均低于空白对照组,并随着暴露浓度的增加而逐渐降低。当暴露浓度较高时(97.4~9 740 μg·L-1),实验组的CAT活性与对照组间差异显著,并在974 μg·L-1浓度组中达到最低活性水平,浓度继续增加至9 740 μg·L-1时,CAT活性未继续降低(见图 1(a))。SOD活性仅在高暴露浓度组中(974~9 740 μg·L-1)显著低于对照组(见图 1(b))。与对照组相比,低浓度PS组中(9.74 μg·L-1)MDA含量未显著改变,随着暴露浓度的增加,MDA含量逐渐升高且与对照组间有显著差异(见图 1(c))。与对照组相比,GST活性在较高浓度组中(97.4~9 740 μg·L-1)显著降低,但各PS实验组间并无显著差异,GST活性整体呈现降低的趋势(见图 1(d))。当暴露浓度为97.4 μg·L-1时,GSH含量显著升高,但其他实验组与对照组间并无显著差异,GSH含量随暴露浓度的增加总体呈现先升高后降低的趋势(见图 1(e))。当暴露浓度为974~9 740 μg·L-1时,GPX活性显著低于对照组,且各实验组间GPX活性存在显著差异,随着暴露浓度的增加GPX活性整体呈降低的趋势(见图 1(f))。
|
(Different letters indicate significant differences between the experimental groups, P < 0.05) 图 1 PS单独暴露对黑褐新糠虾抗氧化机能的影响(不同字母表示各实验组间有显著差异,P<0.05) Fig. 1 Effects of PS exposure on antioxidant capacity in Neomysis awatschensis |
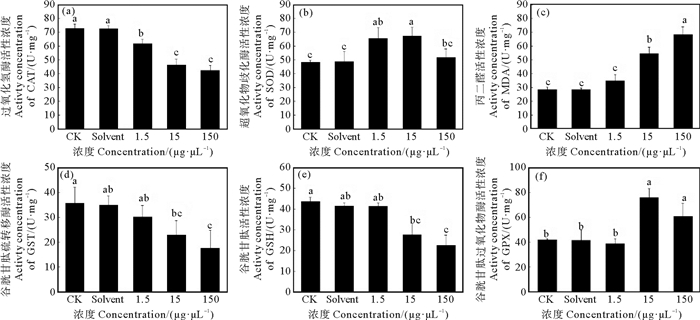
暴露21 d后,空白对照组和溶剂对照组间无显著差异,说明溶剂对实验结果无显著影响。与空白和溶剂对照组相比,各实验组中CAT活性均显著降低,当暴露浓度为150 μg·L-1时,CAT活性达到最低活性水平,CAT活性整体呈现降低的趋势(见图 2(a))。当暴露浓度为1.5~15 μg·L-1时,SOD活性显著高于空白对照组和溶剂对照组,而当浓度进一步增加到150 μg·L-1时,SOD活性恢复至对照组水平,SOD活性整体呈现先升高后降低的趋势(见图 2(b))。与对照组相比,随着暴露浓度的增加,各实验组的MDA含量逐渐升高,当浓度为15~150 μg·L-1时,MDA含量显著高于对照组,且各实验组间的MDA含量差异显著(见图 2(c))。当暴露浓度较高时(15~150 μg·L-1), GST活性显著低于对照组,但无显著的组间差异(见图 2(d))。与对照组相比,低浓度组(1.5 μg·L-1)中的GSH含量未发生显著变化,当浓度进一步升高时,GSH含量显著降低,GSH含量随着暴露浓度的升高整体呈现降低的趋势(见图 2(e))。当暴露浓度处于低水平时(1.5 μg·L-1),GPX活性与对照组无显著差异,随着暴露浓度继续升高,GPX活性与对照组间存在显著差异, 并在15 μg·L-1的浓度组中达到最大活性水平,GPX活性整体呈现先升后降的趋势(见图 2(f))。
|
图 2 BDE-47单独暴露对黑褐新糠虾抗氧化机能的影响 Fig. 2 Effects of BDE-47 exposure on antioxidant capacity in Neomysis awatschensis |
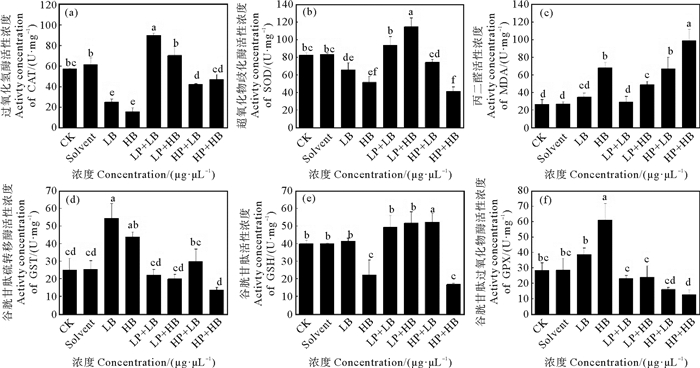
与对照组相比,在BDE-47实验组中投加低浓度PS后,CAT活性显著升高,随着PS投加量的增加,CAT活性出现显著下降。与BDE-47单独暴露时相比,各联合暴露组的CAT活性均显著升高(见图 3(a))。在低浓度PS和高浓度BDE-47、高浓度PS和低浓度BDE-47、高浓度PS和高浓度BDE-47联合暴露组中,观察到SOD活性与对照组间均存在显著差异。与BDE-47单独暴露组相比,当BDE-47浓度较低时,加入低浓度PS可使SOD活性显著升高,继续升高PS浓度则会使SOD活性降低但未见显著差异;当BDE-47浓度较高时,加入低浓度PS同样会使SOD显著升高并达到最大活性水平(见图 3(b))。在各联合暴露组中,当BDE-47暴露浓度较低时, 高浓度PS的存在使MDA含量显著高于BDE-47单独暴露组;当BDE-47暴露浓度较高时,随着PS浓度的升高MDA含量逐渐升高,且在高浓度PS和高浓度BDE-47共存时出现最大含量(见图 3(c))。
|
(CK:空白对照;Solvent:溶剂对照;LB:低浓度BDE-47组;HB:高浓度BDE-47组;LP+LB:低浓度PS+低浓度BDE-47组;LP+HB:低浓度PS+高浓度BDE-47组;HP+LB:高浓度PS+低浓度BDE-47组,HP+HB:高浓度PS+高浓度BDE-47组。CK: Control; SOLVENT: Solvent control; LB: Low BDE-47 concentration groups; HB: High BDE-47 concentration groups; LP+LB: Low PS+Low BDE-47 concentration groups; LP+HB: Low PS+High BDE-47 concentration groups; HP+LB: High PS+ Low BDE-47 concentration groups; HP+HB: High PS+High BDE-47 concentration groups.) 图 3 PS和BDE-47联合暴露对黑褐新糠虾抗氧化机能的影响 Fig. 3 Effects of PS and BDE-47 combined exposure on antioxidant capacity in Neomysis awatschensis |
各联合暴露组中GST活性与对照组相比无显著差异,且均低于BDE-47单独暴露组,当BDE-47浓度较低时,GST活性随着PS投加浓度的升高而显著增加;当BDE-47浓度较高时,增加PS的投加浓度并未显著改变GST活性(见图 3(d))。当低浓度PS分别与低、高浓度的BDE-47联合暴露时,GSH含量与对照组间无显著差异;当高浓度PS分别与低、高浓度的BDE-47联合暴露时,GSH含量与对照组间有显著差异,且随着BDE-47浓度升高显著降低。与BDE-47单独暴露相比,当BDE-47浓度较低时,投加高浓度PS可使GSH含量显著升高,而当BDE-47浓度较高时,低浓度PS的存在可使联合暴露组的GSH含量显著升高(见图 3(e))。与对照组相比,仅高浓度PS和高浓度BDE-47联合暴露组的GPX活性显著降低,且各联合暴露组的GPX活性均显著低于BDE-47单独暴露组(见图 3(f))。
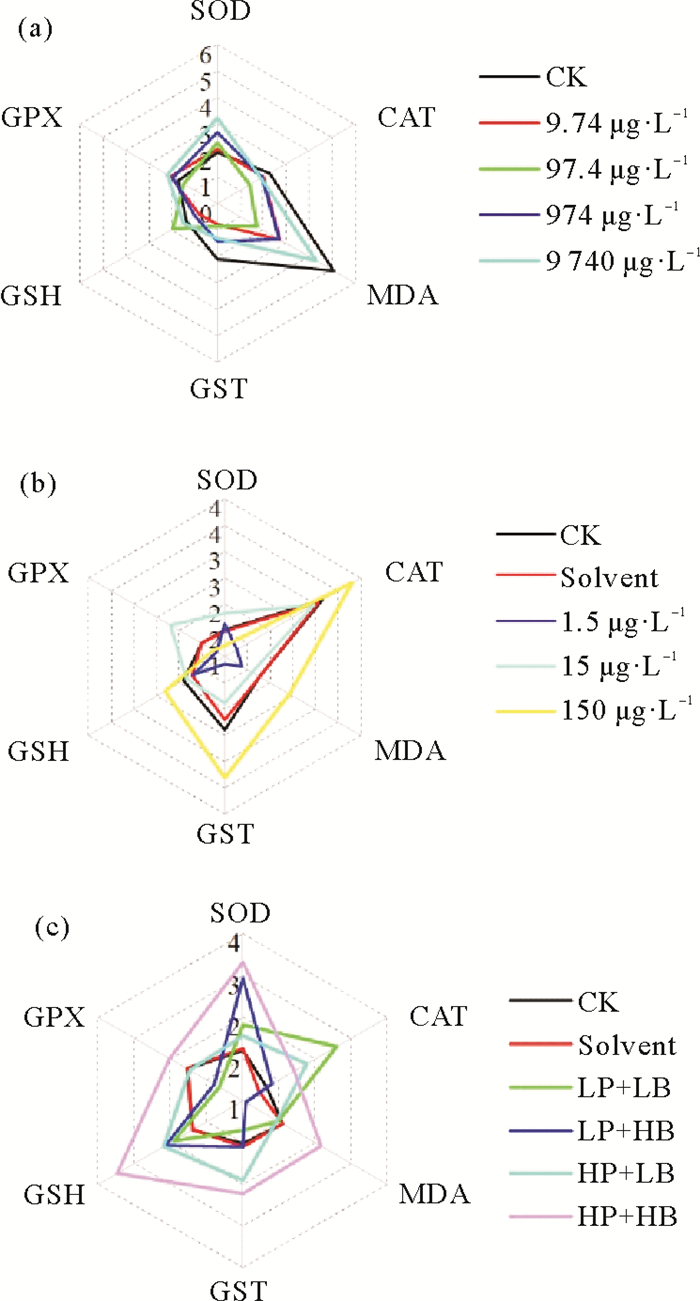
2.4 综合生物标志物分析星状图中每个不规则多边形的面积分别代表该实验组的IBR数值,六种生物标志物在不同的实验组中具有不同的响应模式,与其他实验组相比,最高浓度组的星状图覆盖面积最大,即IBR数值也最大。由图 4(a)可知,在较低暴露浓度下(9.74 μg·L-1),GPX、CAT、MDA及SOD几种生物标志物有较高的响应水平,最高响应水平为9 740 μg·L-1浓度组的MDA含量(4.31)。总体而言,SOD、CAT、MDA和GPX在所有浓度下均有较高的响应水平,说明这几种生物标志物对于PS污染的反应比较灵敏。不同BDE-47暴露浓度下的IBR响应水平如图 4(b)所示,随着暴露浓度的升高,星状图的覆盖面积逐渐增加,说明BDE-47对黑褐新糠虾的胁迫作用随浓度增加而加剧,其中最大响应水平出现在150 μg·L-1浓度组的CAT活性中(3.81)。整体而言,CAT、MDA、GST和GSH有较高的响应水平,表明以上几种生物标志物对于BDE-47污染的反应比较灵敏。PS和BDE-47联合暴露下的IBR响应水平如图 4(c)所示,不同联合暴露条件下的响应情况不一致,当高PS浓度和高BDE-47浓度联合暴露时,星状图覆盖面积最大,IBR数值也最大(28.1),表明当高浓度PS和高浓度BDE-47共存时黑褐新糠虾受到的胁迫效应最强。SOD、MDA、CAT、GST和GSH在所有暴露浓度下均有较高的响应水平,说明以上生物标志物在PS和BDE-47共存时具有较高的灵敏度。
|
(CK:空白对照;Solvent:溶剂对照;LB:低浓度BDE-47组;HB:高浓度BDE-47组;LP+LB:低浓度PS+低浓度BDE-47组;LP+HB:低浓度PS+高浓度BDE-47组;HP+LB:高浓度PS+低浓度BDE-47组,HP+HB:高浓度PS+高浓度BDE-47组。(a) PS单独暴露下黑褐新糠虾体内综合生物标志物响应星状图;(b) BDE-47单独暴露下黑褐新糠虾体内综合生物标志物响应星状图;(c) PS和BDE-47联合暴露下黑褐新糠虾体内综合生物标志物响应星状图。CK: Control; Solvent: Solvent control; LB: Low BDE-47 concentration groups; HB: High BDE-47 concentration groups; LP+LB: Low PS + Low BDE-47 concentration groups; LP+HB: Low PS + High BDE-47 concentration groups; HP+LB: High PS+ Low BDE-47 concentration groups; HP+HB: High PS+ High BDE-47 concentration groups. (a) Integrated Biomarker Response in Neomysis awatschensis exposed to PS; (b) Integrated Biomarker Response in Neomysis awatschensis exposed to BDE-47; (c) Integrated Biomarker Response in Neomysis awatschensis under combined exposure of PS and BDE-47) 图 4 PS和BDE-47单独及联合暴露下黑褐新糠虾体内综合生物标志物响应星状图 Fig. 4 IBR of Neomysis awatschensis under single and combined exposure of PS and BDE-47 |
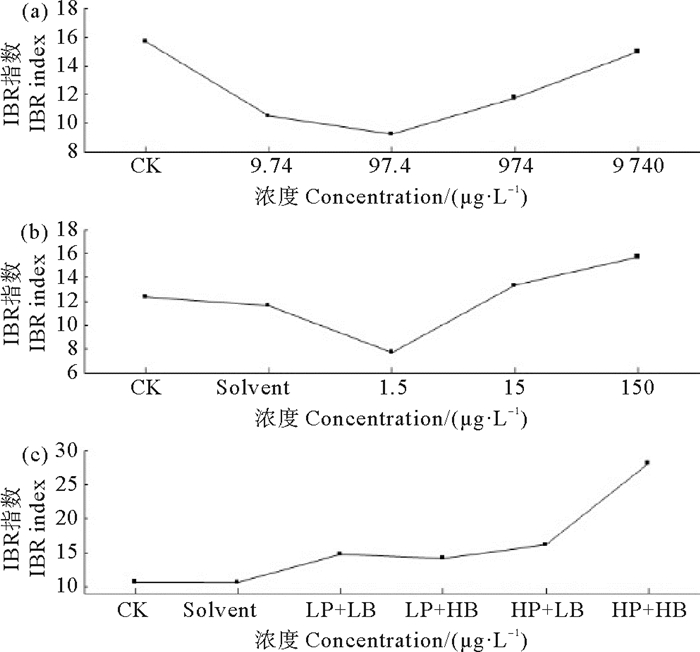
各实验组IBR响应水平随暴露浓度的变化情况如图 5所示。当PS单独暴露时(见图 5(a)),IBR响应水平随着暴露浓度的增加整体上呈现先降低后升高的变化趋势,当暴露浓度为97.4 μg·L-1时有最低的响应水平(9.21),随着暴露浓度的进一步增加,IBR值逐渐增加并在9 740 μg·L-1浓度组中达到最大水平(14.98)。当BDE-47单独暴露时(见图 5(b)),与对空白对照组和溶剂对照组相比,随着暴露浓度的增加IBR数值逐渐增大,并在150 μg·L-1浓度组中达到最大响应水平(15.69)。当PS和BDE-47联合暴露时(见图 5(c)),所有联合暴露实验组的IBR响应水平均高于空白对照组和溶剂对照组,在低浓度PS存在时,增加BDE-47的暴露浓度并未观察到IBR响应水平的升高,而在高浓度PS存在时,增加BDE-47的暴露浓度可使IBR响应水平随之升高,在高浓度PS和高浓度BDE-47共存时有最大响应水平(28.1)。
|
((a) PS单独暴露下黑褐新糠虾体内综合生物标志物响应;(b) BDE-47单独暴露下黑褐新糠虾体内综合生物标志物响应;(c) PS和BDE-47联合暴露下黑褐新糠虾体内综合生物标志物响应。(a) IBR variation with concentrations in Neomysis awatschensis exposed to PS; (b) IBR variation with concentrations in Neomysis awatschensis exposed to BDE-47; (c) IBR variation with concentrations in Neomysis awatschensis under the combined exposure of PS and BDE-47) 图 5 PS和BDE-47单独及联合暴露下黑褐新糠虾体内综合生物标志物响应 Fig. 5 IBR variation with concentrations in Neomysis awatschensis under single and combined exposure of PS and BDE-47 |
本研究选用的黑褐新糠虾是一种小型杂食性甲壳动物,由于其在环境中分布范围广、室内驯养便利,已被用作生态毒理学的模式生物。研究表明[27-29],ROS水平升高和氧化应激是机体在纳米颗粒胁迫下产生损伤的早期事件。本文以黑褐新糠虾为受试生物进行PS的胁迫实验,结果表明PS暴露可能增加黑褐新糠虾体内的ROS水平,从而激活细胞抗氧化防御系统来对抗氧化应激,这与先前的研究报道结论相符[30-31]。在高暴露浓度下(974~9 740 μg·L-1),SOD和GPX的活性被显著抑制,这与Yu等[20]的研究结果相似。这可能是因为在高浓度PS暴露下超氧阴离子的产生速率超过抗氧化防御系统的清除速率,致使生物机体受到不可逆转的损伤。而MDA含量在低浓度下低于对照组,这是因为随着抗氧化防御系统被激活,机体产生的抗氧化物质清除了可对组织细胞造成损伤的自由基,随着PS暴露浓度继续增加,MDA含量逐渐升高,表明PS以浓度依赖的方式诱导脂质过氧化。Zheng等[32]的研究表明PS暴露可使大鼠肝细胞的MDA含量被显著诱导,这与本研究的结果相符。Abidli等[33]通过14 d暴露试验探究了PE对贻贝的潜在毒性,结果表明抗氧化系统内的CAT与GST活性均降低。本研究中,随着PS浓度的增加CAT和GST活性也都受到抑制,这一现象的产生可能是因为高浓度PS需要抗氧化防御系统产生大量的抗氧化酶来将其清除,另外在高浓度PS的长期毒害作用下,机体抗氧化防御系统的解毒功能受到损伤,故CAT和GST活性迅速降低。
在选取的BDE-47暴露浓度范围内,所有实验组的CAT和GST活性均受到显著抑制,这与先前的研究结果相似[34]。这一过程表明在低浓度外源污染物的长期暴露下,机体内自由基、过氧化物的含量大量增加,需要消耗抗氧化酶来将其清除,故造成CAT和GST活性显著低于对照组,当浓度升高至中等浓度时,CAT与GST活性未继续增加,这可能是因为黑褐新糠虾在通过自身的调节能力适应该浓度范围内的BDE-47胁迫。当暴露浓度升高至最大水平时,CAT活性继续降低,而GST活性仍未出现显著变化,由此可知BDE-47对CAT活性的影响较GST更强。已有研究表明[15],解除石油污染胁迫后,半滑舌鳎(Cynoglossus semilaevis)幼鱼体内的CAT活性在一定浓度范围内可恢复至空白水平,并得到了石油胁迫对CAT活性的影响阈值。由此推断,SOD活性在高浓度暴露下可恢复至与对照组相近水平的潜在原因可能是本文所设暴露浓度尚未超过BDE-47对黑褐新糠虾SOD活性的影响阈值,机体仍能通过调节作用适应污染环境。而MDA含量则随着浓度的增加呈现显著的剂量效应关系,这与先前的研究报道相同[35],表明脂质过氧化作用在逐渐加强,最终可能导致生物膜系统的稳态失衡[36],在今后的研究中可结合组织病理学分析深入探究BDE-47的毒害作用。GSH是生物抗氧化防御系统中的重要成分,可作为GST和GPX的反应底物通过催化反应清除自由基和过氧化物,对于维护生物体免疫系统的正常功能具有重要作用[37-38]。较高浓度组(15~150 μg·L-1)的GSH含量显著降低,而GPX的活性显著增加,原因可能是机体受到环境中高浓度BDE-47的长期胁迫后,抗氧化防御系统会产生大量的GPX来清除自由基。
由于其特殊的理化性质,纳米塑料作为载体吸附其他外源化学污染物的潜力值得关注,如有机氯农药[39]、多环芳烃[40]、多溴联苯醚[41]、多氯联苯[42]、双酚A[43]和重金属[44],其中包括致癌物和内分泌干扰物。微塑料的吸附作用可能会增加污染物在生物体内的浓度,并通过食物网向更高营养级生物转移[45]。PS和BDE-47联合暴露组的CAT活性均显著高于BDE-47单独暴露组,表明PS的加入缓解了BDE-47对黑褐新糠虾体内CAT的损伤。联合暴露组的GST活性显著低于BDE-47单独暴露组,并且与对照组活性水平相近,GPX活性的变化规律同GST活性相似,仅在高浓度BDE-47和高浓度PS共存时表现出显著的抑制效应。低浓度PS与低、高浓度BDE-47联合暴露下的GSH含量与对照组相近,以上结果进一步说明PS的存在可能在一定程度上缓解了BDE-47对糠虾机体抗氧化防御系统的胁迫作用,随着PS暴露浓度的继续增加,抗氧化物质的活性会受到抑制,这种效应是产生中毒反应的前兆。由联合暴露组的IBR随浓度变化趋势可知,当PS浓度较低时,升高BDE-47的暴露浓度并未增加氧化胁迫,这也证实了PS的存在可在一定范围内缓解BDE-47的暴露毒性。产生这一现象的原因可能是微塑料的吸附作用降低了BDE-47的生物可利用度,故在一定范围内削减了BDE-47对机体的氧化应激。有研究报道称[46],PVC和低浓度17α-乙烯基雌二醇(EE2)联合暴露时,PVC可通过吸附作用降低EE2的自由态来减缓其对斑马鱼(Danio rerio)运动行为的抑制。Oliveira等[47]研究发现加入低浓度PS微球可将芘对鰕虎鱼(Pomatoschistus microps)的半数致死时间(LT50)从29.0 h延缓至42.1 h。此前也有研究表明[48-49],总比表面积越大,微塑料的吸附效率越大,这可能是低浓度PS暴露减轻胁迫而高浓度PS暴露无此效应的潜在解释。当PS的投加浓度较高时,PS颗粒聚集结合从而减少了总比表面积,降低了PS对自由态BDE-47的吸附,胁迫作用加剧。也有研究表明[50],四溴双酚A(TBBPA)和PS对斑马鱼(Danio rerio)抗氧化防御系统的毒性作用主要表现为协同作用;Lu等[51]的研究也表明,PS与Cd联合暴露可显著抑制斑马鱼(Danio rerio)肠道组织中GSH的含量,二者表现出协同作用;何君仪[52]的研究结果表明,PS的加入会增强三磷酸苯酯(TPP)对斑马鱼(Danio rerio)抗氧化防御系统的氧化胁迫,这与本研究的结论相反。PS与荧蒽联合暴露对贻贝(Mytilus edulis)细胞中ROS的含量先表现为协同效应,后表现为拮抗效应[53]。由此可知,微塑料与外源污染物联合暴露对水生生物的毒性作用模式较为复杂,本文选取了一系列生物标志物作为评价指标来表征微塑料和BDE-47单独及联合暴露对黑褐新糠虾的毒性效应,今后可在本研究的基础上结合组织病理学分析、基因组学和代谢组学等先进分子生物学技术,深入探究其毒性作用机制。
4 结论(1) 随着PS暴露浓度的增加,CAT、GST、SOD和GPX活性均表现出抑制效应,MDA含量表现出诱导效应,而GSH含量仅在97.4 μg·L-1下被显著诱导。随着BDE-47暴露浓度的增加,CAT、GST和GSH均表现出抑制效应,MDA和GPX在较高浓度下被显著诱导,SOD在低浓度下被诱导,当浓度增加至最大水平时恢复至空白水平。
(2) PS和BDE-47联合暴露21 d后,各联合组的CAT和SOD活性随PS投加浓度升高表现出先诱导后抑制的效应,且均显著高于BDE-47单独暴露组,MDA含量随PS投加浓度升高表现出诱导效应,GST和GPX活性与空白水平相近,低浓度PS暴露组中的GSH含量也有相似的变化规律。由于微塑料可以调节污染物的生物可利用度,加入PS可在一定范围内减缓BDE-47对黑褐新糠虾抗氧化防御系统的氧化胁迫,此效应在低浓度PS联合暴露组中更加显著。
| [1] |
Betts K. Why small plastic particles may pose a big problem in the oceans[J]. Environmental Science & Technology, 2008, 42(24): 8995.
(  0) 0) |
| [2] |
Zarfl C, Matthies M. Are marine plastic particles transport vectors for organic pollutants to the Arctic[J]. Marine Pollution Bulletin, 2010, 60(10): 1810-1814. DOI:10.1016/j.marpolbul.2010.05.026
(  0) 0) |
| [3] |
Wu N, Zhang Y, Zhang X, et al. Occurrence and distribution of microplastics in the surface water and sediment of two typical estuaries in Bohai Bay, China[J]. Environmental Science: Processes & Impacts, 2019, 21(7): 1143-1152.
(  0) 0) |
| [4] |
Von M N, Burkhardt H P, Kohler A. Uptake and effects of microplastics on cells and tissue of the blue mussel Mytilus edulis L. after an experimental exposure[J]. Environmental Science & Technology, 2012, 46(20): 11327-11335.
(  0) 0) |
| [5] |
Cozar A, Echevarria F, Gonzalez-Gordillo J I, et al. Plastic debris in the open ocean[J]. Proceedings of the National Academy of Sciences, 2014, 111(28): 10239-10244. DOI:10.1073/pnas.1314705111
(  0) 0) |
| [6] |
Wu Y, Guo P, Zhang X, et al. Effect of microplastics exposure on the photosynthesis system of freshwater algae[J]. Journal of Hazardous Materials, 2019, 374: 219-227. DOI:10.1016/j.jhazmat.2019.04.039
(  0) 0) |
| [7] |
Mattsson K, Ekvall M T, Hansson L, et al. Altered behavior, physiology, and metabolism in fish exposed to polystyrene nanoparticles[J]. Environmental Science & Technology, 2015, 49(1): 553-561.
(  0) 0) |
| [8] |
Palm A, Cousins I T, Mackay D, et al. Assessing the environmental fate of chemicals of emerging concern: A case study of the polybrominated diphenyl ethers[J]. Environmental Pollution, 2002, 117(2): 195-213. DOI:10.1016/S0269-7491(01)00276-7
(  0) 0) |
| [9] |
Jiang Y, Tang X, Sun T, et al. BDE-47 exposure changed the immune function of haemocytes in Mytilus edulis: An explanation based on ROS-mediated pathway[J]. Aquatic Toxicology, 2017, 182: 58-66. DOI:10.1016/j.aquatox.2016.11.010
(  0) 0) |
| [10] |
Arkoosh M R, Van Gaest A L, Strickland S A, et al. Dietary exposure to individual polybrominated diphenyl ether congeners BDE-47 and BDE-99 alters innate immunity and disease susceptibility in juvenile Chinook salmon[J]. Environmental Science & Technology, 2015, 49(11): 6974-6981.
(  0) 0) |
| [11] |
Oliveira M, Ribeiro A, Hylland K, et al. Single and combined effects of microplastics and pyrene on juveniles(0+group) of the common goby Pomatoschistus microps (Teleostei, Gobiidae)[J]. Ecological Indicators, 2013, 34: 641-647. DOI:10.1016/j.ecolind.2013.06.019
(  0) 0) |
| [12] |
Rochman C M, Kurobe T, Flores I, et al. Early warning signs of endocrine disruption in adult fish from the ingestion of polyethylene with and without sorbed chemical pollutants from the marine environment[J]. Science of the Total Environment, 2014, 493(15): 656-661.
(  0) 0) |
| [13] |
Gu H, Wei S, Hu M, et al. Microplastics aggravate the adverse effects of BDE-47 on physiological and defense performance in mussels[J]. Journal of Hazardous Materials, 2020, 398: 122909. DOI:10.1016/j.jhazmat.2020.122909
(  0) 0) |
| [14] |
李磊, 刘金殿, 黄士林, 等. 基于综合生物标志物响应评价苯并芘对脊尾白虾(Exopalaemon carinicauda)的毒性效应[J]. 海洋与湖沼, 2018, 49(2): 444-451. Li L, Liu J D, Huang S L, et al. Integrated assessment of biomarker responses in Exopalaemon carinicauda exposed to Benzo[a]pyrene[J]. Journal of Oceanology and Limnology, 2018, 49(2): 444-451. (  0) 0) |
| [15] |
李传慧. 生物标志物法研究石油胁迫对半滑舌鳎的毒性效应[D]. 青岛: 中国海洋大学环境科学与工程学院, 2011: 45-46. Li C H. Using Biomarkers to Study Toxic Effects of Shengli Crude Oil on Cynoglossus semilaevis[D]. Qingdao: College of Environmental Science and Engineering, Ocean University of China, 2011: 45-46. (  0) 0) |
| [16] |
Li Z, Zlabek V, Turek J, et al. Evaluating environmental impact of STPs situated on streams in the Czech Republic: An integrated approach to biomonitoring the aquatic environment[J]. Water Research, 2011, 45(3): 1403-1413. DOI:10.1016/j.watres.2010.10.032
(  0) 0) |
| [17] |
蒋玫, 李磊, 沈新强, 等. 基于综合生物标志物响应指数评价0#柴油和平湖原油胁迫下的缢蛏(Sinonovacul aconstricta)毒性效应[J]. 环境科学学报, 2015, 35(4): 1174-1182. Jiang M, Li L, Shen X Q, et al. Investigation of toxic effects of No.0 fuel oil and Pinghu crude oil on Sinonovacul aconstricta by using integrated biomarker responses[J]. Acta Scientiae Circumstantiae, 2015, 35(4): 1174-1182. (  0) 0) |
| [18] |
Fok L, Cheung P K, Tang G, et al. Size distribution of stranded small plastic debris on the coast of Guangdong, South China[J]. Environmental Pollution, 2017, 220: 407-412. DOI:10.1016/j.envpol.2016.09.079
(  0) 0) |
| [19] |
Sussarellu R, Suquet M, Thomas Y, et al. Oyster reproduction is affected by exposure to polystyrene microplastics[J]. Proceedings of the National Academy of Sciences, 2016, 113(9): 2430-2435. DOI:10.1073/pnas.1519019113
(  0) 0) |
| [20] |
Yu P, Liu Z, Wu D, et al. Accumulation of polystyrene microplastics in juvenile Eriocheir sinensis and oxidative stress effects in the liver[J]. Aquatic Toxicology, 2018, 200: 28-36. DOI:10.1016/j.aquatox.2018.04.015
(  0) 0) |
| [21] |
Lenz R, Enders K, Nielsen T G. Microplastic exposure studies should be environmentally realistic[J]. Proceedings of the National Academy of Sciences, 2016, 113(29): E4121-E4122. DOI:10.1073/pnas.1606615113
(  0) 0) |
| [22] |
Wang X, Liu L, Zheng H, et al. Polystyrene microplastics impaired the feeding and swimming behavior of mysid shrimp Neomysis japonica[J]. Marine Pollution Bulletin, 2020, 150: 110660. DOI:10.1016/j.marpolbul.2019.110660
(  0) 0) |
| [23] |
陈洁. 2, 2', 4, 4'-四溴联苯醚(BDE-47)对水稻代谢及关键基因表达的影响[D]. 杭州: 浙江大学环境与资源学院, 2020: 3-4. Chen J. Metabolomics and Transcriptomics Reveal Defense Mechanism of Rice(Oryza sativa) Grains Under Stress of 2, 2', 4, 4'-Tetrabromodiphenyl Ether[D]. Hangzhou: College of Environment and Resources, Zhejiang University, 2020: 3-4. (  0) 0) |
| [24] |
Dong S H, Yang Y Y, Cheng B, et al. Responses of antioxidant defenses in the clam Mactra veneriformis to 2, 2', 4, 4'tetrabromodiphenyl ether exposure[J]. Comparative Biochemistry and Physiology, Part C, 2019(217): 98-105.
(  0) 0) |
| [25] |
Ji C L, W u H F, Wei L, et al. Proteomic and metabolomic analysis reveal gender-specific responses of mussel Mytilus galloprovincialis to 2, 2', 4, 4'tetrabromodiphenyl ether(BDE 47)[J]. Aquatic Toxicology, 2013(140-141): 449-457.
(  0) 0) |
| [26] |
Kim W, Lee S, Jung J. Integrated assessment of biomarker responses in common carp(Cyprinus carpio) exposed to perfluorinated organic compounds[J]. Journal of Hazardous Materials, 2010, 180(1-3): 395-400. DOI:10.1016/j.jhazmat.2010.04.044
(  0) 0) |
| [27] |
Li S, Pan X, Wallis L K, et al. Comparison of TiO2 nanoparticle and graphene-TiO2 nanoparticle composite phototoxicity to Daphnia magna and Oryzias latipes[J]. Chemosphere, 2014, 112: 62-69. DOI:10.1016/j.chemosphere.2014.03.058
(  0) 0) |
| [28] |
Lee J W, Kang H, Won E, et al. Multi-walled carbon nanotubes(MWCNTs) lead to growth retardation, antioxidant depletion, and activation of the ERK signaling pathway but decrease copper bioavailability in the monogonont rotifer(Brachionus koreanus)[J]. Aquatic Toxicology, 2016, 172: 67-79. DOI:10.1016/j.aquatox.2015.12.022
(  0) 0) |
| [29] |
Bhattacharya P, Lin S, Turner J P, et al. Physical adsorption of charged plastic nanoparticles affects algal photosynthesis[J]. The Journal of Physical Chemistry C, 2010, 114(39): 16556-16561. DOI:10.1021/jp1054759
(  0) 0) |
| [30] |
Mates J M. Effects of antioxidant enzymes in the molecular control of reactive oxygen species toxicology[J]. Toxicology, 2000, 153(1-3): 83-104. DOI:10.1016/S0300-483X(00)00306-1
(  0) 0) |
| [31] |
Schülke S, Dreidax D, Malik A, et al. Living with stress: regulation of antioxidant defense genes in the subterranean, hypoxia-tolerant mole rat, Spalax[J]. Gene, 2012, 500(2): 199-206. DOI:10.1016/j.gene.2012.03.019
(  0) 0) |
| [32] |
Zheng T, Yuan D, Liu C. Molecular toxicity of nanoplastics involving in oxidative stress and desoxyribonucleic acid damage[J]. Journal of Molecular Recognition, 2019, 32(11): e2804.
(  0) 0) |
| [33] |
Abidli S, Pinheiro M, Lahbib Y, et al. Effects of environmentally relevant levels of polyethylene microplastic on Mytilus galloprovincialis(Mollusca: Bivalvia): Filtration rate and oxidative stress[J]. Environmental Science and Pollution Research, 2021, 28(21): 26643-26652. DOI:10.1007/s11356-021-12506-8
(  0) 0) |
| [34] |
张雨鸣. 四溴联苯醚BDE-47对海洋鱼类毒性和抗氧化酶活性的影响[D]. 青岛: 中国海洋大学海洋生命学院, 2014: 45-46. Zhang Y M. Toxicity and Effect on Anti-Oxidant Enzymes Activity of Tetra-Bromodiphenyl Ether(BDE-47) in Marine Teleosts[D]. Qingdao: College of Marine Life, Ocean University of China, 2014: 45-46. (  0) 0) |
| [35] |
Jiang Y, Tang X, Sun T, et al. BDE-47 exposure changed the immune function of haemocytes in Mytilus edulis: An explanation based on ROS-mediated pathway[J]. Aquatic Toxicology, 2017, 182: 58-66. DOI:10.1016/j.aquatox.2016.11.010
(  0) 0) |
| [36] |
Avio C G, Gorbi S, Milan M, et al. Pollutants bioavailability and toxicological risk from microplastics to marine mussels[J]. Environmental Pollution, 2015, 198: 211-222. DOI:10.1016/j.envpol.2014.12.021
(  0) 0) |
| [37] |
李传慧, 夏斌, 陈碧鹃, 等. 胜利原油对半滑舌鳎幼鱼肝脏谷胱甘肽过氧化物酶和谷胱甘肽转硫酶活性的影响[J]. 海洋环境科学, 2011, 30(6): 827-830. Li C H, Xia B, Chen B J, et al. Effects of Shengli crude oil on activities of GSH-PX and GST in liver of Cynoglossus semilaevis larva[J]. Marine Environmental Science, 2011, 30(6): 827-830. DOI:10.3969/j.issn.1007-6336.2011.06.015 (  0) 0) |
| [38] |
李传慧, 陈碧鹃, 崔毅, 等. 胜利原油对半滑舌鳎幼鱼肝脏过氧化物酶, 溶菌酶和鳃丝Na+-K+-ATPase活力的影响[J]. 海洋环境科学, 2011, 30(5): 681-685. Li C H, Chen B J, Cui Y, et al. Effects of Shengli crude oil on liver peroxidase, lysozyme activity and gill Na+-K+-ATPase activity in juvenile Cynoglossus semilaevis[J]. Marine Environmental Science, 2011, 30(5): 681-685. DOI:10.3969/j.issn.1007-6336.2011.05.017 (  0) 0) |
| [39] |
Rios L M, Moore C, Jones P R. Persistent organic pollutants carried by synthetic polymers in the ocean environment[J]. Marine Pollution Bulletin, 2007, 54(8): 1230-1237. DOI:10.1016/j.marpolbul.2007.03.022
(  0) 0) |
| [40] |
Fisner M, Taniguchi S, Moreira F, et al. Polycyclic aromatic hydrocarbons(PAHs) in plastic pellets: Variability in the concentration and composition at different sediment depths in a sandy beach[J]. Marine Pollution Bulletin, 2013, 70(1-2): 219-226. DOI:10.1016/j.marpolbul.2013.03.008
(  0) 0) |
| [41] |
Teng Y, Zhang J, Zhang Z, et al. The effect of chronic fluorosis on calcium ions and CaMKⅡα, and c-fos expression in the rat hippocampus[J]. Biological Trace Element Research, 2018, 182(2): 295-302. DOI:10.1007/s12011-017-1098-8
(  0) 0) |
| [42] |
Beckingham B, Ghosh U. Differential bioavailability of polychlorinated biphenyls associated with environmental particles: Microplastic in comparison to wood, coal and biochar[J]. Environmental Pollution, 2017, 220: 150-158. DOI:10.1016/j.envpol.2016.09.033
(  0) 0) |
| [43] |
Choi K J, Kim S G, Kim C W, et al. Effects of activated carbon types and service life on removal of endocrine disrupting chemicals: Amitrol, nonylphenol, and bisphenol-A[J]. Chemosphere, 2005, 58(11): 1535-1545. DOI:10.1016/j.chemosphere.2004.11.080
(  0) 0) |
| [44] |
Ashton K, Holmes L, Turner A. Association of metals with plastic production pellets in the marine environment[J]. Marine Pollution Bulletin, 2010, 60(11): 2050-2055. DOI:10.1016/j.marpolbul.2010.07.014
(  0) 0) |
| [45] |
Teuten E L, Saquing J M, Knappe D R U, et al. Transport and release of chemicals from plastics to the environment and to wildlife[J]. Philosophical Transactions of the Royal Society B: Biological Sciences, 2009, 364(1526): 2027-2045. DOI:10.1098/rstb.2008.0284
(  0) 0) |
| [46] |
Chen Q, Gundlach M, Yang S, et al. Quantitative investigation of the mechanisms of microplastics and nanoplastics toward zebrafish larvae locomotor activity[J]. Science of the Total Environment, 2017, 584-585: 1022-1031. DOI:10.1016/j.scitotenv.2017.01.156
(  0) 0) |
| [47] |
Oliveira M, Ribeiro A, Hylland K, et al. Single and combined effects of microplastics and pyrene on juveniles(0+group) of the common goby Pomatoschistus microps (Teleostei, Gobiidae)[J]. Ecological Indicators, 2013, 34: 641-647. DOI:10.1016/j.ecolind.2013.06.019
(  0) 0) |
| [48] |
Liu X W, Zheng M G, Wang L, et al. Sorption behaviors of tris-(2, 3-dibromopropyl) isocyanurate and hexabromocyclododecanes on polypropylene microplastics[J]. Marine Pollution Bulletin, 2018, 135: 581-586. DOI:10.1016/j.marpolbul.2018.07.061
(  0) 0) |
| [49] |
Zhan Z W, Wang J D, Peng J P, et al. Sorption of 3, 3', 4, 4'-tetrachlorobiphenyl by microplastics: A case study of polypropylene[J]. Marine Pollution Bulletin, 2015, 110: 559-563.
(  0) 0) |
| [50] |
左优. 聚苯乙烯微塑料与四溴双酚-A对斑马鱼的复合毒性研究[D]. 西安: 长安大学环境科学与工程学院, 2019: 59-60. Zuo Y. Study on the Complex Toxicity of Polystyrene Microplastics and Tetrabromobisphenol-A to Zebrafish[D]. Xi'an: College of Environmental Science and Engineering, Chang'an University, 2019: 59-60. (  0) 0) |
| [51] |
Lu K, Qiao R, An H, et al. Influence of microplastics on the accumulation and chronic toxic effects of cadmium in zebrafish(Danio rerio)[J]. Chemosphere, 2018, 202: 514-520. DOI:10.1016/j.chemosphere.2018.03.145
(  0) 0) |
| [52] |
何君仪. 微塑料与磷酸三苯酯对斑马鱼的联合毒性效应研究[D]. 南京: 南京理工大学环境与生物工程学院, 2019: 57-58. He J Y. The Combined Toxic Effects of Microplastic and Triphenyl Phosphate on Zebrafish(Danio rerio)[D]. Nanjing: College of Environmental and Biological Engineering, Nanjing University of Science and Technology, 2019: 57-58. (  0) 0) |
| [53] |
Paul-Pont I, Lacroix C, González Fernández C, et al. Exposure of marine mussels Mytilus spp. to polystyrene microplastics: Toxicity and influence on fluoranthene bioaccumulation[J]. Environmental Pollution, 2016, 216: 724-737. DOI:10.1016/j.envpol.2016.06.039
(  0) 0) |
2. Key Laboratory of Marine Environment and Ecology, Ministry of Education, Ocean University of China, Qingdao 266100, China
 2022, Vol. 52
2022, Vol. 52


