2. 国家海洋局北海分局,山东 青岛 266033
黄河口及邻近海域地处暖温带北缘,位于渤海湾和莱州湾的交汇处,是海洋和淡水生态系统的过渡区域。黄河每年向渤海输入大量淡水和泥沙,携带丰富的营养物质,为浮游植物的生长繁殖提供了良好的生态环境[1-2]。近年来受自然因素和人为调控的共同影响,黄河入海径流量和含沙量发生显著的年际和季节变化,营养盐含量变化明显,导致浮游植物群落组成和丰度也随之发生变化[3]。浮游植物是海洋有机质的主要生产者,作为浮游动物的基础饵料是海洋食物网结构的基础环节,在海洋生态系统的物质循环与能量转换过程中起着重要作用。环境条件的改变能直接或间接地影响到浮游植物的群落结构,同时浮游植物物种组成和丰度的变化对环境也具有指示作用,是近海环境监测的主要指示类群之一[4-5]。
2010年以前针对黄河口浮游植物生态学研究主要集中于黄河口浮游植物种类组成、丰度分布和群落结构等方面。张继民[6]、冷宇[7]、刘晓彤[8]等研究了2004—2010年黄河口海域浮游植物种类的数量和优势种类的年际及季节变化特征;近年来,有学者研究了调水调沙对黄河口浮游植物的影响。例如:Yang等[9]的研究结果表明,黄河口水沙调控使径流量的突然增大会导致浮游植物生物量增大;苏芝娟等[10]也发现2013年7月黄河调水调沙后营养盐的大量输送对浮游植物生长有促进效应;Shen等[11]认为2009—2012年黄河调水调沙前后影响黄河口浮游植物生长最主要的因素是水温与浊度的变化;秦雪等[12]研究表明,2013年6和8月黄河口北部浮游植物种类组成和群落结构的差异是由营养盐的变化引起的。
本研究重点探讨了5和8月黄河口近岸及离岸海域不同区域水环境对浮游植物群落特征的影响。黄河口海域地形、地貌、水深变化复杂,导致不同区域水环境特征有明显变化。在黄河水沙入海口区域形成的拦门沙地形隆起,水深较浅,拦门沙以外的海域水深陡然增大[13]。黄河口近岸与离岸海域的温盐、营养盐等水环境条件存在显著的区域差异,浮游植物群落结构也随之发生变化[8]。本研究基于2011—2014年5和8月黄河口及邻近海域浮游植物与水环境数据,运用聚类分析方法将黄河口水环境与浮游植物群落划分成了有显著差异的组群,分析了黄河口不同水域浮游植物群落结构和水环境特征,并采用RDA分析方法探讨了不同水域浮游植物群落结构与水环境因子之间的关系。以期为黄河口生态环境保护措施的制订提供基础资料和理论依据。
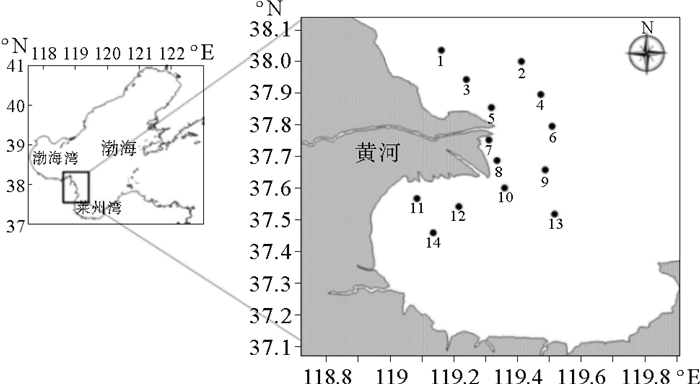
1 材料与方法 1.1 调查海域及采样方法在黄河口及邻近海域(37.4°N~38.1°N、119.0°E~119.6°E)共设14个采样站位(见图 1),于2011—2013年的5、8月和2014年8月进行了7个航次的水环境特征及浮游植物生物学调查。浮游植物样品使用浅水Ⅲ型浮游生物网,采用垂直拖网方式采样,样品用5%福尔马林溶液现场固定,带回实验室进行定量定性分析。样品的采集、保存及分析均执行《海洋调查规范-第6部分:海洋生物调查》(GB12763.6—2007)[14]。水温(T)、水深(Depth)、盐度(S)、透明度(SD)、溶解氧(DO)、溶解无机氮(DIN)、磷酸盐(PO4-P)、化学耗氧量(COD)、石油烃(TPH)测定方法及所有操作均按照《海洋监测规范-第4部分:海水分析》(GB 17378.4—2007)[15]进行。
|
图 1 黄河口及邻近海域采样点分布图 Fig. 1 Sampling station in the Yellow River Estuary and its adjacent waters |
浮游植物丰度以每立方米水体中的个体数(个/m3)表示。应用优势度(Y)[16]、Shannon-Winner多样性指数(H′)[17]对研究海域浮游植物特征进行分析,计算公式如下:
| $ \begin{array}{l} \;\;\;Y = {n_i}/N \times {f_i}, \\ H\prime =-\sum\limits_{i = 1}^S {{P_i}{{\log }_2}{P_i}} 。\end{array} $ |
式中:ni为第i种的丰度;N为所有种类总丰度;fi为第i种在各样品中出现的频率;S为样品中的种类数总数;Pi为第i种的丰度与样品中的总丰度的比值。Y≥0.02为优势种[16]。
利用PRIMER 5.0软件进行相似性聚类分析(CLUSTER)和多维排序尺度分析(Multidimensional scaling,MDS)方法分析浮游植物群落的空间分布[18]。用CANOCO 5.0软件分析浮游植物优势种与水环境因子的关系:物种和环境数据进行lg(x+1)转换,对浮游植物物种数据进行去趋势对应分析(DCA),排序轴梯度长度均小于3,适合用基于线性的冗余分析方法(RDA),应用Monte Carlo法进行相关性检验[19]。
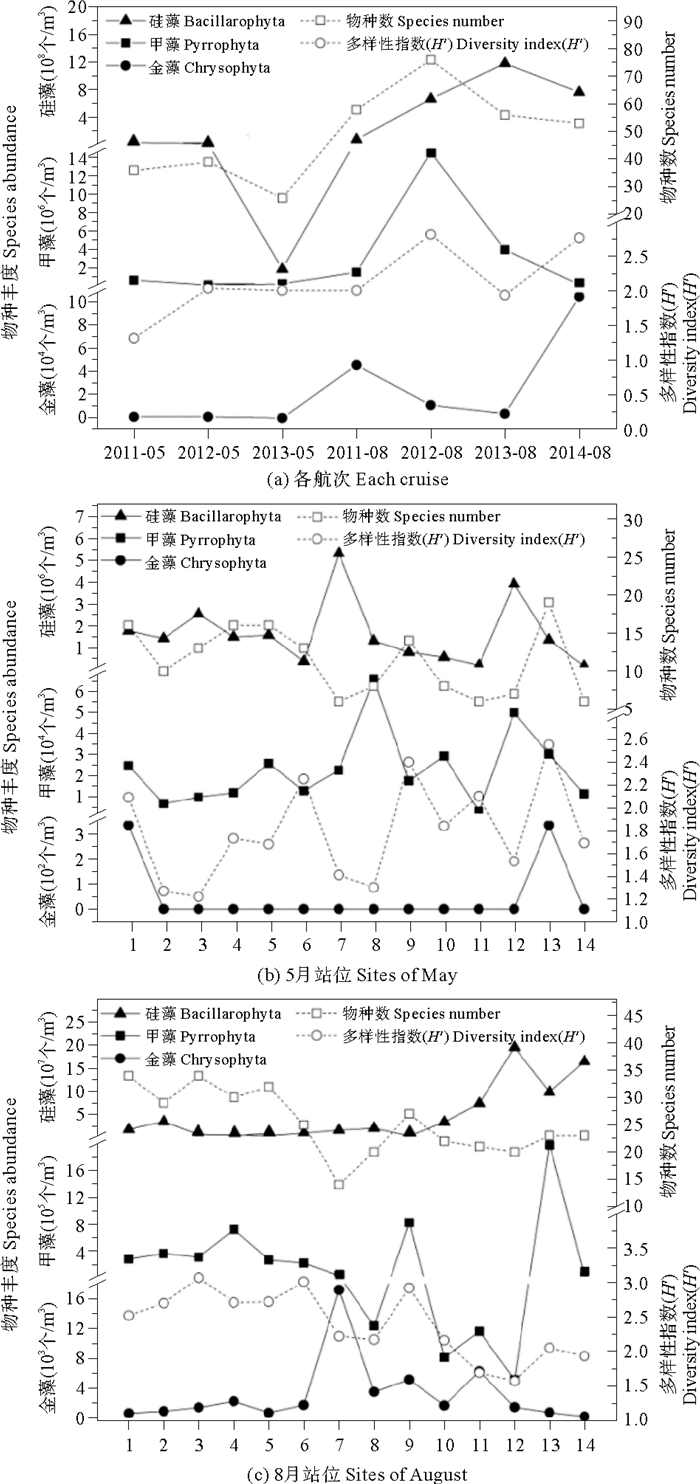
2 结果与讨论 2.1 浮游植物物种组成及空间分布特征 2.1.1 浮游植物物种组成和丰度分布2011—2014年7个航次浮游植物组成、丰度和多样性指数(H')如图 2(a)所示。调查期间的7个航次共采集到浮游植物3门46属108种,其中硅藻门36属85种,占总物种数78.7%;甲藻门9属22种,占20.4%;金藻门1属1种,占0.9%。2011—2013年5月的3个航次共采集到浮游植物60种,隶属于3门30属,其中硅藻门22属48种,甲藻门7属11种,金藻1属1种。2011—2014年8月的4个航次共采集到浮游植物101种,隶属于3门46属,其中硅藻36属80种;甲藻9属20种,金藻1属1种。5和8月各航次物种数平均值分别为34和60种;5和8月浮游植物细胞平均丰度分别2.29×107和6.83×108个/m3,其中硅藻占明显优势,分别占浮游植物细胞丰度的98.6%和99.3%。5和8月浮游植物Shannon-Winner多样性指数(H')平均值分别为1.79和2.39。
|
图 2 2011—2014年5和8月各航次(a)和各站位(b, c)浮游植物物种组成、丰度、物种数及多样性指数(H') Fig. 2 Composition, abundance, species number and diversity index(H') of phytoplankton in each cruise (a) and each site (b, c) in May and August from 2011 to 2014 |
图 2(b)和图 2(c)分别是5和8月14个站位浮游植物组成、丰度和多样性指数(H')。5月,黄河口北部和东部离岸海域的1~6、9和13号站位物种数均大于10种,而黄河口南部沿岸海域的站位物种数均小于10种;河口附近站位浮游植物丰度值较高,7号站位丰度值最高达到5.32×106个/m3,但以单一物种斯氏根管藻为主。而位于莱州湾西部沿岸的11和14站位浮游植物丰度低值分别为1.75×105和1.48×105个/m3;多样性指数(H')较高的站位是黄河口东部离岸海域的6、9和13号站位,而黄河口北部2、3号和河口处的7、8号多样性指数(H')值相对较低。8月,黄河口北部海域的1~6和9号站位的物种数大于25种,位于黄河口南部海域的7、8、11~14号站位物种数较少。而浮游植物细胞丰度值则相反,黄河口南部海域的浮游植物细胞丰度大于黄河口北部海域,12号站位浮游植物丰度值最高达1.96×108个/m3,多样性指数(H')与物种数变化趋势相同。
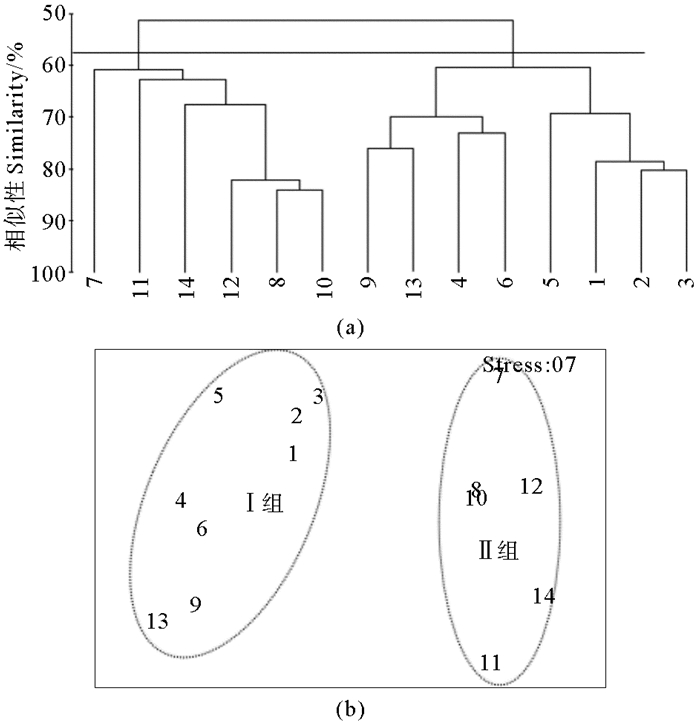
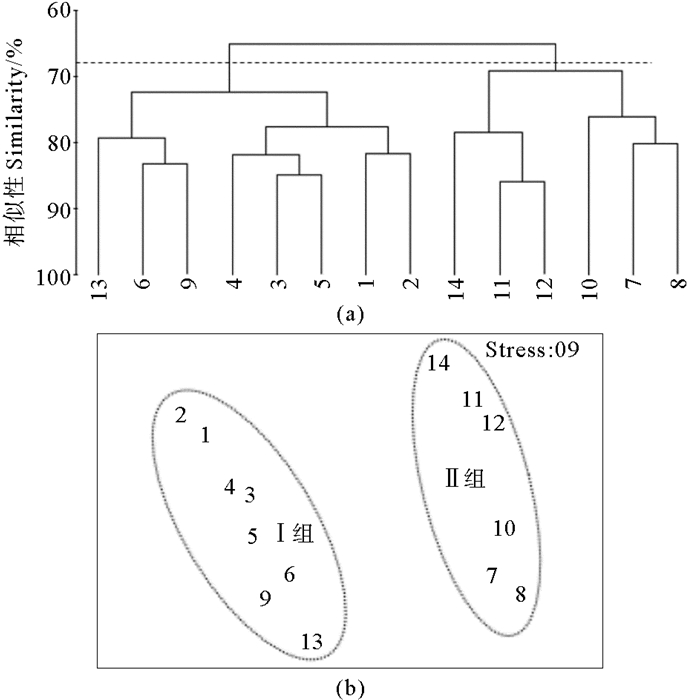
2.1.2 浮游植物群落聚类分析基于各调查站位浮游植物的物种和丰度数据,采用CLUSTER聚类和MDS分析对黄河口及邻近海域的浮游植物群落的空间分布特征进行了讨论。结果显示(见图 3、4),5和8月按照Bray-Curtis相似系数58%和68%为组间分界,可将调查水域浮游植物群落特征划分为显著不同的Ⅰ组和Ⅱ组,单因子相似性分析(ANOSIM)的p均小于0.01(p5月=0.001,p8月=0.001),表明5和8月Ⅰ组和Ⅱ组的差异性显著。5和8月的分组情况相同。
|
图 3 5月浮游植物聚类分析(a)和MDS排序(b)结果 Fig. 3 Cluster (a) and MDS (b) analysis of phytoplankton in May |
|
图 4 8月浮游植物聚类分析(a)和MDS排序(b)结果 Fig. 4 Cluster (a) and MDS (b) analysis of phytoplankton in August |
浮游植物群落结构的二维MDS分析压力系数分别为0.07和0.09,压力系数小于0.1,这说明MDS图形能够正确解释各站位间的相似关系[18],所得到的MDS排序结果与CLUSTER的结果基本一致。Ⅰ组站位包括黄河口北部和东部离岸海域的1、2、3、4、5、6、9和13号站位,Ⅱ组站位包括黄河口南部沿岸海域的7、8、10、11、12、和14号站位。
2.1.3 浮游植物群落特征各组浮游植物群落特征及优势种如表 1,通过单因素方差分析(ANOVA)比较5和8月Ⅰ组和Ⅱ组浮游植物平均物种数、平均丰度、多样性指数(H')的差异性。5月,Ⅰ组站位的平均物种数显著大于Ⅱ组(p < 0.05),两组间的浮游植物细胞丰度与多样性指数(H')没有显著差异(p>0.05)。8月,Ⅰ组的物种数和多样性指数显著大于Ⅱ组(p < 0.05),而浮游植物细胞丰度则显著低于Ⅱ组(p < 0.05)。对比Ⅰ组5和8月的浮游植物群落特征,5月平均物种数显著小于8月(p < 0.05),5和8月平均丰度没有显著差异(p>0.05),5月多样性指数(H')显著低于8月(p < 0.05);Ⅱ组间,5月平均物种数、平均丰度显著小于8月(p < 0.05),多样性指数(H')无显著差异(p>0.05)。
|
|
表 1 黄河口浮游植物5和8月Ⅰ和Ⅱ组的浮游植物群落特征及优势种 Table 1 Phytoplankton community and dominant species of groupⅠand groupⅡin May and August in the Yellow River Estuary |
5月Ⅰ组优势种为斯氏根管藻(Rhizosolenia stolterfothii)、圆筛藻(Coscinodiscus sp.)、具槽帕拉藻(Paralia sulcata (Ehrenberg) Cleve)和印度翼根管藻(Rhizosolenia alata f.indica Hustedt),Ⅱ组优势种为斯氏根管藻和圆筛藻。8月Ⅰ组优势种为拟扭链角毛藻(Chaetoceros pseudocurvisetus Margin)、佛氏海线藻(Thalassionema frauenfeldii)、旋链角毛藻(Chaetoceros curvisetus)和角毛藻(Chaetoceros spp.),Ⅱ组优势种有柔弱角毛藻(Chaetoceros debilis)、角毛藻、中肋骨条藻(Skeletonema costatum)、圆筛藻、垂缘角毛藻(Chaetoceros laciniosus)、拟扭链角毛藻和佛氏海线藻。8月为黄河丰水期,受黄河东南方向的冲淡水影响[20-21],位于黄河口南部的Ⅱ组站位出现一些低盐近岸型(例如:柔弱角毛藻)和广温广盐型(例如:中肋骨条藻)优势种藻类[22]。
2.2 浮游植物与水环境因子关系分析 2.2.1 水环境特征黄河口及邻近海域浮游植物群落结构的区域性差异与黄河口区域复杂的水环境特征关系密切。针对研究海域2011—2014年5和8月水环境因子的聚类分析和MDS分析结果显示(见图 5、6),5和8月按照Bray-Curtis相似系数93.2%和93%为组间分界,5和8月黄河口及邻近海域水环境特征也可分为两组,经单因子相似性分析(ANOSIM)表明其p均小于0.01,Ⅰ组和Ⅱ组差异性显著(p5月=0.001,p8月=0.001)。浮游植物群落结构的二维MDS分析压力系数分别为0.05和0.06,压力系数小于0.1,这说明MDS图形能够正确解释各站位间的相似关系[17],所得到的MDS排序结果与CLUSTER的结果基本一致。Ⅰ组站位包括黄河口北部和东部离岸海域的1、2、3、4、5、6、9和13号站位,Ⅱ组站位包括黄河口南部沿岸海域的7、8、10、11、12、和14号站位。水环境特征分组与浮游植物群落分组情况完全一致。
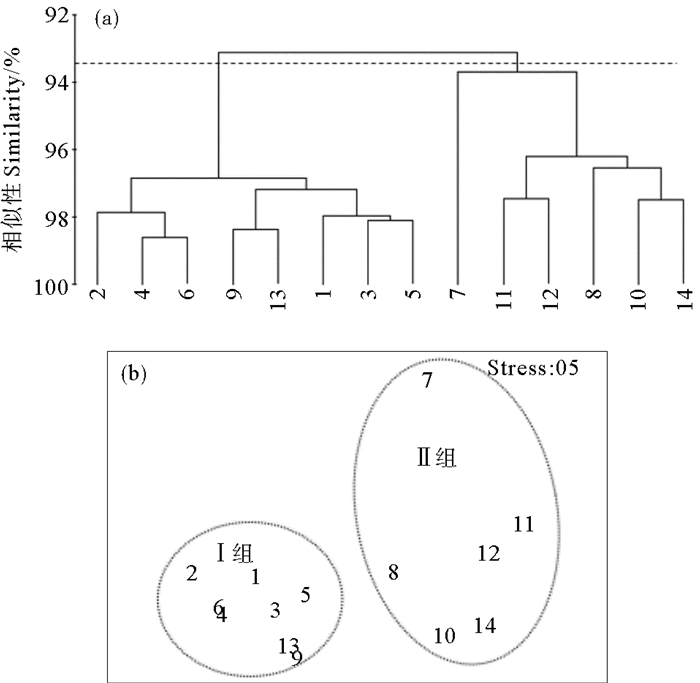
|
图 5 5月水环境数据的聚类分析(a)和MDS排序(b)结果 Fig. 5 Cluster (a) and MDS (b) analysis of water environment in May |
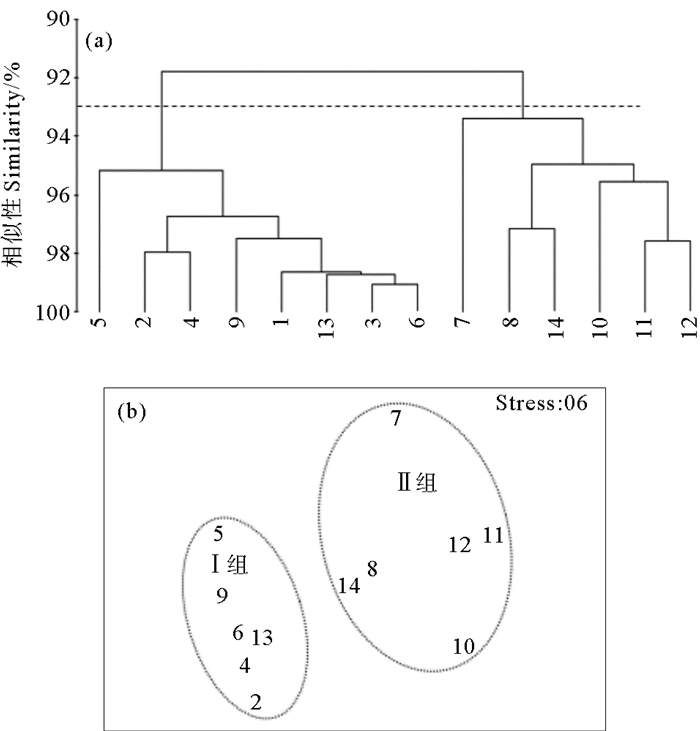
|
图 6 8月水环境数据的聚类分析(a)和MDS排序(b)结果 Fig. 6 Cluster (a) and MDS (b) analysis of water environment in August |
5和8月各组水环境因子平均值如表 2所示,通过单因素方差分析(ANOVA)比较两组水环境特征差异,5月,Ⅰ组的T和COD显著低于Ⅱ组(p < 0.001),而Depth、DO则显著大于Ⅱ组(p < 0.001),Ⅰ组的pH和N:P低于Ⅱ组(p < 0.05),而其它环境因子在两组间无显著差异(p>0.05)。8月,Ⅰ组站位的Depth、S、SD显著大于Ⅱ组各站位(p < 0.001),COD则显著小于Ⅱ组(p < 0.001),Ⅰ组DIN和TPH含量小于Ⅱ组(p < 0.05),而T、pH、DO、PO4-P和N:P在两组间无显著差异(p>0.05)。结合浮游植物群落特征(见表 1)和黄河口及邻近海域水环境特征(见表 2)发现,黄河口北部及东部离岸海域与南部沿岸海域水环境特征存在显著差异,两个区域的浮游植物群落结构特征也存在较显著的差异。
|
|
表 2 黄河口5和8月各组站位水环境平均值±标准差 Table 2 Mean±standard error of water environment of each group in May and August in the Yellow River Estuary |
采用Pearson相关性分析方法探讨5月黄河口水环境和浮游植物群落特征间的关系。结果显示,浮游植物物种数与Depth呈显著正相关(p < 0.05),与pH和COD呈显著负相关(p < 0.05),浮游植物丰度与S呈显著正相关(p < 0.05),多样性指数(H')与水环境相关性不显著(p>0.05)。8月,浮游植物物种数与Depth、S、pH、SD和DO显著正相关(p < 0.05),与COD和TPH呈显著负相关(p < 0.05),浮游植物丰度与T、pH和TPH显著正相关(p < 0.05),多样性指数(H')与Depth显著正相关(p < 0.05),与COD和TPH显著负相关(p < 0.05)。结合表 1和表 2中不同水域的浮游植物和水环境特征,分析结果表明,影响5月浮游植物物种数和总丰度的主要水环境因子有Depth、pH和COD,影响8月浮游植物物种数和总丰度的主要水环境因子有Depth、S、SD、COD和TPH。
2.2.2 优势种与水环境间的RDA分析水环境特征分组与浮游植物群落分组情况完全一致,为了进一步探讨黄河口及邻近海域各水环境因子对浮游植物优势种的影响,对黄河口浮游植物优势种与水环境因子进行RDA分析(见图 7)。RDA排序结果显示,5月前两个排序轴的特征值为0.372和0.256,物种排序轴和环境因子排序轴间的相关系数分别为0.841和0.811;8月前两个排序轴的特征值为0.184和0.140,物种排序轴和环境因子排序轴间的相关系数分别为0.778和0.742。Monte Carlo置换检验所有排序轴均达到显著水平(p < 0.0.05),说明排序结果是可靠的[19]。
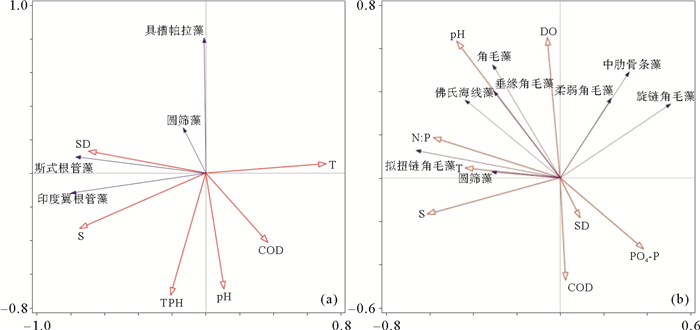
|
图 7 2011—2014年5和8月各组优势种丰度与水环境因子的RDA排序图 Fig. 7 RDA ordination biplot between the abundance of dominant species and water nvironmental factors in May and August from 2011 to 2014 |
水环境因子的筛选采用向前引入法(Forward selection),保留能通过Monte Carlo置换检验(p < 0.05)的显著因子,5月份包括T、COD、S、SD、TPH和pH,8月份包括PO4-P、S、N:P、T、pH、DO、COD和SD。
5月份(见图 7(a)),与第一排序轴呈显著正相关性的水环境因子为T(r=0.606)和COD(r= 0.306),呈显著负相关性的为S(r= -0.627)、SD(r=-0.589)。TPH和pH与第二排序轴呈显著负相关关系,相关系数分别为-0.585和-0.557。优势种斯式根管藻、圆筛藻、具槽帕拉藻和印度翼根管藻与S和SD呈显著正相关关系,与T、COD、pH和TPH呈显著负相关关系。黄河口北部和东部离岸海域Ⅰ组的优势种包括以上4种,而黄河口南部沿岸海域Ⅱ组的优势种仅包括斯氏根管藻和圆筛藻。对比Ⅰ组和Ⅱ组的水环境特征发现(见表 2),Ⅰ组海域的T、COD和pH显著小于Ⅱ组,S、SD和TPH无显著性差异,这表明T、COD和pH是影响5月黄河口海域浮游植物优势种分布的主要水环境因子,仅出现在黄河口北部和东部离岸海域的优势种具槽帕拉藻和印度翼根管藻对水环境变化的敏感程度相对较高。
8月份(见图 7(b)),与第一排序轴呈显著正相关性的水环境因子为PO4-P(r=0.299),呈显著负相关的为S(r=-0.490)、N:P(r= -0.449)和T(r= -0.335)。与第二排序轴呈显著正相关的水环境因子有pH(r=0.480)和DO(r=0.471),呈显著负相关的有COD(r= -0.352)、PO4-P(r= -0.244)和SD(r=-0.142)。拟扭链角毛藻、圆筛藻与S、N:P和T呈显著正相关,与COD、PO4-P和SD显著负相关,佛氏海线藻、角毛藻和垂缘角毛藻与pH和DO显著正相关,与COD、PO4-P和SD显著负相关,柔弱角毛藻、中肋骨条藻和旋链角毛藻与DO显著正相关,与T、S和COD呈显著负相关关系。对比Ⅰ组和Ⅱ组的水环境特征发现(见表 2),黄河口北部和东部离岸海域Ⅰ组海域的S、SD显著大于黄河口南部沿岸海域Ⅱ组,COD显著小于Ⅱ组,PO4-P、N:P、T、pH和DO无显著差异。
对比Ⅰ组和Ⅱ组的浮游植物群落特征(见表 1),Ⅰ组的优势种包括拟扭链角毛藻、佛氏海线藻、旋链角毛藻和角毛藻,Ⅱ组的优势种包括柔弱角毛藻、角毛藻、中肋骨条藻、圆筛藻、垂缘角毛藻、拟扭链角毛藻和佛氏海线藻。在黄河口南部近岸海域占绝对优势的柔弱角毛藻(优势度Y=0.156)为低盐近岸型藻类[22],偏好低盐的水环境,而黄河口北部和东部离岸海域的S较大,以拟扭链角毛藻和佛氏海线藻为主要优势种。8月份,COD与所有优势种丰度值均呈显著负相关关系,表明有机污染对浮游植物产生了明显的负面效应,而且在COD含量较高的黄河口南部近岸海域Ⅱ组优势种中出现了赤潮藻中肋骨条藻,从浮游植物物种结构特征也反映出8月份黄河口北部和东部离岸海域的水环X境质量是要优于黄河口南部近岸海域的。综上所述,S和COD是影响8月份黄河口海域浮游植物物种特征和优势种分布的主要水环境因子。
3 结论(1) 2011—2014年5和8月7个航次的黄河口及邻近海域调查共鉴定浮游植物3门46属108种,其中硅藻种类和丰度占比重最大分别为78.7%和97.3%,5月浮游植物物种数、丰度值和多样性指数(H')均小于8月,黄河口离岸海域的物种数和多样性指数大于近岸河口海域,丰度值则相反。
(2) 基于浮游植物群落结构特征和水环境特征通过聚类和MDS分析将研究区域划分为具有显著差异的两个海域黄河口北部及东部离岸海域(Ⅰ组)和黄河口南部沿岸海域(Ⅱ组)(p < 0.01)。水环境特征分组与浮游植物群落分组情况完全一致,不同海域水环境的显著差异可能是导致浮游植物群落组成及丰度不同的主要因素。影响5月浮游植物物种数和总丰度的主要水环境因子有Depth、pH和COD,影响8月浮游植物种数和总丰度的主要水环境因子有Depth、S、SD、COD和TPH。
(3) 调查海域水环境因子与优势种丰度的RDA结果表明,影响5月黄河口海域浮游植物优势种分布的主要水环境因子为T、COD和pH,8月黄河处于丰水期,受黄河东南方向的冲淡水影响,黄河口南部海域水环境与浮游植物优势种变化明显,影响浮游植物优势种分布的主要水环境因子有S和COD。
| [1] |
Wang Y, Liu Z, Gao H, et al. Response of salinity distribution around the Yellow River mouth to abrupt changes in river discharge[J]. Continental Shelf Research, 2011, 31(6): 685-694. DOI:10.1016/j.csr.2011.01.005
(  0) 0) |
| [2] |
Wang H, Bi N, Saito Y, et al. Recent changes in sediment delivery by the Huanghe (Yellow River) to the sea: Causes and environmental implications in its estuary[J]. Journal of Hydrology, 2010, 391(3): 302-313.
(  0) 0) |
| [3] |
Liu S M, Li L W, Zhang G L, et al. Impacts of human activities on nutrient transports in the Huanghe (Yellow River) estuary[J]. Journal of Hydrology, 2012, 430: 103-110.
(  0) 0) |
| [4] |
Thangaradjou T, Sethubathi G V, Raja S, et al. Influence of environmental variables on phytoplankton floristic pattern along the shallow coasts of southwest Bay of Bengal[J]. Algal Research, 2012, 1(2): 143-154. DOI:10.1016/j.algal.2012.07.005
(  0) 0) |
| [5] |
Ninčević-Gladan Ž, Bužančić M, Kušpilić G, et al. The response of phytoplankton community to anthropogenic pressure gradient in the coastal waters of the eastern Adriatic Sea[J]. Ecological Indicators, 2015, 56: 106-115. DOI:10.1016/j.ecolind.2015.03.018
(  0) 0) |
| [6] |
张继民, 刘霜, 张琦, 等. 黄河口附近海域浮游植物种群变化[J]. 海洋环境科学, 2010, 29(6): 834-837. Zhang J M, Liu S, Zhang Q, et al. Population variation of phytoplankton around Yellow River Estuary[J]. Marine Environmental Science, 2010, 29(6): 834-837. (  0) 0) |
| [7] |
冷宇, 赵升, 刘霜, 等. 黄河口海域夏季浮游植物的分布特征[J]. 水生态学杂志, 2013, 34(6): 41-46. Leng Y, Zhao S, Liu S, et al. Distribution characteristics of phytoplankton in the Estuary of Yellow River during summer[J]. Journal of Hydroecology, 2013, 34(6): 41-46. (  0) 0) |
| [8] |
刘晓彤, 刘光兴. 2009年夏季黄河口及其邻近水域网采浮游植物的群落结构[J]. 海洋学报, 2013, 34(1): 41-46. Liu X T, Liu G X. Net-phytoplankton community structure of the Huanghe Estuary and its adjacent area in the summer of 2009[J]. Acta Oceanologica Sinica, 2013, 34(6): 41-46. (  0) 0) |
| [9] |
Yang Z F, Sun T, Zhao R. Environmental flow assessments in estuaries related to preference of phytoplankton[J]. Hydrology and Earth System Sciences, 2014, 18(5): 1785-1791. DOI:10.5194/hess-18-1785-2014
(  0) 0) |
| [10] |
苏芝娟, 王玉珏, 董志军, 等. 调水调沙后黄河口邻近海域浮游植物群落响应特征[J]. 海洋学报, 2015, 37(4): 62-75. Su Z J, Wang Y J, Dong Z J, et al. Response of phytoplankton assemblages to the water-sediment regulation in the adjacent sea of the Yellow River mouth[J]. Acta Oceanologica Sinica, 2015, 37(4): 62-75. (  0) 0) |
| [11] |
Shen X, Sun T, Liu F, et al. Aquatic metabolism response to the hydrologic alteration in the Yellow River Estuary, China[J]. Journal of Hydrology, 2015, 525: 42-54. DOI:10.1016/j.jhydrol.2015.03.013
(  0) 0) |
| [12] |
秦雪, 徐宾铎, 杨晓改, 等. 黄河口及其邻近水域夏季浮游植物群落结构及其与环境因子的关系[J]. 水产学报, 2016, 40(5): 711-720. Qin X, Xu B D, Yang X G, et al. Phytoplankton community structure and its relationship with environmental variables in summer in the Yellow River Estuary and its adjacent waters[J]. Journal of Fisheries of China, 2016, 40(5): 711-720. (  0) 0) |
| [13] |
徐丛亮, 谷硕, 刘喆, 等. 黄河调水调沙14年来河口拦门沙形态变化特征[J]. 人民黄河, 2016, 38(10): 69-73. Xu C X, Gu S, Liu Z, et al. Characteristics of the River Mouth Bar in the Past 14 Years of the Yellow River Water-Sediment Regulation[J]. Yellow River, 2016, 38(10): 69-73. DOI:10.3969/j.issn.1000-1379.2016.10.014 (  0) 0) |
| [14] |
中华人民共和国国家质量监督检疫总局. GB/T 12763. 6—2007海洋调查规范第6部分: 海洋生物调查[S]. 北京: 中国标准出版社, 2007. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. GB/T 1263. 6-2007 Specifications for Oceanographic Survey-Part 6: Marine Biological Survey[S]. Beijing: China Standards Press, 2007. (  0) 0) |
| [15] |
中华人民共和国国家质量监督检疫总局. GB/T 17378. 4—2007海洋监测规范第4部分: 海水分析[S]. 北京: 中国标准出版社, 2007. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. GB/T 17378. 4—2007 The Specification for Marine Monitoring-Part 4: Seawater Analysis[S]. Beijing: China Standards Press, 2007. (  0) 0) |
| [16] |
Lampitt R S, Wishner K F, Turley C M, et al. Marine snow studies in the Northeast Atlantic Ocean: distribution, composition and role as a food source for migrating plankton[J]. Marine Biology, 1993, 116(4): 689-702. DOI:10.1007/BF00355486
(  0) 0) |
| [17] |
Shannon C E, Weaver W. The Mathematical Theory of Communication[M]. Urbana, USA: University of Illinois Press, 2015.
(  0) 0) |
| [18] |
Clarke K R, Warwick R M. Change in Marine Communities: An approach to Statistical Analysis and Interpretation[M]. Plymouth: Plymouth Marine Laboratory, 1994, 144.
(  0) 0) |
| [19] |
Lep J, milauer P. Multivariate Analysis of Ecological Data Using CANOCO[M]. Cambridge: Cambridge University Press, 2003.
(  0) 0) |
| [20] |
Xu B, Burnett W, Dimova N, et al. Hydrodynamics in the Yellow River Estuary via radium isotopes: Ecological perspectives[J]. Continental Shelf Research, 2013, 66: 19-28. DOI:10.1016/j.csr.2013.06.018
(  0) 0) |
| [21] |
Bian C, Jiang W, Pohlmann T, et al. Hydrography-physical description of the Bohai Sea[J]. Journal of Coastal Research, 2016, 74(1): 1-12.
(  0) 0) |
| [22] |
刘述锡, 樊景凤, 王真良. 北黄海浮游植物群落季节变化[J]. 生态环境学报, 2013, 22(7): 1173-1181. Liu S X, Fan J F, Wang Z L. The seasonal changes of phytoplankton community in North Yellow Sea[J]. Ecology and Environmental Sciences, 2013, 22(7): 1173-1181. (  0) 0) |
2. North China Sea Branch of the State Oceanic Administration, Qingdao 266033, China
 2018, Vol. 48
2018, Vol. 48

