四溴双酚A(Tetrabromobisphenol-A, TBBPA)是一种新型溴代阻燃剂(Brominated Flame Retardants, BFRs),鉴于其良好的阻燃效果,在全球范围内得到广泛使用[1]。随着经济的快速发展,TBBPA的需求量逐年增高,致使在自然环境、生物体甚至人体中均有不同程度的检出,对它的研究也已成为焦点。研究证实,四溴双酚A是一种潜在的具有持久性、生物累积性和毒性的有机化合物,对哺乳动物的毒性低,但对藻类、软体动物、甲壳类和鱼类等水生生物的毒性较高,容易在体内蓄积,并沿着食物链和食物网传递到整个生态系统,引发毒性效应[2-4]。
浮游动物是一类在海洋中没有游泳能力或游泳能力很弱的营漂浮生活的小型动物,分布极广,数量庞大,它不仅在海洋食物网中发挥着承上启下的关键作用[5],还影响着海洋生态系统的物质循环和能量流动,以及结构和功能的改变。除此之外,浮游动物对污染物在食物网的生物放大也起到重要作用。因此,了解污染物和浮游动物之间的相互作用对研究污染物对整个海洋生态系统的影响是至关重要的[6]。目前为止,有关浮游动物生物富集的研究主要针对重金属离子和多溴联苯醚,而对TBBPA的富集研究相对缺乏。
渤海是中国东北部一个典型的温带半封闭性内海,被山东、河北和辽宁3省环绕,仅在东部与北黄海相通[7]。黄海是一个位于中国东部陆架和朝鲜半岛之间的半封闭浅海,中国和韩国的多条河流都注入其中[8-9]。近年来,渤黄海沿岸地区经济发展快速,大量的生活垃圾和工业废物通过大气沉降、地表径流、土壤渗透等方式进入海洋,使得TBBPA污染问题日益严重。但是,中国学者的研究主要集中在淡水领域,有关海洋方面的资料比较匮乏。本文研究了渤、黄海海水中和浮游动物体内的TBBPA浓度以及浮游动物的生物富集能力,为海洋环境的可持续发展提供了科学依据,有利于中国北部近岸海域生态环境和生态系统的健康、可持续发展[10]。
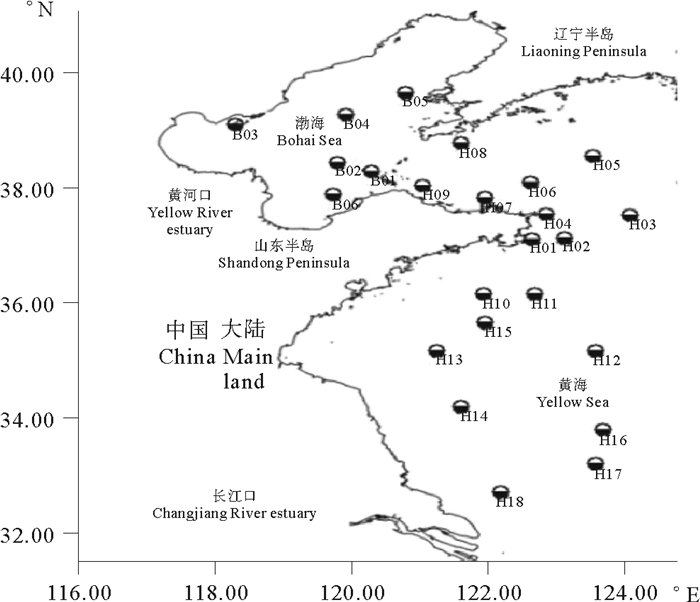
1 材料与方法 1.1 调查站位设置2016年6月25日—7月15日搭载科学调查船“东方红2号”,在渤、黄海海域的24个站位开展了关于海水和浮游动物的调查(见图 1)。各个站位经纬度以及环境因子如表 1所示。
|
图 1 渤、黄海采样站位分布图 Fig. 1 The sampling stations in Bohai sea and Yellow sea |
|
|
表 1 各站位经纬度及环境因子 Table 1 The latitude and longitude values and environmental factors of stations |
海水样品为CDT(Conductance Temperature Depth)采集的表层水。浮游动物样品由中型浮游生物网从底到表垂直拖网获得。一部分生物样品立即加入甲醛溶液固定,待返回实验室后进行分类鉴定;另一部分生物样品于液氮中冷冻保存,待返回实验室后进行TBBPA含量和总脂类含量测定。
1.3 TBBPA含量的测定 1.3.1 分析条件使用配置二极管阵列检测器的高效液相色谱仪(日本,Shimadzu)测定TBBPA浓度。色谱条件:柱温40 ℃,检测波长209 nm,流动相为甲醇和去离子水以85:15(v/v)的比例混合[11],流速为1 mL/min,进样体积20 μL。
1.3.2 质量控制按上述方法处理空白样品,测定发现对分析样品无影响,向其中添加浓度为0.1、1、5、10、25、50 mg/L的标准TBBPA溶液,每个添加溶液做3个平行,测定信噪比S/N>3时,最小浓度为0.01 μg/mL,作为该方法的检出限,计算得到平均加标回收率为92.17%,相对标准偏差为4.8%。
1.4 总脂含量的测定液氮保存的生物样品经冷冻干燥48h后,参照Folch(1957)等[12]方法进行脂质提取。
1.5 计算方法 1.5.1 浮游动物湿重生物量将浮游动物样品置于筛绢上,用吸水纸反复吸除水分,在电子天平上称其湿重,根据采样时的滤水体积,计算湿重生物量(mg/m3)。
1.5.2 生物富集因子生物富集因子(Bioaccumulation Factor,BAF)的计算公式为: BAF = Corg/Cw,其中Corg和Cw分别代表生物体内TBBPA的湿重浓度(ng/kg)和海水溶解态中TBBPA的浓度(ng/L)。
运用Microsoft Excel 2007对数据进行初步统计处理,采用SPSS17.0软件进行单因素方差分析(P<0.05)和Spearson相关性分析,采用95%的置信区间。利用Surfer 12.0软件绘制海水中和浮游动物体内的TBBPA含量以及游动物生物量的平面分布图。
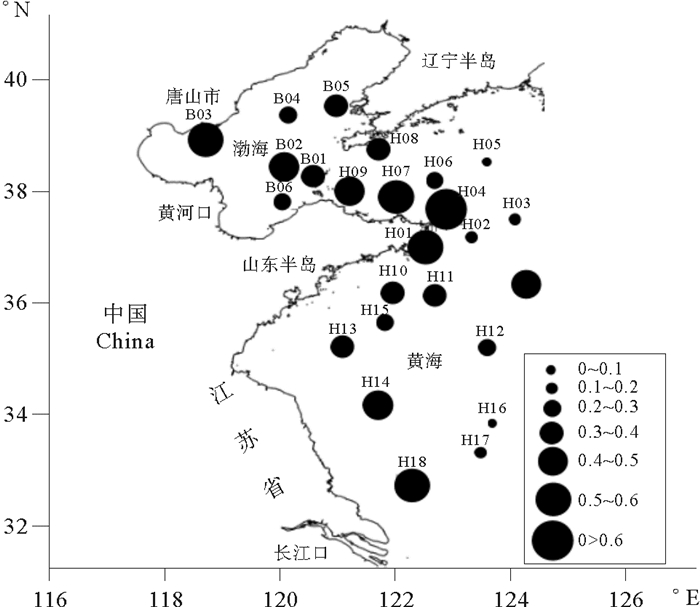
2 结果 2.1 渤、黄海表层水中的TBBPA浓度渤、黄海表层水中的TBBPA浓度范围为0.057~0.607 μg/L。渤海表层水中TBBPA浓度平均值为0.336 μg/L,最高浓度出现在渤海湾靠近唐山市的B03站,最低浓度出现在莱州湾东北部的B06站。黄海表层水中TBBPA浓度平均值为0.418 μg/L,最高浓度出现在山东半岛东北部的H06站,最低浓度出现在黄海东南部的H16站。从平均水平来看,两海域表层水中的TBBPA含量无显著差异。高TBBPA浓度区域(>0.4 μg/L)主要集中在山东半岛东北部近岸海域和江苏省沿岸海域。结果表明,TBBPA浓度分布呈现近岸高、远海低的趋势(见图 2)。
|
图 2 渤、黄海表层水中TBBPA浓度(单位μg/L) Fig. 2 The TBBPA concentration of sea in Bohai sea and Yellow sea(Unit μg/L) |
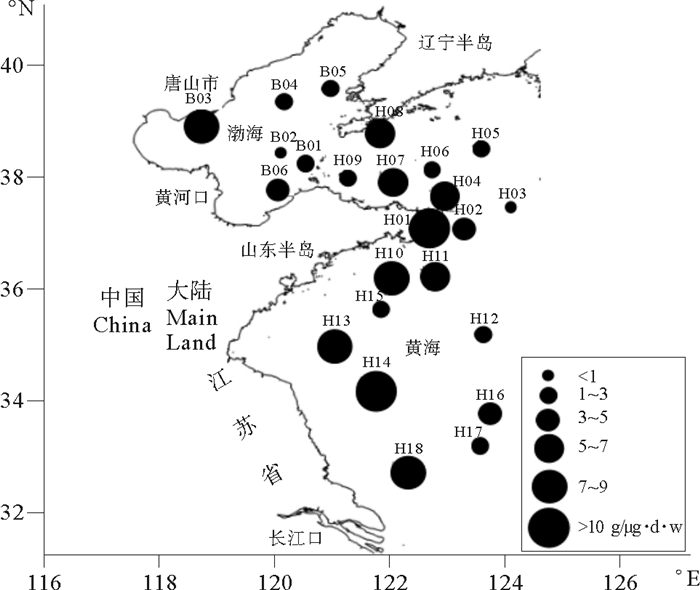
渤、黄海浮游动物体内的TBBPA浓度范围为0.930~10.165 μg/g·d·w,平均值为4.217 μg/g·d·w,最高浓度出现在黄海中部江苏省近岸的H14站,最低浓度出现在渤海中部的B02站。靠近唐山市的B03站、山东半岛最东端的H01站、江苏省北部近岸的H13站和长江口附近的H18站的生物浓度均>5 μg/g·d·w。结果表明,浮游动物体内TBBPA浓度分布趋势与表层水中的分布趋势一致,高浓度区域主要集中在近岸海域,远海浓度较低。浮游动物体内的TBBPA浓度随着海水中浓度的升高而显著升高(r=0.420*,P<0.05)(见图 4)。
|
图 4 黄、渤海海域的浮游动物生物量 Fig. 4 The biomass of Zooplankton in Bohaisea and Yellow sea |
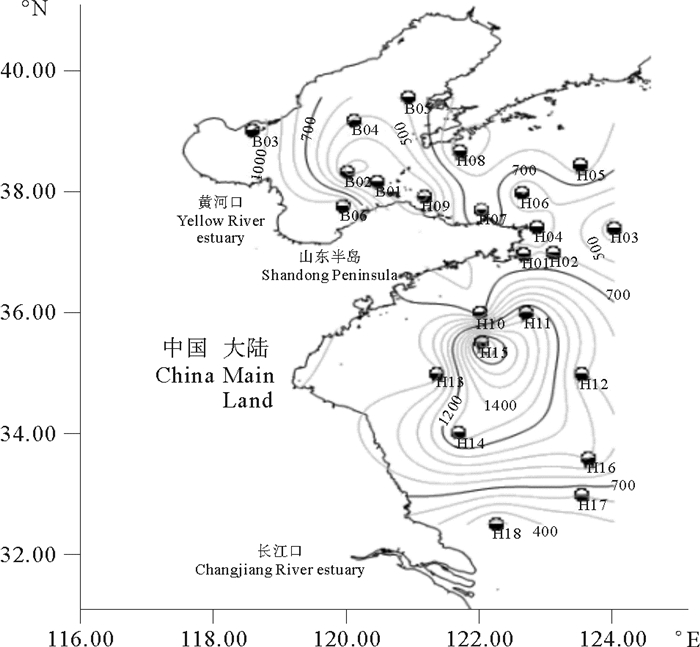
渤、黄海浮游动物的生物量变化范围为251.663~1 982.541 mg/m3(湿重),平均值为777.371 mg/m3(湿重),最大值出现在黄海中部的H15站,最小值出现在黄海南部靠近长江口的H18站。从总体分布来看,呈由近岸向远岸递减的趋势,并在黄海中部形成一个高生物量(>1 200 mg/m3(湿重))的近椭圆形区域(见图 3)。
|
图 3 浮游动物体内的TBBPA浓度 Fig. 3 The TBBPA concentration of Zooplankton in Bohai sea and Yellow sea |
浮游动物生物富集因子(BAF)范围为1.82×103~63.298×103,平均值为14.396×103 ,H16站有最高值,B02站有最低值。结果表明,海洋浮游动物对TBBPA具有相对较强的生物富集性(BAF>5 000)(见图 5)。生物量与BAF呈极显著正相关(r=0.623**,P<0.01),即浮游动物生物量的增加会显著提高BAF(见图 5)。
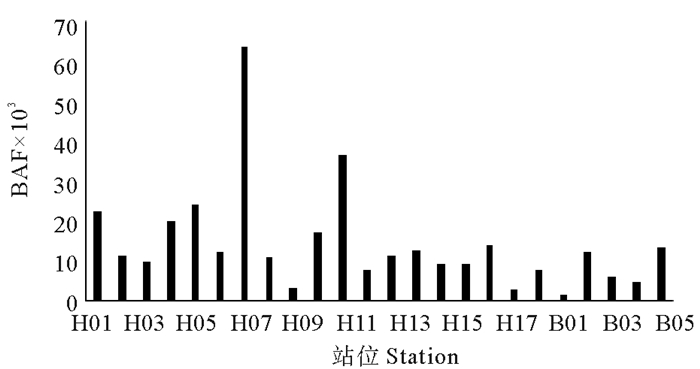
|
图 5 浮游动物的富集因子(BAF) Fig. 5 BAF of zooplankton in Bohai Sea and Yellow Sea |
共鉴定浮游动物63种,包括桡足类23种,季节性浮游动物19种,水螅水母8种,毛颚动物3种,枝角类3种,端足类3种,被囊动物2种,栉水母2种。
季节性浮游动物占浮游动物总量的比例范围为2% ~ 28.5%,种类繁多,以多毛类幼虫、担轮幼虫、浮浪幼虫为主,当比例增加,BAF极显著升高(r= 0.601**, P<0.01)(见图 6A)。
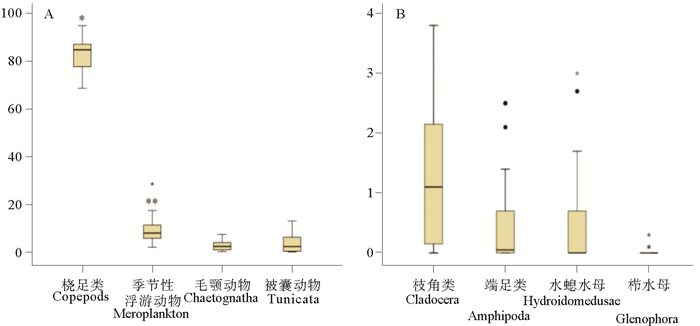
|
(“*”表示P<0.05,显著相关; “* *”表示P<0.01,极显著相关。“*”means P<0.05,significant correlation; “* *”means P<0.01, highly significant correlation.) 图 6 各类浮游动物占总生物量的百分比(须的上下两端表示最大值和最小值;盒子的上端表示第三四分位,下端表示第一四分位;中间的黑线表示中位数;“●”表示离群值,“*”表示极端值) Fig. 6 Box-whisker Plots of TBBPA in surfact waters of Bohai Sea and Yellow Sea.(The central bar in the box displays the median value; the end of the whiskers represent the minimum and maximum values; The start and end of the boxes include half the data points between the median and extreme of the range; "●"mean outliers, "*"mean extreme value) |
桡足类占浮游动物总量的比例范围为68.6%~94.8%,是最重要的组成部分,当比例变小时,BAF显著增加(r=-0.443*, P<0.05)(见图 6A)。毛颚动物、端足类、有尾类、枝角类、水螅水母和栉水母占浮游动物总量的比例范围分别为0.2%~7.3%,nd~2.5%,0.6~13%,0.3~3.8%,nd~3%和nd~0.3%,均与BAF无相关性(P>0.05)(见图 6A、B)。
2.6 浮游动物的脂类含量毛颚动物和季节性浮游动物的总脂类含量占总干重的比例范围分别为6.05%~9.17%和9.36% ~21.54%,当体内脂类含量越高时,BAF极显著增高(P<0.01)。小型桡足类的总脂类含量占总干重的比例范围为8.34%~ 22.31%,其脂类含量的增加会显著提高BAF(P<0.05)。大型桡足类、被囊动物、枝角类和水螅水母的总脂类含量占总干重的比例范围分别为5.57% ~ 9.36%,3.47% ~ 8.91%,4.97%~7.12%和0.67%~1.15%,其脂肪含量的变化均与BAF没有相关性(P>0.05)(见图 7)。
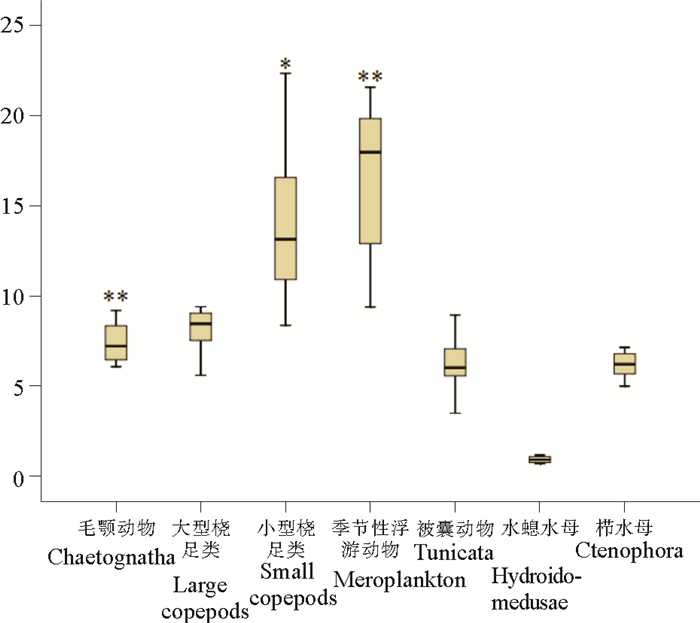
|
(“*”表示P<0.05,显著相关; “* *”表示P<0.01,极显著相关.“*”means P<0.05,significant correlation; “* *”means P<0.01, highly significant correlation.) 图 7 总脂类含量占总干重的百分比(须的上下两端表示最大值和最小值;盒子的上端表示第三四分位,下端表示第一四分位;中间的黑线表示中位数) Fig. 7 Box-whisker Plots of Lipid content of Zooplankton in Bohai Sea and Yellow Sea.(The central bar in the box displays the median value; the end of the whiskers represent the minimum and maximum values; The start and end of the boxes include half the data points between the median and extreme of the range.) |
由于TBBPA的广泛使用,致使在世界多地如德国、日本等有不同程度的检出[13-15]。而中国的污染形势更严峻,Yang等[4]发现巢湖中TBBPA浓度为850~4 870 ng/L。巩文静[16]在春季黄海海水中检测到的TBBPA浓度为nd~0.463 4 μg/L。与有关报道相比,本文研究结果略高,可能因为TBBPA的溶解度随温度升高而增大,并且夏季降水丰富,地表径流增加,将大气和土壤中的污染物冲刷进海洋,导致污染加重。总体来看,TBBPA在海水中的分布呈现近岸高于远海的趋势,渤海湾、唐山和连云港海域等的沿岸、河口和航运港口区域污染尤为严重。由此可见,陆源污染是中国海洋环境污染的主要原因。Ma J等[17]调查显示中国TBBPA的生产区主要集中在东部沿海发达地区,特别是山东、天津和江苏三省,例如山东寿光兄弟科技公司年产TBBPA 20 000 t,造成寿光土壤中的TBBPA浓度高达1.64~7 758 ng/g·d·w[18]。陆源有机化合物通过多种方式进入海洋环境,导致渤、黄海的TBBPA污染程度较高。
当污染物进入海洋后,回避和代谢能力较差的浮游动物最先受到影响,它们将有害物质富集体内,通过食物链和食物网传递到更高营养级,最终危及人类。因此,研究浮游动物与持久性有机污染物(Persistent Organic Pollutant,POPs)相互作用有重要的现实意义。巩文静[16]测定青岛近海、黄海浮游动物体内TBBPA含量范围分别为nd~5.79 μg/g(干重)和nd~9.83 μg/g(干重)。比较之下,本文的研究结果偏高,这可能由于无法将生物样品中携带的浮游植物等完全去除干净,尤其夏季是赤潮高发期,浮游植物成为影响实验结果的重要因素。Tiano等[19]也曾指出采集的样品中会夹杂4%~55%的浮游植物和碎屑颗粒物,它们能更有效吸附疏水性化合物。另外,浮游动物终其一生都生活在水环境中,通过消化道和体表吸收污染物,体内的TBBPA浓度主要受海水中浓度的影响,两者在分布趋势上具有一致性。
3.2 TBBPA含量、浮游动物生物量和种类组成与BAF的关系Boon(2006)等[20]计算加拿大Winnipeg湖中浮游动物对多溴联苯醚的logBAF值为2.8~4.1;在印度松达班红树林湿地中桡足类对微量金属元素的logBAF值4.5~6.5[21],在数量级上与本文结果一致。由此看来,渤、黄海浮游动物对TBBPA具有较强的富集能力,它们也是污染物进入海洋食物链和食物网的一个关键切入点。影响BAF的因素众多,主要分为两类:一类是环境因素,如海洋理化因子—盐度、温度、PH(Hydrogenion concentration)、DO(Dissolved Oxygen),有机物含量以及季节变化等;一类是生物因素,如生物的数量,大小,发育阶段,性别,器官组织差异,种属差异等[22]。本文发现随着浮游动物体内TBBPA浓度的升高,BAF极显著增大(P<0.01),而BAF与海水中的浓度呈负相关,这与李学鹏[22]的结论一致。
浮游动物生物量较高的区域集中在渤海沿岸和黄海中部,特别是受冷水团影响的黄海中部海域,早有报道指出,冷水团中生物的丰度和生物量远高于非冷水团区域[23-24]。沿岸海域营养程度可导致较高生物量。本研究发现生物量越高越容易富集TBBPA,但也有国外学者提出“生物泵”理论[19, 25-26],即生物量增加导致体内疏水性有机化合物的浓度降低。本文个别站位也出现此现象,但在大部分站位中,体内浓度随着生物量的增加而增加。总体来说,本文结果不符合“生物泵”理论,这可能与疏水性的强弱相关,也可能与地理条件有关。
种类组成是另一个重要的影响因素。对桡足类而言,占浮游动物总量的比例与BAF呈负相关。桡足类隶属节肢动物门甲壳纲桡足亚纲,虽没有典型外骨骼的包裹,但体表有几丁质外壳的保护,能有效阻止污染物渗入,起到一定的防御作用。Mauchline (1998)[27]曾报道过桡足类几乎不能通过体表吸收海水中的污染物。季节性浮游动物是指成体不是浮游动物,而幼体以浮游形式生活的一大类群,在浮游动物总量中的比例增加能促进对TBBPA的富集,这也与其自身结构息息相关。夏季代表动物有多毛类幼虫、担轮幼虫和浮浪幼虫,它们的体表上生有许多刚毛或纤毛,这些特点都扩大了与海水的接触面积,增强了对TBBPA的吸收。Pernet(2002)等[28]在研究多毛类幼虫对酚类化合物的吸收时也发现了这个现象。有研究指出毛颚动物以甲壳类、多毛类、小型鱼类为食,同时用体表呼吸,能蓄积更多污染物[6],但本文没有得出此结论,这可能与毛颚动物在研究海区的有限分布有关。除此之外,其他的浮游动物的出现频率较低,对BAF也无显著影响。相对于成体而言,幼体躲避和代谢有毒物质的能力弱,更容易吸收、积累TBBPA,继而引发毒性效应。
3.3 总脂类含量与BAF的关系脂类物质在浮游动物的休眠、生长发育以及繁殖过程中发挥关键作用,很多学者为此展开研究,如测定春、秋季黄海中南部浮游动物的总脂肪含量分别为12.44%和9.91%[29],但对生物富集能力影响的研究却很少涉及。有报道称脂肪含量可是影响SCCPs(Short-Chain Chlorinated Paraffins)在生物体内积累的一个重要因子[30]。Morteza(2016)等[6]研究表明查赫巴尔湾浮游动物体内的高TPAHs(Polycyclic Acromatic Hydrocarbons)浓度是由于脂肪含量高,这也是不同生物体内疏水性有机化合物浓度存在差异的原因。
不同类群的脂类含量顺序:季节性浮游动物>小型桡足类>大型桡足类>毛颚动物>端足类>枝角类>刺胞动物。季节性浮游动物脂类含量最高,刚孵化的幼虫为了满足生长发育的需要,体内常含有较多的脂类物质,如卤虫无节幼虫的粗脂肪含量高达21.54%[31]。桡足类从体长上可分为大型桡足类和小型桡足类,大型桡足类指成体体长≥2 mm;小型桡足类通常是指成体体长1 mm左右的桡足类及其幼体[32]。在本文中大型桡足类的脂类含量与王延清[33]的结果相同。包括幼体的小型桡足类的脂类含量更高,研究指出中纬度海域哲水蚤C5期个体的总脂重量占干重的8%~26%[34-35]。一般而言,海洋浮游桡足类的脂类含量因纬度、季节和食物丰度有巨大的变化,为干重的2%~73%[35]。相比之下,对毛颚动物和被囊动物的脂类研究较少,其含量与自身的结构、食性、季节等相关。本文中枝角类的总脂类含量与林元烧[31]测定的蒙虫裸腹溞的粗脂肪含量相一致。水螅水母的含水量高,脂肪含量低,王娜[36]曾测得水母体内总脂肪含量仅占干重的0.77%。
脂类含量与BAF相关性顺序:季节性浮游动物>毛颚动物>小型桡足类>枝角类>大型桡足类>被囊动物>水螅水母。毛颚动物、小型桡足类、季节性浮游动物的脂类含量的增加会显著增加对TBBPA的生物富集;而其他浮游动物的脂类含量略低,对BAF无影响。不同类群的脂肪组织对TBBPA的富集能力也存在差异,不仅与脂肪含量相关,也可能与脂肪酸组成有关,特别是不饱和性脂肪酸。总的来说,浮游动物含有的脂类含量越高,其生物富集因子(BAF)越大,这说明TBBPA是亲油性的,易于在浮游动物的脂肪组织中富集。许多研究指出,持久性有机化合物的logBAF与logKo/w(Ko/w:辛醇-水分配系数)呈线性正相关,疏水性越强,BAF越大。TBBPA有较强的疏水性(Ko/w=4.5×106;logKo/w=6.65),这也是浮游动物具有较高BAF的一个重要原因。
综上所述,本次研究无论在渤、黄海表层水中还是浮游生物体内均不同程度地检测到TBBPA。相比之前的研究,TBBPA浓度有所增加,可见渤、黄海的污染情况较为严重,应引起足够关注。浮游动物对TBBPA有较强的生物富集能力,BAF随着种类组成以及脂类含量的变化而发生一定的变化,可以从一定程度上反映不同种群对TBBPA的富集潜力有所差异,并且TBBPA作为一种亲脂性有毒有机污染物,易于在浮游动物的脂肪中富集,并经过长时间的富集和生物放大,传递到整个食物网,产生严重后果。因此,本次研究对评估TBBPA在渤、黄海生态系统的污染水平和海洋环境安全与保护提供了科学依据。
| [1] |
Alaee M, Arias P, SjÖdin A, et al. An overview of commercially used brominated flame retardants, their applications, their use patterns in different cuntries/regions and possible modes of release[J]. Environment International, 2003, 29(6): 683-689. DOI:10.1016/S0160-4120(03)00121-1
(  0) 0) |
| [2] |
刘建梅, 刘济宁, 陈英文, 等. 四溴双酚A和三溴苯酚对大型溞的急性和慢性毒性[J]. 环境科学学报, 2015, 35(6): 1946-1954. Liu J M, Liu J N, Chen Y W, et al. Acute and chronic toxicity of Tetrabromobisphenol A and Tribromophenol to Daphnia magna[J]. Acta Scientiae Circumstantiae, 2015, 35(6): 1946-1954. (  0) 0) |
| [3] |
彭浩, 金军, 王英, 等. 四溴双酚-A及其环境问题[J]. 环境与健康杂志, 2006, 6: 571-573. Peng H, Jin J, Wang Y, et al. Tetrabromobisphenol-A and Related Environmental Problems[J]. Environ Health, 2006, 6: 571-573. DOI:10.3969/j.issn.1001-5914.2006.06.047 (  0) 0) |
| [4] |
Yang S, Wang S, Liu H, et al. Tetrabromobisphenol A: tissue distribution in fish, and seasonal variation in water and sediment of Chaohu Lake, China[J]. Environ Sci Pollut Res, 2012, 19: 4090-4096. DOI:10.1007/s11356-012-1023-9
(  0) 0) |
| [5] |
朱延忠. 夏、冬季北黄海大中型浮游动物群落生态学研究[D]. 青岛: 中国海洋大学, 2008: 4-5. Zhu Y Z. Study on the Macro-zooplankton and Meso-zooplankton Community Ecology in the North Yellow Sea in Summer and Winter[D]. Qingdao: Ocean University of China, 2008: 4-5. (  0) 0) |
| [6] |
Morteza Z, Ali M, Leila K, et al. Assessment of concentration, bioaccumulation and sources of polycyclic aromatic hydrocarbons in zooplankton of Chabahar Bay[J]. Marine Pollution Bulletin, 2016, 107(1): 408-412. DOI:10.1016/j.marpolbul.2016.02.045
(  0) 0) |
| [7] |
毕洪生, 孙松, 高尚武, 等. 渤海浮游动物群落生态特点Ⅱ.桡足类数量分布及变动[J]. 生态学报, 2001, 2: 177-179. Bi H S, Sun S, Gao S W, et al. The ecological characteristics of zooplankton community in the Bo-hai SeaⅡ.The distribution of copepoda abundance and seasonal dynamics[J]. Acta Ecologica Sinica, 2001, 2: 177-179. DOI:10.3321/j.issn:1000-0933.2001.02.001 (  0) 0) |
| [8] |
周建平. 黄渤海表层水中汞的形态及分布特征[D]. 青岛: 中国海洋大学, 2014: 5-10. Zhou J P. Distribution of Mercury in the Surface Water of the Yellow Sea and Bohai Sea[D]. Qingdao: Ocean University of China, 2014: 5-10. (  0) 0) |
| [9] |
Wang K, Feng S Z. Numerical experiments on the wind-driven circulation in the Bohai, Huanghai and East China Sea in winter[J]. Chinese Journal of Oceanology and Limnology, 1999, 17: 10-18. DOI:10.1007/BF02842695
(  0) 0) |
| [10] |
赵军杰. 基于吸收和荧光性质对中国黄渤海海域有色溶解有机物(CDOM)的分布特征研究[D]. 青岛: 中国海洋大学, 2013: 11-12. Zhao J J. The Study on Characteristics and Distribution of Chromophoric Dissolved Organic Matter (CDOM) based on Absorption and Fluorescence Properties in the Bohai Sea and the Yellow Sea[D]. Qingdao: Ocean University of China, 2013: 11-12. (  0) 0) |
| [11] |
任海霞. 高效液相色谱法测定四溴双酚-A[J]. 城镇供水(水质分析与监测), 2012, 2: 42-44. Ren H X. Determination of Tetrabromobisphenol-A by High Performance liquid Chromatography[J]. City And Town Water Supply, 2012, 2: 42-44. (  0) 0) |
| [12] |
Folch J, Lees M, Sloane-Stanley, et al. A simple method for the isolation and purification of total lipids from animal tissues[J]. J Biol Chem, 1957, 226: 497-509.
(  0) 0) |
| [13] |
Kuch B, Korner W, Hagenmaier H. Monitoring von bromiertenFlammschutzmitteln in Fliessgewässern, Abwässern und Klärschlümmen in Baden-Würtemberg[J]. Abschiissbericht des BWPlus-Forschungsvothabens BWBO, 2001, 99-110.
(  0) 0) |
| [14] |
S. SUZUKI, A. HASEGAWA. Determination of Hexabromocyclododecane Diastereoisomers and Tetrebromobisphenol A in Water and Sediment by Liquid Chromatography/Mass Spectrometry[J]. Analytical Sciences, 2006, 22(3): 469. DOI:10.2116/analsci.22.469
(  0) 0) |
| [15] |
Guerra P, Eljarrat E, Barcelo D. Simultaneous determination of Hexabromocyclododecane, Tetrabromobisphenol A, and related compounds in sewage sludge and sediment samples from Ebro River basin (Spain)[J]. Anal Bioanal Chem, 2010, 397: 2817-2824. DOI:10.1007/s00216-010-3670-3
(  0) 0) |
| [16] |
巩文静. 四溴双酚A(TBBPA)对近海常见桡足类的毒性效应及其在中国北方海域的污染分布[D]. 青岛: 中国海洋大学, 2016: 73-78. Gong W J. TheToxic Effects of Tetrabromobisphenol A (TBBPA)to Marine Common Copepods and Its Environmental Distribution in the North China Sea[D]. Qingdao: Ocean University of China, 2016: 73-78. (  0) 0) |
| [17] |
Ma J, Qiu X, Zhang J, et al. State of polybrominated diphenyl ethers in China: An overview[J]. Chemosphere, 2012, 88: 769-778. DOI:10.1016/j.chemosphere.2012.03.093
(  0) 0) |
| [18] |
Kou Liu, Jun Li, Shengjun Yan, et al. A review of status of tetrabromobisphenol A (TBBPA) in China[J]. Chemosphere, 2016, 148: 8-20. DOI:10.1016/j.chemosphere.2016.01.023
(  0) 0) |
| [19] |
Tiano M, Tronczynski J, Harmelin-Vivien M, et al. PCB concentrations in plankton size classes, a temporal study in Marseille Bay, Western Mediterranean Sea[J]. Mar Pollut Bull, 2014, 89: 331-339. DOI:10.1016/j.marpolbul.2014.09.040
(  0) 0) |
| [20] |
Boon J P, Lewis W E, Tjoen A C M R, et al. Levels of polybrominated diphenylether(PBDE)flame retardants in animals representing different trophic levels of the North Sea food web[J]. Environmental Science & Technology, 2002, 36(19): 4025-4030.
(  0) 0) |
| [21] |
Bhaskar Deb B, Jiang-Shiou H, Li-ChunT, et al. Bioaccumulation of trace elements in dominant mesozooplankton group inhabiting in the coastal regions of Indian Sundarban mangrove wetland[J]. Marine Pollution Bulletin, 2014, 87: 345-351. DOI:10.1016/j.marpolbul.2014.07.050
(  0) 0) |
| [22] |
李学鹏. 重金属在双壳贝类体内的生物富集动力学及净化技术的初步研究[D]. 浙江: 浙江工商大学, 2008: 54-55. Li X P. Preliminary Studies on the Kinetics of Bioconcentration and Depuration of Heavy Metals in Biavlves[D]. Zhejiang: Zhejiang Gongshang University, 2008: 54-55. (  0) 0) |
| [23] |
刘清河, 刘晓收, 许嫚, 等. 夏季南黄海冷水团及其周边海域小型底栖动物类群组成与分布[J]. 生态学报, 2015, 35(24): 8062-8074. Liu Q H, Liu X S, Xu M, et al. Meiofaunal assemblage and distribution in the southern Yellow Sea Cold Water Mass and its adjacent waters in summer[J]. Acta Ecologica Sinica, 2015, 35(24): 8062-8074. (  0) 0) |
| [24] |
王晓, 王宗灵, 蒲新明, 等. 夏季南黄海浮游动物分布及其影响因素分析[J]. 海洋学报, 2013, 35(5): 147-155. Wang X, Wang Z l, Pu X M, et al. Analysis of the distribution of zooplankton in the Southern Yellow Sea in summer and its influencing factors[J]. Acta Oceanologica Sinica (in Chinese), 2013, 35(5): 147-155. (  0) 0) |
| [25] |
Nizzetto L, Gioia R, Li J, et al. Biological pump control of the fate and distribution of hydrophobic organic pollutants in water and plankton[J]. Environ Sci Technol, 2012, 46: 3204-3211. DOI:10.1021/es204176q
(  0) 0) |
| [26] |
Todorova S, Driscoll C T, Matthews D A, et al. Zooplankton community changes confound the biodilution theory of methylmercury accumulation in a recovering mercury-contaminated Lake[J]. Environ Sci Technol, 2015, 49: 4066-4071. DOI:10.1021/es5044084
(  0) 0) |
| [27] |
Mauchline J. The Biology of Calanoid Copepodes[M]. USA: Adv Mar Biol, 1998, 33.
(  0) 0) |
| [28] |
Pernet B, Qian P Y, Rouse G, et al. Phylum annelida: Polychaeta[M]. //Young C M. Atlas of Marine Invertebrate Larvae. Academic Press, 2002: 209-242.
(  0) 0) |
| [29] |
聂丹丹, 张波, 金显仕. 黄海中南部浮游动物春季和秋季生化及能值分析[J]. 渔业科学进展, 2009, 30(1): 8-15. Nie D D, Zhang B, Jin X S. Energy and biochemical composition of zooplankton during autumn andspring in southern and central Yellow Sea[J]. Progress in Fishery Sciences, 2009, 30(1): 8-15. (  0) 0) |
| [30] |
马新. 东北方典型区域多溴联苯醚和锻炼氯化石蜡的生物富集及放大研究[D]. 大连: 大连理工大学, 2014: 77. Ma X. Research on Bioconcentration and Biomagniflcation of Polybrominated Diphenyl Ethers and Short-Chain Chlorinated Paraffins in a Typical Northern Area of China[D]. Dalian: Dalian University of Technology, 2014: 77. (  0) 0) |
| [31] |
林元烧, 曹文清, 郑爱榕, 等. 几种饵料浮游动物脂肪酸组成分析及营养效果评价[J]. 台湾海峡, 2001, 20: 0164-0169. Lin Y S, Cao W Q, Zheng A R, et al. Fatty acid composition analysis and their nutrient effecte valuation of some pelagic food organisms[J]. Journal of Oceanography in Taiwan Strait, 2001, 20: 0164-0169. (  0) 0) |
| [32] |
孙晓红. 小型桡足类种群动力学研究[D]. 青岛: 中国科学院海洋研究所, 2008: 3. Sun X H. Population Dynamics of Small Copepod[D]. Qingdao: The Institute of Oceanology, Chinese Academy of Sciences, 2008: 3. (  0) 0) |
| [33] |
王延清, 李超伦, 刘梦坛, 等. 黄海春季和秋季中华哲水蚤脂类含量及组成分析[J]. 海洋学报, 2013, 36(2): 99-107. Wang Y Q, Li C L, Liu M T, et al. Lipid content and composition of Calanussinicus in the Yellow Sea in Spring and autumn[J]. Acta Oceanologica Sinica(in Chinese), 2013, 36(2): 99-107. (  0) 0) |
| [34] |
Hakanson J L. The long and short therm feeding condition in field-caught Calanuspacificus, as determined from the lipid content[J]. Limnology and Oceanography, 1984, 29(4): 794-804. DOI:10.4319/lo.1984.29.4.0794
(  0) 0) |
| [35] |
Lee R F, Hirota J. Wax esters in tropical zooplankton and nekton and the geographical distribution of wax esters in marine copepods[J]. Limnology and Oceanography, 1973, 18(2): 227-239. DOI:10.4319/lo.1973.18.2.0227
(  0) 0) |
| [36] |
王娜. 脂肪酸等生物标志物在海洋食物网研究中的应用[D]. 上海: 华东师范大学, 2008: 45 Wang N. Application of Fatty Acids Biomarker in Marine Food Web Research: A Case in the Yangtse River Estuary Sea Area[D]. Shanghai: East China Normal University, 2008: 45. (  0) 0) |
 2018, Vol. 48
2018, Vol. 48


