我国的海水养殖业迅速发展,在满足人们对海产品需求过程中起了重要作用。然而,在生产过程中,海水养殖区、养殖场产生的大量污染物直接进入海洋环境,长期积累导致水质恶化,海洋生态系统失衡。在评价养殖水质的多种指标中,氨氮是最需要密切关注的指标之一[1]。水产养殖过程中的氮源污染主要来自于人工投饵、动物粪便、残饵以及死亡动植物,以硝态氮、亚硝态氮和氨氮等形式存在。其中氨氮是引起水生生物毒害的主要因子,它能破坏鱼类的腮组织,诱发烂鳃病,抑制血液载氧能力,使呼吸机能下降,引起养殖动物缺氧或中毒死亡[2-3]。同时水中浓度过高的氨还会严重影响鱼虾体内酶的催化作用和细胞膜的稳定性,并破坏排泄系统和渗透平衡[4]。为此,养殖水体中氨氮的监测和控制一直是人们重点关注的焦点。
对于海水养殖环境中氨氮的控制方法,目前主要采用物理法、化学法和生物法。物理法有换水、曝气、投撒沸石粉或壳聚糖等处理方法;化学法包括使用适量生石灰、臭氧、过氧化氢、二氧化氯等化学试剂来降低氨氮浓度;生物法包括微生物、植物和水生动物或者多种生物的联合修复作用等。其中生物法与传统物理化学法相比,具有投资低、环境相容性好、无二次污染、不危害养殖功能等优点,是目前最具发展前景的水体修复技术[5]。其中,微生物修复是研究最早也是目前最主要的生物修复方法,但直接使用游离态微生物菌剂有很多缺点,如菌剂易随换水过程稀释,且不能准确定位;利用效率低,无法满足去除效果等[6]。在海水养殖区中,残余饵料、粪便等有机污染物一般通过重力沉降到养殖环境底部,然后在较长的时间内,分解产物再从底部向上层水域扩散,因此需要利用合适的固定化载体和方法,使所需菌剂到达养殖水体的底部,达到原位降解底部有机污染物、控制污染物向上层水中扩散的目的[6-7]。
对于微生物的固定多采用包埋法,应用沸石吸附法固定的研究正处于起步阶段。边阁等[8]用海藻酸钠固定化亚硝化-反硝化细菌,结果表明,4.5%的海藻酸钠和2.1%的氯化钙为最佳条件,54 h对氨氮的去除率为95.65%。岳建伟等[9]采用聚乙烯醇(PVA)-硼酸法对2株异养硝化-好氧反硝化菌进行了包埋固定化,通过正交实验选出最佳包埋条件,结果表明,包埋量4%、PVA质量浓度5%,交联时间12 h,小球直径2.5 mm为最佳条件。沸石密度大,沉降性能好,自身具有很强的吸附氨氮的能力,能够为固定化的氨氧化菌提供更丰富的底物,创造良好的微环境,具有广阔的应用前景[10-11]。刘嘉夫等[12]将从扬州古运河沉积物中驯化分离的硝化、反硝化细菌固定于斜发沸石上,发现挂膜沸石对氨氮的去除率达到94.64%以上,可有效抑制沉积物氨氮释放,达到了降低污染底泥氨氮负荷的目的。同样,陈兵红[11]应用改性沸石作为载体固定化氨氧化菌,优化固定化方法后对氨氮的去除率达到99.72%。可见,应用沸石吸附固定化脱氮菌具有一定的研究基础,在海水养殖环境修复中具有很好的应用前景。
本研究应用沸石吸附固定嗜盐的氨氧化-反硝化菌株,分析温度、溶解氧(DO)以及固定化脱氮菌的投加量等对氨氮去除效果的影响,继而,将固定化菌剂应用于海水养殖系统中,探讨固定化脱氮菌对氨氮的控制效果,为其在海水养殖中的应用提供数据支持。
1 材料与方法 1.1 海水养殖系统的建立本研究采用的海水养殖系统为长方体结构,长100 cm,高90 cm,宽40 cm,超白玻璃材料,系统外接过滤器及过滤棉,用于除去养殖过程中悬浮物及微生物,通过水泵保证养殖系统中水体每小时循环过滤3次,系统安装曝气泵和温度计。
从胶州湾近岸养殖区取沉积物和海水,装入养殖系统中。装入的泥沙高度为20 cm,海水高度为50 cm。待泥沙沉淀完全,水质澄清时,开始投放鱼苗,其中养殖系统Ⅰ、Ⅱ分别投放10尾长约15 cm的梭鱼,系统Ⅲ、Ⅳ为对照,不投放鱼苗。每天定时向系统Ⅰ、Ⅱ投加饵料,饵料为常规市售,主要成分:蛋白50%、脂肪10%、纤维3%、灰分17%、钙2%、总磷1.8%、水分10%、赖氨酸2.3%。所投饵料从少到多,观察养殖系统底部开始出现明显残饵时所投饵料即为每天投饵量,经过测试,每个系统每天投饵料为12~14 g。养殖系统每隔1周换水1次,换水量约1/3,每隔2周清洗1次过滤棉。
1.2 脱氮菌株及其培养本研究使用的脱氮菌为卓贝尔氏菌(Zobellella sp.),为课题组自胶州湾沉积物中分离,具有异养硝化、好氧反硝化的能力,在盐度低于55时,氨氧化-反硝化产物中无亚硝态氮积累。菌株应用异养硝化基础培养基(DM)培养,取5 mL菌液加入95 mL灭菌培养基,置于30 ℃,150 r/min振荡24 h,使菌液在600 nm吸光度OD600为1.5。
DM培养基(g/L)[13]:KH2PO4 1.5,MgSO4·7H2O 0.01,NaHPO4 7.9,柠檬酸钠5.66,NaNO3 0.841 5,NH4Cl 0.264 8,NaCl 35,去离子水1 000 mL,微量元素溶液2 mL,pH=7.0~7.5。无NaNO3的DM培养基是不加NaNO3,其它成分均与DM培养基相同,用来检测固定化脱氮菌对氨氮的氧化作用;无NH4Cl的DM培养基是不加NH4Cl,其它成分均与DM培养基相同,用来验证固定化脱氮菌的反硝化作用。
1.3 脱氮菌的固定化及特征分析 1.3.1 固定化方法采用吸附法对菌剂进行固定化。选择15目斜发沸石为吸附材料,以pH=5的磷酸对沸石进行化学改性,然后进行吸附固定化。(1)按每克沸石5 mL磷酸溶液(pH=5)的比例将沸石加入到磷酸溶液,30 ℃,150 r/min振荡30 min,静置24 h后,沸石用灭菌蒸馏水润洗3次,除去多余磷酸;(2)取50 mL菌液,OD600=1.5,1.05×109 CFU/mL,分别将0.5、1、2、3 g(干重)改性沸石加入菌液中,30 ℃,150 r/min振荡吸附24 h,弃去上清液,用灭菌蒸馏水冲润沸石3次以除去未吸附的细菌;(3)取以上获得的固定化菌剂,分别投入无NaNO3的DM培养基,振荡培养24 h后,测定氨氮剩余量,计算氨氮去除率,选出固定化时沸石的最佳投加量。
氨氮去除率(E)的计算公式为:
| $ {\rm E} = ({C_0} - C)/{C_0} \times 100\%。$ |
式中:C0为初始氨氮浓度(mg/L);C为处理后氨氮浓度(mg/L)。
为了确定沸石载体对菌剂吸附量,取50 mL菌液,OD600=1.5,初始浓度1.05×109 CFU/mL,其中一组加入2 g沸石,另一组不加沸石为对照,吸附固定化后,取固定化以后上清悬浮液和不加沸石对照菌液,采用稀释平板菌落记数法测定样品中的活菌数,计算沸石吸附菌量。
沸石吸附菌量Nabs(CFU/g)计算公式为:
| $ {\rm{Nabs}} = [({N_0} - {N_1}) \times 50]/2。$ |
式中:N0为未加沸石的菌液中细菌数量(CFU/mL);N1为投加沸石吸附后悬浮液中剩余游离菌量(CFU/mL)。
1.3.2 固定化脱氮菌的特征分析(1) 菌剂固定化的状态观察
将新制备的沸石固定化菌剂用灭菌蒸馏水冲洗3次,取出4~5粒装入1.5 mL无菌离心管中,按照文献[14]中的方法进行适当的预处理,使用扫描电子显微镜(JEM-1200EX, JEOL Japan)对固定化颗粒表面进行观察。
(2) 温度、氨氮初始浓度对脱氮效果的影响
取2 g固定化菌剂、相当于2 g固定化菌量的菌液以及2 g无菌沸石分别加入到50 mL无NaNO3的DM培养基中,氨氮起始浓度分别为30、50、70、90、110、130 mg/L,在30 ℃,150 r/min的摇床中振荡培养24 h,测定氨氮的去除率。在10~60 ℃范围内设6个梯度,在起始氨氮浓度为90 mg/L的无NaNO3的DM培养基中加入2 g沸石固定化菌剂,在150 r/min条件下恒温振荡24 h后测定氨氮去除率。
为分析固定化菌剂氧化氨氮的产物,在50 mL无NaNO3的DM培养基中加入2 g沸石固定化菌剂,放置于30 ℃、150 r/min条件的摇床中振荡培养48 h,每24 h测定一次氨氮、硝酸盐氮和亚硝酸盐氮。为分析固定化菌是否具有反硝化能力,将沸石固定化菌剂投入50 mL无NH4Cl的DM培养基中,30 ℃、150 r/min条件下振荡培养48 h,每24 h测定一次硝氮和亚硝氮浓度。
(3) 固定化脱氮菌的重复使用效果
为了验证固定化后菌剂的重复使用能力,在30 ℃,150 r/min条件下,应用固定化菌剂处理氨氮初始浓度为90 mg/L的无NaNO3的DM培养基,振荡24 h后,将沸石固定化菌剂取出并用灭菌蒸馏水冲洗3次,再置入新的无NaNO3的DM培养基中,测定氨氮的去除效果,重复使用5次。
1.4 固定化菌剂的应用为了满足固定化菌剂在实际生产中的需要,选用耐腐、透水无纺土工布制作成袋状,将沸石固定化的菌剂完全平铺于袋内,沸石颗粒基本无重叠,并通过交叉缝制布袋限制颗粒移动。根据预试验发现10~12 g沸石固定化菌剂刚好完全平铺于10 cm×10 cm的土工布袋。
在实际养殖环境中,养殖区水体深度大多在2 m左右,不同区域溶解氧量差异较大,尤其是在有机饵料沉积较多的区域,由于污染物的氧化分解而导致底部出现缺氧状态,因此需要探讨不同溶解氧条件下,该固定化菌剂对氨氮的控制效果。在系统Ⅲ、Ⅳ中,每天投加相同质量的饵料,微生物分解有机物会消耗氧气,若不运行曝气系统,由于系统水位较深,仅依靠自然复氧,氧气很难到达底部,无法满足养殖系统中对氧气的需要。因此在该系统中,在投加饵料及不运行曝气系统的情况下,该养殖系统中溶解氧很快就会下降至0.5 mg/L以下。通过控制曝气量,使养殖系统中的溶解氧含量分别为DO<0.5 mg/L,DO=1~3.5 mg/L,DO>6.5 mg/L,待系统稳定后,将10 g沸石固定化菌剂装入10 cm×10 cm的土工布布袋中,靠土工布自身吸水加重后缓慢沉入系统Ⅲ底部中央,平铺于沉积物-水界面,其面积约占底面积的2.5%,系统Ⅳ使用土工布布袋装入等量无菌沸石作为对照。连续测定48 h内对氨氮的平均控制率,应用7 d后,再取出固定菌剂用灭菌蒸馏水冲洗干净,取约2 g加入无NaNO3的DM培养基中振荡24 h,分析菌剂是否失活。
待养殖系统Ⅰ、Ⅱ的梭鱼完全适应环境后,将新制备的12 g沸石固定化菌剂平铺装入10 cm×10 cm的土工布布袋中,由于环境温度较前期实验有所下降,故略提高了菌剂使用量。按前述方法将土工布布袋平铺于沉积物-水界面,其面积约占底面积的2.5%;将同等质量的无菌沸石平铺于同样尺寸的土工布布袋中,按相同方法沉入养殖系统Ⅱ底部中央。每天监测氮元素及溶解氧的变化。
氨氮的平均控制率计算公式为:
| $ {\rm{\bar Y}} = [\sum (({C_{0t}} - {C_t})/{C_{0t}})]/t \times 100\%。$ |
其中:C0t为加入无菌沸石后每天对照组测定的氨氮浓度(mg/L);Ct为加入固定化菌剂后每天实验组测定的氨氮浓度(mg/L);t为时间(d)。
1.5 测定方法氨氮(NH3-N)采用纳氏试剂分光光度法测定;硝酸盐氮(NO3--N)采用紫外分光光度法测定;亚硝酸盐氮(NO2--N)采用分光光度法测定;溶解氧采用便携式溶解氧仪测定(哈希,美国)。
2 结果与讨论 2.1 固定化脱氮菌对氨氮的去除效果 2.1.1 脱氮菌在载体上固定化后的形态使用电镜对固定化之后的脱氮菌进行观察,结果如图 1。从图片可见,沸石内部具有较多的孔隙,杆状的脱氮菌被成功吸附在沸石上。微生物主要吸附在孔洞表面,有利于与外界进行底物与代谢产物的交换。

|
图 1 固定化脱氮菌在载体表面的形态 Fig. 1 Microbial morphology of immobilized ammonia oxidizing bacteria on carrier surface |
在使用沸石吸附固定化脱氮菌时,分别按照每50 mL菌液加0.5、1、2、3 g改性沸石进行固定化,所得固定化菌剂颗粒对氨氮的去除率分别为39%,56%,89%,92%,表现出逐渐提高的趋势,但与固定化载体质量并不成正比,相对于使用2g进行吸附的结果,使用3 g进行吸附时对氨氮的去除效率提高仅为4%,这表明2 g沸石基本可将培养液中细菌吸附完毕,再增加沸石量也不会明显提高细菌吸附量。为此,在固定化菌剂的制备中,生长至OD600=1.5的培养液,微生物数量为1.05×109 CFU/mL,50 mL菌液最适沸石使用量为2 g。
通过平板菌落计数分析,菌液初始含菌量为N0=1.05×109 CFU/mL,应用2 g沸石吸附后剩余悬浮液中游离菌量为N1=4.3×108 CFU/mL,因此,单位质量沸石固定化菌剂中的含菌量为Nabs=[(N0-N1)×50]/2=1.55×1010 CFU/g。张闻等[15]在用生物炭固定化石油降解菌时测定固定化菌剂含降解菌量为5.8×109 CFU/g,对5 g/L原油培养基的周除油率是47.6%~50.7%,有很好的除油效果。周珊等[16]以竹炭为载体固定硝化菌、反硝化菌等微生物,探究对氨氮的去除效果,竹炭固定化的菌量达3.1×108 CFU/g。因此,该固定化菌剂所吸附的菌量能够满足使用的需要。
2.1.3 温度及沸石固定化菌剂投加量对氨氮去除的影响(1) 温度对固定脱氮菌去除氨氮效果的影响
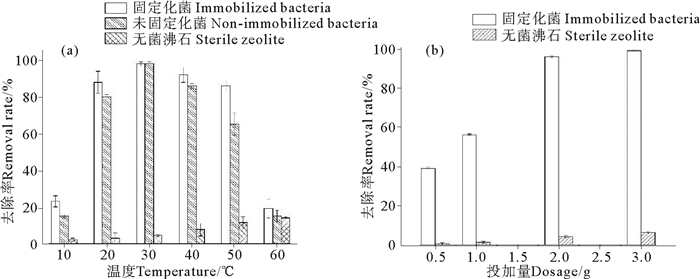
在自然养殖环境中,水温一直在波动,而温度是影响微生物生长繁殖的重要环境因子,只有在合适的温度范围内微生物才能更好的生长繁殖,温度过高或过低都会使微生物的生长速率降低,从而影响对污染物的去除效果[17-18]。因此需要确定固定化菌剂受温度的影响情况,考察固定化脱氮菌的最适温度,以便在实际使用中根据温度变化对菌剂使用量进行调整,以达到更好的效果。在10~60 ℃设6个梯度,在24 h内对同浓度氨氮的去除率如图 2a。
|
图 2 温度(a)、沸石固定化菌剂投加量(b)与氨氮去除率关系 Fig. 2 Relationship between temperature (a), zeolite immobilized bacteria dosage (b) and ammonia nitrogen removal rate |
由图可见,对初始氨氮浓度90 mg/L的无NaNO3的DM培养基,固定化脱氨菌在20~50 ℃温度下对氨氮的去除率均在88%以上,在30 ℃时最高,可达98%,而在10和60 ℃温度下固定化菌剂对氨氮的去除率分别为23%,19%,说明该固定化脱氮菌可在20~50 ℃的温度范围内较好的发挥作用,其中30 ℃时效果最佳。将固定化菌剂与非固定化菌剂比较发现,经过沸石吸附固定的菌剂对温度的耐受性比非固定化菌剂更好。另外,随着温度的升高,无菌沸石对氨氮的吸附作用增强,所以在高温条件下,固定化菌剂比非固定化菌剂对氨氮的去除率高可能是沸石本身也对氨氮有一定的吸附作用,两者共同作用使得固定化菌剂去除率更高一些。
Dong等[19]用海藻酸钠包埋固定氨氧化菌,探究了20~40 ℃对固定化菌转化氨氮能力的影响,结果表明,30 ℃是固定化脱氮菌生长和去除氨氮的最佳温度。袁林江[20]用聚乙烯醇(PVA)包埋固定反硝化菌,测定10~50 ℃下包埋菌与未包埋菌的反硝化作用,结果表明,包埋菌与非包埋菌的最适温度均为30 ℃,当温度降低或升高时,未包埋菌的反硝化作用均低于包埋菌。这些研究表明温度是影响固定化菌剂应用效果的重要因素,温度过高或过低都会使菌剂代谢缓慢甚至失活,使脱氮效果降低。
本研究使用的固定化脱氮菌的适用温度范围很广,为该菌的实际应用奠定了基础。在近海养殖过程中,温度一般为10~30 ℃,因此,该固定化菌剂可以很好的使用。
(2) 沸石固定化菌剂投加量对氨氮去除效果的影响
在固定化菌剂投入使用时,菌剂的投加量对氨氮的去除效果会产生影响。使用量过少,不能很好的控制氨氮,使用量过多,又会造成浪费。因此,在实际应用时,沸石固定化菌剂的投加量也是需要考虑的影响因素之一。在起始氨氮浓度为90 mg/L无NaNO3的DM培养基中分别加入0.5、1、2、3 g沸石固定化菌剂,24 h内对氨氮的平均去除率如图 2b所示。
可以看出,0.5、1、2、3 g沸石固定化菌剂对氨氮的去除率分别为39%、56%、96%、99%,相应质量的无菌沸石对氨氮的去除率分别为0.5%、1.25%、4.24%、6.24%。可见,对氨氮的去除主要是沸石吸附固定的脱氮菌的作用,在相同氨氮浓度和处理时间内,随着沸石固定化菌剂投加量的增加,对氨氮的去除率也随之增加。当沸石固定化菌剂投加量在0.5~2 g之间时,对氨氮的去除效果变化幅度较大;大于2 g时,对氨氮的去除效果提高较小,基本已达到最大去除率。说明在一定范围内的固定化菌剂投加量对氨氮的去除效果是有明显影响,投加量越多,去除效果越好。但从实际应用角度出发,既要考虑去除效果,又要考虑经济效益,针对不同的污染情况和环境条件变化,需要选择一个最适的使用量以达到更好的应用效果。
辛福言等[21]在对虾池中有机物降解时,对固定化菌剂的使用量也进行了探究,发现模拟池中固定化菌剂加入量为2~5 g时对COD去除效果变化较大,大于5 g时,对COD去除效果提高放缓。Erna等[22]研究了10~200个固定化脱氮菌小球的使用对氨去除速率的影响,结果表明150个小球去除氨氮的速率最快。由此可见在固定化菌的应用研究中,确定固定化菌剂投加量是必要的,要做到既能使菌剂达到去除污染物的目的,又要在成本上保证菌剂的可利用性。
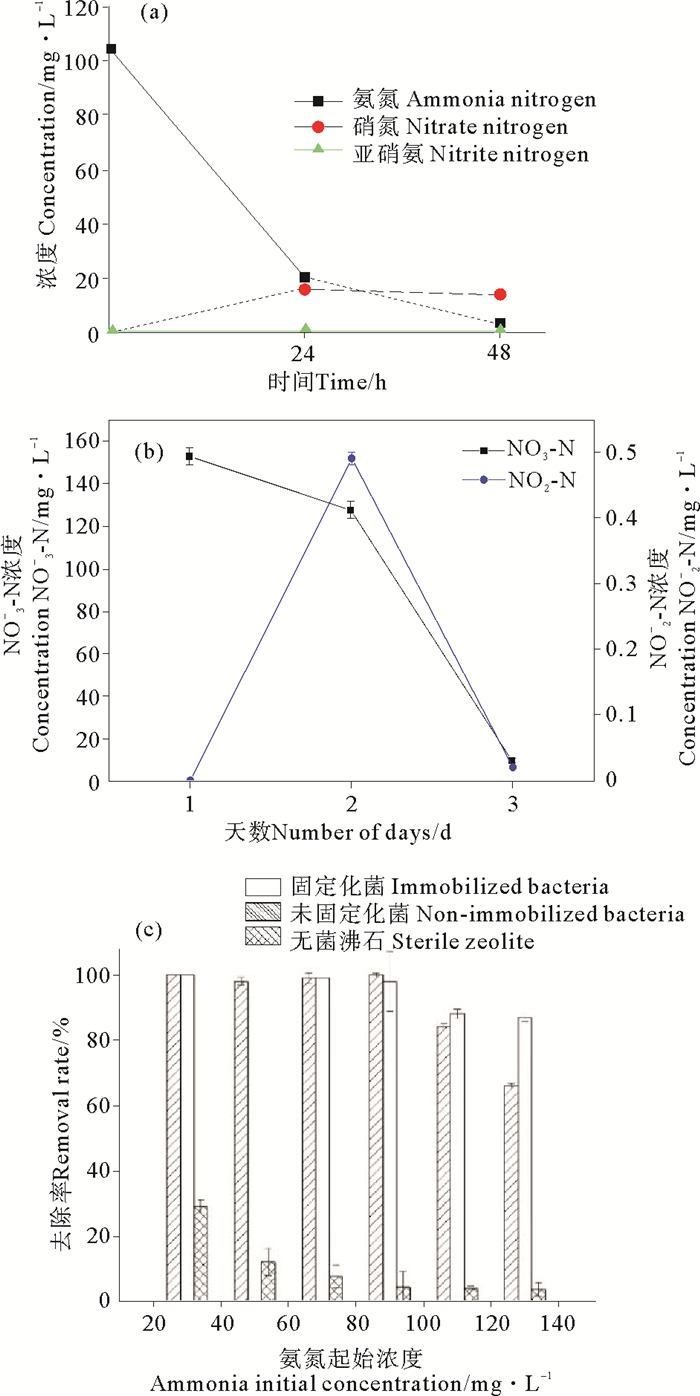
2.1.4 固定化菌剂对氨氮的氧化能力 2.1.4.1 氨氮氧化的产物分析2 g固定化菌剂在50 mL无NaNO3的DM培养基中振荡培养48 h,氨氮、硝氮和亚硝氮的浓度变化结果如图 3a。经过48 h振荡培养后,氨氮从104.56 mg/L降到了3.07 mg/L,硝氮增长到16.39 mg/L后基本保持不变,而亚硝氮基本没有产生。表明该固定化菌剂对氨氮进行去除时,会产生少量硝氮积累;从图 3b可以看出,该菌在无NH4Cl、只有硝氮的DM培养基中培养48 h内会将硝氮基本去除,在反应过程中有亚硝氮的积累,表明该菌具有反硝化作用。由于该菌同时具备硝化、反硝化能力,在氨氮去除过程中,硝氮的积累将随着时间延长被全部去除。
|
图 3 固定化菌剂对氨氮的氧化(a)、对硝氮的反硝化(b)以及不同浓度氨氮的去除效果(c) Fig. 3 Oxidation of ammonia nitrogen (a), denitrification of nitrate (b), and removal of ammonia nitrogen at different concentrations (c) by immobilized bacteria |
陈君等[23]在处理氨氮废水时,利用亚硝化菌Ochrobactrum anthropic CZ在DO为8 mg/L条件下,可以将初始氨氮浓度为50 mg/L的氨氮去除95%以上,而亚硝氮的积累量达2.1 mg/L。这说明一般固定化菌剂在去除氨氮时会产生大量的亚硝氮。相比而言,本研究固定化的脱氮菌在氨氮去除过程中几乎无亚硝氮积累,这对于养殖环境的修复来说是极有利的。亚硝氮危害极大,当养殖环境中浓度超过0.1 mg/L,就会对养殖生物产生危害[24]。
2.1.4.2 氨氮起始浓度对固定化菌剂氨氮去除的影响不同氨氮起始浓度对固定化菌剂氨氮的去除能力的影响如图 3c。由图可见,在24 h之内,固定化脱氮菌可以将90 mg/L以内的氨氮完全去除,当起始氨氮浓度分别为110和130 mg/L时,固定化脱氮菌的氨氮去除率分别为84%和66%,分别也相当于去除了约90 mg/L的氨氮。说明由于固定化脱氮菌总量的限制,2 g固定化菌剂24 h时的最大催化能力,即氨氮去除能力为90 mg/L氨氮,即相当于对氨氮的去除速率为1.875 mg·g-1·h-1·L-1。当氨氮浓度大于90 mg/L时,非固定化菌剂对氨氮的去除能力略高于固定化后的菌剂,这可能与非固定化菌剂中细菌的绝对数量更高一些有关。
周珊等[16]在用竹炭固定化硝化菌、反硝化菌研究中发现,在48 h内25 g竹炭固定化微生物可将150 mL起始氨氮浓度为200 mg/L的水样中氨氮去除70.2%,即对氨氮的最大去除速率为0.42 mg·g-1·d-1。黄正等[25]用PVA和活性炭包埋硝化细菌,得到的固定化小球24 h对含氨氮量为45 mg/L的养殖废水的去除率达82.5%。本研究固定化后菌剂的最大氨氮去除速率相对更高一些,对温度等外界条件的耐受性也随之增加。另外,无菌沸石对氨氮也有吸附去除能力,由图 3b计算可知2 g沸石吸附氨氮量基本不变,因此随着氨氮浓度升高,无菌沸石的去除率随之降低。
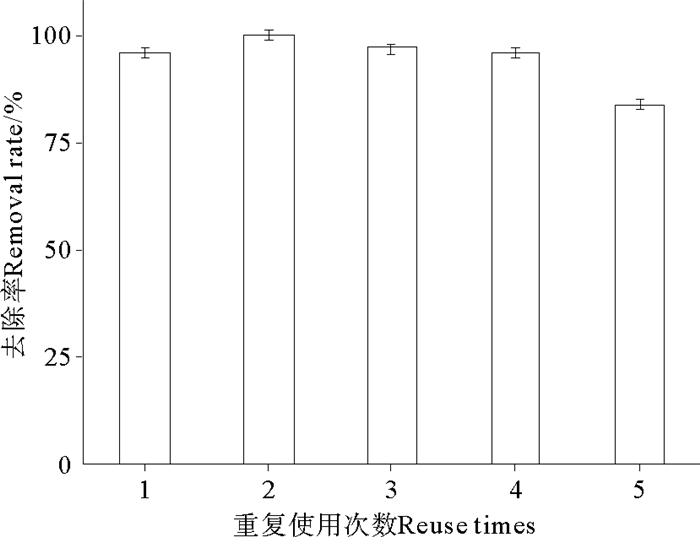
2.1.5 固定化菌剂的重复使用潜力天然沸石自身虽然对氨氮有很好的吸附能力,但是沸石吸附氨氮是一个物理-化学过程,存在吸附饱和现象。而用沸石固定化的脱氮菌,沸石既可作为微生物生长的载体,又可以吸附氨氮,帮助脱氮菌富集水体中的底物,同时沸石还可依靠微生物的硝化作用而实现生物再生[26-27]。由图 4可知,固定化脱氮菌具有一定的重复使用能力,在重复使用5次之后对氨氮的去除率仍然能够达到84%,说明固定化脱氮菌能够多次使用,这对该固定化脱氮菌在实际应用中是很重要的。
|
图 4 固定化脱氮菌的重复使用能力 Fig. 4 Reproducibility of immobilized ammonia oxidizing bacteria |
边阁等[8]以海藻酸钠共固定化亚硝化-反硝化细菌,制备的共固定化小球在更换3次培养基使用后,小球数量减少了3/4,且剩余小球形态变差,已不能再继续培养使用。Dong等[28]在用海藻酸钙包埋固定氨氧化菌时研究了固定小球的循环使用次数,结果表明,每次使用后,都会有固定小球膨胀破碎,第六次回收重复使用时,残留的固定小球膨胀破碎很多,已无法再使用。而本研究所使用的固定化菌在重复使用5次后沸石并无明显变化,对氨氮的去除率也仍很高,进一步说明本研究所用固定化脱氮菌具有很高的重复利用率,这也进一步为该固定化菌剂适宜在实际养殖环境中使用提供了有利的理论依据。
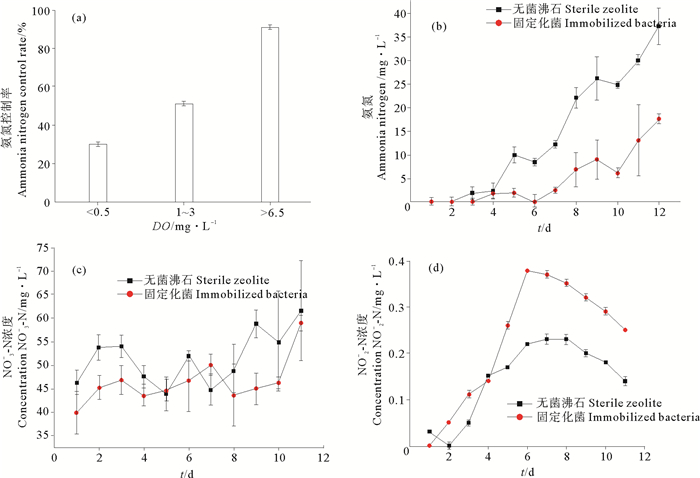
2.2 固定化脱氮菌在海水养殖环境中的应用效果分析 2.2.1 溶解氧对固定化菌剂控制氨氮效果的影响在实验阶段,养殖系统的实际水温为20 ℃,盐度为33。在3种不同DO条件下,固定化脱氮菌48 h内对养殖系统Ⅲ、Ⅳ系统中氨氮的平均控制率如图 5a。由图可见,固定化脱氮菌对氨氮的控制效果受DO的影响很大,当DO<0.5 mg/L,即处于缺氧状态时,氨氮的平均控制率仅30%;当DO在1~3.5 mg/L,即微量溶解氧时,氨氮的平均控制率为51%;当DO>6.5 mg/L,即溶解氧较充足时,氨氮的平均控制率为91%;对于无菌沸石而言,在3种条件下氨氮浓度均明显迅速上升,几乎均无去除,表明氨氮去除过程均是脱氮菌参与完成。固定化脱氮菌在3种环境中使用1周后,缺氧条件下的固定化菌剂重新测试,发现菌剂已完全失活,对氨氮已无去除效果,而在氧含量较高的两个条件下的菌剂仍具有活性,这也进一步说明了DO对固定化脱氮菌的重复利用能力也有很大影响。
|
图 5 固定化脱氮菌的应用效果分析 Fig. 5 Application effect of immobilized ammonia oxidizing bacteria |
刘少敏等[29]研究了DO对固定化硝化菌氨氮去除效果的影响,表明DO浓度在3~4 mg/L时对氨氮的去除率达96%左右,DO浓度在2~3 mg/L时对氨氮的去除率达80%左右。李正魁等[18]以共聚物为载体将纯种氨氧化菌LNL3固定化,发现DO=4.03 mg/L是最适宜的DO浓度,其氨氮去除率达到最大值91.17%,DO<4.03 mg/L时,氨氮去除率较低,DO>4.03 mg/L时,氨氮去除率增加甚微。这说明溶解氧对固定化菌去除氨氮的效果有明显影响,特别是缺氧条件。
可见,固定化菌剂在实际养殖环境中使用时,养殖环境底部可能缺氧的条件既会对菌剂使用效果产生明显影响,也会增加氨氮产生并释放到水体中的可能,因此适当增加曝气也是有必要的。
2.2.2 固定化脱氮菌对系统中氨氮的控制在本实验进行时,养殖系统的实际温度为16 ℃,盐度为33,DO 6.5 mg/L。在系统Ⅰ、Ⅱ正常运行第4天时,分别于泥水界面处铺放装有固定化的菌剂以及无菌沸石的10 cm×10 cm土工布袋,从图 5b可以看出,无菌沸石对照组的氨氮浓度迅速上升,第12天时达到37.24 mg/L,而固定化的菌剂实验组氨氮在第10天前一直保持10 mg/L以下,第12天上升至17.61 mg/L,在此期间的控制率为(73±17)%。对照组是土工布袋与沸石共同吸附作用结果,而实验组是固定化菌、土工布袋与沸石联合作用的结果。对比结果可见,固定化菌剂在养殖系统泥水界面覆盖率为2.5%时,即可对氨氮有明显的控制效果,若能够在允许的情况下提高菌剂使用量和覆盖度,则能够更好地控制氨氮的产生。
近海养殖方式主要包括开放式的网箱养殖、半封闭的低位池塘养殖以及全封闭的高位池塘养殖。本菌剂比较适用于后两种养殖方式,其中低位池塘养殖过程中,隔一定时间会借助潮汐涨落通过开关闸门来换掉池塘中的部分养殖水;而高位池塘则是通过人工灌排水方式换水,换水后养殖环境中的氨氮会被稀释一部分,但由于更换海水量有限,靠近沉积物的氨氮浓度仍会较高,本研究的固定化菌剂可在池塘底部泥水交界面处对氨氮进行控制,避免其进入上覆水中。在实际养殖环境中换水的流动过程对固定化菌有一定的冲击,但由于使用了土工布以及用线绳固定使其对固定化菌的影响不大。因此该菌的控制效果能够满足实际需要,具有显著的应用价值。
在图 2a中,20 ℃时2 g固定化菌剂对氨氮起始浓度为90 mg/L的培养基中氨氮的去除量可达79 mg/L,10 ℃时去除量达18 mg/L。本试验温度为16 ℃,温度虽接近20 ℃,但对氨氮的去除量却小于20 ℃时去除量,若在正常养殖环境中,随着温度的提高,则会对氨氮的控制效果更佳。
2.2.3 固定化脱氮菌对硝氮、亚硝氮的影响由图 5c可以看出,从第4天投加固定化菌剂后,实验组与对照组硝氮浓度均出现一定程度的波动,均为45~55 mg/L,相差不显著(P>0.05)。这可能跟菌剂铺放位置和脱氮时序性有关,该菌的硝化-反硝化进程是按照传统的脱氮流程,即“氨氮→亚硝氮→硝氮→亚硝氮→氮气”来完成的,当沉积于底层的含氮有机物分解时,产生大量的氨氮,向上层水体扩散过程中,则可被铺放在泥水界面的菌剂捕获,快速氧化为硝氮,而硝氮释放后则会扩散进入水体,水体中的硝氮再通过扩散向下进入菌剂则存在较大的浮力障碍,使得实验组中固定化脱氮菌剂的含菌量虽然远大于对照组中自然存在的反硝化菌,但由于硝氮向下扩散受到一定的浮力障碍,实验组中硝氮的浓度虽一直低于对照组,但两者的变化趋势相近,变化量差距不大。因此在实际应用中,除了在泥水界面铺放菌剂外,也可在水体中泼洒一些菌剂,以促进水体中硝氮的去除。
由于该菌的脱氮进程是按照“氨氮→亚硝氮→硝氮→亚硝氮→氮气”完成的,从第4天投加固定化菌剂后,亚硝酸盐氮含量迅速增加(见图 5d),而对照组增加缓慢,说明固定化脱氮菌在水中的作用非常明显,在好氧状态下,可以快速将大量氨氮转化成亚硝氮。实验组亚硝氮第6天时开始迅速下降,说明实验组是固定化脱氮菌和环境中自然存在的硝化菌共同起作用,将大量的氨氮氧化成亚硝氮,再进一步氧化为硝态氮,降低亚硝氮的浓度,而对照组是依靠自然存在的硝化菌起作用,微生物分散存在且量少,使氨氮的氧化量和作用速率远比实验组小,因此对照组中亚硝氮的增长量和变化速率均远小于实验组。
另外,根据图 3a,在培养条件下亚硝氮浓度很低,几乎检测不到;而在养殖环境中,氨氮浓度远远低于培养条件中的氨氮浓度,但亚硝氮浓度却远高于培养条件,可能主要还是由于污染物扩散速度及其扩散方向性造成的。在培养条件下,是完全混合的,菌剂可以与污染充分接触,进而完成氧化-还原过程;而在实际环境中,污染物只有通过浓度梯度的扩散才能与菌剂接触,因此限制了污染物与菌剂接触机会,降低了其对污染的控制。因此,在实际环境中,可以适当提高固定化菌剂的使用量和分布范围,提高与污染物的接触面,以减少亚硝氮的产生,加快亚硝氮转化成硝氮并进一步反硝化为氮气。
可见,在海水养殖环境的修复中,对于固定化菌剂的实际投加量,要结合理论值和自然环境的污染程度及各种自然条件进行选择,以达到最佳控制效果和经济效益;并且应配合合理投饵、定时换水和增加曝气,使养殖环境得以改善。
3 结语针对海水养殖环境中氨氮污染的问题,制备了固定化菌剂并进行了应用,结论如下:
采用沸石吸附固定化具有硝化-反硝化功能的脱氮菌卓贝尔氏菌(Zobellella sp.),载体含菌量为1.55×1010 CFU/g,脱氮菌株可以很好的吸附在改性沸石表面。该固定化菌剂适合在含氧量较高(DO>6.5 mg/L)的水体中使用;适宜温度范围为20~50 ℃,在30 ℃时2 g沸石固定化菌剂在24 h时的最大氨氮去除能力为90 mg/L;该固定化菌剂在重复使用5次后,对氨氮的去除率仍能达到84%。
在海水养殖环境中,应用土工布布袋包被固定化菌剂并平铺于泥水界面,覆盖率为2.5%,可以有效改善养殖水体质量,在整个运行过程中对氨氮的控制率达到(73±17)%。表明该固定化脱氮菌在水产养殖水质改善过程中对氨氮的控制效果具有十分明显的优势。
| [1] |
张卫强, 朱英. 养殖水体中氨氮的危害及其检测方法研究进展[J]. 环境卫生学杂志, 2012, 2(6): 324-327. Zhang W Q, Zhu Y. Advances on the research of the hazard of ammonia nitrogen in aquaculture water and its determination method[J]. Journal of Environmental Hygiene Dec, 2012, 2(6): 324-327. (  0) 0) |
| [2] |
董乔仕. 养殖水体氨氮的危害及改良[J]. 齐鲁渔业, 2002, 19(9): 9-10. Dong Q S. Harm and improvement of ammonia nitrogen in breeding water[J]. Shandong Fisheries, 2002, 19(9): 9-10. (  0) 0) |
| [3] |
周平. 氨氮对水产养殖的危害及防治措施[J]. 中国水产, 2013(8): 63-64. Zhou P. Harmfulness of ammonia nitrogen to aquaculture and its control measures[J]. Chinese Journal of Fisheries, 2013(8): 63-64. DOI:10.3969/j.issn.1002-6681.2013.08.025 (  0) 0) |
| [4] |
王彦波, 许梓荣, 邓岳松. 水产养殖中氨氮和亚硝酸盐氮的危害及治理[J]. 饲料工业, 2002, 23(12): 46-48. Wang Y B, Xu Z R, Deng Y S. Harm and control of ammonia nitrogen and nitrite nitrogen in aquaculture[J]. Feed Industry, 2002, 23(12): 46-48. DOI:10.3969/j.issn.1001-991X.2002.12.018 (  0) 0) |
| [5] |
冯敏毅, 马甡, 文国樑, 等. 水产养殖环境生物修复技术的研究进展[J]. 海洋科学, 2006, 30(9): 84-87. Feng Y M, Ma S, Wen G D, et al. Advances in bioremediation researches on aquacultural environment[J]. Marine Sciences, 2006, 30(9): 84-87. DOI:10.3969/j.issn.1000-3096.2006.09.017 (  0) 0) |
| [6] |
李纯厚, 王学锋, 王晓伟, 等. 中国海水养殖环境质量及其生态修复技术研究进展[J]. 农业环境科学学报, 2006, 25(增刊): 310-315. Li C H, Wang X F, Wang X W, et al. Water quality for mariculture and its ecological rehabilitation technology[J]. Journal of Agro-Environment Science, 2006, 25(supp): 310-315. (  0) 0) |
| [7] |
刘军, 刘斌, 谢骏. 生物修复技术在水产养殖中的应用[J]. 水利渔业, 2005, 25(1): 63-65. Liu J, Liu B, Xie J. Application of bioremediation technology in aquaculture[J]. Water Conservancy and Fisheries, 2005, 25(1): 63-65. DOI:10.3969/j.issn.1003-1278.2005.01.026 (  0) 0) |
| [8] |
Bian G, Xu X X, Miao J Z, et al. Study on the process and characteristics of Co-immobilized ammonia-oxidizing bacteria and denitrifying bacteria[J]. Hubei Agricultural Sciences, 2016, 55(1): 170-175.
(  0) 0) |
| [9] |
Yue J W, Wang P, Zhang Y P, et al. Study on entrapped immobilization and preservation of heterophic nitrification aerobic denitrify bacteria[J]. Journal of Beijing Technology and Business University, 2012, 30(1): 51-56.
(  0) 0) |
| [10] |
商平, 魏丽娜, 刘涛利, 等. 改性沸石结合组合菌固定化小球去除河水中氨氮[J]. 水处理技术, 2010, 36(5): 51-56. Shang P, Wei L N, Liu T L, et al. The immobilization pellet of modified zeolite binding combination bacteria removing ammonia nitrogen of river[J]. Technology of Water Treatment, 2010, 36(5): 51-56. (  0) 0) |
| [11] |
陈兵红. 沸石固定化细胞处理农村生活污水中氨氮效果研究[J]. 环境科学与技术, 2009, 32(7): 132-135. Chen B H. Biodegradation effect of ammonia nitrogen in rural domestic wastewater by immobilized cells with zeolite[J]. Environmental Science and Technology, 2009, 32(7): 132-135. DOI:10.3969/j.issn.1003-6504.2009.07.034 (  0) 0) |
| [12] |
刘嘉夫, 马越, 谭盼. 沸石联合固定化微生物技术抑制沉积物氨氮释放[J]. 科学技术与工程, 2013, 34(13): 10232-10237. Liu J F, Ma Y, Tan P. Study on mechanism of removing ammonium from water by clinoptilolite-microbe combined immobilization technology[J]. Science Technology and Engineering, 2013, 34(13): 10232-10237. (  0) 0) |
| [13] |
Li W F, Fu L Q, Deng B, et al. Identification and denitrification characteristics of an aerobic denitrifier[J]. Environmental Science, 2011, 32(8): 2403-2408.
(  0) 0) |
| [14] |
中国石油天然气总公司. SY/T 5162-1997岩石样品扫描电子显微镜分析方法[S].北京: 中国标准出版社, 1998. China National Petroleum Corporation. SY/T 5162-1997 Rock Sample Analysis by Scanning Electron Microscopy[S]. Beijing: Standards Press of China, 1998. (  0) 0) |
| [15] |
张闻, 赵延君, 王加宁, 等. 生物炭固定化石油降解菌剂的制备[J]. 江苏农业科学, 2015, 43(6): 341-345. Zhang W, Zhao Y J, Wang J N, et al. Preparation of biochar immobilized petroleum degrading bacteria[J]. Jiangsu Agricultural Sciences, 2015, 43(6): 341-345. (  0) 0) |
| [16] |
周珊, 周汇, 单胜道. 竹炭固定化微生物去除水样中氨氮的研究[J]. 林业科学, 2009, 45(6): 133-138. Zhou S, Zhou H, Dan S D. Removal of ammonia nitrogen in aqueous samples by bamboo-carbon immobilized microorganism[J]. Scientia Silvae Sinicae, 2009, 45(6): 133-138. DOI:10.3321/j.issn:1001-7488.2009.06.023 (  0) 0) |
| [17] |
张爽, 姜蔚, 徐桂芹, 等. 固定化硝化菌在不同温度下对氨氮的去除效能研究[J]. 环境科学与管理, 2008, 33(5): 91-95. Zhang S, Jiang W, Xu G Q, et al. Study on the removal of nitrogen from wastewater using immobilized nitrobacteria at different temperature[J]. Environmental Science and Management, 2008, 33(5): 91-95. DOI:10.3969/j.issn.1673-1212.2008.05.025 (  0) 0) |
| [18] |
李正魁, 石鲁娜, 杨竹攸, 等. 纯种氨氧化细菌Comamonas aquatic LNL3的固定化及短程硝化性能研究[J]. 环境科学, 2009, 30(10): 2952-2957. Li Z K, Shi L N, Yang Z Y, et al. Immobilized ammonia-oxidizing bacteria Comamonas aquatic INl3 and its partial nitrification characterization[J]. Environmental Science, 2009, 30(10): 2952-2957. DOI:10.3321/j.issn:0250-3301.2009.10.023 (  0) 0) |
| [19] |
Dong Y, Zhang Y, Tu B. Immobilization of ammonia-oxidizing bacteria by polyvinyl alcohol and sodium alginate[J]. Brazilian Journal of Micrbiology, 2017, 48: 515-521. DOI:10.1016/j.bjm.2017.02.001
(  0) 0) |
| [20] |
袁林江. 聚乙烯醇(PVA)固定化反硝化菌的脱氮特性[J]. 中国环境科学, 1998, 18(2): 189-191. Yuan L J. Denitrification characters of denitrifying bacteria immobilized by polyvinyl alcohol (PVA)[J]. China Environmental Science, 1998, 18(2): 189-191. DOI:10.3321/j.issn:1000-6923.1998.02.023 (  0) 0) |
| [21] |
辛福言, 李秋芬, 邹玉霞, 等. 虾池环境生物修复作用菌的模拟应用[J]. 应用与环境生物学报, 2002, 8(1): 75-77. Xin F Y, Li Q F, Zou Y X, et al. Simulated application of functional bacteria in bioremediation of shrimp culture environment[J]. Chinese Journal of Applied and Environmental Biology, 2002, 8(1): 75-77. DOI:10.3321/j.issn:1006-687X.2002.01.015 (  0) 0) |
| [22] |
N Maya E, Sanjoy B, Mohamed S, et al. Screening, identification and immobilization of ammonia oxidizing bacterial consortium collected from mangrove areas and shrimp farms[J]. Asian Journal of Animal and Veterinary Advances, 2013, 8(1): 73-81. DOI:10.3923/ajava.2013.73.81
(  0) 0) |
| [23] |
Chen J, Zhang A X, Zhong W H, et al. Ammonia removal of wastewater by immobilized ammonia-oxidizing bacteria with denitrying bacteria and biofilm observation[J]. Biotechnology, 2008, 18(3): 76-80.
(  0) 0) |
| [24] |
罗华明, 程岩雄, 李利卫. 养殖水质中亚硝酸盐、氨氮、硫化氢、pH值过高形成的原因、危害及处理办法[J]. 渔业致富指南, 2005(14): 34-34. Luo H M, Cheng Y X, Li L W. Cause, harm and treatment of nitrite, ammonia, hydrogen sulfide and high pH value in aquaculture water quality[J]. A Guide to Enriching Fishery, 2005(14): 34-34. (  0) 0) |
| [25] |
黄正, 范玮, 李谷, 等. 固定化硝化细菌去除养殖废水中氨氮的研究[J]. 华中科技大学学报(医学版), 2002, 31(1): 18-20. Huang Z, Fan W, Li G, et al. Removing ammonia nitrogen from fishery wastewater by immobilized nitrifying bacteria[J]. Huazhong University of Science and Technology (Medical Edition), 2002, 31(1): 18-20. DOI:10.3870/j.issn.1672-0741.2002.01.006 (  0) 0) |
| [26] |
张晟瑀, 林学钰, 周兰影, 等. 沸石联合微生物固定化去除微污染水体中氨氮的研究[J]. 环境污染与防治, 2009, 4(31): 14-17. Zhang S Y, Lin X Y, Zhou L Y, et al. Removing ammonia nitrogen fromslightly-polluted water by zeolite-microbe combined immobilization technology[J]. Environmental Pollution and Prevention, 2009, 4(31): 14-17. (  0) 0) |
| [27] |
田琳, 孔强, 仁宗明, 等. 活性炭和沸石对氨氮的吸附特性及生物再生[J]. 环境工程学报, 2012, 6(10): 3424-3428. Tian L, Kong Q, Ren Z M, et al. Adsorption characteristics of activated carbon and zeolite and their biological regeneration[J]. Chinese Journal of Environmental Engineering, 2012, 6(10): 3424-3428. (  0) 0) |
| [28] |
Dong Y, Miao J Z, Chen A H. Research on immobilized ammonia-oxidizing bacteria by sodium alginate[J]. Applied Mechanics and Materials, 2014, 618: 283-287. DOI:10.4028/www.scientific.net/AMM.618
(  0) 0) |
| [29] |
Liu S, Chu L, Zhu J. Removal of ammonia nitrogen from sewage by immobilization nitrification bacteria[J]. Chinese Journal of Environmental Engineering, 2014, 8(10): 4261-4266.
(  0) 0) |
 2018, Vol. 48
2018, Vol. 48


