2. 中国海洋大学海洋环境与生态教育部重点实验室, 山东 青岛 266100;
3. 中国海洋大学化学化工学院, 山东 青岛 266100
偶氮染料是一类常见的工业污染物,在其生产及纺织品染色过程中进入环境[1]。目前,常用的偶氮染料废水的处理技术有吸附法[2]和生物法[3]等。但是,吸附法并不能真正从废水中去除染料。生物法占地面积大、效率低、操作灵活性低,处理高浓度偶氮染料废水效果欠佳。氢转移催化是利用催化剂将供氢体的电子传输给染料分子,在染料分子偶氮键的氮原子上发生加氢反应,使染料分子断裂并生成了相应的氨基化合物。氢转移催化反应由于具有低能耗、易操作、无二次污染等优点,在偶氮染料废水处理中有广阔的应用前景[4]。
贵金属纳米粒子在染料分子的氢转移催化反应中表现了优异的催化活性[5-6],但由于高成本和回收困难等问题的存在使其难以得到广泛应用。因此,开发低成本且具有与贵金属纳米粒子性能类似的高效催化剂是研究的重点。其中,纳米铜(Copper nanoparticles, CuNPs)因其催化活性高、价格低廉、应用范围广等优点,而备受关注[7]。甲壳素广泛分布于虾、蟹、昆虫等的甲壳和某些真菌的细胞壁中,是自然界中继纤维素之后的第二大生物多糖[8]。壳聚糖(Chitosan, CS)是甲壳素部分脱乙酰化的产物,其分子结构中大量存在的自由氨基和羟基与CuNPs之间存在着较强的配位作用[9]。因此,壳聚糖是CuNPs的良好载体,将CuNPs负载于壳聚糖微球上,不仅可以防止CuNPs的团聚,还可以实现反应体系中催化剂的有效分离和回收。
本文以壳聚糖和CuCl2·2H2O为原料,分别采用直接负载法和吸附法制备了壳聚糖/纳米铜复合微球,运用傅里叶变换红外光谱、X-射线衍射以及扫描电镜对壳聚糖/纳米铜复合微球的结构进行了表征。以刚果红(Congo red, CR)为目标污染物,考察了壳聚糖/纳米铜复合微球的制备方法、制备条件及氢转移催化反应条件对CR的脱色性能影响,探讨了氢转移催化反应动力学,研究了催化剂的重复利用性能,对CR染料的脱色过程和反应机理进行了初步讨论,为壳聚糖/纳米铜复合微球在染料废水处理中的应用提供依据。
1 材料和仪器 1.1 材料与试剂壳聚糖(Chitosan, CS,山东奥康生物科技公司,脱乙酰度94.9%,粘均分子量487.5 kDa),硼氢化钠(NaBH4,国药集团化学试剂有限公司),刚果红(Congo red,CR,天津大茂化学厂),其他化学试剂均为分析纯,实验用水均为去离子水,实验所有玻璃器皿均用现配王水(HNO3∶HCl=1∶3,v/v)浸泡,并冲洗干净。
1.2 实验仪器UV-2100P紫外可见分光光度计,Tensor 27傅立叶变换红外光谱仪,D8 Advance X射线衍射仪,HITACHI S-4800扫描电子显微镜。
2 实验部分 2.1 壳聚糖/纳米铜复合微球的制备 2.1.1 直接负载法将2 g CS和0.5 g CuCl2·2H2O同时溶于100 mL 1%(v/v)的CH3COOH溶液中,静置至溶液中无气泡后,用5#注射器(针头直径为0.7 mm)逐滴滴入浓度为1 mol/L的NaOH溶液中,得到微球。将微球在NaOH溶液中静置24 h后,用蒸馏水充分洗涤,滤纸吸干微球表面水分后,置于100 mL 0.1 mol/L NaBH4溶液中振荡还原4 h,制得壳聚糖/纳米铜复合微球,标记为CS/CuNPs。考察CuCl2·2H2O的投加量对微球催化性能的影响时,改变CuCl2·2H2O的质量为0.1,0.2,0.3,0.4和0.5 g,其他制备条件保持不变。考察NaBH4浓度对微球催化性能的影响时,改变NaBH4溶液的浓度为0.01、0.03、0.05、0.10、0.20和0.30 mol/L,其他制备条件保持不变。
2.1.2 吸附法将2 g CS溶于100 mL 1%(v/v)的CH3COOH溶液中,静置至溶液中无气泡后,用5#注射器逐滴滴入浓度为1 mol/L的NaOH溶液中制备壳聚糖微球。壳聚糖微球在NaOH溶液中静置24 h后,用蒸馏水充分洗涤至洗涤液呈中性。将其置于100 mL浓度为200 mg/L的CuCl2·2H2O溶液中吸附4 h,达到吸附饱和后,于100 mL 0.1 mol/L NaBH4溶液中振荡还原4 h,制备壳聚糖/纳米铜复合微球,标记为CS/CuNPs-X。考察CuCl2·2H2O浓度对微球催化性能的影响时,改变CuCl2·2H2O浓度为50、100、150、200和250 mg/L,其他制备条件保持不变。考察NaBH4浓度对微球催化性能的影响时,改变NaBH4溶液的浓度为0.01、0.03、0.05、0.10、0.20和0.30 mol/L,其他制备条件保持不变。
2.2 壳聚糖/纳米铜微球中铜含量的测定取浓度为400 mg/L的二乙基二硫代氨基甲酸钠(DDTC-Na)溶液5 mL,与5 mL CuCl2溶液混合生成黄棕色络合物,在450 nm处测定Cu(Ⅱ)与DDTC-Na配合物的吸光度,依式(1)计算壳聚糖微球中Cu(Ⅱ)的量[10]:
| $ {w_{{\rm{Cu}}}} = \frac{{\left( {{C_{\rm{0}}} - {C_{\rm{e}}}} \right)V}}{m}。$ | (1) |
式中:wCu为壳聚糖微球中Cu(Ⅱ)的量,mg/g;C0为Cu(Ⅱ)溶液初始浓度,mg/L;Ce为吸附平衡时Cu(Ⅱ)溶液的剩余浓度,mg/L;V为Cu(Ⅱ)溶液的体积,L;m为壳聚糖微球的质量,g。
2.3 壳聚糖/纳米铜微球的结构表征红外光谱(FT-IR)采用KBr压片,用Tensor 27傅立叶变换红外光谱仪记录,扫描范围4 000~500 cm-1。
X射线衍射(XRD)分析用D8 Advance X射线衍射仪记录,CuKα为射线源,管电流500 mA,管电压40 kV,扫描范围(2θ)为5°~90°,扫描步长为0.02°。
扫描电镜(SEM)用HITACHI S-4800扫描电子显微镜,加速电压为5.0 kV。
2.4 氢转移催化反应取0.05 g壳聚糖/纳米铜复合微球,置于20 mL 100 mg/L的CR溶液和20 mL 0.05 mol/L NaBH4溶液的混合液中,30 ℃反应,在反应过程中每隔一定时间取样,测定溶液在489 nm处的吸光度值,CR染料溶液的脱色率依(2)式计算:
| $ {\rm{Decolorization }}\left( \% \right) = (1 - {A_t}/{A_0}) \times 100{\rm{ }}。$ | (2) |
式中:A0为CR溶液在489 nm处的吸光度值;At为氢转移催化反应进行t时刻时CR溶液在489 nm处的吸光度值。
2.5 反应动力学准一级动力学方程可以用来描述CR染料的催化反应动力学:
| $ {\rm{ln }}({C_0}/C){\rm{ }} = kt{\rm{ }}。$ | (3) |
式中:k为准一级反应速率常数,min-1;t为反应时间,min;C0和C分别为CR的初始浓度和反应t时刻的浓度,mg/L。
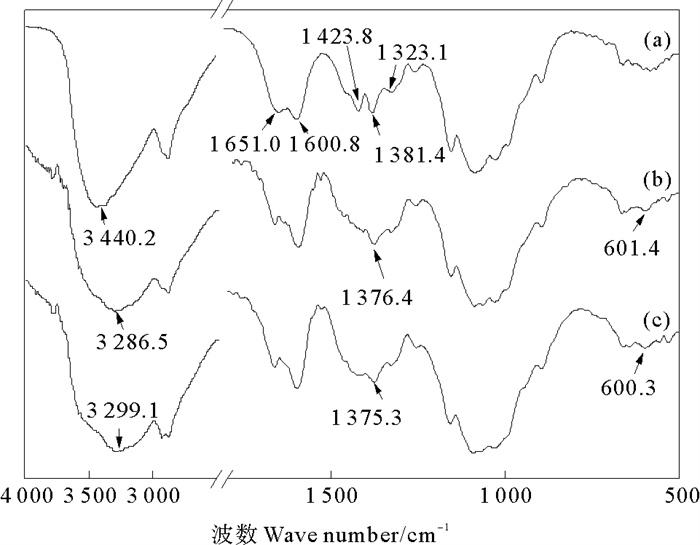
3 结果与讨论 3.1 壳聚糖/纳米铜复合微球的结构表征 3.1.1 红外(FT-IR)光谱图 1为壳聚糖和壳聚糖/纳米铜复合微球的FT-IR光谱图。如图所示,CS在3 440.2 cm-1处的宽吸收峰可归属为-OH和-NH2的重叠伸缩振动,在1 651.0,1 600.8,1 423.8,1 381.4和1 323.1 cm-1处的吸收峰,分别归属为酰胺Ⅰ中N-乙酰基的-C=O的伸缩振动,游离-NH2的弯曲振动,-OH的弯曲振动,C-H的弯曲振动和酰胺Ⅲ中N-H的弯曲振动[11-13]。与CS相比,CS/CuNPs和CS/CuNPs-X红外光谱图中在601.4和600.3 cm-1出现新的吸收峰,这说明有CuNPs生成[14-15],1 423.8 cm-1处的吸收峰消失,3 286.5和3 299.1 cm-1处归属于-OH和-NH2基团的重叠伸缩振动向低波数方向移动,且吸收峰变宽,证实了CS中-OH和-NH2和CuNPs发生相互作用[16-17]。结果证明,CuNPs成功负载在壳聚糖微球上。
|
图 1 壳聚糖微球(a)、CS/CuNPs(b)、CS/CuNPs-X(c) 的FT-IR光谱图 Fig. 1 FT-IR spectra of CS microspheres(a), CS/CuNPs(b) and CS/CuNPs-X(c) |
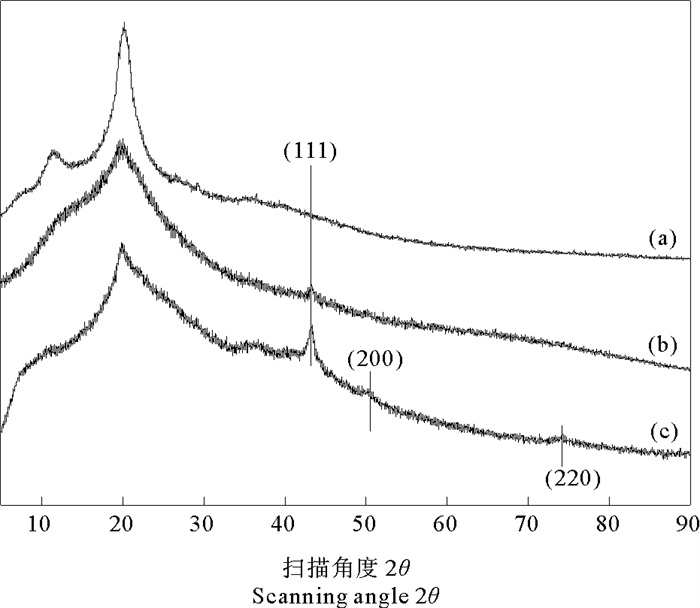
图 2为壳聚糖及壳聚糖/纳米铜微球的XRD图谱。如图所示,CS属结晶性高分子,在衍射角2θ为11.6°和20.2°出现强衍射峰,这是由壳聚糖分子中的-OH和-NH2形成了较强的分子内和分子间氢键所致[18-19]。与CS相比,壳聚糖/纳米铜复合微球在11.6°和20.2°的结晶衍射峰强度均明显减弱,表明CuNPs与壳聚糖的-OH和-NH2之间发生了相互作用,在一定程度上削弱了壳聚糖分子间的氢键作用,破坏了壳聚糖的有序结构,导致结晶能力下降[20],这与FT-IR光谱结果一致。
|
图 2 壳聚糖微球(a)、CS/CuNPs(b)、CS/CuNPs-X(c)的XRD图 Fig. 2 XRD pattern of CS microspheres(a), CS/CuNPs(b) and CS/CuNPs-X(c) |
CS/CuNPs在43.5°的衍射峰,CS/CuNPs-X在43.5°,50.4°,73.9°的衍射峰分别对应于CuNPs的(111),(200),(220)晶面(JCPDS 4-0836 (FCC Cu))。(111)的衍射峰强度明显高于其他衍射峰强度,表明CuNPs主要沿(111)方向生长[21]。
3.1.3 扫描电镜(SEM)图 3为壳聚糖微球及壳聚糖/纳米铜复合微球的SEM图。由图 3(a)可以看出,壳聚糖微球表面粗糙、表面积较大,作为CuNPs的载体,能在一定程度上阻止CuNPs的团聚。由图 3(b)和图 3(c)可知,由直接负载法和吸附法制备的壳聚糖/纳米铜复合微球,CuNPs粒子的尺寸和形貌有明显的差异。CS/CuNPs中CuNPs的粒径分布较为均匀,而CS/CuNPs-X中CuNPs的粒径分布较宽。这可能是因为在CS/CuNPs-X的制备过程中,Cu(Ⅱ)主要吸附在壳聚糖微球的表面,吸附位点数量较多,导致在Cu(Ⅱ)还原过程中,CuNPs发生一定程度的团聚,导致CuNPs粒径较大,形状不规则。

|
图 3 壳聚糖微球(a),CS/CuNPs(b)和CS/CuNPs-X(c)的SEM图 Fig. 3 SEM images of CS microspheres(a), CS/CuNPs(b) and CS/CuNPs-X(c) |
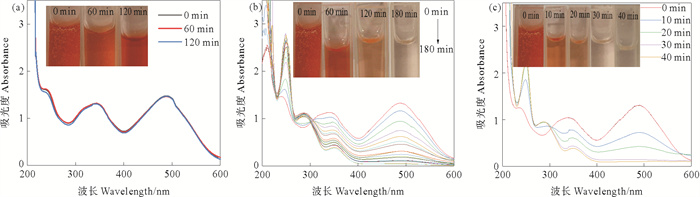
图 4(a)为不添加催化剂时,20 mL 100 mg/L CR和20 mL 0.05 mol/L NaBH4混合溶液在不同反应时间的紫外-可见光谱图。如图所示,无催化剂的条件下,反应120 min后,CR溶液在489 nm处的特征吸收峰几乎没有变化,表明在无催化剂的条件下,NaBH4溶液还原CR脱色反应缓慢。
|
图 4 CR溶液在无催化剂(a)和CS/CuNPs(b)、CS/CuNPs-X(c)催化下的紫外-可见光谱图 Fig. 4 UV-Vis spectra of CR solution without catalysts(a) and catalyzed by CS/CuNPs(b), CS/CuNPs-X(c) |
图 4(b)和(c)分别为以CS/CuNPs和CS/CuNPs-X为催化剂时,反应体系在不同反应时间的紫外-可见光谱图。如图所示,CR溶液在489 nm处的吸收峰强随着反应时间的延长而减小,以CS/CuNPs为催化剂时,反应进行180 min时溶液接近无色,而以CS/CuNPs-X为催化剂时,反应进行到40 min时溶液即接近无色,表明催化剂对CR溶液具有良好的催化性能。
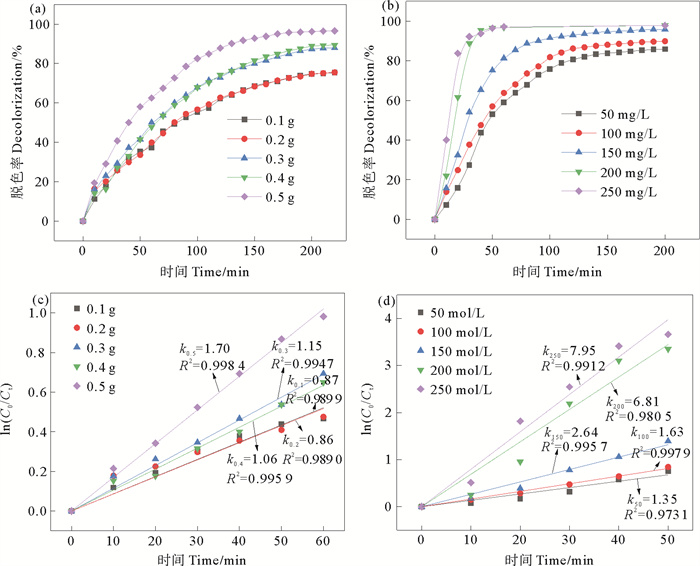
3.3 催化剂的制备条件对CR脱色效果的影响 3.3.1 氯化铜添加量对CR脱色效果的影响壳聚糖/纳米铜复合微球制备过程中氯化铜的添加量对催化剂性能的影响如图 5(a),(b)所示。CuCl2·2H2O的添加量为0.1、0.2、0.3、0.4和0.5 g时,制备的CS/CuNPs中,Cu(Ⅱ)含量分别为0.37、0.74、1.11、1.48和1.85 mg/g。如图 5(a)所示,在所研究的CuCl2·2H2O投加量范围内,直接负载法制备的微球对CR染料的脱色率随催化反应时间的延长和CuCl2·2H2O添加量的增加而增大。CuCl2·2H2O的投加量为0.1~0.4 g时,催化剂在氢转移催化反应进行到200 min后,CR染料的脱色率不再随反应时间的延长而增加,最大脱色率为74.7%,74.8%,87.3%和89.2%。CuCl2·2H2O的投加量为0.5 g时,催化反应进行到180 min时,CR染料的脱色率达到最大,为95.8%。
|
图 5 氯化铜添加量对直接负载法(a)和吸附法制(b)备的催化剂催化性能的影响及其准一级反应动力学拟合曲线(c)和(d) Fig. 5 Effect of the dosage of copper chloride on the catalytic activity of catalyst prepared by direct loading method(a), adsorption loading method(b) and their kinetic curve of pseudo-first order reaction (c) and (d) |
吸附法制备的壳聚糖/纳米铜复合微球,当CuCl2溶液的初始浓度分别为50、100、150、200和250 mg/L时,铜离子的吸附容量分别为1.38、1.62、1.79、1.97和3.04 mg/g。如图 5(b)所示,当CuCl2溶液的初始浓度分别为50、100和150 mg/L时,催化剂对CR的脱色率在反应进行到180 min时达到最大,继续延长反应时间,脱色率不再增大,最大脱色率分别为85.3%、89.4%和95.6%。当CuCl2·2H2O溶液的初始浓度为200和250 mg/L时,CR溶液在反应进行60 min时脱色率即可达96.8%和97.2%。
图 5(c), (d)分别为不同氯化铜的添加量下制备的催化剂对CR氢转移催化反应的准一级动力学拟合图。由图可知,两种方法制备的催化剂对CR的氢转移催化反应均符合准一级反应动力学模型,且反应速率均随CuCl2·2H2O的添加量的增大而增大,表明随着壳聚糖/纳米铜复合微球制备时CuCl2·2H2O添加量的增加,催化剂中CuNPs的数量增多,反应活性位点增加,催化反应速率加快。综合考虑经济性和催化效率两方面,直接负载法中选择0.5 g,吸附法中选择200 mg/L CuCl2·2H2O初始浓度为最佳氯化铜添加量。
3.3.2 Cu(Ⅱ)还原剂浓度对CR脱色效果的影响壳聚糖/纳米铜复合微球制备过程中Cu(Ⅱ)还原剂的浓度对催化剂性能的影响如图 6(a),(b)所示。由图 6(a)可知,直接负载法制备的壳聚糖/纳米铜复合微球对CR的脱色率随催化剂制备时还原剂浓度的增加而增大,但在所研究范围内(0.01~0.30 mol/L)影响有限。Cu(Ⅱ)还原剂浓度为0.01 mol/L时,在氢转移催化反应进行220 min后,CR染料溶液的脱色率不再随反应时间的变化而变化,此时脱色率为86.0%,可能是因为较低Cu(Ⅱ)还原剂浓度下无法将微球中螯合的Cu(Ⅱ)完全还原[22],这就导致了CR溶液的脱色率较低。在还原剂浓度为0.03和0.05 mol/L时,氢转移催化反应进行220 min后,CR溶液的脱色率不再随反应时间的变化而变化,此时脱色率分别为92.1%和95.1%。提高Cu(Ⅱ)还原剂浓度至0.10~0.30 mol/L,CR溶液的脱色率无明显差异,反应进行到180 min时CR溶液的脱色率为95.8%,96.2%和95.7%。

|
图 6 Cu(Ⅱ)还原剂浓度对直接负载法(a),吸附法(b)制备的催化剂催化性能的影响及其准一级反应动力学拟合曲线(c)和(d) Fig. 6 Effect of Cu(Ⅱ) reductant concentration on the catalytic activity of catalyst prepared by direct loading method(a), adsorption loading method(b) and their kinetic curve of pseudo-first order reaction (c) and (d) |
由图 6(b)可知,不同浓度的还原剂条件下由吸附法制备的壳聚糖/纳米铜复合微球对CR溶液的最终脱色率并无明显影响,在所研究范围内(0.01~0.30 mol/L)氢转移催化反应进行到60 min时,脱色率分别为95.9%,95.0%,95.2%,96.8%,97.5%和97.4%。
图 6(c), (d)分别为不同Cu(Ⅱ)还原剂浓度下制备的催化剂对CR氢转移催化反应的准一级动力学拟合图。由图可知,两种方法制备的催化剂对CR的氢转移催化反应均符合准一级反应动力学模型。在Cu(Ⅱ)还原剂为0.01~0.10 mol/L范围内,随着还原剂浓度的增加,氢转移催化反应速率增大,当还原剂浓度超过0.10 mol/L,反应速率则不再发生明显变化,表明了在Cu(Ⅱ)还原剂浓度大于0.10 mol/L时,负载在壳聚糖微球中的Cu(Ⅱ)被完全还原,因此,选取0.1 mol/L的Cu(Ⅱ)还原剂浓度为最佳。
3.4 氢转移催化反应条件对CR脱色效果的影响 3.4.1 催化剂投加量对CR脱色效果的影响氢转移催化反应中催化剂的投加量对催化剂性能的影响如图 7(a),(b)所示。由图 7(a)可知,当CS/CuNPs的投加量为0.01和0.03 g时,反应进行200 min后,CR的脱色率从54.7%增加至78.1%。增加催化剂的投加量至0.05 g,CR的脱色率在180 min为95.8%,继续增加催化剂的投加量至0.07和0.09 g时,脱色率不再增加,此时脱色率为96.9%和96.5%。由图 7(b)可知,当CS/CuNPs-X的投加量为0.01和0.03 g时,反应200 min后脱色率达到最大,此时CR的脱色率为68.8%和84.1%。催化剂的投加量增加至0.05 g时,CR溶液的脱色率在反应进行60 min时即可达96.8%,继续增加催化剂的投加量至0.07和0.09 g时,CR溶液的脱色率无明显变化。
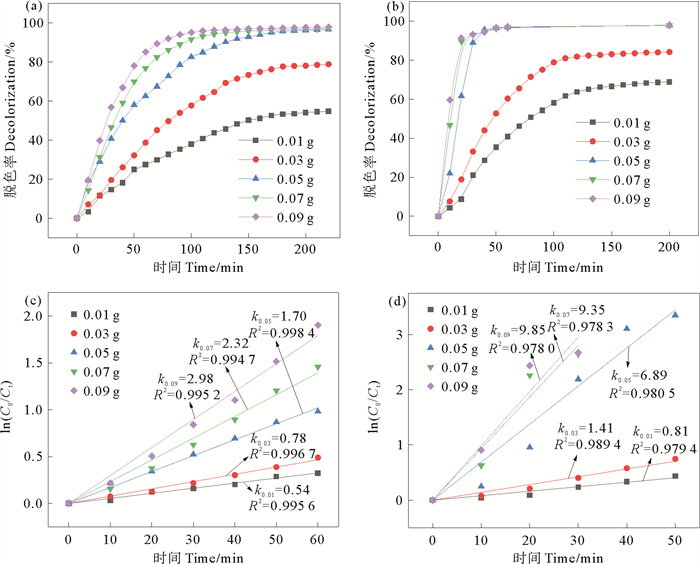
|
图 7 催化剂投加量对CS/CuNPs(a),CS/CuNPs-X(b)催化性能的影响及其准一级反应动力学拟合曲线(c)和(d) Fig. 7 Effect of catalyst dosage on the catalytic activity of CS/CuNPs(a) and CS/CuNPs-X(b) and their kinetic curve of pseudo-first order reaction (c) and (d) |
图 7(c), (d)分别为不同CS/CuNPs和CS/CuNPs-X的投加量对CR氢转移催化反应的准一级动力学拟合图。由图可知,CS/CuNPs和CS/CuNPs-X对CR的氢转移催化反应均符合准一级反应动力学模型,且反应速率均随催化剂的投加量的增大而增大,表明随着催化剂的投加量增加,催化剂为CR分子和BH4-的吸附提供了足够的催化反应活性位点,增大了反应速率并且缩短了反应时间[23]。在相同的反应条件下,CS/CuNPs-X催化的反应速率高于CS/CuNPs。
3.4.2 供氢体浓度CR脱色效果的影响氢转移催化反应中供氢体溶液的浓度对催化性能的影响如图 8(a),(b)所示。由图 8(a)可知,以CS/CuNPs为催化剂时,供氢体浓度从0.01 mol/L增加至0.05 mol/L,氢转移催化反应进行200 min,CR溶液的脱色率从25.9%增加至95.8%。继续增加供氢体的浓度,CR溶液的脱色率和反应速率不再明显变化。这可能是因为催化剂表面活性位点有限,即便继续增大供氢体浓度也不能再提高对CR的脱色率。由图 8(b)可知,以CS/CuNPs-X为催化剂时,当供氢体浓度由0.01 mol/L增大至0.03 mol/L,反应进行到200 min时,CR的脱色率从66.7%增加至96.5%。供氢体浓度增加至0.05 mol/L时,反应进行到60 min时CR溶液的脱色率即可达96.8%。继续增加供氢体浓度,CR溶液的脱色率不再明显变化。
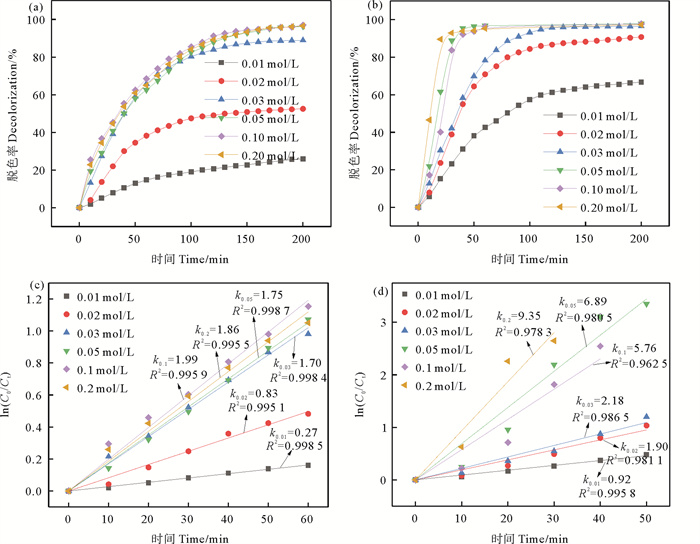
|
图 8 供氢体浓度对CS/CuNPs(a),CS/CuNPs-X(b)催化性能的影响及其准一级反应动力学拟合曲线(c)和(d) Fig. 8 Effect of hydrogen donor concentration on the catalytic activity of CS/CuNPs(a) and CS/CuNPs-X(b) and their kinetic curve of pseudo-first order reaction (c) and (d) |
图 8(c), (d)为不同供氢体浓度对CR氢转移催化反应的准一级动力学拟合图,两种催化剂对CR的氢转移催化反应均符合准一级反应动力学模型。由图 8(c)可知,以CS/CuNPs为催化剂,在供氢体浓度大于0.05 mol/L的条件下,反应速率相近;而以CS/CuNPs-X为催化剂时,反应速率则随着供氢体浓度的增大而增大。且在相同的供氢体浓度下,CS/CuNPs-X对CR的氢转移催化反应的反应速率大于CS/CuNPs。这是因为氢转移催化反应主要发生在催化剂表面的活性位点[24],而CS/CuNPs-X负载的CuNPs多位于微球表层,所以在供氢体充足的情况下,CS/CuNPs-X的催化速率较高。因此,综合两种微球的催化效率及经济性,选择0.05 mol/L为反应最佳供氢体浓度。
3.5 催化剂重复使用对催化性能的影响分别称取CS/CuNPs和CS/CuNPs-X各0.05 g,置于20 mL 100 mg/L的CR溶液和20 mL 0.05 mol/L的NaBH4溶液的混合液中,反应220 min后取样。反应结束后多次洗涤,继续用于催化反应,探究催化剂的重复使用对CR溶液脱色效果的影响,结果如图 9所示。CS/CuNPs和CS/CuNPs-X第1次使用时,CR溶液的脱色率分别为96.9%和97.6%,重复使用10次后,CR溶液的脱色率为93.9%和89.4%。表明两种方法制备的催化剂均具有良好的重复使用性。CS/CuNPs制备过程中CS中的-NH2对Cu (Ⅱ)具有极强的螯合能力,使得微球结构较为稳定[25]。而CS/CuNPs-X制备过程中Cu (Ⅱ)多集中在表面,稳定性不高,导致在多次循环使用的情况下出现催化活性下降的现象。
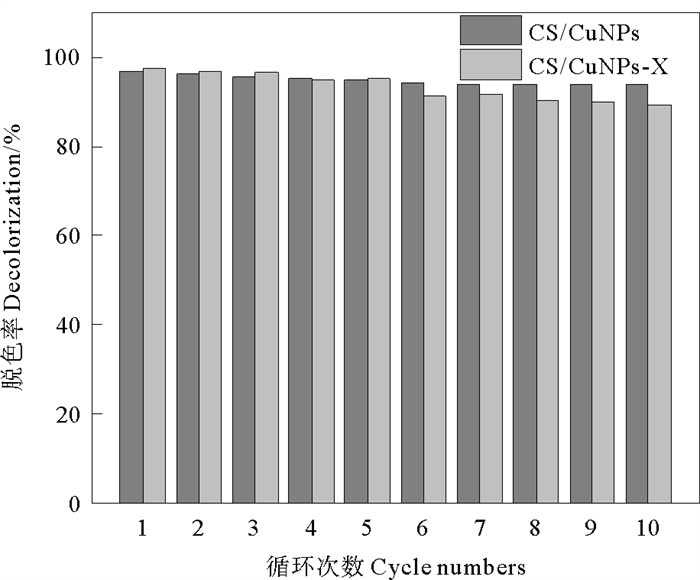
|
图 9 催化剂重复使用对CR脱色效果的影响 Fig. 9 Effect of repeated use of catalyst on the decolorization effect of CR |
由以上实验结果可以推测,壳聚糖/纳米铜复合微球氢转移催化CR反应主要分为两步。如图 10所示,第一步是NaBH4解离产生的BH4-,CR分子从溶液扩散到催化剂的表面。第二步是在催化剂表面进行氢转移催化反应,由BH4-释放的电子转移到CuNPs上,带电子的CuNPs激活CR分子中的偶氮键,其偶氮双键通过共轭作用被削弱,从而导致偶氮键断裂,还原为毒性较低的小分子有机物[26]。由于氢转移催化反应发生在催化剂表面,而吸附法制备的CS/CuNPs-X中,CuNPs多集中于微球表面,因此,其催化CR脱色的反应速率大于直接负载法制备的CS/CuNPs。且随着催化剂制备过程中CuCl2·2H2O添加量的增大,制备的催化剂表面的CuNPs增多,催化效率也随之增强。
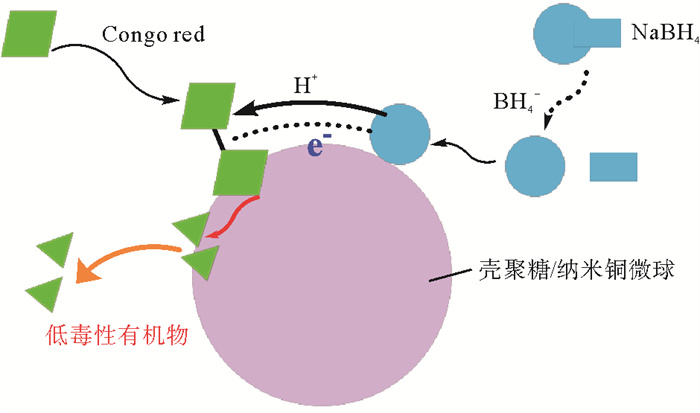
|
图 10 壳聚糖/纳米铜微球还原CR过程 Fig. 10 CR reduction process by chitosan/copper nanoparticles microspheres |
结合CR溶液在氢转移催化的不同反应时间下的紫外-可见光谱图(见图 4(b)和(c)),可以推测壳聚糖/纳米铜复合微球催化还原CR染料可能的机理如图 11所示[27]。489 nm处CR的显色基团,即偶氮键的吸收峰强度随着反应时间的延长而降低,同时290和350 nm处分别出现了萘环和1-氨基-4-萘磺酸钠的吸收峰,证明了CR分子中的偶氮键断裂及相关产物的生成[28]。
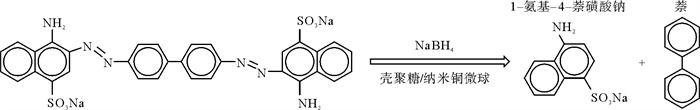
|
图 11 壳聚糖/纳米铜微球还原CR的反应式 Fig. 11 Reaction formula of CR reduction by chitosan/copper nanoparticles microspheres |
(1) 以壳聚糖微球为载体,通过直接负载法和吸附法制备了壳聚糖/纳米铜复合微球,二者均表现了良好的氢转移催化偶氮染料CR脱色的性能,且反应均符合准一级动力学模型。
(2) 催化剂的制备方法明显影响其催化反应活性。在催化剂中Cu(Ⅱ)含量相近、相同的氢转移催化反应条件下,CS/CuNPs-X对CR的催化反应速率高于CS/CuNPs。CS/CuNPs和CS/CuNPs-X和分别在180和60 min达到反应平衡,此时CR脱色率为95.8%和96.8%。
(3) CS/CuNPs和CS/CuNPs-X重复使用10次后,CR的脱色率为93.9%和89.4%,表明催化剂具有良好的重复使用性能。
| [1] |
Rache M L, García A R, Zea H R, et al. Azo-dye orange Ⅱ degradation by the heterogeneous Fenton-like process using a zeolite Y-Fe catalyst—Kinetics with a model based on the Fermi's equation[J]. Applied Catalysis B: Environmental, 2014, 146: 192-200. DOI:10.1016/j.apcatb.2013.04.028
(  0) 0) |
| [2] |
Huang H, Schwab K, Jacangelo J G. Pretreatment for low pressure membranes in water treatment: A review[J]. Environmental Science & Technology, 2009, 43(9): 3011-3019.
(  0) 0) |
| [3] |
Sponza D T, IŞik M. Decolorization and azo dye degradation by anaerobic/aerobic sequential process[J]. Enzyme and Microbial Technology, 2002, 31(1-2): 102-110. DOI:10.1016/S0141-0229(02)00081-9
(  0) 0) |
| [4] |
Naseem K, Farooqi Z H, Begum R, et al. Removal of Congo red dye from aqueous medium by its catalytic reduction using sodium borohydride in the presence of various inorganic nano-catalysts: A review[J]. Journal of Cleaner Production, 2018, 187(20): 296-307.
(  0) 0) |
| [5] |
Sahoo A, Tripathy S K, Dehury N, et al. A porous trimetallic Au@Pd@Ru nanoparticle system: Synthesis, characterisation and efficient dye degradation and removal[J]. Journal of Materials Chemistry A, 2015, 3(38): 19376-19383. DOI:10.1039/C5TA03959B
(  0) 0) |
| [6] |
Niu T, Xu J B, Xiao W, et al. Cellulose-based catalytic membranes fabricated by deposition of gold nanoparticles on natural cellulose nanofibres[J]. RSC Advances, 2014, 4(10): 4901-4904. DOI:10.1039/c3ra44622k
(  0) 0) |
| [7] |
徐丽叶, 匡达, 邓意达. 纳米铜的制备及应用研究[J]. 材料导报, 2013, 27(z1): 37-41. DOI:10.3969/j.issn.1005-023X.2013.z1.012 (  0) 0) |
| [8] |
Kumar M N V R. A review of chitin and chitosan applications[J]. Reactive & Functional Polymers, 2000, 46(1): 1-27.
(  0) 0) |
| [9] |
Anbinder P S, Macchi C, Amalvy J, et al. A study of the structural changes in a chitosan matrix produced by the adsorption of copper and chromium ions[J]. Carbohydrate Polymers, 2019, 222: 114987. DOI:10.1016/j.carbpol.2019.114987
(  0) 0) |
| [10] |
廖强强, 李义久, 相波, 等. 二乙基二硫代氨基甲酸钠与Cu~(2+)、Pb~(2+)、Cd~(2+)、Ni~(2+)的络合性研究[J]. 精细化工, 2008, 25(3): 281-283. DOI:10.3321/j.issn:1003-5214.2008.03.018 (  0) 0) |
| [11] |
Pereda M, Aranguren M I, Marcovich N E. Characterization of chitosan/caseinate films[J]. Journal of Applied Polymer Science, 2008, 107(2): 1080-1090. DOI:10.1002/app.27052
(  0) 0) |
| [12] |
Liu Y L, Xing R G, Yang H Y, et al. Chitin extraction from shrimp (Litopenaeus vannamei) shells by successive two-step fermentation with Lactobacillus rhamnoides and Bacillus amyloliquefaciens[J]. International Journal of Biological Macromolecules, 2020, 148: 424-433. DOI:10.1016/j.ijbiomac.2020.01.124
(  0) 0) |
| [13] |
Hritcu D, Dodi G, Silion M, et al. Composite magnetic chitosan microspheres: In situ preparation and characterization[J]. Polymer Bulletin, 2011, 67(1): 177-186. DOI:10.1007/s00289-010-0439-y
(  0) 0) |
| [14] |
Haider S, Kamal T, Khan S B, et al. Natural polymers supported copper nanoparticles for pollutants degradation[J]. Applied Surface Science, 2016, 387: 1154-1161. DOI:10.1016/j.apsusc.2016.06.133
(  0) 0) |
| [15] |
Vanti G L, Masaphy S, Kurjogi M, et al. Synthesis and application of chitosan-copper nanoparticles on damping off causing plant pathogenic fungi[J]. International Journal of Biological Macromolecules, 2019, 156: 1387-1395.
(  0) 0) |
| [16] |
Corma A, Concepción P, Domíngez I, et al. Gold supported on a biopolymer (chitosan) catalyzes the regioselective hydroamination of alkynes[J]. Journal of Catalysis, 2007, 251(1): 39-47. DOI:10.1016/j.jcat.2007.07.021
(  0) 0) |
| [17] |
Cárdenas-Triviňo G, Cruzat-Contreras C. Study of aggregation of gold nanoparticles in chitosan[J]. Journal of Cluster Science, 2018, 29: 1081-1088. DOI:10.1007/s10876-018-1419-x
(  0) 0) |
| [18] |
Zong Z Y, Kimura Y, Takahashi M, et al. Characterization of chemical and solid state structures of acylated chitosans[J]. Polymer, 2000, 41(3): 899-906. DOI:10.1016/S0032-3861(99)00270-0
(  0) 0) |
| [19] |
Feng F, Liu Y, Zhao B Y, et al. Characterization of half N-acetylated chitosan powders and films[J]. Procedia Engineering, 2012, 27: 718-732. DOI:10.1016/j.proeng.2011.12.511
(  0) 0) |
| [20] |
王小祥, 王平, 王芳, 等. 改性壳聚糖的制备及其对水中酞酸酯的吸附[J]. 环境科学与技术, 2012, 35(8): 26-29. DOI:10.3969/j.issn.1003-6504.2012.08.006 (  0) 0) |
| [21] |
Kumar B, Smita K, Debut A, et al. Utilization of Persea americana (Avocado) oil for the synthesis of gold nanoparticles in sunlight and evaluation of antioxidant and photocatalytic activities[J]. Environmental Nanotechnology, Monitoring & Management, 2018, 10: 231-237.
(  0) 0) |
| [22] |
Jia B Q, Mei Y, Cheng L, et al. Preparation of copper nanoparticles coated cellulose films with antibacterial properties through one-step reduction[J]. Acs Applied Materials & Interfaces, 2012, 4(6): 2897-2902.
(  0) 0) |
| [23] |
Atarod M, Nasrollahzadeh M, Sajadi S M. Euphorbia heterophylla leaf extract mediated green synthesis of Ag/TiO2 nanocomposite and investigation of its excellent catalytic activity for reduction of variety of dyes in water[J]. Journal of Colloid & Interface Science, 2016, 462: 272-279.
(  0) 0) |
| [24] |
Jia Z Q, Sun H J, Du Z X, et al. Catalytic bubble-free hydrogenation reduction of azo dye by porous membranes loaded with palladium nanoparticles[J]. Journal of Environmental Sciences, 2014, 26(2): 478-482. DOI:10.1016/S1001-0742(13)60416-7
(  0) 0) |
| [25] |
刘维俊. 高分子壳聚糖对微量金属离子的螯合作用研究[J]. 应用化工, 2002, 31(4): 16-18. DOI:10.3969/j.issn.1671-3206.2002.04.006 (  0) 0) |
| [26] |
Murugan E, Shanmugam P. Surface grafted hyper-branched polyglycerol stabilized Ag and AuNPs heterogeneous catalysts for efficient reduction of Congo red[J]. Journal of Nanoscience and Nanotechnology, 2016, 16(1): 426-428. DOI:10.1166/jnn.2016.10655
(  0) 0) |
| [27] |
Rajesh R, Kumar S S, Venkatesan R. Efficient degradation of azo dyes using Ag and Au nanoparticles stabilized on graphene oxide functionalized with PAMAM dendrimers[J]. New Journal of Chemistry, 2014, 38(4): 1551-1558. DOI:10.1039/c3nj01050c
(  0) 0) |
| [28] |
Zheng Y, Wang A Q. Ag nanoparticle-entrapped hydrogel as promising material for catalytic reduction of organic dyes[J]. Journal of Materials Chemistry, 2012, 22(32): 16552-16559. DOI:10.1039/c2jm32774k
(  0) 0) |
2. The Key Laboratory of Marine Environmental and Ecology (Ocean University of China), Ministry of Education, Qingdao 266100, China;
3. College of Chemistry and Chemical Engineering, Ocean University of China, Qingdao 266100, China
 2022, Vol. 52
2022, Vol. 52


