2. 崂山实验室 海洋健康诊疗与养护研究室, 山东 青岛 266237
岩藻黄素(Fucoxanthin)是含氧衍生物,属于类胡萝卜素[1]。岩藻黄素在三角褐指藻(Phaeodactylum tricornutum)、海带(Laminaria japonica)和裙带菜(Undaria pinnatifida)[2]中广泛分布。岩藻黄素作为捕光色素,与叶绿素a/c结合形成岩藻黄素-叶绿素a/c蛋白复合物(Fucoxanthin-chlorophyll a/c-binding protein complex, FCP)[3]。岩藻黄素在440~470 nm之间具有可见吸收光谱,FCPs可以有效吸收蓝光和绿光[4],从而协助藻类顺利生存[5]。岩藻黄素在光保护和光传递方面发挥着重要作用[6]。此外,岩藻黄素还具有多种重要的生物学功能[7],如高抗氧化性[8-9]、抗肥胖[10]、抗炎症等[11],且对神经、心脑血管、皮肤等也有一定的保护作用[12-13]。
目前,岩藻黄素主要来源于大型褐藻,但大型藻存在培养周期长、产率低等问题[14]。与大型褐藻相比,微藻具有生长周期短、培养工艺成熟及公开完整的全基因组信息等优势[15]。其中,三角褐指藻(P. tricornutum)是具有代表性的模式微藻,因具有生长速度快、遗传转化体系成熟、富含岩藻黄素等优点而受到广泛关注[16-18]。
由于天然藻种中岩藻黄素含量较低、规模化生产技术体系仍需完善,从而导致岩藻黄素的价格居高不下[19]。提高藻种的岩藻黄素含量和产率是降低生产成本的关键点之一。尿苷二磷酸葡萄糖(Uridine diphosphate glucose, UDPG)是葡萄糖的主要活化形式之一,作为葡萄糖基的供体在糖代谢中发挥着重要作用[20-21]。本课题组前期研究发现,外源添加200、300和400 μmol/L的UDPG均可显著促进三角褐指藻积累岩藻黄素,但岩藻黄素含量差异不显著。因此,添加UDPG的适宜浓度需要更进一步的探究。本文在外源添加UDPG浓度低于200 μmol/L前提下,探究了外源添加不同浓度UDPG对三角褐指藻光合作用能力以及岩藻黄素含量的影响,为解析UDPG促进岩藻黄素积累的分子机制提供理论支持。
1 材料与方法 1.1 藻种来源及培养条件三角褐指藻来源于中国海洋大学海水养殖教育部重点实验室应用微藻生物学实验室。三角褐指藻在f/2培养基[22]中培养,置于温度为(20±1) ℃、盐度为30、初始pH为7.8、光照为75 μmol·s-1·m-2(12 h∶12 h)条件下培养。
1.2 UDPG浓度设置UDPG标品配置成200 mmol/L母液,置于避光、-20 ℃条件下保存备用。基于实验室前期研究,添加0、32.5、65.0、97.5 μL的母液至终浓度分别为0、50、100、150 μmol/L,隔天添加至藻细胞生长平台期,每个浓度设置3个生物学重复。
1.3 叶绿素荧光参数测定藻细胞培养过程中,每天固定时间在超净工作台中取2 mL藻液并暗处理20 min,通过叶绿素荧光仪Water-PAM测定Fv/Fm(光系统Ⅱ的最大光能转换效率)、Y(Ⅱ)(光系统Ⅱ的实际光合效率)等叶绿素荧光参数,比较不同浓度UDPG对藻细胞光合作用能力的影响。
1.4 终生物量测定预先烘干至恒重的GF/C玻璃纤维膜称重并记为W1,三角褐指藻细胞进入平台期时取藻液10 mL,记为V,将其真空抽滤过膜并置于60 ℃的烘箱中烘干至恒重,称重并记为W2。藻细胞生物量(Biomass)计算公式为
| $ \begin{equation} B_{\mathrm{DW}}(\mathrm{g} / \mathrm{L})=\left(W_2-W_1\right) / V_{\text {。}} \end{equation} $ |
离心(3 000g, 5 min)收获平台末期的藻细胞,弃上清,将沉淀置于ALPHR 1-4 LD真空冷冻干燥机(德国CHRIST)中冷冻干燥24 h。准确称取10 mg冷冻干燥的藻粉置于研磨管中,加入1 mL冷乙醇。使用生物样品均质仪破碎藻细胞,置于转速为250 r/min的HNY-2102c恒温培养箱(天津欧诺)中浸提1 h。4 ℃下离心(3 000g, 5 min),取1 mL上清液。重复浸提2~3次,合并色素提取液,使用0.22 μm有机系滤膜过滤所提取的色素并存储于棕色色谱进样瓶中。
1.5.2 HPLC定量分析色素参考Zapata等[23]的方法,采用Waters高效液相色谱法(High performance liquid chromatography, HPLC)进行色素的定量分析。通过Waters C8色谱柱,流动相A为甲醇∶乙腈∶吡啶水(50∶25∶25, V∶V∶V),流动相B为甲醇∶乙腈∶丙酮(20∶60∶20, V∶ V∶V)。洗脱程序为0~22 min:100%A~50%A, 0%B~50%B; 22~28 min: 50%A~20%A, 50%B~80%B; 28~40 min: 20%A~5%A, 80%B~95%B; 40~43 min: 5%A~5%A, 95%B~95%B; 43~45 min: 5%A~100%A, 95%B~0%B。进样量为100 μL, 洗脱时间为45 min,检测波长为440 nm,流速保持在1 mL/min[24]。
1.6 数据分析所有数据均采用Origin 2021进行绘图分析;SPSS 2023进行单因素方差分析(ANOVA),计算各处理组之间的显著性差异,显著性水平为P<0.05。所有数据均以平均值±标准差(SD)形式显示。
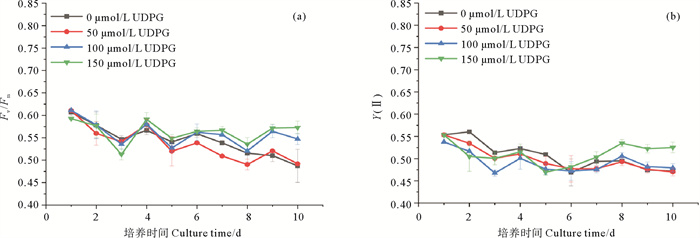
2 结果 2.1 不同浓度UDPG对三角褐指藻光合作用能力的影响不同浓度UDPG对三角褐指藻光合作用能力的影响如图 1所示。Fv/Fm代表光系统Ⅱ的最大光能转换效率,如图 1(a)所示,培养第1天藻细胞的Fv/Fm值在0.6左右,随培养时间的延长,Fv/Fm呈逐渐下降的趋势,在培养的第7~10天,150 μmol/L UDPG处理组的Fv/Fm显著高于对照组。Y(Ⅱ)代表光系统Ⅱ的实际光能转换效率。如图 1(b)所示,Y(Ⅱ)的变化趋势与Fv/Fm相似,呈逐渐下降的趋势,但150 μmol/L UDPG处理组的Y(Ⅱ)显著高于对照组。以上结果表明,150 μmol/L UDPG处理组显著促进了三角褐指藻细胞的光合作用能力。
|
( Fv/Fm: 光系统Ⅱ最大光能转换效率; Y(Ⅱ): 光系统Ⅱ实际光能转换效率。Fv/Fm: Maximum quantum yield of photosystem Ⅱ; Y(Ⅱ): Effective quantum yield of photosystem Ⅱ. ) 图 1 不同浓度UDPG对三角褐指藻Fv/Fm(a)和Y(Ⅱ)(b)的影响 Fig. 1 Effects of different concentrations of UDPG on Fv/Fm (a) and Y(Ⅱ) (b) of P. tricornutum |
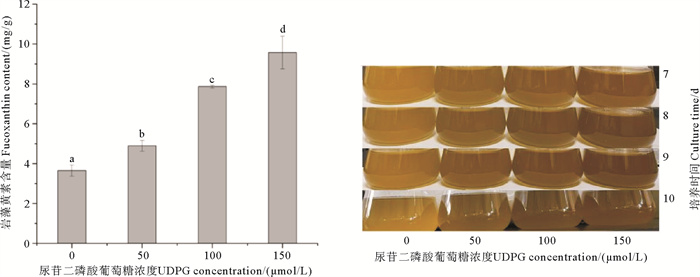
UDPG对三角褐指藻岩藻黄素含量的影响如图 2所示。添加UDPG处理组中岩藻黄素含量显著高于对照组。其中,对照组岩藻黄素含量为(3.66±0.28) mg/g,50、100、150 μmol/L UDPG处理组岩藻黄素含量分别为(4.90±0.27)、(7.87±0.07)和(9.57±0.81) mg/g,比对照组分别提高了33.88%、115.09%和161.76%。此外,在添加UDPG的处理组中,藻液颜色逐渐加深,由金棕色变为明显的棕褐色。上述结果表明,外源添加UDPG显著促进了三角褐指藻岩藻黄素的积累。
|
( 左图中字母为多重比较结果,字母不同表示差异显著。The letters represent the multiple comparison results on the left figure, the difference is significant when the letters are different. ) 图 2 不同浓度UDPG对三角褐指藻岩藻黄素含量的影响 Fig. 2 The effects of different concentrations of UDPG on fucoxanthin content of P. tricornutum |
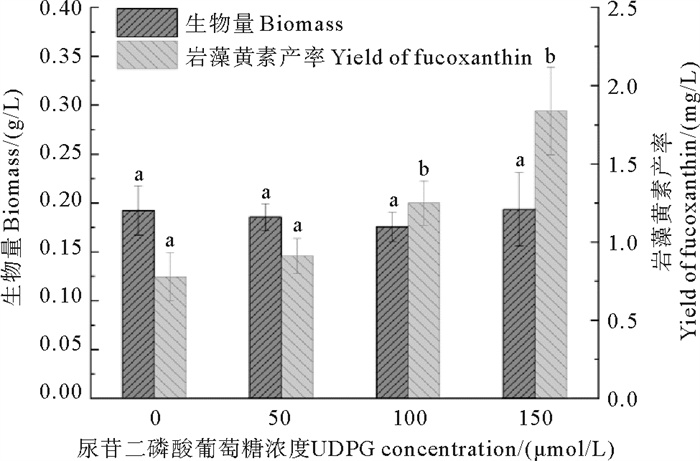
添加不同浓度UDPG对三角褐指藻岩藻黄素产率及生物量的影响如图 3所示。50、100、150 μmol/L UDPG处理组的生物量与对照组相比差异不显著(P>0.05)。然而,不同浓度UDPG处理组下岩藻黄素产率的变化差异显著。对照组岩藻黄素的产率为(0.78±0.15) mg/L,50、100、150 μmol/L UDPG处理组岩藻黄素产率分别为(0.91±0.11)、(1.25±0.14)和(1.84±0.28) mg/L,比对照组分别提高了17.24%、60.87%和136.81%。
|
( 图中字母为多重比较结果,字母相同表示差异不显著, 字母不同表示差异显著。The letters represent the multiple comparison results, the difference is not significant if the letters are the same, the difference is significant when the letters are different. ) 图 3 不同浓度UDPG对三角褐指藻岩藻黄素产率及生物量的影响 Fig. 3 The effects of different concentrations of UDPG on the yield of fucoxanthin and biomass of P.tricornutum |
不同浓度UDPG对各色素产率的影响如表 1所示。各色素产率随UDPG浓度的增加而增加。150 μmol/L UDPG处理下叶绿素a、硅甲藻黄素、β-胡萝卜素、脱镁叶绿素a等产率分别为2.234、0.701、0.191、0.137 mg/L,分别比对照组提高了306.92%、73.08%、151.31%、1 857.14%。
|
|
表 1 不同浓度UDPG对三角褐指藻其他色素产率的影响 Table 1 The effects of different concentrations of UDPG on the yield of other pigments of P. tricornutummg/L |
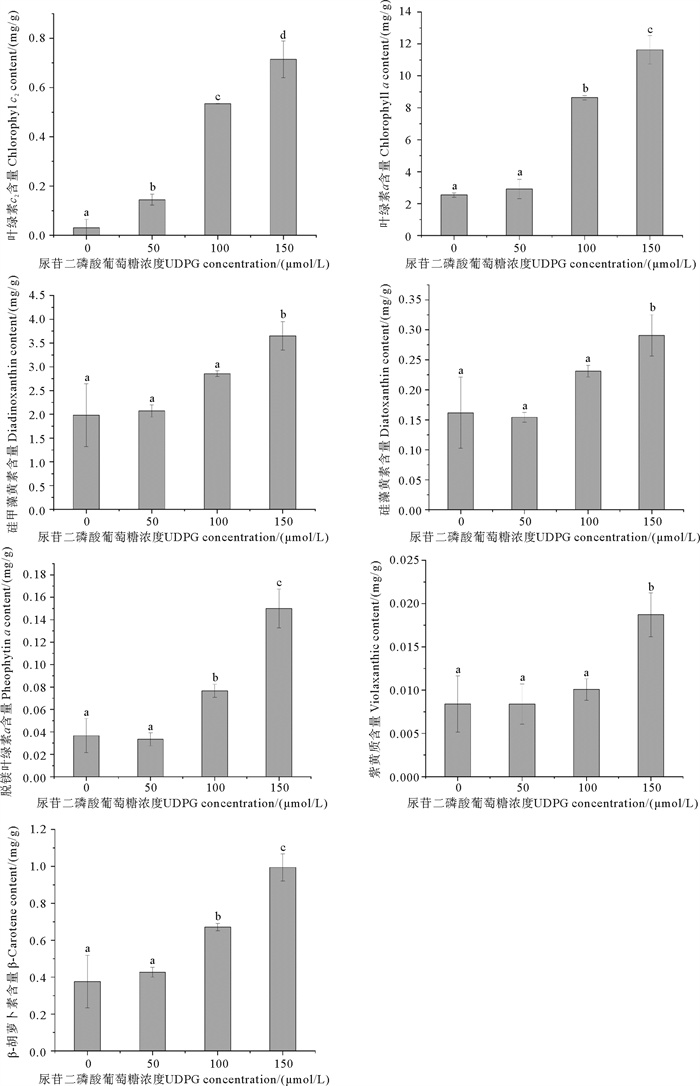
此外,如图 4所示,随UDPG浓度的增加其他色素含量明显升高(P<0.05)。150 μmol/L UDPG处理组的硅甲藻黄素、硅藻黄素、β-胡萝卜素、紫黄质、叶绿素a和叶绿素c2等色素的含量分别比对照组提高了84.31%、79.73%、164.74%、123.04%、358.35%和2 260.09%。
|
( 图中字母为多重比较结果,字母相同表示差异不显著,字母不同表示差异显著。The letters represent the multiple comparison results, the difference is not significant if the letters are the same, the difference is significant when the letters are different. ) 图 4 不同浓度UDPG对三角褐指藻其他色素含量的影响 Fig. 4 The effects of different concentrations of UDPG on the content of other pigments of P. tricornutum |
Fv/Fm代表光系统Ⅱ的最大光能转换效率[25],在正常的生理状态下,大多数硅藻的Fv/Fm值在0.6~0.7之间[26]。如图 1所示,随着培养时间的延长,Fv/Fm呈下降趋势,这可能是藻细胞进入稳定期,培养基中的营养物质含量逐渐下降,导致藻细胞的光合作用能力也呈减弱的趋势[27]。尽管如此,150 μmol/L UDPG处理组的Fv/Fm显著高于对照组,这可能是由于UDPG显著提高了岩藻黄素与叶绿素a的含量,它们结合形成FCPs,而FCPs是许多藻类的主要捕光复合物,其有助于提高藻细胞的光合作用能力[28]。
由于岩藻黄素显著的生物学活性,其具有极高的应用价值。本研究首次探究了外源添加不同浓度UDPG对三角褐指藻岩藻黄素含量的影响,结果表明UDPG可显著促进岩藻黄素的积累。此外,不同浓度UDPG也不同程度地提高了其他色素含量(见图 4)。那么,藻细胞如何维持物质之间的平衡呢?在植物糖代谢中,内源UDPG主要由尿苷二磷酸葡萄糖焦磷酸化酶(UDP-glucose pyrophosphorylase, UGPase)催化产生。在三角褐指藻中UGPase主要有UGP1和UGP2两个编码基因[29]。张瑞豪[30]研究发现,过表达UGP1和UGP2导致三角褐指藻中金藻昆布多糖含量显著提高,总脂含量显著降低;而肖腾飞[31]研究表明,敲除UGP1和UGP2导致三角褐指藻中总脂含量显著增加,金藻昆布多糖含量显著降低。因此,内源性UDPG可能通过改变三角褐指藻碳流分配来维持细胞内各物质之间的平衡,而外源添加不同浓度UDPG对三角褐指藻碳流分配的影响需要进一步探究。
近年来,如何提高藻种的岩藻黄素含量受到很多学者的关注。朱帅旗等[32]研究表明,外源添加0.2 mg/L硫酸铈铵(Ammonium cerous sulfate, ACS)能够促进三角褐指藻岩藻黄素含量的积累,但其含量仅为1.28 mg/g。另外,乙酰水杨酸(Acetylsalicylic acid, ASA)、茉莉酸甲酯(Methyl jasmonate, MeJA)等均可不同程度地促进三角褐指藻积累岩藻黄素,岩藻黄素含量在1.2~2.0 mg/g之间[33]。Wang等[34]发现,在三角褐指藻中添加1.5 mL/L的海带(Laminaria japonica)水解物可同时促进藻细胞生长和岩藻黄素的积累,其岩藻黄素含量可达17.55 mg/g。韦凤娟等[35]报道,外源添加2.5~10 mmol/L雷帕霉素(Rapamycin, RPM)可显著促进三角褐指藻中岩藻黄素的含量,其含量提高了40%。在本研究中,外源添加150 μmol/L UDPG显著促进了岩藻黄素积累,岩藻黄素含量提高了161.76%,与已报道的研究结果[32-35]相比,本研究提升岩藻黄素含量的效果显著,这可为高效生产岩藻黄素提供一种新策略。
也有一些学者通过调控岩藻黄素合成路径中的关键酶基因来提高岩藻黄素含量。Manfellotto等[36]研究发现过表达紫黄质环脱氧酶(Violaxanthin de-epoxidase, VDE)基因和玉米黄质环氧酶(Zeaxanthin epoxidase, ZEP3)基因,实验组的岩藻黄素含量比对照组相提高了4倍;Kadono等[37]发现过表达八氢番茄红素合酶(Phytoene Synthase, PSY)基因使得三角褐指藻中岩藻黄素含量提高了1.8倍;Yang等[38]敲除三角褐指藻隐花色素(Cryptochrome, Cryp)基因使得岩藻黄素含量显著提高。上述相关研究为解析岩藻黄素合成路径中关键酶基因的功能奠定理论基础。
由于三角褐指藻中岩藻黄素的合成途径是基于高等植物拟南芥中类胡萝卜素合成途径提出来的[39],但紫黄质与岩藻黄素之间的反应步骤仍未完全阐明[40],这限制了通过调控关键酶基因来提高岩藻黄素含量的研究。如图 5所示,三角褐指藻中岩藻黄素的合成路径主要包括2-C-甲基-D-赤藓糖醇-4-磷酸途径(MEP)、牻牛儿基牻牛儿基焦磷酸途径(GGPP)和类胡萝卜素的形成[41-42]。其中,岩藻黄素合成路径中的第一步是由限速酶1-脱氧-D-木酮糖-5-磷酸合酶(DXS)催化,通过MEP途径形成二甲基烯丙基二磷酸(DMAPP)和异戊烯焦磷酸(IPP),它们是类胡萝卜素生成的前体物质[43]。类胡萝卜素的合成以GGPP为底物,由八氢番茄红素合酶(PSY)和八氢番茄红素脱氢酶(PDS)经过环化反应,最终生成β-胡萝卜素[37]。β-胡萝卜素进一步生成玉米黄质,玉米黄质经过叶黄素循环生成环玉米黄质、紫黄质[44]。然而,叶黄素循环主要受光照强度的影响,在较弱的光照强度下,由玉米黄质环氧酶(ZEP)催化形成紫黄质;而在较强的光照强度下,由紫黄质脱环氧酶(VDE)催化该反应[45]。有学者提出了两条具有代表性的假设途径:途径一是紫黄质生成新黄质,由新黄质生成岩藻黄素[46];途径二是由硅甲藻黄素生成岩藻黄素[47]。
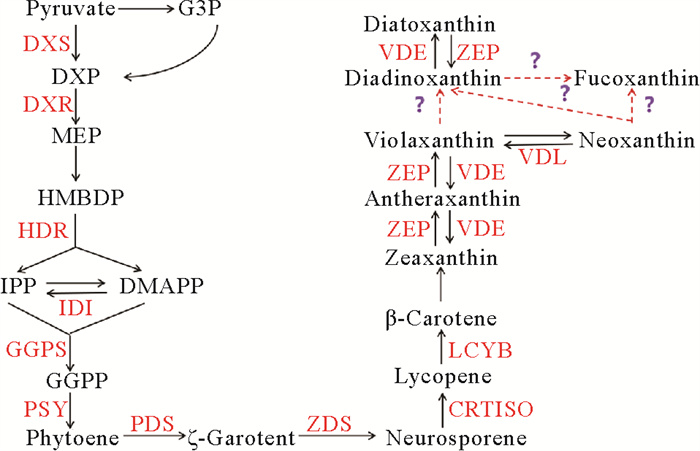
|
( G3P: 甘油醛-3-磷酸Glyceraldehyde-3--phosphate; DXS: 1-脱氧-D-木酮糖-5-磷酸合酶1-deoxy-D-xylulose-5-phosphate synthase; DXP: 1-脱氧-D-木酮糖-5-磷酸1-deoxy-D-xylu-lose-5-phosphate; DXR: 1-脱氧-D-木酮糖-5-磷酸还原异构酶1-deoxy-D-xylulose-5-phosphate reductoisomerase; MEP: 2-C-甲基-D-赤藓醇-4-磷酸酯2-C-methyl-D-erythrito-l 4-phosphate; HMBDP: 4-羟基-3-甲基-2-烯基二磷酸酯4-hydroxy-3-methylbut-2-enyldiphos-phate; HDR: 4-羟基-3-甲基-2-烯基二磷酸还原酶4-hydroxy-3-methylbut-2-enyl-diphosphate reductase; IPP: 异戊烯焦磷酸Isopentenyl dipho-sphate; DMAPP: 二甲基烯丙基二磷酸Dimethylallyl diphosphate; IDI: 异戊烯焦磷酸异构酶Isopentenyl diphosphate isomerase; GGPS:牻牛儿基牻牛儿基焦磷酸合成酶Geranylgeranyl diphosphate synthase;GGPP: 牻牛儿基牻牛儿基焦磷酸Geranylgeranyl diphosphate; PSY: 八氢番茄红素合酶Phyt-oene synthase; PDS: 八氢番茄红素去饱和酶Phytoene desaturase; ZDS: 胡萝卜素去饱和酶Carotene desaturase; CRTISO:类胡萝卜素异构酶Carotenoid isomerase;LCYB: 番茄红素-β-环化酶Lycopene-β-cyclase; ZEP: 玉米黄质环氧酶Zeaxanthin epoxidase; VDE: 紫黄质脱环氧酶Violaxanthin de-epoxidase; VDL:类紫黄质脱环氧化酶Violaxanthin de-epoxidase-like。) 图 5 三角褐指藻岩藻黄素合成路径[1] Fig. 5 Synthesis path of fucoxanthin of P. tricornutum[1] |
在本研究中,岩藻黄素(Fucoxanthin)、紫黄质(Violaxanthin)、硅甲藻黄素(Diadinoxanthin)和硅藻黄素(Diatoxanthin)的含量均随着UDPG浓度的增加而升高,这为通过对岩藻黄素合成路径中关键基因的探究来解析UDPG促进岩藻黄素积累的分子机制提供一定的参考。除上述色素外,UDPG也显著提高了三角褐指藻叶绿素a的含量,而岩藻黄素与叶绿素a结合形成FCPs[48],这解释了UDPG提高三角褐指藻光合作用能力的原因。
综上,本实验探究了外源添加不同浓度UDPG对三角褐指藻光合作用能力及岩藻黄素积累的影响。结果表明,在本研究所设置的浓度范围内,UDPG浓度的增加有助于藻细胞光合作用能力的提高和岩藻黄素的积累,150 μmol/L UDPG处理组岩藻黄素含量达到(9.57±0.81)mg/g。另外,硅甲藻黄素、硅藻黄素、紫黄质等色素是岩藻黄素合成路径中的主要色素,它们均随着UDPG浓度的增加而增加,这为解析岩藻黄素的合成路径提供了一定的理论参考。
4 结语本研究通过高效液相色谱法测定不同浓度UDPG对三角褐指藻岩藻黄素含量的影响,首次发现外源添加UDPG可显著促进三角褐指藻积累岩藻黄素,研究为通过三角褐指藻高效生产岩藻黄素提供了一种新策略。然而,UDPG促进三角褐指藻岩藻黄素积累的具体分子机制尚待探索和研究。本研究为后期解析岩藻黄素的生物合成路径提供了相关的理论支持。
| [1] |
Wang S, Wu S, Yang G, et al. A review on the progress, challenges and prospects in commercializing microalgal fucoxanthin[J]. Biotechnol Advances, 2021, 53: 107865. DOI:10.1016/j.biotechadv.2021.107865 (  0) 0) |
| [2] |
Peng J, Yuan J P, Wu C F, et al. Fucoxanthin, a marine carotenoid present in brown seaweeds and diatoms: Metabolism and bioactivities relevant to human health[J]. Marine Drugs, 2011, 9(10): 1806-1828. DOI:10.3390/md9101806 (  0) 0) |
| [3] |
Lu X, Liu B, He Y J, et al. Novel insights into mixotrophic cultivation of nitzschia laevis for co-production of fucoxanthin and eicosapentaenoic acid-science direct[J]. Bioresource Technology, 2019, 294: 122145. DOI:10.1016/j.biortech.2019.122145 (  0) 0) |
| [4] |
Sugawara T, Baskaran V, Tsuzuki W, et al. Brown algae fucoxanthin is hydrolyzed to fucoxanthinol during absorption by Caco-2 human intestinal cells and mice[J]. Journal of Nutrition, 2002, 132(5): 946-951. DOI:10.1093/jn/132.5.946 (  0) 0) |
| [5] |
徐才哲. 三角褐指藻岩藻黄素-叶绿素a/c蛋白复合体的结构和功能研究[D]. 石家庄: 河北科技大学, 2015. Xu C Z. Structural and Functional Studies on the Fucoxanthin-Chlorophyll a/c Protein Complex of Phaeodactylum tricornutum[D]. Shijiazhuang: Hebei University of Science and Technology, 2015. (  0) 0) |
| [6] |
Chen D, Yuan X, Zheng X, et al. Multi-omics analyses provide insight into the biosyn-thesis pathways of fucoxanthin in isochrysis galbana[J]. Genomics Proteomics Bioinformatics, 2021, 20(6): 1138-1153. (  0) 0) |
| [7] |
乔子纯, 刘光明, 曹敏杰, 等. 加工过程中褐藻岩藻黄素的特征光谱变化[J]. 集美大学学报(自然科学版), 2018(1): 27-32. Qiao Z C, Liu G M, Cao M J, et al. Characteristic spectral changes of fucoxanthin in brown algae during processing[J]. Journal of Jimei University(Natural Science), 2018(1): 27-32. (  0) 0) |
| [8] |
Wang S K, Li Y, White W L, et al. Extracts from New Zealand Undaria pinnatifida containing fucoxanthin as potential functional biomaterials against cancer in vitro[J]. Journal of Functional Biomaterials, 2014, 5(2): 29-42. DOI:10.3390/jfb5020029 (  0) 0) |
| [9] |
Zhao D, Kim S M, Pan C H, et al. Effects of heating, aerial exposure and illumination on stability of fucoxanthin in canola oil[J]. Food Chemistry, 2014, 145: 505-513. DOI:10.1016/j.foodchem.2013.08.045 (  0) 0) |
| [10] |
Woo M N, Jeon S M, Shin Y C, et al. Anti-obese property of fucoxanthin is partly mediated by altering lipid-regulating enzymes and uncoupling proteins of visceral adipose tissue in mice[J]. Molecular Nutrition & Food Research, 2010, 53(12): 1603-1611. (  0) 0) |
| [11] |
Lee A H, Shin H Y, Park J H, et al. Fucoxanthin from microalgae Phaeodactylum tricornutum inhibits pro-inflammatory cytokines by regulating both NF-kappaB and NLRP3 inflammasome activation[J]. Scientific Reports, 2021, 11(1): 543. DOI:10.1038/s41598-020-80748-6 (  0) 0) |
| [12] |
Zhang L, Wang H, Fan Y, et al. Fucoxanthin provides neuroprotection in models of traumatic brain injury via the Nrf2-ARE and Nrf2-autophagy pathways[J]. Scientific Reports, 2017, 7: 46763. DOI:10.1038/srep46763 (  0) 0) |
| [13] |
张文源, 高保燕, 雷学青, 等. 岩藻黄素的理化与生物学特性、制备技术及其生理活性研究进展[J]. 中国海洋药物, 2015(3): 81-95. Zhang W Y, Gao B Y, Lei X Q, et al. Progress in the study of physicochemical and biological properties, preparation technology and physiological activity of fucoxanthin[J]. China Marine Drugs, 2015(3): 81-95. (  0) 0) |
| [14] |
Terasaki M, Hirose A, Narayan B, et al. Evaluation of recoverable functional lipid components of several brown seaweeds (phaeophyta) from Japan with special reference to fucoxanthin and fucosterol contents[J]. Journal of Phycology, 2009, 45(4): 974-980. DOI:10.1111/j.1529-8817.2009.00706.x (  0) 0) |
| [15] |
Bowler C, Allen A E, Badger J H, et al. The phaeodactylum genome reveals the evolutionary history of diatom genomes[J]. Nature, 2008, 456(7219): 239-244. DOI:10.1038/nature07410 (  0) 0) |
| [16] |
Apt K E, Kroth-Pancic P G, Grossman A R. Stable nuclear transformation of the diatom Phaeodactylum tricornutum[J]. Molecular and General Genetics, 1996, 252: 572-579. (  0) 0) |
| [17] |
Xie W H, Zhu C C, Zhang N S, et al. Construction of novel chloroplast expression vector and development of an efficient transformation system for the diatom Phaeodactylum tricornutum[J]. Marine Biotechnology, 2014, 16(5): 538-546. DOI:10.1007/s10126-014-9570-3 (  0) 0) |
| [18] |
Leong Y K, Chen C Y, Varjani S, et al. Producing fucoxanthin from algae-recent advances in cultivation strategies and downstream processing[J]. Bioresource Technology, 2022, 344: 126170. DOI:10.1016/j.biortech.2021.126170 (  0) 0) |
| [19] |
Kim S M, Jung Y J, Kwon O N, et al. A potential commercial source of fucoxanthin extracted from the microalga Phaeodactylum tricornutum[J]. Applied Biochemistry & Biotechnology, 2012, 166(7): 1843-1855. (  0) 0) |
| [20] |
Janse van Rensburg H C, Van den Ende W. UDP-Glucose: A potential signaling molecule in plants?[J]. Frontiers in Plant Science, 2017, 8: 2230. (  0) 0) |
| [21] |
Xiao G, Zhou J, Lu X, et al. Excessive UDPG resulting from the mutation of UAP1 causes programmed cell death by triggering reactive oxygen species accumulation and caspase-like activity in rice[J]. New Phytologist, 2018, 217(1): 332-343. DOI:10.1111/nph.14818 (  0) 0) |
| [22] |
Guillard R. Culture of phytoplankton for feeding marine invertebrates[J]. Culture of Marine Invertebrate Animals, 1975(1): 29-60. (  0) 0) |
| [23] |
Zapata M, Rodríguez F, Garrido J. Separation of chlorophylls and carotenoids from marine phytoplankton: A new HPLC method using a reversed phase C8 column and pyridine-containing mobile phases[J]. Marine Ecology Progress, 2000, 195(3): 29-45. (  0) 0) |
| [24] |
王锦秀, 孔凡洲, 陈振帆, 等. 六株球形棕囊藻的色素组成特征研究[J]. 海洋与湖沼, 2019, 50(3): 611-620. Wang J X, Kong F Z, Chen Z F, et al. Characterization of the pigment composition of six strains of phaeocystis globosa[J]. Oceanologia et Limnologia Sinica, 2019, 50(3): 611-620. (  0) 0) |
| [25] |
Kitajima M, Butler W L. Excitation spectra for photosystem Ⅰ and photosystem Ⅱ in chloroplasts and the spectral characteristics of the distributions of quanta between the two photosystems[J]. Biochimica Biophysica Acta-Bioenergetics, 1975, 408(3): 297-305. DOI:10.1016/0005-2728(75)90131-0 (  0) 0) |
| [26] |
Chisti Y. Biodiesel from microalgae[J]. Biotechnol Advances, 2007, 25(3): 294-306. DOI:10.1016/j.biotechadv.2007.02.001 (  0) 0) |
| [27] |
陈禹先, 佟少明, 侯和胜. 三角褐指藻光合与生长参数测量方法的研究[J]. 激光生物学报, 2018(1): 28-35. Chen Y X, Tong S M, Hou H S. A study on measurement methods of photosynthesis and growth parameters ofPhaeodactylum tricornutum[J]. Acta Laser Biology Sinica, 2018(1): 28-35. (  0) 0) |
| [28] |
Gelzinis A, Butkus V, Songaila E, et al. Mapping energy transfer channels in fucoxanthin-chlorophyll protein complex[J]. Biochimica Biophysica Acta-Bioenergetics, 2015, 1847(2): 241-247. DOI:10.1016/j.bbabio.2014.11.004 (  0) 0) |
| [29] |
Huang W, Rio B C, Kroth P G. Diatom vacuolar 1, 6-beta-transglycosylases can functionally complement the respective yeast mutants[J]. Eukaryot Microbiol, 2016, 63(4): 536-546. DOI:10.1111/jeu.12298 (  0) 0) |
| [30] |
张瑞豪. 三角褐指藻尿苷二磷酸葡萄糖焦磷酸化酶在碳流分配中的作用机制研究[D]. 青岛: 中国海洋大学, 2020. Zhang R H. A Mechanism for Carbon Allocation of UDP-Glucose Pyrophosphorylase in Phaeodactylum tricornutum[D]. Qingdao: Ocean University of China, 2020. (  0) 0) |
| [31] |
肖腾飞. 三角褐指藻CRISPR/Cas9基因编辑体系建立及尿苷二磷酸葡萄糖焦磷酸化酶功能探究[D]. 青岛: 中国海洋大学, 2022. Xiao T F. Establishment of CRISPR/Cas9 Gene-Editing System and the Functional Research of UDP-Glucose Pyrophosphorylase in Phaeodactylum tricornutum[D]. Qingdao: Ocean University of China, 2022. (  0) 0) |
| [32] |
朱帅旗, 龚一富, 刘浩, 等. 硫酸铈铵对三角褐指藻岩藻黄素含量的影响及转录差异研究[J]. 中国稀土学报, 2014(6): 750-757. Zhu S Q, Gong Y F, Liu H, et al. Effects of ammonium cerous sulfate on fucoxanthin content in Phaeodactylum tricornutum and research of transcriptional differences[J]. Journal of the Chinese Society of Rare earths, 2014(6): 750-757. (  0) 0) |
| [33] |
俞凯, 龚一富, 朱帅旗, 等. 不同外源诱导子对三角褐指藻lcyb基因转录及其岩藻黄素含量的影响[J]. 农业生物技术学报, 2017, 25(12): 2009-2017. Yu K, Gong Y F, Zhu S Q, et al. Effects of different exogenous elicitors on lcyb gene transcription and fucoxanthin content in Phaeodactylum tricornutum[J]. Journal of Agricultural Biotechnology, 2017, 25(12): 2009-2017. (  0) 0) |
| [34] |
Wang Z P, Wang P K, Ma Y, et al. Laminaria japonica hydrolysate promotes fucoxanthin accumulation in Phaeodactylum tricornutum[J]. Bioresource Technology, 2022, 344: 126117. DOI:10.1016/j.biortech.2021.126117 (  0) 0) |
| [35] |
韦凤娟, 龚一富, 章丽, 等. 雷帕霉素对三角褐指藻岩藻黄素含量及关键酶基因表达的影响[J]. 生物学杂志, 2022(3): 72-77. Wei F J, Gong Y F, Zhang L, et al. Effects of rapamycin on the content of fucoxanthin in Phaeodactylum tricornutum and the expression of key enzyme genes[J]. Journal of Blology, 2022(3): 72-77. (  0) 0) |
| [36] |
Manfellotto F, Stella G R, Falciatore A, et al. Engineering the unicellular alga Phaeodactylum tricornutum for enhancing carotenoid production[J]. Antioxidants, 2020, 9(8): 757. DOI:10.3390/antiox9080757 (  0) 0) |
| [37] |
Kadono T, Kira N, Suzuki K, et al. Effect of an introduced phytoene synthase gene expression on carotenoid biosynthesis in the marine diatom Phaeodactylum tricornutum[J]. Marine Drugs, 2015, 13(8): 5334-5357. DOI:10.3390/md13085334 (  0) 0) |
| [38] |
Yang W, Zhou L, Wang J, et al. Knockout of a diatom cryptochrome by CRISPR/Cas9 causes an increase in light-harvesting protein levels and accumulation of fucoxanthin[J]. Algal Research, 2022, 66: 102822. DOI:10.1016/j.algal.2022.102822 (  0) 0) |
| [39] |
王紫璇, 李佳佳, 于旭东, 等. 高等植物类胡萝卜素生物合成研究进展[J]. 分子植物育种, 2021(8): 2627-2637. Wang Z X, Li J J, Yu X D, et al. An overview of carotenoids biosynthesis in higher plants[J]. Molecular Plant Breeding, 2021(8): 2627-2637. (  0) 0) |
| [40] |
Wilhelm L C. Algae displaying the diadinoxanthin cycle also possess the violaxanthin cycle[J]. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(15): 8784-8789. (  0) 0) |
| [41] |
Athanasakoglou A, Kampranis S C. Diatom isoprenoids: advances and biotechnological potential[J]. Biotechnology Advances, 2019, 37(8): 107417. (  0) 0) |
| [42] |
Bertrand M. Carotenoid biosynthesis in diatoms[J]. Photosynthesis Research, 2010, 106(1-2): 89-102. (  0) 0) |
| [43] |
Stauber J L, Jeffrey S W. Photosynthetic pigments in fifty-one species of marine diatoms[J]. Journal of Phycology, 1988, 24(2): 158-172. (  0) 0) |
| [44] |
Coesel S, Obornik M, Varela J, et al. Evolutionary origins and functions of the carotenoid biosynthetic pathway in marine diatoms[J]. PLoS One, 2008, 3(8): 2896. (  0) 0) |
| [45] |
Kuczynska P, Jemiola-Rzeminska M, Strzalka K. Photosynthetic pigments in diatoms[J]. Marine Drugs, 2015, 13(9): 5847-5881. (  0) 0) |
| [46] |
Dambek M, Eilers U, Breitenbach J, et al. Biosynthesis of fucoxanthin and diadinoxanthin and function of initial pathway genes in Phaeodactylum tricornutum[J]. Journal of Experimental Botany, 2012, 63(15): 5607-5612. (  0) 0) |
| [47] |
Lohr M, Wilhelm C. Xanthophyll synthesis in diatoms: Quantification of putative intermediates and comparison of pigment conversion kinetics with rate constants derived from a model[J]. Planta, 2001, 212(3): 382-391. (  0) 0) |
| [48] |
Caron L, Douady D, Quinet-Szely M, et al. Gene structure of a chlorophyll a/c-binding protein from a brown alga: Presence of an intron and phylogenetic implications[J]. Journal of Molecular Evolution, 1996, 43(3): 270-280. (  0) 0) |
2. Ocean Health Diagnosis and Care Research Center, Laoshan Laboratory, Qingdao 266237, China
 2024, Vol. 54
2024, Vol. 54


