2. 青岛市海泊河污水处理厂,山东 青岛 266021;
3. 中国海洋大学环境科学与工程学院,山东 青岛 266100
Cu2+广泛存在于电镀、印刷、电子制造、金属加工工业及养殖业废水中。铜是微生物生长必不可少的微量元素,但浓度过高会对微生物造成危害,干扰细胞的新陈代谢[1],同时引起脂质过氧化、蛋白质破坏和酶活性抑制[2]。由于污水生物处理系统主要依靠微生物对污水进行处理,因此废水中的Cu2+可能通过抑制微生物活性而改变废水生物处理系统中活性污泥(或生物膜)的生化特性,引起微生物群落结构变化,从而影响污水生物处理系统对废水中有机物和氮等污染物的去除效果。序批式反应器(Sequencing Batch Reactor,简称SBR)对极端条件具有较强的耐受性,SBR常用来处理含铜废水[3]。许多学者研究了Cu2+对SBR去除有机物和脱氮性能的影响[4-7]。Wang等[3]研究发现长期暴露条件下,浓度为10~50 mg·L-1的Cu2+能抑制SBR的脱氮性能,且抑制程度随Cu2+浓度升高而增加。Liu等[8]研究发现长期运行条件下浓度为5 mg·L-1的Cu2+能导致SBR对COD和氨氮的去除率下降。
在污水生物处理过程中,微生物分泌的胞外聚合物(Extracellular Polymeric Substances,简称EPS)能够影响活性污泥表面电荷、絮体结构、絮凝性、沉降性及脱水性[9-10]。EPS的化学成分主要包括多糖、蛋白质、腐殖质和DNA等,其中存在大量的羧基、磷酸基、胺基和羟基等带电官能团,这些官能团具有吸附和粘附性能。活性污泥可以通过增加EPS的分泌有效吸附废水中的重金属,从而减少重金属对活性污泥中功能菌的潜在毒性[11-15]。已有文献报道,废水中Cu2+的存在能够影响活性污泥中EPS的产量。Wang等[3]和Ma等[16]发现Cu2+浓度范围分别为10~50 mg·L-1和1~10 mg·L-1时,随Cu2+浓度升高活性污泥和生物膜中EPS含量逐渐升高。而Liu等[8]发现5 mg·L-1Cu2+长期作用下活性污泥EPS含量逐渐降低。然而,目前关于Cu2+对活性污泥EPS结构、组分、官能团及化学组成影响的研究鲜有报道。本文研究了在长期暴露条件下10 mg·L-1 Cu2+对SBR活性污泥中松散附着EPS(LB-EPS)和紧密附着EPS(TB-EPS)产量的影响,通过傅里叶红外光谱(FTIR)和X射线光电子能谱(XPS)分析LB-EPS和TB-EPS主要官能团及化学组成的变化。
1 材料与方法 1.1 实验装置及运行条件实验所用SBR材质为有机玻璃,其容积、有效高度、内径和容积交换率分别为7.7 L、50 cm、14 cm和50%。SBR进水通过蠕动泵控制从反应器底部进入,其出水由电磁阀控制从反应器中间排出。SBR每日运行4个周期,每个周期6 h,工作程序如下:进水阶段5 min; 缺氧阶段60 min; 好氧阶段180 min; 缺氧阶段60 min; 沉淀阶段30 min; 排水阶段5 min; 闲置阶段20 min。SBR运行过程中,各阶段通过时间控制器进行自动调控; 在缺氧阶段,通过磁力搅拌器确保污泥和污水充分混合,反应器中溶解氧浓度小于0.5 mg·L-1。SBR采用底部曝气方式,其曝气量通过气体转子流量计调节,以保持好氧阶段的溶解氧浓度大于2 mg·L-1。定期排放污泥,使污泥龄保持在20 d左右。SBR的运行阶段如表 1所示。
|
|
表 1 运行阶段 Table 1 Operation phase |
SBR的接种污泥取自青岛市李村河污水处理厂二沉池的回流污泥,初始污泥浓度约为4 000 mg·L-1。SBR进水中COD和NH4+-N浓度分别为(497.47±17.57)和(30.45±0.95) mg·L-1。SBR进水的具体组成成分如下(mg·L-1):CH3COONa 641.0;NH4Cl 114.6;K2HPO4 9.4;KH2PO4 8.5;NaHCO3 112.5;MnCl2·4H2O 0.12;CoCl2·6H2O 0.15;Na2MoO4·2H2O 0.06;KI 0.03;H3BO3 0.15;ZnSO4·7H2O 0.12;FeCl3·6H2O 1.5和CuSO4·5H2O 39.06。模拟废水的pH约为7.8。
1.3 分析方法COD、NH4+-N、NO2--N、NO3--N和MLVSS均采用国家规定的标准方法测定[17]。溶解氧浓度和pH值分别采用便携式溶解氧仪和pHS-3D酸度计测定。
1.4 胞外聚合物提取和分析方法 1.4.1 胞外聚合物提取和测定EPS的提取采用热提取法[18],具体步骤如下:在搅拌阶段,从SBR中取40 mL污泥悬浮液,在4 ℃、4 000 g条件下离心15 min后弃去上清液,得到浓缩的活性污泥样品; 向活性污泥样品中加入70 ℃的NaCl溶液(0.05%)定容至40 mL,快速振荡摇匀1 min,然后在4 ℃、4 000 r·min-1条件下离心15 min,将上清液经0.45 μm醋酸纤维素膜过滤得到LB-EPS; 再用60 ℃的NaCl溶液(0.05%)补至原体积,快速振荡摇匀1 min,并将其置于60 ℃条件下水浴30 min,然后在4 ℃、4 000 r·min-1条件下离心15 min,将上清液经0.45 μm醋酸纤维素膜过滤得到TB-EPS。PS含量采用蒽酮比色法测定[18],PN含量采用改进的Folin-酚试剂法测定[19]。
1.4.2 傅里叶变换红外光谱分析LB-EPS和TB-EPS样品的红外光谱(FTIR)采用傅里叶变换红外光谱仪(Tensor 27,Bruker Optics,德国)测定。LB-EPS和TB-EPS提取液经过冷冻干燥处理后与干燥的光谱纯KBr按照1:100研磨混合,并于一定压力下保持若干分钟制成半透明薄片,在400~4 000 cm-1波数范围内扫描,检测器分辨率为4 cm-1。
1.4.3 X射线光电子能谱分析采用X射线光电子能谱仪(K-Alpha,Thermo Scientific,美国)分析样品中C、N、O、P及重金属Cu,激发源为Al Kα线,功率为150 W,工作时的基础真空为2.0×10-7 Pa,电子结合能用污染碳的C ls峰(284.6 eV)校正。采用XPS peak 4.1软件进行谱峰拟合。
2 结果与讨论 2.1 Cu2+对SBR性能的影响表 2为长期暴露条件下浓度为10 mg·L-1的Cu2+对SBR性能的影响。在进水Cu2+浓度为0 mg·L-1时,SBR经15天的运行达到稳定状态,COD和NH4+-N的去除率分别为(92.55±1.35)%和(98.67±0.50)%。随后,向SBR进水中持续加入10 mg·L-1 Cu2+。在SBR运行的第16~第55天,COD和NH4+-N去除率保持稳定; 而在第56~第75天,SBR对COD和NH4+-N的去除率降低,与进水Cu2+浓度为0 mg·L-1时相比SBR对COD和NH4+-N的平均去除率分别降低了3.88%和6.41%。进水Cu2+浓度为0 mg·L-1时,出水NO2--N和NO3--N浓度分别稳定在(0.69±0.29)和(4.90±0.18) mg·L-1。向SBR添加Cu2+后,随运行时间的延长,出水NO2--N浓度先升高后降低,而出水NO3--N浓度先降低后升高。上述结果与已有研究结果相似,在长期暴露条件下,Cu2+能抑制污泥中的硝化细菌活性,进而导致氨氮去除效率降低[1]。
|
|
表 2 Cu2+的长期暴露对SBR性能的影响 Table 2 Effect of Cu2+ on the SBR performance under long-term exposure |
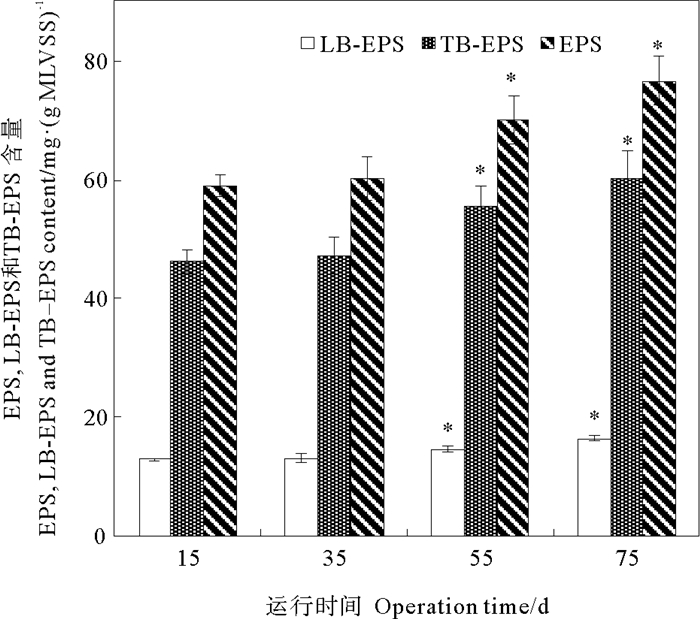
图 1为长期暴露条件下Cu2+对活性污泥EPS、LB-EPS和TB-EPS产量的影响。在进水Cu2+浓度为0 mg·L-1的第15天,SBR中活性污泥EPS、LB-EPS和TB-EPS含量分别为(58.95±1.76)、(12.80±0.16)和(46.16±1.91) mg·(g MLVSS)-1。向反应器中加入Cu2+后,当SBR运行至第35天时EPS、LB-EPS和TB-EPS含量与第15天相比无明显变化; 而随着运行时间的延长,活性污泥中EPS、LB-EPS和TB-EPS含量增加,当SBR运行至第75天时,EPS、LB-EPS和TB-EPS含量分别增加至(76.65±4.05)、(16.34±0.45)和(60.31±4.43) mg·(g MLVSS)-1,与第15天相比,分别增加了27.71%、30.67%和30.03%。上述实验结果表明,10 mg·L-1 Cu2+的长期作用能够刺激SBR中活性污泥产生更多EPS、LB-EPS和TB-EPS。随着运行时间的延长,活性污泥对Cu2+的吸附量逐渐增多。高浓度的Cu2+能干扰细胞的新陈代谢[1],进而对活性污泥产生毒性,微生物可以通过分泌更多EPS减少重金属对活性污泥中微生物的毒性[13-15]。Wang等[3]研究发现随着进水Cu2+浓度由10 mg·L-1逐渐升高至50 mg·L-1,SBR中活性污泥EPS产量逐渐升高; 而Liu等[8]发现向进水中持续添加5 mg·L-1 Cu2+,SBR中活性污泥EPS产量随运行时间延长而降低,可能是二者反应器运行方式和实验条件不同导致研究结果不同。
|
((“*”表示该样品与进水Cu2+浓度为0 mg·L-1时的EPS含量差异性显著(p < 0.05)。Asterisks indicate statistical differences (p < 0.05) from the EPS content at 0 mg·L-1 Cu2+.) ) 图 1 长期暴露条件下Cu2+对活性污泥EPS,LB-EPS和TB-EPS产量的影响 Fig. 1 Effect of Cu2+ on the EPS, LB-EPS and TB-EPS contents of activated sludge under long-term exposure |
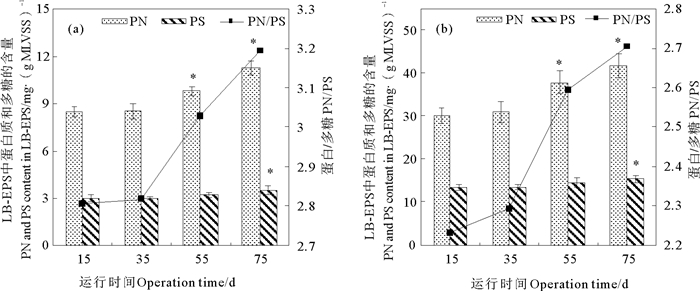
在长期暴露条件下10 mg·L-1Cu2+对活性污泥LB-EPS和TB-EPS中PN和PS含量的影响如图 2所示。在进水Cu2+浓度为0 mg·L-1的第15天,LB-EPS和TB-EPS中PN含量分别为(8.44±0.30)和(30.11±1.80) mg·(g MLVSS)-1。SBR进水中加入Cu2+后,当SBR运行至第35天时,LB-EPS和TB-EPS中PN含量与第15天相比无明显变化; 随SBR运行时间延长PN含量逐渐上升,当SBR运行至75天时,LB-EPS和TB-EPS中PN含量与第15天相比分别上升了33.14%和41.75% (p < 0.05)。在进水Cu2+浓度为0 mg·L-1时,LB-EPS和TB-EPS中PS含量分别为(3.01±0.24)和(13.49±0.59)mg·(g MLVSS)-1,随运行时间的延长LB-EPS和TB-EPS中PS含量轻微升高。SBR中添加Cu2+后,LB-EPS和TB-EPS中PN/PS均随SBR运行时间的延长而上升,分别由第15天时的2.81和2.23升高至第75天时的3.19和2.7。由上述结果可知,在长期暴露条件下10 mg·L-1 Cu2+促进活性污泥分泌蛋白质和多糖,并且蛋白质的增长量高于多糖的增长量。蛋白质的部分官能团可以和重金属离子络合以降低重金属对微生物的毒害作用,随着持续向进水中投加Cu2+,SBR中Cu2+浓度的积累可以刺激微生物通过调整自身的生理代谢活动分泌出更多的蛋白质与Cu2+络合[14, 20-21],这导致LB-EPS和TB-EPS中PN含量的增加。
|
(“*”表示该样品与进水Cu2+浓度为0 mg·L-1时的样品差异性显著(p < 0.05)。Asterisks indicate statistical differences (p < 0.05) from the PN or PS content at 0 mg·L-1 Cu2+. ) 图 2 Cu2+对LB-EPS(a)和TB-EPS(b)中蛋白质和多糖含量及蛋白质与多糖质量比的影响 Fig. 2 Effect of Cu2+ on the PN and PS contents and PN/PS in LB-EPS (a) and TB-EPS (b) |
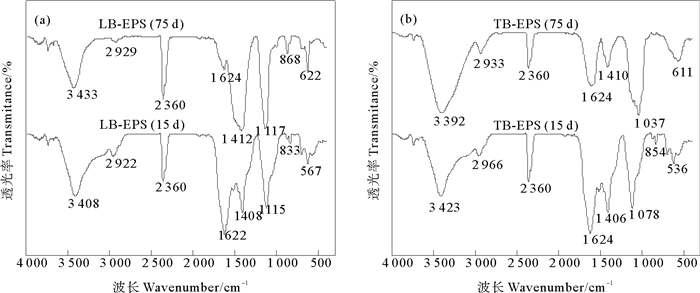
为了揭示Cu2+对活性污泥LB-EPS和TB-EPS官能团的影响,本研究考察了在第15天和75天时SBR中活性污泥LB-EPS和TB-EPS的FTIR光谱图变化情况(见图 3)。活性污泥LB-EPS和TB-EPS的FTIR光谱在3 392~3 433 cm-1处的谱峰可归属为蛋白质N-H键的伸缩振动和碳水化合物中O-H键的伸缩振动[22-23]。1 622~1 624 cm-1处的谱峰是由蛋白质二级结构中β-折叠的C=O伸缩振动形成的[24]。1 406~1 412 cm-1处的谱峰由蛋白类物质羧基中的C-O键伸缩振动造成[25]。1 037~1 117 cm-1处的谱峰由多糖类物质中的C-O键伸缩振动造成[26]。TB-EPS在吸附Cu2+后蛋白质中N-H键和碳水化合物中O-H键的伸缩振动向低波数移动31 cm-1,说明TB-EPS中蛋白质和多糖参与Cu2+的吸附,PN中N-H键和PS中O-H键的相当对含量减少。在加入Cu2+后,LB-EPS和TB-EPS中C=O键的吸收峰变钝,说明蛋白质吸附了大量的Cu2+,C=O键的相对含量减少; TB-EPS蛋白类物质羧基中C-O键吸收峰变弱,多糖类物质中的C-O键的吸收峰发生红移,说明Cu2+导致TB-EPS蛋白质和多糖中C-O键的相对含量减少。波长小于1 000 cm-1为指纹区,此吸附带的吸收峰与核酸中的磷酸盐有关[27]。进水中未加入Cu2+时,LB-EPS和TB-EPS分别在567和536 cm-1处出现吸收峰,而进水中加入Cu2+后,LB-EPS和TB-EPS在此处的吸收峰均发生蓝移。
|
图 3 Cu2+对LB-EPS(a)和TB-EPS(b)红外光谱的影响 Fig. 3 Effect of Cu2+ on the FTIR spectra of LB-EPS (a) and TB-EPS (b) |
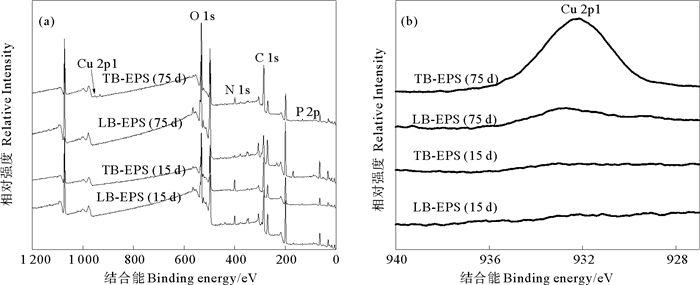
通过XPS测定了LB-EPS和TB-EPS的原子组成和百分含量。图 4为SBR运行至第15天和第75天时LB-EPS和TB-EPS的XPS全谱扫描图和Cu 2p1高分辨谱图。表 3为Cu2+作用下活性污泥LB-EPS和TB-EPS的XPS能谱参数。LB-EPS和TB-EPS在284.8、399.4~400、531.1~531.3和132.2~133.6 eV处均有峰,分别对应C 1s、N 1s、O 1s和P 2p。LB-EPS中总C百分含量由第15天时的47.7%下降至第75天时的24.0%,TB-EPS中总C百分含量无明显变化; LB-EPS和TB-EPS中N百分含量分别由第15天时的7.4%和10.2%下降至第75天时的2.6%和4.7%;LB-EPS和TB-EPS中O百分含量分别由第15天时的36.8%和30.3%增加至55.8%和36.2%;LB-EPS中P百分含量由第15天时的0.7%升高至第75天时的1.0%,TB-EPS中P百分含量变化不明显。根据已有报道可知,元素N与蛋白质中含氮基团相关,例如胺基(或酰胺基)[28-30],这与EPS红外光谱中相应的吸附带变化情况一致。与进水中未加入Cu2+时相比,进水中添加Cu2+后的LB-EPS和TB-EPS分别在932.3和932.3 eV处出现明显峰(见图 4(b)),且Cu的百分含量分别由第15天时的0.2%和0.2%增加至第75天时的0.6%和0.5%。相关报道指出EPS能吸附重金属[13-14],因此加入Cu2+后LB-EPS和TB-EPS中Cu百分含量升高。由表 3可知,在进水中未加入Cu2+时,LB-EPS中元素百分含量大小顺序为C>O>N。与未加Cu2+相比,进水中加入Cu2+后,LB-EPS中元素百分含量大小顺序为O>C>N。
|
图 4 Cu2+作用下LB-EPS和TB-EPS的XPS全谱扫描图(a)和Cu 2p1高分辨谱图(b) Fig. 4 XPS wide survey scans (a) and Cu 2p1 XPS spectra (b) of LB-EPS and TB-EPS under Cu2+ stress |
|
|
表 3 Cu2+作用下活性污泥LB-EPS和TB-EPS的XPS能谱参数 Table 3 Binding energies, atomic percentage and assignments of XPS spectral bands of LB-EPS and TB-EPS under Cu2+ stress |
图 5和6分别为C和O两种元素的XPS高分辨图谱。由于不同的结合能对应着不同的化学信息,因此通过对高分辨图谱的分析可以深入了解EPS的组成情况。由图 5和表 3可知,在进水中未加入Cu2+时,LB-EPS和TB-EPS中C可以分为4个峰:284.4 eV处的峰是C-(C, H)峰,为脂类或者氨基酸侧链; 284.9~285.2 eV处的峰为C-(O, N),为酰胺、醇或醚胺基; 286.0~286.4 eV处的C=O或O-C-O峰,来自羧酸盐、羰基、酰胺、缩醛或半缩醛; 287.8~288.2 eV处的O=C-OH峰来自羧酸和尿酸的羧基或酯基[31-32]。与第15天相比,LB-EPS和TB-EPS中C-(C, H)峰的结合能均降低,其在总C中的百分含量分别降低了23.7%和9.2%;同样,O=C-OH的百分含量分别降低了2.9%和1.1%;LB-EPS和TB-EPS中C-(O, N)的百分含量分别升高了14.4%和18.9%,而LB-EPS和TB-EPS中C=O或O-C-O百分含量分别升高了11.3%和下降了8.6%。由图 6和表 3可知,LB-EPS和TB-EPS中O可以分为2个峰,C=O(530.8~530.9 eV),O-C-O或O-C-H(531.9~532.2 eV)[30-31]。当进水中Cu2+浓度为10 mg·L-1后,与进水Cu2+浓度为0 mg·L-1时相比,LB-EPS和TB-EPS中C=O结合能均下降了0.4 eV,而LB-EPS和TB-EPS中O-C-O(或C-OH)的结合能分别下降0.3 eV和0.5 eV; LB-EPS和TB-EPS中C=O百分含量分别下降了21.6%和25.7%,而LB-EPS和TB-EPS中O-C-O(或C-OH)的百分含量则分别上升了21.6%和25.7%。C和O基团结合能的改变表明EPS与Cu2+相互作用伴随着电荷转移,说明羟基和羧基参与了与Cu2+的相互作用。基团百分含量的变化表明添加Cu2+后EPS的组成成分发生改变。
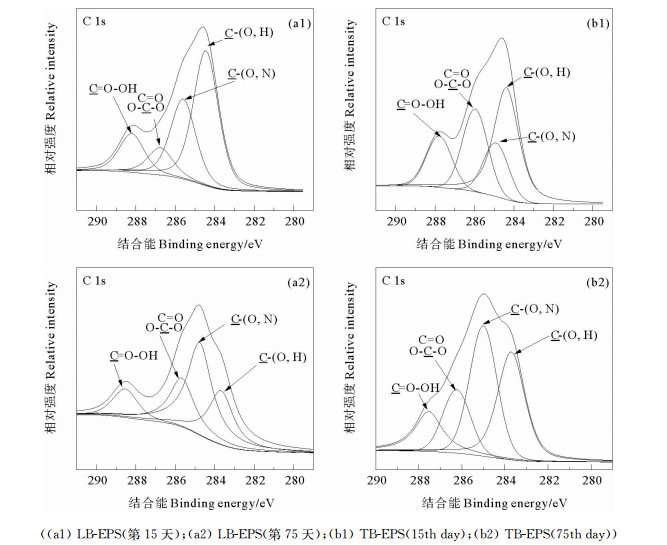
|
图 5 LB-EPS和TB-EPS中C 1s高分辨图谱 Fig. 5 High resolution C 1s XPS spectra of LB-EPS and TB-EPS |

|
图 6 LB-EPS和TB-EPS中O1s的高分辨图谱 Fig. 6 High resolution O1s XPS spectra of LB-EPS and TB-EPS |
(1) 进水中Cu2+浓度为10 mg·L-1后,SBR运行的第16~第55天,COD和NH4+-N的去除率无明显变化。随着运行时间的延长SBR对COD和NH4+-N的去除率降低,在第56~第75天,SBR对COD和NH4+-N的平均去除率与进水Cu2+浓度为0 mg·L-1时相比分别降低了3.88%和6.41%。
(2) 在10 mg·L-1Cu2+长期暴露条件下,活性污泥中EPS、LB-EPS和TB-EPS产量及LB-EPS和TB-EPS中PN均随运行时间的延长而升高。
(3) FTIR分析表明,长期暴露条件下10 mg·L-1Cu2+导致TB-EPS中PN的C=O键、N-H键和C-O键相对含量降低。
(4) XPS能谱分析结果表明,在10 mg·L-1Cu2+长期作用下,LB-EPS和TB-EPS中元素Cu和O含量增加。
| [1] |
Ochoa-Herrera V, León G, Banihani Q, et al. Toxicity of copper (Ⅱ) ions to microorganisms in biological wastewater treatment systems[J]. Science of the Total Environment, 2011, 412-413: 380-385.
(  0) 0) |
| [2] |
Dupont C L, Grass G, Rensing C. Copper toxicity and the origin of bacterial resistance-new insights and applications[J]. Metallomics, 2011, 3: 1109-1118.
(  0) 0) |
| [3] |
Wang S, Gao M C, Wang Z C, et al. The effects of divalent copper on performance, extracellular polymeric substances and microbial community of an anoxic-aerobic sequencing batch reactor[J]. RSC Advances, 2015, 5: 30737-30747.
(  0) 0) |
| [4] |
Khor S M, Ng S L, Lim P E, et al. The effects of nickel (Ⅱ) and chromium (Ⅵ) on oxygen demand, nitrogen and metal removal in a sequencing batch reactor[J]. Environonmental Technology, 2011, 32(16): 1903-1914.
(  0) 0) |
| [5] |
Wang X H, Gai L H, Sun X F, et al. Effects of long-term addition of Cu (Ⅱ) and Ni (Ⅱ) on the biochemical properties of aerobic granules in sequencing batch reactors[J]. Applied Microbiology and Biotechnology, 2010, 86: 1967-1975.
(  0) 0) |
| [6] |
Ong S A, Lim P E, Seng C E. Effects of adsorbents and copper (Ⅱ) on activated sludge microorganisms and sequencing batch reactor treatment process[J]. Journal of Hazardous Materials, 2003, 103: 263-277.
(  0) 0) |
| [7] |
Jiang R X, Sun S J, Wang K, et al. Impacts of Cu (Ⅱ) on the kinetics of nitrogen removal during the waste water treatment process[J]. Ecotoxicology and Environmental Safety, 2013, 98: 54-58.
(  0) 0) |
| [8] |
Liu X T, Yin H, Tang S Y, et al. Effects of single and combined copper/perfluorooctane sulfonate on sequencing batch reactor process and microbial community in activated sludge[J]. Bioresource Technology, 2017, 238: 407-415.
(  0) 0) |
| [9] |
Liu Y, Fang H H P. Influences of extracellular polymeric substances (EPS) on flocculation, settling, and dewatering of activated sludge[J]. Critical Reviews in Environmental Science and Technology, 2003, 33(3): 237-273.
(  0) 0) |
| [10] |
Yang S F, Li X Y. Influence of extracellular polymeric substances (EPS) on the characteristics of activated sludge under non-steady-state conditions[J]. Process Biochemistry, 2009, 44(1): 91-96.
(  0) 0) |
| [11] |
Comte S, Guibaud G, Baudu M. Biosorption properties of extracellular polymeric substances (EPS) towards Cd, Cu and Pb for different pH values[J]. Journal of Hazardous Materials, 2008, 151(1): 185-193.
(  0) 0) |
| [12] |
Liu H, Fang H H P. Characterization of electrostatic binding sites of extracellular polymers by linear programming analysis of titration data[J]. Biotechnology and Bioengineering, 2002, 80(7): 806-811.
(  0) 0) |
| [13] |
Li J, Liu X, Liu Y, et al. The effect of continuous exposure of copper on the properties and extracellular polymeric substances (EPS) of bulking activated sludge[J]. Environmental Science and Pollution Research, 2011, 18: 1567-1573.
(  0) 0) |
| [14] |
Sheng G P, Xu J, Luo H W, et al. Thermodynamic analysis on the binding of heavy metals onto extracellular polymeric substances (EPS) of activated sludge[J]. Water Research, 2013, 47: 607-614.
(  0) 0) |
| [15] |
Sun X F, Wang S G, Zhang X M, et al. Spectroscopic study of Zn2+ and Co2+ binding to extracellular polymeric substances (EPS) from aerobic granules[J]. Journal of Colloid and Interface Science, 2009, 335(1): 11-17.
(  0) 0) |
| [16] |
Ma Y P, Yuan D L, Mu B L, et al. Reactor performance, biofilm property and microbial community of anaerobic ammonia-oxidizing bacteria under long-term exposure to elevated Cu (Ⅱ)[J]. International Biodeterioration & Biodegradation, 2018, 129: 156-162.
(  0) 0) |
| [17] |
国家环境保护总局, 水和废水监测分析方法编委会. 水和废水监测分析方法[M]. 第四版. 北京: 中国环境科学出版社, 2002. Chinese NEPA. Water and Wastewater Monitoring Methods[M]. Fourth ed. Beijing, China: Chinese Environmental Science Publishing Press, 2002. (  0) 0) |
| [18] |
Li X Y, Yang S F. Influence of loosely bound extracellular polymeric substances (EPS) on the flocculation, sedimentation and dewaterability of activated sludge[J]. Water Research, 2007, 41: 1022-1030.
(  0) 0) |
| [19] |
Frølund B, Palmgren R, Keiding K, et al. Extraction of extracellular polymers from activated sludge using a cation exchange resin[J]. Water Research, 1996, 30(8): 1749-1758.
(  0) 0) |
| [20] |
Hou W, Ma Z, Sun L, et al. Extracellular polymeric substances from copper-tolerance Sinorhizobium meliloti immobilize Cu2+[J]. Journal of Hazardous Materials, 2013, 261: 614-620.
(  0) 0) |
| [21] |
Sheng G P, Yu H Q, Yue Z B. Production of extracellular polymeric substances from Rhodopseudomonas acidophila in the presence of toxic substances[J]. Applied Microbiology and Biotechnology, 2005, 69: 216-222.
(  0) 0) |
| [22] |
Ramesh A, Lee D J, Hong S G. Soluble microbial products (SMP) and soluble extracellular polymeric substances (EPS) from wastewater sludge[J]. Applied Microbiology and Biotechnology, 2006, 73: 219-225.
(  0) 0) |
| [23] |
Sun X F, Ma Y, Liu X W, et al. Sorption and detoxification of chromium(Ⅵ) by aerobic granules functionalized with polyethylenimine[J]. Water Research, 2010, 44: 2517-2524.
(  0) 0) |
| [24] |
Wang Z, Wu Z, Yin X, et al. Membrane fouling in a submerged membrane bioreactor (MBR) under sub-critical flux operation: Membrane foulant and gel layer characterization[J]. Journal of Membrane Science, 2008, 325: 238-244.
(  0) 0) |
| [25] |
Pongjanyakul T, Puttipipatkhachorn S. Xanthan-alginate composite gel beads: Molecular interaction and in vitro characterization[J]. International Journal of Pharmaceutics, 2007, 331: 61-71.
(  0) 0) |
| [26] |
Zhu L, Lv M L, Dai X, et al. The stability of aerobic granular sludge under 4-chloroaniline shock in a sequential air-lift bioreactor (SABR)[J]. Bioresource Technology, 2013, 140: 126-130.
(  0) 0) |
| [27] |
Guibaud G, Tixier N, Bouju A, et al. Relation between extracellular polymer's composition and its ability to complex Cd, Cu and Pb[J]. Chemosphere, 2003, 52: 1701-1710.
(  0) 0) |
| [28] |
Wang Z C, Gao M C, Wang S, et al. Effect of hexavalent chromium on extracellular polymeric substances of granular sludge from an aerobic granular sequencing batch reactor[J]. Chemical Engineering Journal, 2014, 251: 165-174.
(  0) 0) |
| [29] |
Badireddy A R, Chellam S, Gassman P L, et al. Role of extracellular polymeric substances in bioflocculation of activated sludge microorganisms under glucose-controlled conditions[J]. Water Research, 2010, 44: 4505-4516.
(  0) 0) |
| [30] |
Omoike A, Chorover J. Spectroscopic study of extracellular polymeric substances from Bacillus subtilis: Aqueous chemistry and adsorption effects[J]. Biomacromolecules, 2004, 5: 1219-1230.
(  0) 0) |
| [31] |
Ma B R, Li S S, Wang S, et al. Effect of Fe3O4 nanoparticles on composition and spectroscopic characteristics of extracellular polymeric substances from activated sludge[J]. Process Biochemistry, 2018, 75: 212-220.
(  0) 0) |
| [32] |
柴德芳, 宋萍, 申露文, 等. Aeromonas veronii N8不同类型胞外聚合物的性质及其Zn2+吸附特征[J]. 环境科学学报, 2016, 36(10): 3665-3674. Chai D F, Song P, Shen L W, et al. The properties of extracelluar polymeric substances of Aeromonas veronii N8 and its adsorption for Zn2+[J]. Acta Scientiae Circumstantiae, 2016, 36(10): 3665-3674. (  0) 0) |
2. Haibohe Municipal Wastewater Treatment Plant, Qingdao 266021, China;
3. College of Environmental Science and Engineering, Ocean University of China, Qingdao 266100, China
 2020, Vol. 50
2020, Vol. 50


