2. 青岛明朗环境工程有限公司,山东 青岛 266061
苯胺黑染料是指分子结构中含有苯环的黑色染料,它是以苯胺和硝基苯为原料, 在三氯化铁为催化剂的条件下制备的[1]。苯胺黑广泛用于棉织物的染色和印花,还作为重要的化工染料广泛应用于塑料、胶木粉、电木粉、皮鞋油和油墨的着色。苯胺黑具有结构稳定、着色后不易褪色的特点,而且在环境中的滞留期比较长[2],所以苯胺黑染料废水是一种难处理的工业废水,依靠常规物理法、化学法和生物法处理工艺很难达到理想效果[3]。在国家水污染物排放要求日趋严格的形势下,探讨和寻求新的染料废水的高效处理方法,对防止染料废水的环境污染,促进染料行业可持续发展具有重要意义[4-7]。
对含有难降解有机物的废水来说,高级氧化技术由于其所特有的优良的氧化性能, 越来越引起广泛的重视[8-11]。臭氧作为高级氧化技术中常用的氧化剂,溶于水中能产生具有强氧化性的羟基自由基,利用其强氧化性氧化分解废水中的难降解有机物,降低出水COD浓度,提高废水可生化性的同时破坏染料废水中染料的发色或助色基团,从而起到脱色效果[12-17]。先前的研究表明,单独臭氧氧化是以直接氧化为主,分子臭氧的直接氧化具有很强的选择性,而且直接反应的氧化速度较慢, 氧化效率不高,因此单独臭氧氧化在实际应用中受到限制[18]。近年来, 臭氧氧化技术有了新的发展, 主要表现在应用各种催化方法强化臭氧氧化单元的氧化能力及臭氧氧化技术与其他技术的联合使用来提高臭氧的分解速率, 使臭氧氧化过程以间接氧化为主, 提高臭氧的氧化效果。王璐[19]采用臭氧和均相催化臭氧氧化技术对分散染料废水进行处理,结果表明,在一定的投加量范围,Mn2+、Fe2+、Co2+、Ni2+对分散染料废水的臭氧氧化反应均有催化作用,在弱碱性条件下,Fe2+、Co2+的催化氧化作用更强。石岩等[20]对三种偶氮染料的研究发现比仅用O3,O3/UV法对偶氮染料的降解速率快一倍多。I. Arslan[21]采用Fe 2+催化臭氧氧化法对分散染料废水进行了处理, 结果表明, 当臭氧投加质量浓度为2 300 mg/L、Fe 2+应用剂量为0.09~18 mmol/L、废水的pH为3~13时, 脱色率、COD的去除率分别由单独臭氧氧化时的77%提高至97%,11%提高到54%。目前臭氧处理染料废水相关的研究对象大多为模拟染料废水或单一染料组分,对实际染料行业或印染行业废水的应用报道较少。
臭氧氧化法处理实际染料行业仅用单一方法不能得到很好的处理效果。考虑到实际染料废水组分复杂,水质多变的特点,结合已有研究进展,本实验采用均相催化臭氧氧化与生物处理联用的方法,开展苯胺黑染料废水深度处理实验,研究不同催化剂对臭氧氧化苯胺黑废水的催化效果,探讨均相催化臭氧氧化联用活性污泥法深度处理苯胺黑染料废水的可行性以及关键运行条件,为实际苯胺黑染料废水处理提供技术参考。
1 材料与方法 1.1 试验用水苯胺黑染料废水取自青岛某染料厂废水处理系统的二沉池出水,水质各项指标(平均值)如表 1所示。其中废水pH为8.90。
|
|
表 1 试验废水水质指标 Table 1 Characteristics of wastewater |
试验装置如图 1所示。具体试验步骤如下:
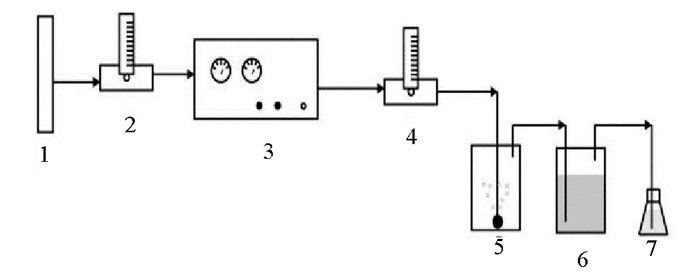
|
(1.氧气罐;2.气体流量计;3.臭氧发生器;4.气体流量计;5.反应罐;6.吸收罐;7.安全瓶。1.Oxygen tank;2.Gas flowmeter;3.Ozone generator;4.Gas flowmeter;5.Reaction tank;6.Tourill;7.Safety flack.) 图 1 臭氧氧化实验装置 Fig. 1 Ozone oxidation experimental apparatus |
(1) 对臭氧反应罐用去离子水进行清洗,在反应罐内加入1 L待处理的染料废水溶液;(2)打开臭氧发生器(以纯氧为气源),先排空1 min左右,待气相中臭氧浓度稳定后,将含臭氧的气体以稳定的气速切入反应罐中,反应液中出现气泡,以此为反应开始,并计时。试验过程中臭氧发生量为10 g/h,臭氧进气量为0.4 m3/h;(3)臭氧氧化实验:单独臭氧氧化实验主要考察不同pH条件下处理效果。二沉池染料废水的pH值为8.90,将pH值调成2、4、6、8、10后分别进行臭氧氧化处理。在反应罐通入臭氧0、5、10、15、20、25、30 min时分别取水样分析测定COD、苯胺、色度、pH等指标。均相催化臭氧氧化实验中,废水使用未调pH的原水1 L, 在废水中分别投加30 mg/L的Cu2+、Fe2+和Mn2+, 然后通入臭氧。在接触臭氧5、10、15、20、25、30 min时取样分析COD、苯胺和色度,并与臭氧单独氧化时进行了比较;(4)后续生物处理实验:利用前面均相催化臭氧氧化处理水,继续开展生物处理。在圆柱型反应器(有效容积1 L)内,接种青岛某染料厂废水处理系统曝气池污泥,污泥MLSS浓度约为3 000 mg/L,投加废水1 L,进行连续曝气,每1 h取样,经沉淀后取上清液测定CODCr和氨氮浓度。实验温度保持25 ℃左右,反应器中DO能够达到3~4 mg/L。
每次进行生物处理前需要将臭氧氧化处理的染料废水静置一天,让水中的臭氧散发,以确保臭氧不会影响活性污泥微生物。
1.3 分析方法分析项目包括pH、CODCr、氨氮、苯胺和色度。其中pH采用离子电极法,CODCr采用重铬酸钾法测定,氨氮采用水杨酸分光光度法、苯胺采用N-(1-萘基)乙二胺偶氮分光光度法、色度采用稀释倍数法测定。
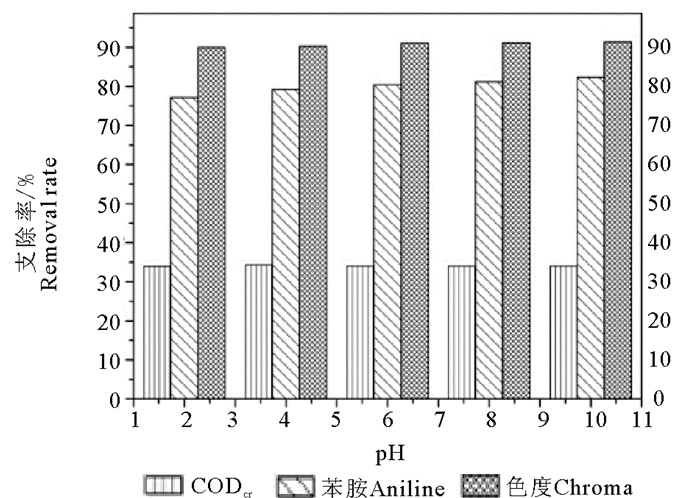
2 结果与讨论 2.1 废水pH值对单独臭氧氧化的影响由图 2可知,CODCr的去除率在pH值为2、4和6时,分别为34%,34.3%和34.0%,基本稳定在34%左右。结果表明,在酸性条件下,臭氧氧化可以部分去除此类染料废水中的CODCr。随着pH值的增加,CODCr的去除率有所增加,由酸性时的34%左右增加到40%左右,在pH值为10时,CODCr的去除率达到41.1%。不同pH条件下臭氧单独氧化对苯胺的去除趋势也雷同。在实验设计的5种pH值条件下,单独臭氧氧化染料废水苯胺的去除率都高于75%,臭氧氧化30 min时苯胺的浓度均下降到0.7 mg/L以下;碱性条件下苯胺去除率随着pH值的增大由77.2%增加到82.3%,增加幅度比较小。可见pH值对此类染料废水苯胺的去除效果影响比较小。在酸性条件下,臭氧直接氧化,对氧化有机物的选择性很强,对一些有机物不能氧化,所以去除率比较低;在碱性条件下,可以促进·OH的生成,·OH具有很强的氧化性,并且·OH氧化有机物没有选择性,可以很快的去除有机物,所以提高了CODCr和苯胺的去除率。但是仅仅因为碱性单方面条件,促进产生的·OH还是有限的,所以CODCr去除率增加幅度有限。这说明要提高CODCr的去除率,应考虑其他因素来增加·OH产生。
|
图 2 单独臭氧氧化、不同pH值时CODCr、苯胺和色度去除率 Fig. 2 Removal efficiency of CODCr, aniline and chroma in ozonation alone at different value of pH |
由图 2可知,在单独臭氧氧化染料废水时,色度的去除效果最好,不同pH条件下都在90%以上,明显高于CODCr和苯胺的去除效果,并且从图中可以看出pH值的大小对色度的去除几乎没有影响,在臭氧单独氧化处理染料废水30 min后,臭氧对色度的去除率都达到94%。
2.2 均相催化臭氧氧化实验结果原试验用染料废水的pH值范围在8~9,为碱性溶液,从单独臭氧氧化实验结果来看,偏碱性条件下臭氧氧化处理效果好。为了节省处理成本,后续均相催化臭氧氧化实验中对对原水不进行pH值调节。从前一段单独臭氧处理实验结果看出,CODCr和色度去除率有待进一步提高。本阶段采用三种金属离子催化剂,考察CODCr浓度和色度变化,研究了其对臭氧氧化反应的促进效果,结果如下。
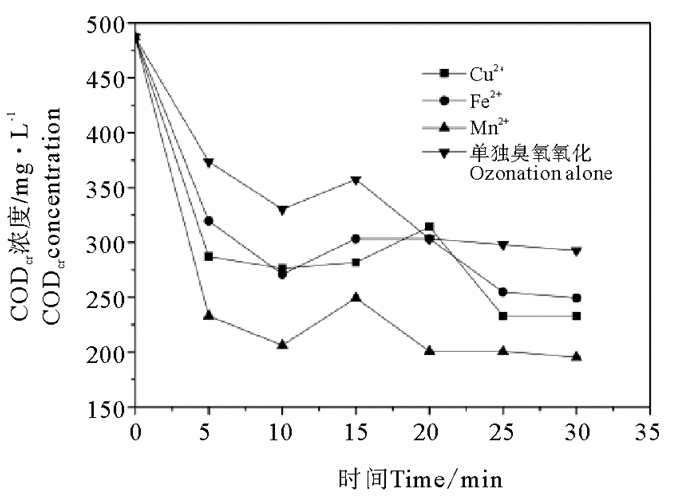
2.2.1 CODCr去除效果分析图 3表示Cu2+、Fe2+、Mn2+三种金属离子均相催化臭氧氧化废水时CODCr浓度变化。由图 3可以明显的看出Mn2+催化臭氧氧化废水时CODCr去除效果最好,Mn2+催化臭氧氧化废水时的CODCr的去除率远远高于其他两种离子。通入臭氧20 min时,CODCr的浓度从490 mg/L下降到200 mg/L左右,去除率基本趋于稳定,达到59.1%。
|
图 3 均相催化臭氧氧化时废水CODCr浓度变化 Fig. 3 The concentration variation of CODCr under homogeneous catalysis of different ions |
Fe2+和Cu2+两种金属离子催化臭氧氧化染料废水时,CODCr去除效果相似,Fe2+催化臭氧氧化染料废水CODCr的去除率达到44.8%,略大于Cu2+,低于Mn2+。三种离子都能起到催化臭氧氧化染料废水的效果,对CODCr的处理都比单独臭氧氧化时效果好。因为金属离子催化臭氧氧化,催化产生·OH,而羟基自由基对于有机物的反应速率非常快,基本都在105~108 mol·s-1,并且对有机物的反应几乎没有选择性,可以大幅度提升反应速率。由图 3可以看出,不同臭氧氧化条件下随着时间的增加CODCr浓度不是一直减少,在10 min左右时有个短暂上升过程,这是因为苯胺黑废水中有一部分很难降解的有机物,臭氧氧化时间过短,不足以将这部分难降解的有机物降解,在通入臭氧时间为10 min时才开始发生降解,降解为小分子有机物导致CODCr浓度短暂上升。
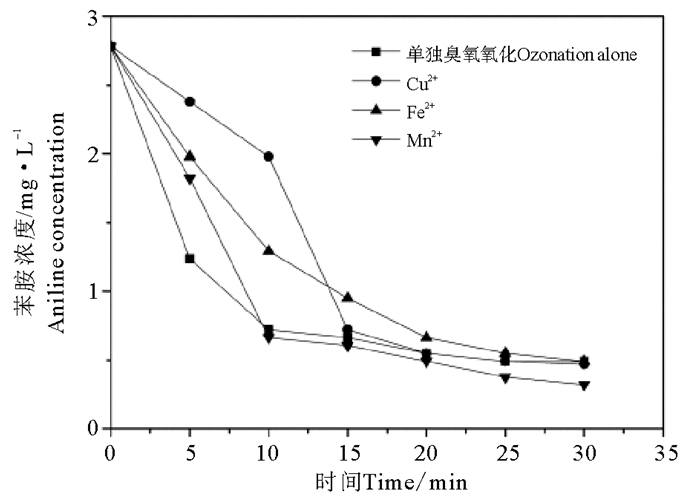
2.2.2 苯胺去除效果分析图 4显示单独臭氧氧化和Fe2+、Mn2+、Cu2+三种金属离子均相催化臭氧氧化时苯胺浓度的变化规律。由图看出单独臭氧氧化30 min时苯胺的浓度由2.73 mg/L下降到0.5 mg/L,去除率最高达到82%。臭氧氧化苯胺的降解途径一般认为是首先苯胺被分解为对亚胺醌,随后再发生一系列水解和氧化分解生成中间产物,最后只有部分有机物矿化为二氧化碳和水[22]。
|
图 4 均相催化臭氧氧化时苯胺浓度变化 Fig. 4 The concentration variation of aniline under ozonation alone and homogeneous catalysis of different ions |
在Cu2+、Fe2+、Mn2+这三种金属离子催化臭氧处理时,苯胺的浓度都逐步下降,在20 min后都趋于稳定。比较单独臭氧氧化,Cu2+、Fe2+离子的催化氧化效果不明显,在接触臭氧30 min时苯胺浓度基本相同,Mn2+催化效果相对明显,在接触臭氧20 min以后其对苯胺的去除率高于其他三种情况,最高达90.5%。
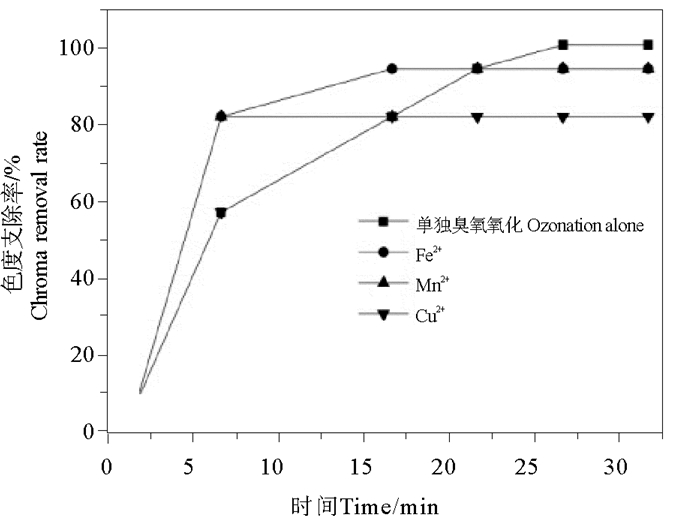
2.2.3 脱色效果分析由图 5可以看出,单独臭氧氧化时色度去除率最高可达到94%左右,而在Fe2+、Mn2+、Cu2+这三种金属离子催化剂条件下色度去除率变化趋势基本一致,在15 min都达到色度去除率的最大值,三种条件下Cu2+催化臭氧氧化染料废水对色度的去除率相对比较低,仅达到75%。而Mn2+和Fe2+两种金属催化条件下,色度的去除率最大达到87.5%。与单独臭氧氧化色度的去除率94%相比可知,Fe2+、Mn2+、Cu2+这三种催化剂催化臭氧氧化条件下色度的去除率都低于单独臭氧氧化染料废水时色度的去除率,原因是这三种金属离子在溶液中都是显色溶液,所以增加了原染料废水中的色度值,从而降低了色度的去除效率。因此,后续有必要研究既能稳定提高色度去除率,又能避免金属离子溶液显色效应的技术手段。
|
图 5 均相催化臭氧氧化时色度去除率 Fig. 5 Removal efficiency of chroma under homogeneous catalysis of different ions |
从上述催化臭氧氧化处理结果来看,处理后的色度和苯胺浓度均满足一级排放标准,无需再进行生物处理,而处理后CODCr浓度基本满足二级排放标准,但不能稳定达标,有必要采取保障措施。本研究中将Mn2+催化臭氧氧化处理后的染料废水继续用活性污泥法进行进一步深度处理。在废水好氧生物处理中曝气时间是影响处理效率的一个最基本的因素,曝气时间的长短直接影响到有机物降解的程度和硝化进程。曝气量充足的情况下,生物反应器连续曝气运行10 h过程中废水COD和氨氮浓度变化如表 2所示。
|
|
表 2 不同曝气时间下的CODCr、氨氮浓度变化 Table 2 CODCr and NH4+-N concentration with aeration time |
由表 2可以看出,在曝气时间为1~5 h时,CODCr和氨氮去除率缓慢增加,在6 h后分别稳定在65%和78%左右。由此可见最佳曝气时间为6 h,此时生物处理出水的CODCr低于72 mg/L、氨氮低于0.8 mg/L,可满足染料废水排放相关的一级标准。
3 结论(1) 单独臭氧氧化处理苯胺黑染料废水时,碱性条件下处理效果优于酸性条件,在pH值为10时,CODCr、苯胺和色度去除率分别达到41.1%、82.3%和94%。
(2) 在金属离子均相催化臭氧氧化染料废水时,比较了单独臭氧氧化和分别用Cu2+,Fe2+和Mn2+进行30 min催化反应,单独臭氧氧化和三种金属离子催化氧化去除CODCr能力为Mn2+>Fe2+>Cu2+>单独臭氧氧化,去除苯胺的能力为Mn2+>单独臭氧氧化>Cu2+>Fe2+;Mn2+催化臭氧条件下可以高效的去除CODCr和苯胺,去除率分别为59.1%,90.5%;Mn2+和Fe2+对色度的去除率均为87.5%,高于Cu2+的催化脱色效果,均低于臭氧单独氧化时色度的去除。
(3) 在最佳催化剂条件下催化臭氧氧化染料废水,将处理后的染料废水继续用活性污泥法进行深度处理,确定污泥浓度为3 000 mg/L时最佳曝气时间为6 h,出水CODCr浓度小于72 mg/L、氨氮浓度小于0.8 mg/L,达到染料废水排放的一级标准。
| [1] |
王守恒, 王爱群. 醇溶苯胺黑生产废水中苯胺的回收[J]. 化学工业与工程技术, 2009(3): 48-50. Wang S H, Wang A Q. The production of anilinein waste water recycling in Alcohol soluble aniline black[J]. Chemical Industry and Engineering Technology, 2009(3): 48-50. (  0) 0) |
| [2] |
张宇峰, 滕洁, 张雪英, 等. 染料废水处理技术的研究进展[J]. 工业水处理, 2003(4): 23-27. Zhang Y F, Teng H, Zhang X Y. The research progress of dye wastewater treatment technology[J]. Industrial Water Conditioning, 2003(4): 23-27. DOI:10.11894/1005-829x.2003.23(4).23 (  0) 0) |
| [3] |
李长江, 张磊, 赵永柱, 等. 臭氧氧化法深度处理二沉池出水实验研究[J]. 市政技术, 2013(4): 137-139. Zhang C J, Zhang L, Zhao Y Z. Experimental study on advanced treatment of two settling tank effluent by ozone oxidation[J]. Municipal Technology, 2013(4): 137-139. (  0) 0) |
| [4] |
李丽芳, 汪林, 张炜铭, 等. 高级氧化法处理光引发剂生产废水[J]. 化工环保, 2017(1): 8-12. Li L F, Sun J, Zhang W M. Advanced oxidation treatment of light initiator production wastewater[J]. Environmental Protection of Chemical Industry, 2017(1): 8-12. (  0) 0) |
| [5] |
朱虹, 孙杰, 李建超. 印染废水处理技术[M]. 北京: 中国纺织出版社, 2004. Zhu H, Sun J, Li J C. Printing and Dyeing Wastewater Treatment Technology[M]. Beijing: China Textile Press, 2004. (  0) 0) |
| [6] |
Yousuf A M, Robert S, Jose R, et al. Electro coagulation(EC)-science and applications[J]. Journal of Hazardous Materials B, 2001(84): 29-41.
(  0) 0) |
| [7] |
Chen Guoha. Electro chemical technologies in wastewater treatment[J]. Separation and Purification Technology, 2004(38): 11-41.
(  0) 0) |
| [8] |
胡俊生, 李春荣, 徐志荣, 等. UV/H2O2法降解水中阴离子表面活性剂[J]. 沈阳建筑大学学报:自然科学版, 2007, 23(4): 639-642. Hu J S, Li C R, Xu Z R. The degradation of anionic surfactant by UV/H2O2[J]. Journal of Shenyang Architectural University: Natural Science Edition, 2007, 23(4): 639-642. (  0) 0) |
| [9] |
胡俊生, 徐志荣, 李春荣, 等. 水体中对氯苯酚的电化学降解研究[J]. 沈阳建筑大学学报:自然科学版, 2007, 23(5): 822-825. Hu J S, Xu Z R, Xu Z R. Chlorine for electrochemical degradation of phenol in water[J]. Journal of Shenyang Architectural University: Natural Science Edition, 2007, 23(5): 822-825. (  0) 0) |
| [10] |
Plant L, Jeff M. Hydrogen peroxide: a potent force to Destroy organic in wastewater[J]. Chem Eng, 1994(101): 16-20.
(  0) 0) |
| [11] |
Sundstrom D W, Weir B A, Barber T A, et al. Destruction of pollutants and microorganism sin water by UV light and hydrogen peroxide[J]. Wat Pollut Res J Canada, 1992, 27(1): 57-68.
(  0) 0) |
| [12] |
史惠祥, 赵伟荣, 汪大翚. 偶氮染料的臭氧氧化机理研究[J]. 浙江大学学报(工学版), 2003, 37(6): 734-738. Shi Huixiang, Zhao Weirong, Wang Dajun. Ozone oxidation mechanism of azo dye[J]. Journal of Zhejiang University (Engineering Science), 2003, 37(6): 734-738. (  0) 0) |
| [13] |
Chen T Y, Kao C M, Hong A, et al. Application of ozone on the decolorization of reactive dyes-Orange-13 and Blue-19[J]. Desalination, 2009, 249(3): 1238-1242. DOI:10.1016/j.desal.2008.10.032
(  0) 0) |
| [14] |
Wu J N, Doan H, Upreti S. Decolorization of aqueous textile reactive dye by ozone[J]. Chemical Engineering Journal, 2008, 142(2): 156-160. DOI:10.1016/j.cej.2007.11.019
(  0) 0) |
| [15] |
Thrhan K, Durukan I, Ozturkcan S A, et al. Decolorization of textile basic dye in aqueous solution by ozone[J]. Dyes and Pigments, 2012, 92(3): 897-901. DOI:10.1016/j.dyepig.2011.07.012
(  0) 0) |
| [16] |
Bagha A R T, Mahmoodi N M, Menger F M. Degradation of a persistent organic dye from colored textile wastewater by ozonation[J]. Desalination, 2010, 260(1-3): 34-38. DOI:10.1016/j.desal.2010.05.004
(  0) 0) |
| [17] |
Khadhraoui M, Trabelsi H, Ksibi M, et al. Discoloration and detoxicification of a congo red dye solution by means of ozone treatment for a possible water reuse[J]. Journal of Hazardous Materials, 2009, 161(2-3): 974-981. DOI:10.1016/j.jhazmat.2008.04.060
(  0) 0) |
| [18] |
马龙, 王雅洁, 杨成. 废水高级氧化技术研究现状与发展[J]. 环境工程, 2016(6): 52-55. Ma L, Wang Y J, Yang C. Research status and development of advanced oxidation technology for wastewater[J]. Environmental Engineering, 2016(6): 52-55. (  0) 0) |
| [19] |
王璐. 均相催化臭氧氧化处理分散染料废水的研究[D]. 上海: 东华大学, 2012. Wang L. Homogeneous Catalytic Ozonation of Disperse Dye Wastewater Treatment Research[D]. Shanghai: Donghua Univerisity, 2012. (  0) 0) |
| [20] |
石岩, 邓淑仪, 许丹宇, 等. 臭氧催化氧化法处理含酚废水的研究进展[J]. 环境工程, 2015(3): 17-20. Shi Y, Deng S Y, Xu D Y. Research Progress on the treatment of phenol wastewater by ozone catalytic oxidation[J]. Environmental Engineering, 2015(3): 17-20. (  0) 0) |
| [21] |
Arslan I. Treatability of a simulated disperse dye-bath by ferrous iron coagulation, ozonation, and ferrous iron-catalyzed ozonation[J]. Journal of Hazardous Materials, 2001, 85(3): 229-241. DOI:10.1016/S0304-3894(01)00232-1
(  0) 0) |
| [22] |
宁军, 陈立伟, 蔡天明. 臭氧催化氧化降解苯胺的机理[J]. 环境工程学报, 2013(2): 551-556. Ning J, Chen L W, Cai T M. The mechanism of ozone catalytic oxidation degradation of aniline[J]. Chinese Journal of Environmental Engineering, 2013(2): 551-556. (  0) 0) |
2. Minglang Environmental Engineering Co., Ltd, Qingdao 266061, China
 2018, Vol. 48
2018, Vol. 48


