2. 上海海洋大学 国家远洋渔业工程技术研究中心, 上海 201306;
3. 上海海洋大学 大洋渔业资源可持续开发教育部重点实验室, 上海 201306;
4. 上海海洋大学 农业农村部大洋渔业开发重点实验室, 上海 201306;
5. 上海海洋大学 农业农村部大洋渔业资源环境科学观测实验站, 上海 201306
鸢乌贼(Sthenoteuthis oualaniensis)属枪形目(Teuthoidea)柔鱼科(Ommastrephidae),具有生命周期短、生长速度快的特点[1-2]。鸢乌贼种群结构复杂,按季节可分为春生群、夏生群和秋生群3个不同产卵群体,按个体大小可分为大型群、中型群和小型群3个体型群,且随着洄游和洋流的变化,群体由若干地方种群组成,而不是一个单一的种群[3-5]。鸢乌贼生命周期大约为1年,终生一次繁殖[1]。其生物资源量大且世代更新速度快,可承受较大捕捞压力,极具开发潜力,是中国远洋鱿钓渔业和灯光罩网渔业重要的经济头足类[3]。鸢乌贼主要的作业渔场有琉球群岛渔场、中国台湾以西渔场、中国南海渔场、亚丁湾渔场和西北印度洋渔场[3, 6-8]。在西北印度洋海域,鸢乌贼是众多中上层鱼类的主要饵料生物,占据重要的生态位,同时也是中国远洋鱿钓渔业重要的捕捞目标,探捕结果表明,西北印度洋鸢乌贼资源量在200×104t以上[6]。目前国内对印度洋鸢乌贼的研究主要集中于年龄、摄食和渔场分布等方面[9-14],而针对其生殖发育及生殖投入的研究却鲜有报道。鉴于此,本文根据2019年3—5月中国灯光罩网渔船在印度洋西北海域生产调查期间采集的鸢乌贼样本,对其性腺发育及生殖投入进行了研究,完善了其繁殖生物学研究,补充了其渔业生物学资料,为多群体大洋性柔鱼的繁殖策略研究提供了新方法,为鸢乌贼资源的可持续利用和科学管理提供了参考。
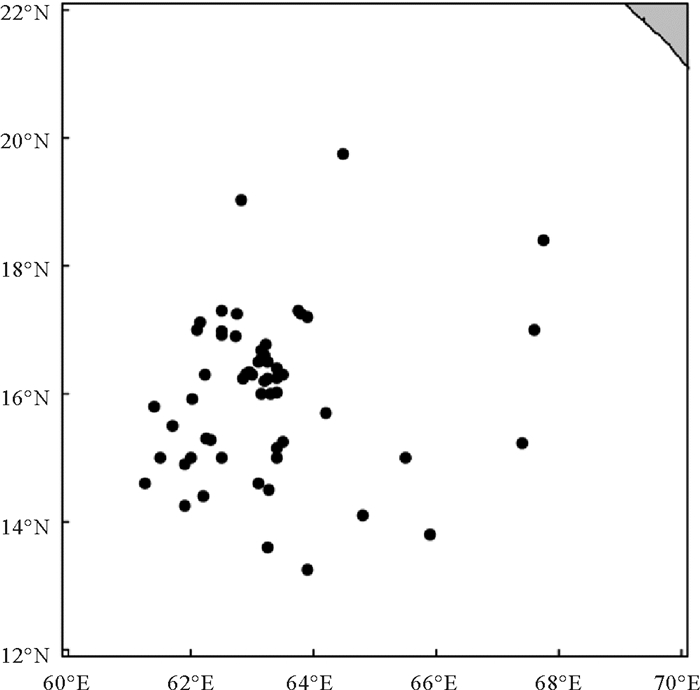
1 材料与方法 1.1 样本采集样品采集时间为2019年3—5月,采集海域为西北印度洋13°05′N—19°45′N、61°06′E—67°50′E(见图 1),采集渔船为“欣海1223”号灯光罩网渔船。采样时,从每个作业点渔获物中随机挑选鸢乌贼样本20~30尾(当在同一经纬度连续作业时,1周采样1次,当经纬度发生变化时则每天采样1次),样本经过冷冻保存后运回实验室,共得样本557尾,其中有效样本539尾。
|
图 1 调查采样站位图 Fig. 1 Site of investigations and samples |
在实验室解冻后,对样本胴长(Mantle length,ML)、体质量(Body weight,BW)和生殖系统质量(Reproductive system weight,RsW)进行测定,其中雌性包括卵巢质量(Ovary weight,OvaW)和缠卵腺质量(Nidamental gland weight,NGW),雄性包括精巢质量(Testis weight,TesW)和精荚复合体质量(Spermatophoric complex weight,SCW)。测量雌性的缠卵腺长度(Length of nidamental gland,NGL),对摄食等级(Stomach fullness degree,FD)和性腺成熟度(Maturity stage,MAT)进行目测和鉴定。依照柔鱼科的划分标准,性成熟度分为Ⅰ~Ⅴ期[15-17]; 摄食等级分为0~4级,其中0级为空胃个体(FD 0),4级为满胃个体(FD 4)[18]。其中,胴长用精度为0.1 mm的皮尺测定,缠卵腺长度使用精度为0.01 mm的电子游标卡尺测定; 体质量由电子秤测定,精确至1 g; 其它性腺质量由精密电子天平测定,精确至0.01 g。
1.3 数据分析计算性腺指数、缠卵腺指数和精荚复合体指数。
性腺指数(Gonadosomatic index,GSI)[19-21]:
| $ \begin{array}{l} {\rm{雌性(Female):GSI = }}\frac{{{\rm{OvaW}}}}{{{\rm{BW}}}}{\rm{ \times 100\% , }}\\ {\rm{雄性(Male):GSI = }}\frac{{{\rm{ TesW }}}}{{{\rm{BW}}}}{\rm{ \times 100\% }}。\end{array} $ | (1) |
缠卵腺指数(Nidamental gland index,NGI)[18]:
| $ \mathrm{NGI}=\frac{\mathrm{NGL}}{\mathrm{ML}} \times 100 \%。$ | (2) |
精荚复合体指数(Spermatophoric complex index,SCI)[20]:
| $ \mathrm{SCI}=\frac{\mathrm{SCW}}{\mathrm{BW}} \times 100 \%。$ | (3) |
应用非参数卡方检验分析(Nonparametric chi-square)检验不同月份鸢乌贼的性腺指数、缠卵腺指数、精荚复合体指数和摄食等级的差异性,并检验上述指标在不同性腺成熟度下的差异[20-21]。采用Person相关系数(r)分析雌性性腺指数与缠卵腺指数之间的相关性、雄性性腺指数与精荚复合体指数之间的相关性[19, 21-22]。
分别求取雌雄个体体质量与胴长在幂函数回归关系下的标准化残差(BW-ML residuals),并以此作为个体的体征指标[19, 21-23]。分别对雌雄个体的生殖系统质量与胴长进行线性回归,求取残差(RsW-ML residuals),并以此作为个体的生殖投入指标[19, 21-23]。采用单因素方差分析(Analysis of variance,ANOVA)分别检验体征指标、生殖投入指标和性腺指数在不同月份、不同的性腺成熟度及不同摄食强度下的差异性。利用Spearman-rank系数(Sr)分析生殖投入指标与体征指标之间的关系[21-22]。
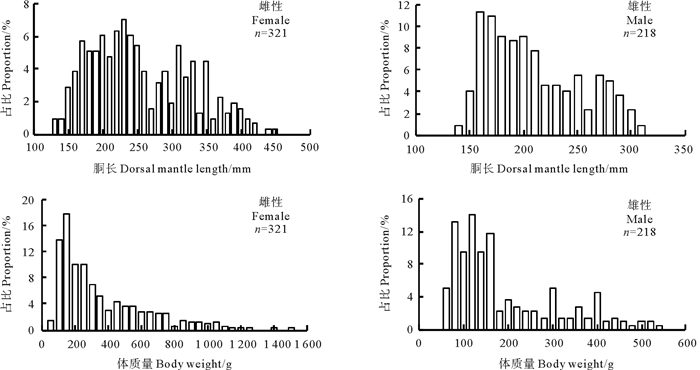
2 结果 2.1 渔业生物学组成 2.1.1 胴长及体质量分布共获得有效鸢乌贼实验样本539尾,性成熟个体207尾,占样本总数的38.4%。其中雌性样本321尾,胴长范围为126~441 mm,体质量范围为39~1 471 g,性成熟个体胴长范围为151~315 mm,体质量范围为56~550 g; 雄性样本218尾,胴长范围为138~306 mm,体质量范围为42~530 g,性成熟个体胴长范围为109~306 mm,体质量范围为53~530 g(见图 2)。
|
图 2 鸢乌贼胴长和体质量分布 Fig. 2 The frequency distribution of mentle length and body weight of S. oualaniensis |
在539尾鸢乌贼样本中,雌性个体321尾,雄性个体218尾。成熟度Ⅰ期时,个体数量最多,其中雌性190尾,雄性23尾; 成熟度Ⅱ期时,雌性65尾,雄性50尾; 成熟度Ⅲ期时,雌性43尾,雄性102尾; 成熟度Ⅳ期时,雌性18尾,雄性39尾。成熟度Ⅴ期时,样本个体极少,仅发现雄性个体2尾(见表 1)。
|
|
表 1 鸢乌贼性腺成熟度组成 Table 1 Composition of sex maturity for S. oualaniensis |
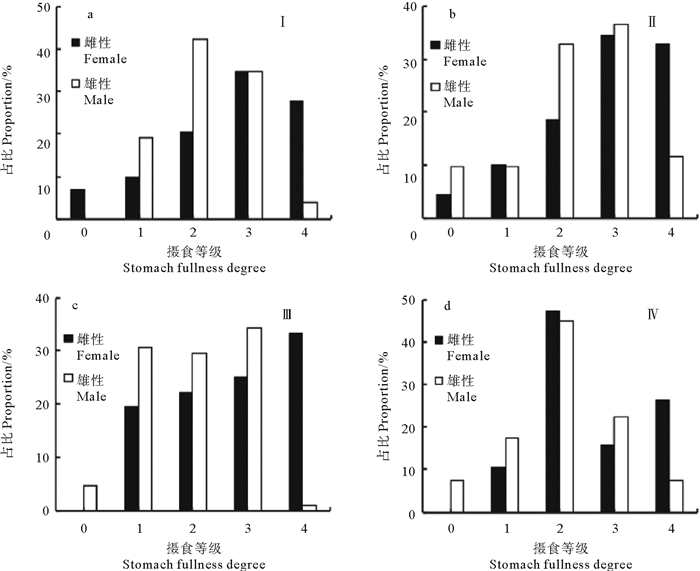
不同性成熟阶段,雌性鸢乌贼摄食等级不同,成熟度Ⅰ期时,摄食等级以2~4级为主(χ2=55.452,P < 0.01)(见图 3a); 成熟度Ⅱ期时,以3级和4级为主,空胃率较成熟度Ⅰ期时有所下降(χ2=25.143,P < 0.01) (见图 3b); 成熟度Ⅲ期时,未见空胃个体,摄食等级1级、2级和4级个体所占比例较成熟度Ⅱ期时有所增大,且3级所占比例显著降低(χ2=10.944,P=0.027)(见图 3c); 成熟度Ⅳ期时,雌性鸢乌贼也未见空胃个体,摄食等级1级、3级和4级的个体所占比例均较成熟度Ⅲ期时降低,但3级个体所占比例显著增大(χ2=12.316,P=0.015)(见图 3d)。综上所述,雌性鸢乌贼个体在成熟度Ⅰ期至Ⅲ期的发育过程中,摄食等级总体在增大,而在Ⅳ期时,摄食等级有所下降。
|
图 3 不同性腺成熟度鸢乌贼摄食等级组成频率分布 Fig. 3 Distribution of stomach fulness degree by sexual maturation of S. oualaniensis |
不同性成熟等级,雄性鸢乌贼摄食等级也不相同,成熟度Ⅰ期时,无空胃个体,摄食等级以2、3级为主(χ2=17.846,P=0.001)(见图 3a); Ⅱ期时,也以2、3级为主,且所占比例比更接近,(χ2=18.769,P=0.001)(见图 3b); Ⅲ期时,以1级、2级和3级为主,摄食等级1级个体所占比例较成熟度Ⅱ期时显著增大,满胃率显著降低(χ2=54.407,P < 0.01)(见图 3c); Ⅳ期时,以2级为主,但4级个体所占比例较成熟度Ⅲ期时显著增大(χ2=30.800,P < 0.01)(见图 3d)。总体而言,随着性腺发育从Ⅰ期到Ⅲ期,雌、雄性鸢乌贼的摄食等级都在增加,且雌性摄食等级低于雄性; 当临近性成熟时,摄食等级有所下降,雌性摄食等级总体高于雄性。
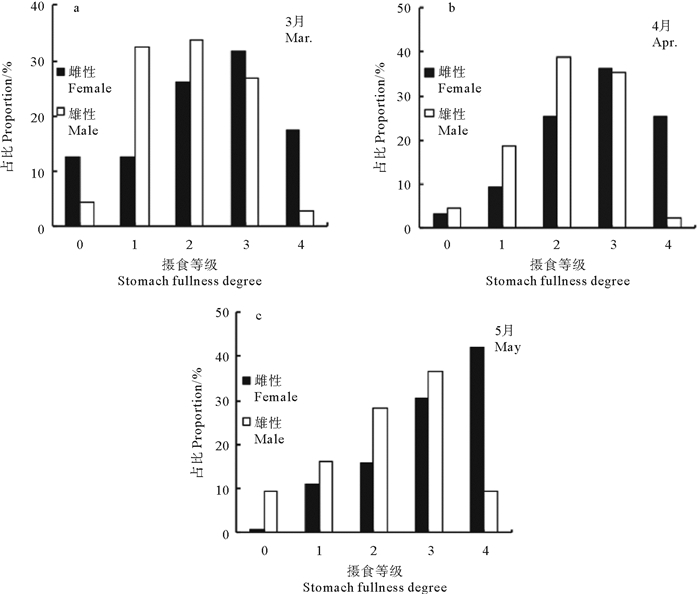
2.3 不同月份摄食等级组成不同月份间雌性鸢乌贼摄食等级都存在差异。雌性个体,3月时,摄食等级以2级和3级为主(χ2=15.231,P=0.004,见图 4a); 4月时,也以2级和3级为主,但4级的个体所占比例较3月时略有增大且满胃率显著增大(χ2=33.553,P < 0.01,见图 4b); 5月时,以3级和4级为主,满胃率显著增大(χ2=68.641,P < 0.01,见图 4c)。雄性个体,3月时,摄食等级以1级和2级为主(χ2=33.155,P < 0.01,见图 4a); 4月(χ2=48.235,P < 0.01)和5月(χ2=2.405,P < 0.01)时,都以2级和3级为主(见图 4b和图 4c)。总体而言,随着月份增加雌、雄鸢乌贼个体捕食强度都逐渐增强。
|
图 4 不同月份鸢乌贼摄食等级组成频率分布 Fig. 4 Distribution of stomach fulness degree by month of S. oualaniensis |
3—5月,雌性鸢乌贼性成熟个体所占比例呈显著上升趋势,对应的空胃个体所占比例变化趋势与之相反(r=-0.999,P < 0.01),而满胃个体所占比例变化趋势与之相同(r=0.872,P=0.325)(见图 5a)。雄性鸢乌贼性成熟个体所占比例呈先下降后上升趋势,对应的空胃及满胃个体所占比例都与之变化趋势相同,但关系均不显著(mature-FD 0:r=0.131,P=0.916;mature-FD 4:r=0.264,P=0.830)(见图 5b)。
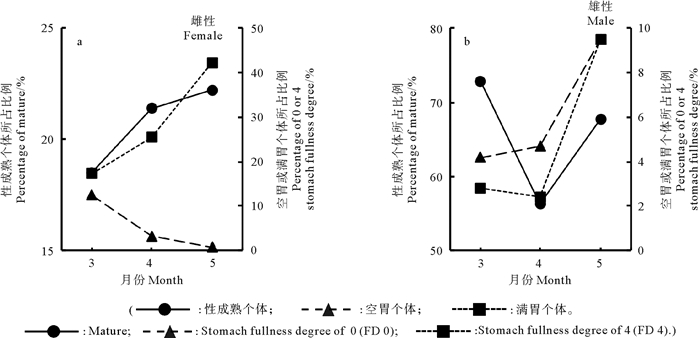
|
图 5 摄食等级的月份差异与性腺发育的关系 Fig. 5 Relationship between monthly differences in stomach fullness degree(FD) and maturity development |
雌性鸢乌贼性腺指数范围为0.06%~9.26%(1.02%±1.68%),缠卵腺指数范围为5.56%~47.37%(16.99%±10.61%)。随着性腺发育,性腺指数与缠卵腺指数均呈增大趋势,且二者变化趋势相似,均在性成熟度Ⅰ~Ⅱ期及Ⅲ~Ⅳ期增长平缓,在成熟度Ⅱ~Ⅲ期时增长显著,且在成熟度Ⅳ期时达到最大值(见图 6)(GSI:F=466.340,P < 0.01;NGI:F= 1 142.51,P < 0.01),二者变化趋势相同(r=0.917,P < 0.01)。
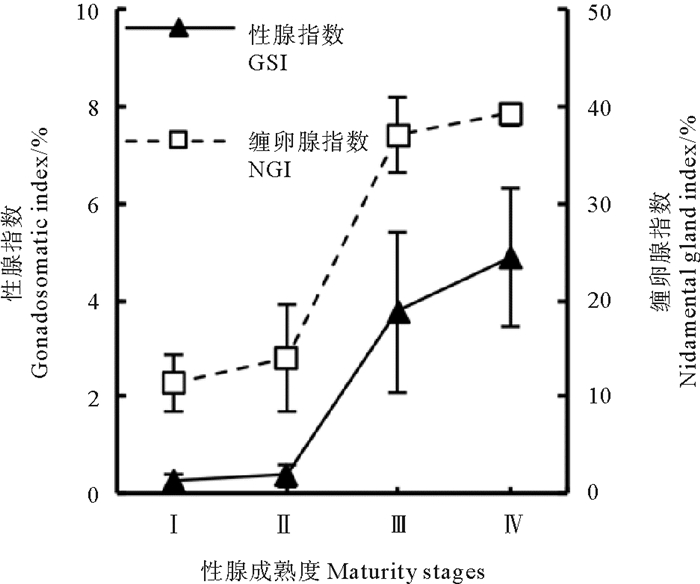
|
图 6 雌性鸢乌贼的性腺指数及缠卵腺指数 Fig. 6 The gonadosomatic index(GSI) and nidamental gland index(NGI) of female S. oualaniensis |
雄性性腺指数范围为0.12%~4.59%(2.76%±0.87%),精荚复合体指数范围为0.06%~7.19%(2.55%±1.55%)。在成熟度Ⅰ~Ⅲ期时,性腺指数与精荚复合体指数均显著增大; 在成熟度Ⅲ~Ⅳ期时,性腺指数略有降低,而精荚复合体指数仍平缓增大(见图 7)(GSI:F=41.329,P < 0.01; SCI:F=106.605,P < 0.01),二者变化趋势接近(r=0.486,P < 0.01)。
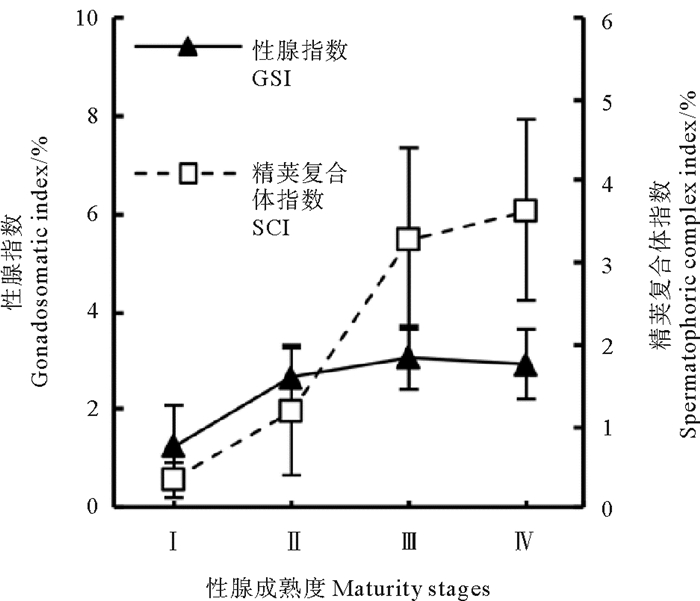
|
图 7 雄性鸢乌贼的性腺指数及精荚复合体指数 Fig. 7 The gonadosomatic index(GSI) and spermatophoric complex index(SCI) of male S. oualaniensis |
标准化残差分析表明,雌性鸢乌贼的体征指标(BW-DML residuals)随着性腺发育成熟呈下降趋势,成熟度Ⅲ期后质量特征较差,但不同性成熟度之间不存在显著性差异(F=2.110,P=0.099);而生殖投入指标((RsW-DML residuals)则随着性腺发育成熟呈升高趋势,性成熟度Ⅱ期后,均呈正值,表征良好,且升高显著(F=147.151,P < 0.01)(见图 8a)。雌性鸢乌贼的体征指标随着摄食等级的增大呈下降趋势,在胃摄食等级3级时,为负值,表征较差(F=3.321,P=0.011);而生殖投入指标随着摄食等级的增大呈升高趋势(F=2.365,P=0.053)(见图 8b)。体征指标与生殖投入指标略呈负相关,但无明显相关性(Sr=-0.111,P=0.049)。
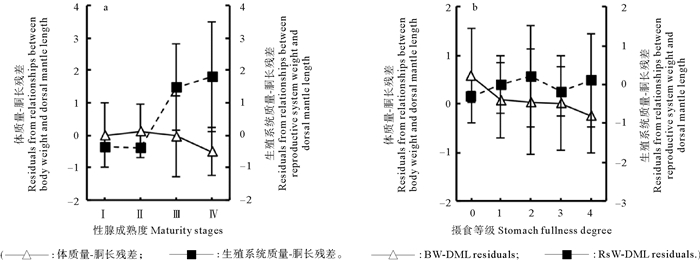
|
图 8 雌性鸢乌贼的体质量-胴长残差和生殖系统质量-胴长残差 Fig. 8 The average residuals from relationships between body weight and dorsal mantle length(BW-DML residuals) and between reproductive system weight and dorsal mantle length(RsW-DML residuals) grouped in female S. oualaniensis |
雄性鸢乌贼的体征指标和生殖投入指标均随着性腺发育成熟整体呈升高趋势,二者均在性成熟度Ⅲ期后表征良好,成熟度Ⅱ期后体征指标升高较平缓(F=4.299,P=0.006),生殖投入指标显著升高(F=22.481,P < 0.01)(见图 9a)。雌性鸢乌贼的体征指标随着摄食等级的增大先降低后升高,于摄食等级2级时达到最低(F=3.117,P=0.016);生殖投入指标随着摄食等级的增大先降低后升高,在摄食等级2、3级时为负,4级时为正(F=2.642,P=0.035)(见图 9b)。体征指标与生殖投入指标略呈正相关关系(Sr=0.270,P < 0.01)。
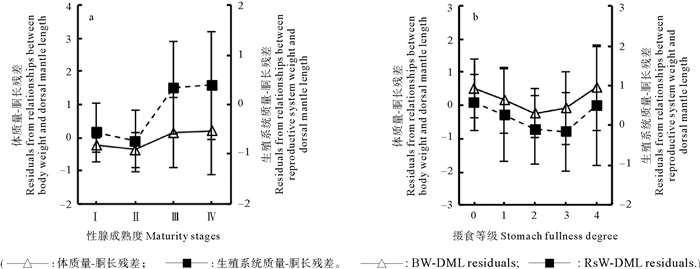
|
图 9 雄性鸢乌贼的体质量-胴长残差和生殖系统质量-胴长残差 Fig. 9 The average residuals from relationships between body weight and dorsal mantle length(BW-DML residuals) and between reproductive system weight and dorsal mantle length(RsW-DML residuals) grouped in male S. oualaniensis |
鸢乌贼的摄食对象主要包括头足类、鱼类及桡足类等小型动物,且随着栖息环境的变化及鸢乌贼自身个体生长,摄食对象存在明显的差异[24]。据叶旭昌等研究认为,印度洋西北部鸢乌贼以鱿鱼为主要摄食对象[25]; 据Parry等研究,夏威夷群岛东北部鸢乌贼以甲壳类为主要摄食对象[26]; Okutani等认为冲绳群岛鸢乌贼以甲壳类为主要摄食对象[27]; 据张宇美及龚玉艳等的研究,南海鸢乌贼以头足类和鱼类为主要摄食对象[24, 28-29]。对比相关研究,与其他热带海域相同种类相比,西北印度洋鸢乌贼互相残食现象更普遍,这可能是不同海域生产力不同所致[23]。季风气候导致印度洋西北海域形成了十分独特的海洋环流,春夏季(西南季风期间)形成反气旋环流并形成强烈的上升流,秋冬季(东北季风期间)则形成气旋环流,导致了该海域初级生产力的季节性差异极大,而海域生产力是影响头足类摄食行为的主导因素[30-31]。本研究结果表明,雌、雄鸢乌贼在不同月份个体摄食等级差异极大,但总体而言,3—5月雌、雄鸢乌贼摄食等级较高的样本所占比例均呈增大趋势,这表明在春夏季随着时间的推移,该海域的生产力或呈升高趋势。本研究结果表明,随着性腺的发育,个体摄食等级组成波动也较大,随着性腺发育等级的增大,高摄食等级(3~4级)的鸢乌贼个体雌雄比例呈增大趋势。已有研究表明,与雄性相比,雌性鸢乌贼在性腺发育时所需摄入的外源能量更多[8]。
3.2 性腺发育头足类大多为终生一次发育,且性腺发育与个体生长不同步,性腺发育的时间偏后,从性腺开始发育到繁殖后死亡仅占整个生活史的1/10~1/5[21, 32-34]。鸢乌贼个体交配及产卵的时间可以持续1~3个月,鸢乌贼种群在各月份均有性成熟个体[35]。国内目前对西北印度洋鸢乌贼的性腺发育研究较少,本研究结果表明,雌、雄鸢乌贼的性腺指标均随性腺成熟度的增大呈增大趋势,但在Ⅳ期时,雄性性腺指数呈下降趋势。此时接近繁殖时期,雄性鸢乌贼摄食获得的能量可能主要存储于肌肉组织中,以进行后期的繁殖活动,性腺质量不再增加,以等待雌性鸢乌贼发育成熟,最终导致雌性个体性腺发育较晚但成体较大、雄性个体性腺发育较早但个体相对偏小,这可能与其繁殖策略有关。与其他头足类类似,鸢乌贼为“机会主义者”,繁殖策略为典型的r选择策略,即产生足够多的后代以适应多变的环境,在整个生活史中雌性起主导作用[36]。此外,本研究结果表明,相同胴长组的个体在性腺发育程度上存在较大差异,产生差异的原因可能也与该海域鸢乌贼复杂的种群结构有关,还有可能与样本自身的捕食能力有关[9]。
3.3 生殖投入头足类在个体的肌肉组织与性腺组织之间,乃至个体不同部位肌肉组织之间存在内源性的能量转化[8, 37-38]。有些属种的个体生长与性腺发育同步,个体生长随着性腺发育而逐渐减缓,至性腺发育成熟时逐渐停止生长,摄食所得能量储存于体内,繁殖期间所需的能量依赖于体内既有能量的转移,另一些属种性腺发育所需的能量则完全依赖于其他部位肌肉组织的转化[8, 23, 38]。本研究结果表明,西北印度洋鸢乌贼性腺指数及其附属性腺指数(雌性的缠卵腺指数、雄性的精荚复合体指数)均随性腺发育增长显著,但是成熟个体的性腺指数较低,与中国南海的鸢乌贼相似[8, 37]。据Mcgrath等的研究,头足类成熟个体性腺指数低于15%的种类,其生殖投入类型更倾向于外源性,即通过摄食获得[39]。结合本研究所得的性腺指数,初步推断印度洋鸢乌贼生殖投入类型为外源性。
本研究结果表明,西北印度洋鸢乌贼雌、雄个体的体征指标和生殖投入指标具明显差异性,随着性腺发育,雌性体征指标呈下降趋势,生殖投入指标呈上升趋势,而雄性体征指标和生殖投入指标则均呈上升趋势。该结果与同科的茎柔鱼(Dosidicus gigas)及乌贼科的巴塔哥尼亚枪乌贼(Doryteuthis gahi)均有较大差异[21, 23],可能意味着鸢乌贼与上述两种大洋性头足类具有不同的生存策略,摄食等级的月份差异与性腺发育的关系也验证了该推断。但是,鉴于本次采样所得鸢乌贼的种群复杂,具体的能量投入及其来源情况仍需后续扩大采样,对单一群体单一性别的鸢乌贼进行稳定同位素和脂肪酸等生物标记测定研究。
| [1] |
Alexander I A, Paul G K R, Graham J P, et al. World squid fisheries[J]. Reviews in Fisheries Science & Aquaculture, 2015, 23(2): 92-252. (  0) 0) |
| [2] |
Zuev G V, Nigmatullin C M, Nikol'skii V N. Nectonic Oceanic Squids[M]. Moscow: Agropromizdat, 1985.
(  0) 0) |
| [3] |
董正之. 世界大洋经济头足类生物学[M]. 济南: 山东科学技术出版社, 1991. Dong Z Z. Biology of the Economic Species of Cephalopods in the World Oceans[M]. Jinan: Shandong Science and Technology Press, 1991. (  0) 0) |
| [4] |
Takagi K, Kitahara T, Suzuki N, et al. The age and growth of Sthenoteuthis oualaniensis (Cephalopoda: Ommastrephidae) in the Pacific Ocean[J]. Bulletin of Marine Science, 2002, 71(2): 1105-1108. (  0) 0) |
| [5] |
Chembian A J, Mathew S. Population structure of the purpleback squid Sthenoteuthis oualaniensis (Lesson, 1830) along the South-west coast of India[J]. Indian Journal of Fisheries, 2014, 61(3): 20-28. (  0) 0) |
| [6] |
赵荣兴. 印度洋可开发的外洋性头足类[J]. 现代渔业信息, 1992(8): 25-26. Zhao R X. Exploitable cephalopods in the Indian Ocean[J]. Modern Fisheries Information, 1992(8): 25-26. (  0) 0) |
| [7] |
陆化杰, 童玉和, 刘维, 等. 厄尔尼诺年春季中国南海中沙群岛海域鸢乌贼的渔业生物学特性[J]. 水产学报, 2018, 42(6): 912-921. Lu H J, Tong Y H, Liu W, et al. Fisheries biological characteristics of Sthenoteuthis oualaniensis in the spring season in the El Nino year of 2016 in the Zhongsha Islands waters of South China Sea[J]. Journal of Fisheries of China, 2018, 42(6): 912-921. (  0) 0) |
| [8] |
朱凯, 孙程婕, 陈新军, 等. 南海鸢乌贼中型群雌性个体肌肉和性腺组织能量积累及其分配[J]. 海洋渔业, 2019, 41(6): 641-651. Zhu K, Sun C J, Chen X J, et al. Energy accumulation of somatic and gonadal tissues and its allocation to reproduction in medium from of female Sthenoteuthis oualaniensis in the South China Sea[J]. Marine Fisheries, 2019, 41(6): 641-651. DOI:10.3969/j.issn.1004-2490.2019.06.001 (  0) 0) |
| [9] |
刘必林, 陈新军, 钟俊生. 采用耳石研究印度洋西北海域鸢乌贼的年龄、生长和种群结构[J]. 大连水产学院学报, 2009, 24(3): 206-212. Liu B L, Chen X J, Zhong J S. Age, growth and population structure of squid Sthenoteuthis oualaniensis in Northwest Indian Ocean by statolith microstructure[J]. Journal of Dalian Fisheries University, 2009, 24(3): 206-212. DOI:10.3969/j.issn.1000-9957.2009.03.004 (  0) 0) |
| [10] |
王洪浩, 何涛, 陆化杰, 等. 性成熟和个体大小对西北印度洋鸢乌贼耳石形态的影响[J]. 水产学报, 2021, 45(8): 1350-1360. Wang H H, He T, Lu H J, et al. Effects of sexual maturity and body size on statolith shape of Sthenoteuthis oualaniensis in the Northwest Indian Ocean[J]. Journal of Fisheries of China, 2021, 45(8): 1350-1360. (  0) 0) |
| [11] |
陆化杰, 王洪浩, 刘凯, 等. 厄尔尼诺发生期冬春季西北印度洋鸢乌贼耳石外形生长特性[J]. 生态学杂志, 2020, 39(11): 3694-3703. Lu H J, Wang H H, Liu K, et al. Growth characteristics of statolith of Sthenoteuthis oualaniensis in the Northwest Indian Ocean in spring and winter in the El Nino year[J]. Chinese Journal of Ecology, 2020, 39(11): 3694-3703. (  0) 0) |
| [12] |
陈新军, 叶旭昌. 印度洋西北部海域鸢乌贼渔场与海洋环境因子关系的初步分析[J]. 上海水产大学学报, 2005(1): 55-60. Chen X J, Ye X C. Preliminary study on the relationship between fishing ground of Symlectoteuthis oualaniensis and environmental factors in Northwestern Indian Ocean[J]. Journal of Shanghai Fisheries University, 2005(1): 55-60. (  0) 0) |
| [13] |
林东明, 陈新军. 印度洋西北部海域鸢乌贼渔场分布及其与海面温度的关系[J]. 海洋科学进展, 2006(4): 546-551. Lin D M, Chen X J. Fishing ground distribution of Symplectoteuthis ouslsniensis and its relations to SST in the Northwestern Indian Ocean[J]. Advances in Marine Science, 2006(4): 546-551. DOI:10.3969/j.issn.1671-6647.2006.04.018 (  0) 0) |
| [14] |
邵锋, 陈新军. 印度洋西北海域鸢乌贼渔场分布与海面高度的关系[J]. 海洋科学, 2008, 32(11): 88-92. Shao F, Chen X J. Relationship between fishing ground of Symlectoteuthis oualaniensis and sea surface height in the Northwest Indian Ocean[J]. Marine Sciences, 2008, 32(11): 88-92. (  0) 0) |
| [15] |
Arkhipkin A. Age, growth and maturation of the european squid loligo vulgaris (myopsida, loliginidae) on the West Saharan shelf[J]. Journal of the Marine Biological Association of the UK, 1995, 75(3): 593-604. DOI:10.1017/S0025315400039035 (  0) 0) |
| [16] |
Lipinski M R, Underhill L G. Sexual maturation in squid: Quantum or continuum?[J]. Taylor & Francis Group, 2010, 15(1): 207-223. (  0) 0) |
| [17] |
刘必林, 陈新军. 头足类生殖系统及其在分类学上的应用[J]. 水产学报, 2010, 34(8): 1219-1226. Liu B L, Chen X J. Cephalopods reproductive system and its application to taxonomy[J]. Journal of Fisheries of China, 2010, 34(8): 1219-1226. (  0) 0) |
| [18] |
Hatfield E M C, Murray A W A. Objective assessment of maturity in the Patagonian squid Loligo gahi (Cephalopoda: Loliginidae) from Falkland Islands waters[J]. ICES Journal of Marine Science, 1999, 56(5): 746-756. DOI:10.1006/jmsc.1999.0514 (  0) 0) |
| [19] |
Rodrigues M, Guerra A, Troncoso J S. Reproduction of the Atlantic bobtail squid Sepiola atlantica (Cephalopoda: Sepiolidae) in Northwest Spain[J]. Invertebrate Biology, 2012, 131(1): 30-39. DOI:10.1111/j.1744-7410.2011.00253.x (  0) 0) |
| [20] |
Kaufman S D, Johnston T A, Leggett W C, et al. Relationships between body condition indices and proximate composition in adult walleyes[J]. Transactions of the American Fisheries Society, 2007, 136(6): 1566-1576. DOI:10.1577/T06-262.1 (  0) 0) |
| [21] |
林东明, 朱国平, 陈新军, 等. 西南大西洋巴塔哥尼亚枪乌贼的繁殖生物学特性[J]. 水产学报, 2017, 41(5): 795-805. Lin D M, Zhu G P, Chen X J, et al. Reproductive characteristics of Patagonian longfin squid(Doryteuthis gahi) in the Southwest Atlantic Ocean[J]. Journal of Fisheries of China, 2017, 41(5): 795-805. (  0) 0) |
| [22] |
Otero J, Gonzalez A F, Sieiro M P, et al. Reproductive cycle and energy allocation of Octopus vulgaris in Galician waters, NE Atlantic[J]. Fisheries Research, 2007, 85(1-2): 122-129. DOI:10.1016/j.fishres.2007.01.007 (  0) 0) |
| [23] |
韩飞, 陈新军, 林东明, 等. 东太平洋赤道海域茎柔鱼体征生长及生殖投入[J]. 水产学报, 2019, 43(12): 2511-2522. Han F, Chen X J, Lin D M, et al. Body condition and reproductive investment of Dosidicus gigas in the equatorial waters of Eastern Pacific Ocean[J]. Journal of Fisheries of China, 2019, 43(12): 2511-2522. (  0) 0) |
| [24] |
龚玉艳, 孔啸兰, 杨玉滔, 等. 南海鸢乌贼微型群体的摄食习性研究[J]. 海洋渔业, 2018, 40(4): 394-403. Gong Y Y, Kong X L, Yang Y T, et al. Feeding habits of dwarf-form Sthenoteuthis oualaniensis population in the South China Sea[J]. Marine Fisheries, 2018, 40(4): 394-403. DOI:10.3969/j.issn.1004-2490.2018.04.002 (  0) 0) |
| [25] |
叶旭昌, 陈新军. 印度洋西北海域鸢乌贼生物学特性初步研究[J]. 上海水产大学学报, 2004, 13(4): 316-322. Ye X C, Chen X J. Study of biological characteristics of Symlectoteuthis oualaniensis in the Northwestern Indian Ocean[J]. Journal of Shanghai Fisheries University, 2004, 13(4): 316-322. (  0) 0) |
| [26] |
Matthew P P. The Trophic Ecology of Two Ommastrephid Squid Species, Ommastrephes bartramii and Sthenoteuthis oualaniensis, in the North Pacific Sub-Tropical Gyre[D]. Manoa: University of Hawaii, 2003.
(  0) 0) |
| [27] |
Okutani T, Tung I. Reviews of biology of commercially important squids in Japanese and adjacent waters. 1. Symplectoteuthis ouala-niensis(Lesson)[J]. Veliger, 1978, 21(1): 87-94. (  0) 0) |
| [28] |
张宇美, 颜云榕, 卢伙胜, 等. 西沙群岛海域鸢乌贼摄食与繁殖生物学初步研究[J]. 广东海洋大学学报, 2013, 33(3): 56-64. Zhang Y M, Yan Y R, Lu H S, et al. Study on feeding and reproduction biology of purple flying squid, Sthenoteuthis oualaniensis in the Western South China Sea[J]. Journal of Guangdong Ocean University, 2013, 33(3): 56-64. DOI:10.3969/j.issn.1673-9159.2013.03.010 (  0) 0) |
| [29] |
龚玉艳, 詹凤娉, 杨玉滔, 等. 南海鸢乌贼摄食习性的初步研究[J]. 南方水产科学, 2016, 12(4): 80-87. Gong Y Y, Zhan F P, Yang Y T, et al. Feeding habits of Symplectoteuthis oualaniensis in the South China Sea[J]. South China Fisheries Science, 2016, 12(4): 80-87. DOI:10.3969/j.issn.2095-0780.2016.04.010 (  0) 0) |
| [30] |
钱卫国, 陈新军, 刘必林, 等. 印度洋西北海域秋季鸢乌贼渔场分布与浮游动物的关系[J]. 海洋渔业, 2006(4): 265-271. Qian W G, Chen X J, Liu B L, et al. The relationship between fishing ground distribution of Symlectoteuthis oualaniensis and zooplankton in the Northwestern Indian Ocean in autumn[J]. Marine Fisheries, 2006(4): 265-271. DOI:10.3969/j.issn.1004-2490.2006.04.001 (  0) 0) |
| [31] |
陆化杰, 宁欣, 刘维, 等. 不同气候条件下南海西沙海域鸢乌贼(Sthenoteuthis oualaniensis)渔业生物学比较研究[J]. 海洋与湖沼, 2021, 52(4): 1029-1038. Lu H J, Ning X, Liu W, et al. Comparison in fishery biology of Sthenoteuthis oualaniensis in different climate events in the South China Sea[J]. Oceanologia et Limnologia Sinica, 2021, 52(4): 1029-1038. (  0) 0) |
| [32] |
Jereb P, Roper C F E. Cephalopods of the World: An Annotated and Illustrated Catalogue of Cephalopod Species Known to Date. Volume 2. Myopsid and Oegopsid Squids[J]. Rome: FAO, 2010. (  0) 0) |
| [33] |
Schwarz R, Perez J A A. Age structure and life cycles of the Argentine shortfin squid Illex argentinus (Cephalopoda: Ommastrephidae) in southern Brazil[J]. Journal of the Marine Biological Association of the United Kingdom, 2012, 93(2): 557-565. (  0) 0) |
| [34] |
Boyle J A A, Pierce G J, Hastie L C. Flexible reproductive strategies in the squid Loligo forbesi[J]. Marine Biology, 1995, 121(3): 501-508. DOI:10.1007/BF00349459 (  0) 0) |
| [35] |
朱凯. 南海中南部鸢乌贼形态学与繁殖生物学研究[D]. 上海: 上海海洋大学, 2017. Zhu K. A study on Morphology and Reproductive Biology of Purple Flying Squid Sthenoteuthis oualaniensis in the Centraland Southern South China Sea[D]. Shanghai: Shanghai Ocean University, 2017. (  0) 0) |
| [36] |
Gretta T P, Natalie A M. Life history of a short-lived squid(Sepioteuthis australis): Resource allocation as a function of size, growth, maturation, and hatching season[J]. ICES Journal of Marine Science: Journal du Conseil, 2006, 63(6): 995-1004. DOI:10.1016/j.icesjms.2006.04.007 (  0) 0) |
| [37] |
朱凯, 张立川, 陈新军, 等. 南海鸢乌贼中型群雄性个体肌肉和性腺组织能量积累及其分配[J]. 热带海洋学报, 2019, 38(4): 41-51. Zhu K, Zhang L C, Chen X J, et al. Energy accumulation and allocation of somatic and reproductive tissues in medium form of male Sthenoteuthis oualaniensis in the South China Sea[J]. Journal of Tropical Oceanography, 2019, 38(4): 41-51. (  0) 0) |
| [38] |
Jonsson N, Jonsson B. Body composition and energy allocation in life-history stages of brown trout[J]. Journal of Fish Biology, 2010, 53(6): 1306-1316. (  0) 0) |
| [39] |
Mcgrath B, Jackson G. Egg production in the arrow squid Nototodarus gouldi(Cephalopoda: Ommastrephidae), fast and furious or slow and steady?[J]. Marine Biology, 2002, 141(4): 699-706. DOI:10.1007/s00227-002-0864-z (  0) 0) |
2. National Distant-Water Fisheries Engineering Research Center, Shanghai Ocean University, Shanghai 201306, China;
3. The Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Ministry of Education, Shanghai Ocean University, Shanghai 201306, China;
4. The Key Laboratory of Oceanic Fisheries Exploration, Ministry of Agriculture and Rural Affairs, Shanghai Ocean University, Shanghai 201306, China;
5. Scientific Observing and Experimental Station of Oceanic Fishery Resources, Ministry of Agriculture and Rural Affairs, Shanghai Ocean University, Shanghai 201306, China
 2022, Vol. 52
2022, Vol. 52


