2. 青岛海洋科学与技术国家实验室 海洋生态与环境科学功能实验室,山东 青岛266200;
3. 中国海洋大学海洋环境与生态教育部重点实验室,山东 青岛266100;
4. 三沙航迹珊瑚礁保护研究所,海南 三沙573199;
5. 中国海洋大学海底科学与探测技术教育部重点实验室,山东 青岛266100;
6. 中国海洋大学海洋化学理论与工程技术教育部重点实验室,山东 青岛266100
海洋蓝洞是与外界水体隔绝的寡营养生态系统,表层通过潮汐作用与海水进行微弱的水体交换[1]。蓝洞内部由于光照不足、营养物质缺乏及水体动力学交换水平低[2],初级生产力水平较低。蓝洞温度和盐度层化现象明显[3],而温、盐跃层是影响浮游植物垂直分布的重要因素[4],蓝洞内部温盐层化现象也可能对浮游植物的垂直分布产生显著的影响。
海洋蓝洞深层无光、寡营养及水体动力学交换水平低等特殊的环境特征,形成特殊的栖息地和生态位[5]。Garrabou等[6]在地中海蓝洞(Medes Island cave)发现,浮游生物物种丰富度和生物量随深度增加逐渐下降。硅藻对尤卡坦半岛蓝洞(Casa cenote)浮游植物的物种丰富度贡献最大,占总种类数的75%[7]。Iliffe等[8]发现在蓝洞深层无光环境中没有浮游植物生存,无光合作用产生氧气。而蓝洞内部稳定且层化的水体限制了深层水和表层水的垂直混合及氧气交换,导致蓝洞下层缺氧形成无氧层。此外,水体层化会成为生物垂直移动的物理屏障,导致蓝洞不同水层的浮游植物粒径不同[7]。
虽然国外学者对海洋蓝洞的浮游植物开展了许多研究,但针对蓝洞浮游植物昼夜变化及与外礁坡区别的研究尚未见报道。南海西沙永乐龙洞是世界上最深的海洋蓝洞,内部水体存在多个温盐跃层,且90 m以下水体为无氧环境[9]。永乐龙洞内部生态系统海洋生物群落的分布及其与南海开阔水域的差异目前尚不了解。浮游植物(包括微微型、微型和小型浮游植物)作为海洋生态系统主要的生产者,在其能量流动和物质循环过程中起着至关重要的作用[10]。永乐龙洞浮游植物如何分布、昼夜变化及与外礁坡和潟湖中浮游植物分布有何异同,都值得深入分析和研究。
为了解南海永乐龙洞浮游植物的群落特征和昼夜垂直分布,本研究分别在日间和夜间通过采水的方式对永乐龙洞、潟湖及外礁坡的微微型浮游植物、微型和小型浮游植物及叶绿素a进行样品采集,研究龙洞浮游植物的昼夜垂直分布及其与潟湖和外礁坡的差异性,以期为南海龙洞浮游植物生态学研究提供基础性资料。
1 材料与方法2017年3月在三沙永乐龙洞(14日夜间、17日白天)、澙湖(13日)及外礁坡(22日)乘渔船进行浮游生态调查(见图 1)。样品的保存、分析均按照《海洋调查规范》[11]进行。温度、盐度及水深等环境因子采用SBE 19 plus型(温、盐、深和浊度)和JFE-Advantech公司ASTD 102型(温、盐、深、溶解氧、叶绿素、浊度)CTD的联合观测获得。
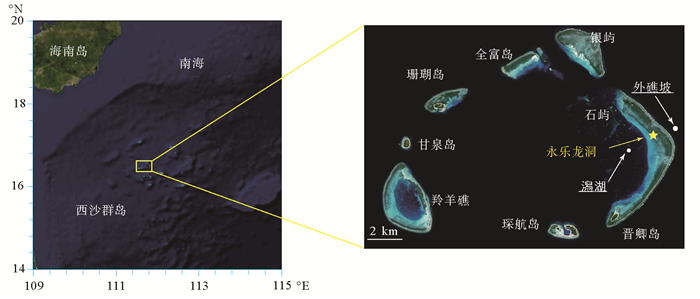
|
图 1 调查站位图 Fig. 1 Map of sampling stations |
使用5 L Niskin采水瓶于龙洞(0、5、10、20、40、60、80、90、100、150 m)、潟湖(0 m)及外礁坡(0、10、150、200 m)采集海水。每层海水采集1 L水样,避光保存于终浓度为2%的中性鲁哥氏液中,用于微型和小型浮游植物形态鉴定与计数。分级过滤(5和0.45 μm)500 mL的海水,过滤后将滤膜包裹于铝箔包内,置于液氮中避光保存用于测定叶绿素a(日间10 m层、20 m层、150 m层和夜间150 m层5 μm滤膜采集的叶绿素a样品缺失;夜间150 m层0.45 μm滤膜采集的样品缺失;潟湖表层样品仅使用0.45 μm滤膜过滤)。微微型浮游植物样品,取10 mL海水加入2 mL多聚甲醛溶液,避光固定15 min,液氮保存。
实验室内对微型和小型浮游植物样品进行浓缩处理,使用0.1 mL计数框于Nikon YS100生物显微镜下进行种类鉴定并计数。
叶绿素a样品采用荧光分析仪测定。在低温避光的条件下将滤膜浸泡于10 mL浓度为90%的丙酮中萃取24 h。离心机离心后取其上清液,使用荧光光度计(F-4500)进行测定。
采用流式细胞仪(BD FACSCalibur, 488 nm)对微微型浮游植物进行分析。将深度冰冻的样品放置在冰水浴中缓慢解冻,取995 μL样品加入内标5 μL荧光小球(Polysciences Co.,USA),混匀后注入流式细胞测定仪,激发光波长为488 nm。通过CellQuest软件(BDCo.)进行数据分析。
叶绿素a浓度、微微型浮游植物、微型和小型浮游植物丰度的垂直分布图均采用Origin8.5绘制。
2 结果 2.1 叶绿素a龙洞日间和夜间叶绿素a浓度均呈现随深度先增加后减小的趋势。龙洞日间叶绿素a浓度最大值(0.42 μg/L)出现在40 m层;龙洞夜间叶绿素a浓度最大值(0.59 μg/L)出现在20 m层;龙洞日间和夜间90 m水层均未检测到叶绿素a。潟湖表层叶绿素a浓度0.09 μg/L,略高于龙洞表层叶绿素a浓度(日间:0.04 μg/L;夜间:0.08 μg/L)。0.45~5 μm粒径范围的叶绿素a浓度高于粒径大于5 μm的叶绿素a浓度(见图 2)。

|
图 2 叶绿素a垂直分布 Fig. 2 Vertical distribution of chlorophyll a |
龙洞日间微微型浮游植物丰度最大值层出现在表层,丰度高达3.2×104 cells/mL;最小值出现在60 m层,丰度仅为1.6×103 cells/mL。夜间微微型浮游植物的丰度最大值层出现在20 m水层,丰度高达5.1×104 cells/mL;最小值出现在100 m水层,丰度为1.1×103 cells/mL。外礁坡微微型浮游植物丰度随水深呈现降低的趋势。其丰度最大值(3.0×104 cells/mL)出现在表层;最小值(4.6×103 cells/mL)出现在200 m层。潟湖表层微微型浮游植物丰度为1.3×103 cells/mL,低于龙洞及外礁坡(见图 3a)。
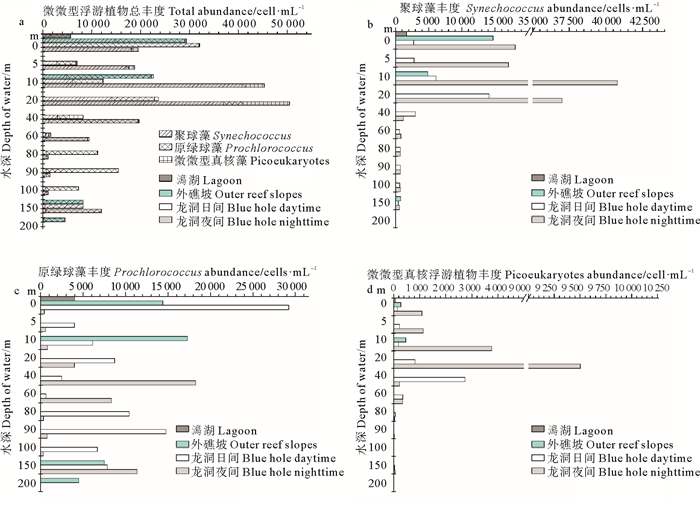
|
(a.总丰度;b.聚球藻;c.原绿球藻;d.微微型真核浮游植物。a. Total abundance; b. Synechococcus; c. Prochlorococcus; d. Picoeukaryotes.) 图 3 微微型浮游植物丰度 Fig. 3 Pico-phytoplankton abundance |
龙洞日间聚球藻(Synechococcus)主要集中在0~40 m水层,40 m以下水层丰度较低。聚球藻丰度最大值层出现在20 m层,丰度为1.4×104 cells/mL;丰度最小值出现在150 m层,丰度仅为0.4×103 cells/mL;夜间聚球藻主要出现在0~20 m水层,20 m以下水层丰度低。其丰度最大值层出现在10 m层,丰度为4.1×104 cells/mL;丰度最小值出现在150 m层,丰度为0.6×103 cells/mL。外礁坡聚球藻丰度随水深呈现递减的趋势,表层是丰度最大值层,丰度为1.5×104 cells/mL。潟湖表层聚球藻丰度为1.7×103 cells/mL,远低于龙洞夜间和外礁坡表层聚球藻丰度。
龙洞日间原绿球藻(Prochlorococcus)表层丰度为2.9×104 cells/mL,是其丰度最大值层;丰度最小值层出现在60 m层,丰度为0.6×103 cells/mL。夜间原绿球藻丰度最大值层出现在40 m层,丰度为1.8×104 cells/mL,最小值出现在100 m层,丰度为0.3×103 cells/mL。外礁坡原绿球藻最大值层出现在10 m层,丰度为1.7×104 cells/mL;最小值层为200 m层,丰度为4.5×103 cells/mL。潟湖表层原绿球藻丰度为4.0×103 cells/mL,低于龙洞日间和外礁坡表层原绿球藻丰度。
龙洞内微微型真核浮游植物(Picoeukaryotes)主要集中在0~60 m水层,下层水体丰度低。日间微微型真核浮游植物丰度最大值层出现在40 m层,丰度为2.7×103 cells/mL;夜间丰度最大值层出现在20 m层,丰度为9.5×103 cells/mL。外礁坡微微型真核浮游植物主要出现在上层(0~10 m), 而下层水体(150和200 m)丰度极低。潟湖微微型真核浮游植物的丰度为0.7×102 cells/mL,低于龙洞内部和外礁坡微微型真核浮游植物丰度(见图 3)。
2.3 微型和小型浮游植物本研究共记录微型和小型浮游植物5门41属55种(含未定种),其中,硅藻(34种)和甲藻(15种)物种最多,分别占总种类数的63.0%和27.8%。龙洞日间与夜间微型和小型浮游植物总种类数均为34种,潟湖种类数仅有18种,外礁坡总种类数为24种(见表 1)。双鞭毛藻、菱形藻、蓝藻及隐藻是本研究中丰度较高的种类,束毛藻仅在外礁坡表现出较高的丰度,石囊藻仅在龙洞日间丰度较高。
|
|
表 1 龙洞及其邻近水域浮游植物种类组成 Table 1 Phytoplankton species composition of Yongle Blue Hole |
龙洞日间浮游植物丰度最大值出现在40 m层(9.8×104 cells/L),丰度最小值出现在100 m层(0.4×103 cells/L)。夜间浮游植物丰度随水深增加呈先增加后减小的趋势,最大值出现在20 m层(4.1×104 cells/L),最小值出现在150 m层(0.3×103 cells/L)。外礁坡浮游植物丰度最大值出现在表层(6.8×104 cells/L),潟湖表层浮游植物丰度为1.3×103 cells/L(见图 4)。
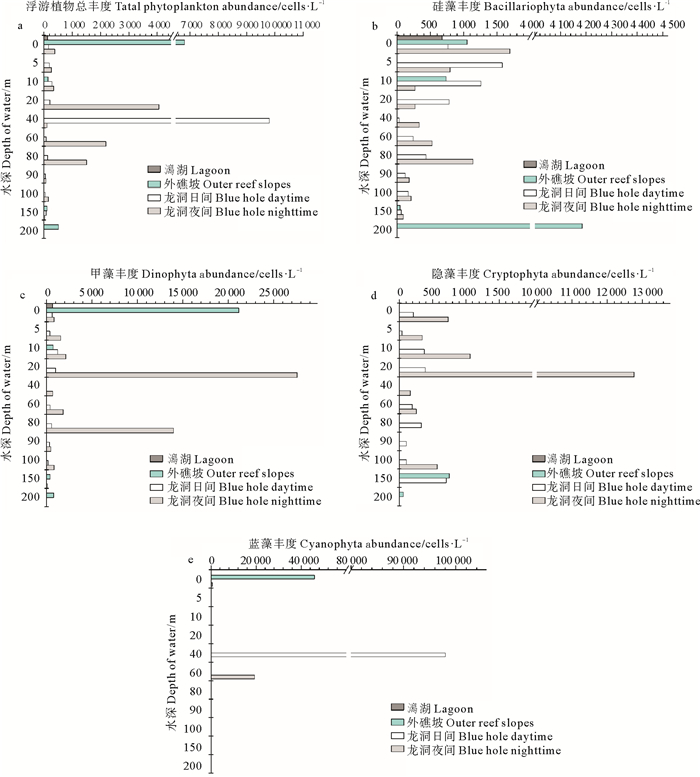
|
(a.总丰度;b.硅藻;c.甲藻;d.隐藻; e.蓝藻。a.Total abundance; b.Bacillariophyta; c.Dinophyta; d.Cryptophyta; e. Cyanophyta.) 图 4 浮游植物丰度垂直分布 Fig. 4 Vertical distribution of phytoplankton abundance |
龙洞日间硅藻丰度最大值出现在5 m层(1.6×103 cells/L),夜间最大值出现在表层(1.7×103 cells/L)。外礁坡硅藻丰度最大值出现在200 m层(4.2×103 cells/L)。潟湖内硅藻丰度为0.7×103 cells/L,低于龙洞和外礁坡表层硅藻丰度。
甲藻在龙洞日间丰度均较低,最大值出现在10 m层(1.2×103 cells/L),夜间甲藻主要集中在20和80 m层,20 m层是其丰度最大值层(2.8×104 cells/L)。外礁坡甲藻丰度最大值出现在表层(2.1×104 cells/L),高于其它层甲藻丰度。潟湖甲藻表层丰度为0.6×103 cells/L,与龙洞表层丰度相近,小于外礁坡表层甲藻丰度。
龙洞日间隐藻在各层分布较均匀,最大值层出现在150 m层(0.7×103 cells/L);夜间主要集中在20 m层(1.3×104 cells/L),高于其他水层隐藻丰度。外礁坡隐藻主要出现在下层水体,上层水体未采集到隐藻。潟湖表层也未采集到隐藻。
蓝藻日间主要出现在龙洞的40 m层,丰度为9.8×104 cells/L,其他水层均未出现蓝藻;夜间主要集中在40 m层,丰度为1.9×104 cells/L。外礁坡蓝藻主要集中在表层,丰度为4.6×104 cells/L,下层水体未采集到蓝藻。潟湖表层水体未采集到蓝藻。
2.4 永乐龙洞理化参数永乐龙洞水体理化参数由同航次CTD采集获得,水体多参数剖面显示:洞内存在多个温盐跃层,其中50 m水深处跃层最强;叶绿素a浓度垂向分布表现为多峰特征,90 m水层是其浓度最大值层;溶解氧垂向变化颇为复杂,在温盐跃层处迅速降低,且在90 m水层处降至0,即无氧状态。
3 讨论南海由于受到上升流、内波等影响,叶绿素a浓度垂直梯度明显[12],垂向变化多为单峰型,最大值常出现在次表层(春、夏季为75 m;冬季为50 m),表层和深层(>100 m)浓度都较低[13-14]。与南海开阔水域相比,龙洞叶绿素a浓度最大值出现的水层较浅,日间叶绿素a浓度最大值出现在40 m层(0.42 μg/L),夜间出现在20 m层(0.59 μg/L),高于南海开阔水域叶绿素a浓度(0.24 μg/L)[14]。与潟湖表层相比,龙洞表层叶绿素a浓度更低,其原因可能是潟湖内水深较浅,浮游植物都集中在表层。龙洞90 m水层处日间和夜间均未检测到叶绿素a(见图 2),而微微型、微型及小型浮游植物均在90 m层出现,其产生原因目前尚不明确,有待进一步研究。
南海原绿球藻平均丰度高于聚球藻和微微型真核浮游植物,原绿球藻和微微型真核浮游植物主要分布在100 m以浅的水层,聚球藻则分布在75 m以浅的水层[15-16]。永乐龙洞微微型浮游植物与南海存在显著差异:龙洞夜间上层(5~20 m)聚球藻丰度比原绿球藻和微微型真核浮游植物高出1个数量级,而原绿球藻丰度在40 m以下的水层高于聚球藻和微微型真核浮游植物(见图 3)。相较于聚球藻和原绿球藻,微微型真核浮游植物在洞内丰度最低,这与南海的研究结果一致[15]。其原因可能是微微型真核藻对营养的吸收、利用及环境承受能力相对较差,在竞争中不占优势,丰度较低[17]。
永乐龙洞微微型浮游植物昼夜变化显著。日间微微型浮游植物丰度最大值出现在表层,原绿球藻对其贡献率最高,聚球藻丰度较低;而夜间最大值转移至20 m层,原绿球藻丰度明显降低,聚球藻成为其丰度贡献率最大的类群。聚球藻丰度明显的昼夜变化主要集中在龙洞上层水体(0~20 m),20 m以下水层变化微小。原绿球藻日间丰度最大值出现在表层,远高于其他水层,夜间丰度最大层则下移至40 m。微微型真核浮游植物夜间丰度最大值出现在20 m层,而40 m层是其日间丰度最大层。外礁坡聚球藻和原绿球藻的垂直分布与龙洞也存在明显不同。外礁坡聚球藻丰度最大值出现在表层,而龙洞内丰度最大值出现在次表层(日间:20 m层;夜间:10 m层);外礁坡原绿球藻最大值出现在10 m层,而龙洞表层原绿球藻丰度最高。潟湖表层微微型浮游植物丰度低于龙洞和外礁坡,原绿球藻是其丰度最高的类群,聚球藻次之,这与龙洞和外礁坡表层微微型浮游植物的组成相似。
本研究共鉴定微型和小型浮游植物5门41属55种(含未定种),总种类数远小于南海观测资料[18-19](见表 2)。永乐龙洞浮游植物硅藻的种类数最多,其次为甲藻(见表 1),这与南海的研究结果相吻合[18-20]。龙洞微型和小型浮游植物的生物多样性高于潟湖和外礁坡,与浮游动物的同步观测结果一致[21]。其原因可能是龙洞内部空间异质性更高,从而提高了生物多样性[22]。
|
|
表 2 永乐龙洞浮游植物与南海相关研究的比较 Table 2 Comparison of phytoplankton in Yongle blue hole and South China Sea |
南海浮游植物以硅藻为主,其丰度占浮游植物总丰度的90%以上;甲藻次之,其丰度约占浮游植物总丰度的5%以内;金藻和蓝藻丰度较低[18, 23-24]。本研究中硅藻丰度未表现出明显的优势,甲藻对浮游植物总丰度的贡献高于硅藻,与南海历史研究资料存在显著差异。此外,龙洞浮游植物主要集中在20~80 m层,而表层和底层丰度低,这与南海浮游植物在上层水体丰度高的结论[25-26]也存在明显的差别。与南海北部浮游植物的研究[18-19, 25]比(见表 2),龙洞内浮游植物丰度处于较高水平。
外礁坡浮游植物丰度最大值层出现在表层,且甲藻和蓝藻对其丰度贡献率最高,与龙洞内浮游植物的垂直分布存在显著差异。龙洞内硅藻主要集中在80 m以上的水层,80 m以下水层丰度较低,而外礁坡硅藻集中在200 m层,其原因可能是龙洞内水体层化严重,垂向混合作用微弱,上层硅藻难以通过垂向混合作用进入下层水体。外礁坡和龙洞内的甲藻和蓝藻均集中在单一水层,且垂向分布差异明显。潟湖表层浮游植物主要以硅藻和甲藻为主,与龙洞表层浮游植物组成相似。
微型和小型浮游植物丰度最大值出现在20~40 m层,昼夜变化显著,这与浮游动物的分布趋势类似[21]。硅藻和甲藻作为微型和小型浮游植物的重要类群,也表现出明显的昼夜变化。硅藻日间主要分布在上层水体(0~20 m),而夜间集中在0~5 m水层和60~80 m水层。夜间甲藻在龙洞20和80 m水层处丰度极高,而日间甲藻在各水层丰度均较低(见图 4c)。本研究中蓝藻的昼夜变化较为特殊,日间蓝藻仅出现在40 m层,且丰度极高,夜间集中出现在60 m层,其具体成因还有待于进一步的调查和研究。隐藻虽然在之前南海的研究中很少提及[18, 20],但本次研究中隐藻也表现出明显的昼夜变化,且与叶绿素a昼夜变化存在较高的一致性(见图 2、4d)。
Iliffe等[8]发现在蓝洞深层的无光环境中没有浮游植物生存,无法光合作用产生氧气。本研究在溶解氧降至0的90 m及以下水层,仍然检测到浮游植物(见图 3、4),但其是否在90 m以下水层存活目前尚未可知,有待后续的观测和验证。南海龙洞作为目前世界上最深的蓝洞,其水深与外界水体的交换量及水体理化环境等因素与其他海洋蓝洞必然会存在差异,而这些差异都可能会对蓝洞内部浮游植物的分布产生影响。产生该差异的原因尚不明确,有待进一步的研究。
4 结论(1) 本研究共记录微型和小型浮游植物5门41属55种(含未定种)。其中,硅藻(34种)和甲藻(15种)种类数最多,分别占总种类数的63.0%和27.8%。日间龙洞丰度最高的类群为甲藻(5.0×104 cells/L),而夜间蓝藻丰度最高(9.8×104 cells/L)。
(2) 永乐龙洞浮游植物垂直分布昼夜变化明显。微微型浮游植物日间丰度最大值出现在表层,而夜间转移至20 m层;微型和小型浮游植物日间丰度最大值层出现在40 m层,夜间则上移至20 m层。
(3) 龙洞内微微型浮游植物丰度的垂向分布与外礁坡具有一定的相似性,上层丰度均高于下层;而潟湖表层微微型浮游植物丰度低于龙洞内。龙洞内微型和小型浮游植物生物多样性高于潟湖和外礁坡。
致谢: 感谢三沙航迹珊瑚礁保护研究所琼琼海渔03138号考察船船长陈宜川及全体船员在调查过程中提供了后勤支持和协助,马洪林、陈霖、杨迪松等协助采样,在此一并致谢。
| [1] |
Iliffe T M, Kornicker L S. Worldwide diving discoveries of living fossil animals from the depths of anchialine and marine caves[J]. Smithsonian Contributions to Marine Sciences, 2009, 38: 269-280.
(  0) 0) |
| [2] |
Navarrobarranco C, Guerragarcía J M, Sáncheztocino L, et al. Soft-bottom crustacean assemblages in Mediterranean marine caves: The cave of Cerro Gordo (Granada, Spain) as case study[J]. Helgoland Marine Research, 2012, 66(4): 567-576. DOI:10.1007/s10152-012-0292-5
(  0) 0) |
| [3] |
Fichez R. Benthic oxygen uptake and carbon cycling under aphotic and resource-limiting conditions in a submarine cave[J]. Marine Biology, 1991, 110(1): 137-143. DOI:10.1007/BF01313100
(  0) 0) |
| [4] |
黄邦钦, 洪华生, 林学举, 等. 台湾海峡微微型浮游植物的生态研究——Ⅰ.时空分布及其调控机制[J]. 海洋学报(中文版), 2003(4): 72-82. HUANG Bang-Qin, HONG Hua-Sheng, LIN Xue-Ju, et al. Ecological study on picophytoplankton in the Taiwan Strait——Ⅰ. Spatial and temporal distribution and its controlling mechanism[J]. Acta Oceanologica Sinica, 2003(4): 72-82. (  0) 0) |
| [5] |
Ereskovsky A V, Kovtun O A, Pronin K. Marine cave biota of the Tarkhankut Peninsula (Black Sea, Crimea), with emphasis on sponge taxonomic composition, spatial distribution and ecological particularities[J]. Journal of the Marine Biological Association of the United Kingdom, 2016, 96(2): 391-406. DOI:10.1017/S0025315415001071
(  0) 0) |
| [6] |
Garrabou J, Flos J. A simple diffusion-sedimentation model to explain planktonic gradients within a NW Mediterranean submarine cave[J]. Marine Ecology Progress, 1995, 123(1-3): 273-280.
(  0) 0) |
| [7] |
Sánchez M, Alcocer J, Escobar E, et al. Phytoplankton of cenotes and anchialine caves along a distance gradient from the northeastern coast of Quintana Roo, Yucatan Peninsula[J]. Hydrobiologia, 2002, 467(1-3): 79-89.
(  0) 0) |
| [8] |
Iliffe T M, Bishop R E. Adaptations to Life in Marine Caves[M]. Patrick Safran. Oxford, UK: UNESCO, 2007.
(  0) 0) |
| [9] |
毕乃双, 傅亮, 陈洪举, 等. 南海三沙永乐龙洞关键水体环境要素特征及其影响因素[J]. 科学通报, 2018(21): 2184-2194. BI Nai-Shuang, FU Liang, CHEN Hong-Ju, et al. Hydrographic features of the Yongle Blue Hole in the South China Sea and their influential factors[J]. Science Bulletin, 2018(21): 2184-2194. (  0) 0) |
| [10] |
Yu C, Xiu N, Zi L. Studies on primary production and new production of the Zhujiang Estuary, China[J]. Acta Oceanologica Sinica, 2002, 24(3): 101-111.
(  0) 0) |
| [11] |
国家海洋局. GB/T 12763. 6-2007海洋调查规范海洋生物调查[S].北京: 中国标准出版社, 2008. State Oceanic Administration. GB/T 12763. 6-2007 Specifications for Oceanographic Survey Marine Biological Survey[S]. Beijing: Standards Press of China, 2008. (  0) 0) |
| [12] |
于杰, 陈国宝, 张魁, 等. 南海中部海域夏季叶绿素a浓度垂向分布特征[J]. 南方水产科学, 2016, 12(4): 1-8. YU Jie, CHEN Guo-Bao, ZHANG Kui, et al. Vertical distribution of summer chlorophyll a concentration in the middle South China Sea[J]. South China Fisheries Science, 2016, 12(4): 1-8. DOI:10.3969/j.issn.2095-0780.2016.04.001 (  0) 0) |
| [13] |
黄良民. 南海不同海区叶绿素a和海水荧光值的垂向变化[J]. 热带海洋学报, 1992, 11(4): 89-95. HUANG Liang-Min. Vertical variations of chlorophyll a and fluorescence values of different areas in South China Sea[J]. Tropic Oceanology, 1992, 11(4): 89-95. (  0) 0) |
| [14] |
柯志新, 黄良民, 谭烨辉, 等. 2008年夏末南海北部叶绿素a的空间分布特征及其影响因素[J]. 热带海洋学报, 2013, 32(4): 51-57. KE Zhi-Xin, HUANG Liang-Min, TAN Ye-Hui, et al. Spatial distribution of chlorophyll a and its relations with environmental factors in northern South China Sea in late summer 2008[J]. Journal of Tropical Oceanography, 2013, 32(4): 51-57. DOI:10.3969/j.issn.1009-5470.2013.04.008 (  0) 0) |
| [15] |
张渊洲, 张健林, 杨清松, 等. 南海北部春季微微型浮游植物丰度的分布[J]. 生物学杂志, 2015, 32(5): 58-62. ZHANG Yuan-Zhou, ZHANG Jian-Lin, YANG Qing-Song, et al. The abundance distribution of picophytoplankton in the northern South China Sea in spring[J]. Journal of Biology, 2015, 32(5): 58-62. (  0) 0) |
| [16] |
王军星, 谭烨辉, 黄良民, 等. 冬季南海南部微微型浮游植物分布及其影响因素[J]. 生态学报, 2016(6): 1698-1710. WANG Jun-Xing, TAN Ye-Hui, HUANG Liang-Min, et al. Wintertime picophytoplankton distribution and its driving factors in the southern South China Sea[J]. Acta Ecologica Sinica, 2016(6): 1698-1710. (  0) 0) |
| [17] |
Romari K, Vaulot D. Composition and temporal variability of picoeukaryote communities at a coastal site of the English Channel from 18S rDNA sequences[J]. Limnology & Oceanography, 2004, 49(3): 784-798.
(  0) 0) |
| [18] |
孙军, 宋书群, 乐凤凤, 等. 2004年冬季南海北部浮游植物[J]. 海洋学报(中文版), 2007(5): 132-145. SUN Jun, SONG Shu-Qun, LE Feng-Feng, et al. Phytoplankton in northern South China Sea in the winter of 2004[J]. Acta Oceanologica Sinica, 2007(5): 132-145. (  0) 0) |
| [19] |
马威, 孙军, 田伟. 2009年冬季南海北部网采浮游植物群落结构[J]. 海洋科学, 2011, 35(9): 8-13. MA Wei, SUN Jun, TIAN Wei. Community structure of netz-phytoplankton in northern South China Sea in winter, 2009[J]. Marine Sciences, 2011, 35(9): 8-13. (  0) 0) |
| [20] |
李涛, 刘胜, 王桂芬, 等. 2004年秋季南海北部浮游植物组成及其数量分布特征[J]. 热带海洋学报, 2010, 36(2): 65-73. LI Tao, LIU Sheng, WANG Gui-Fen, et al. Species composition of phytoplankton and its distribution in the northern South China Sea in autumn 2004[J]. Journal of Tropical Oceanography, 2010, 36(2): 65-73. (  0) 0) |
| [21] |
陈畅, 傅亮, 毕乃双, 等. 南海西沙永乐龙洞浮游动物的群落组成及昼夜垂直分布特征[J]. 海洋与湖沼, 2018, 49(3): 594-603. CHEN Chang, FU Liang, BI Nai-Shuang, et al. Zooplankton community composition and diel vertical distribution in the Yongle Blue Hole, XiSha islands, South China Sea[J]. Oceanologia et Limnologia Sinica, 2018, 49(3): 594-603. (  0) 0) |
| [22] |
Griffin J N, Jenkins S R, Gamfeldt L, et al. Spatial heterogeneity increases the importance of species richness for an ecosystem process[J]. Oikos, 2010, 118(9): 1335-1342.
(  0) 0) |
| [23] |
乐凤凤, 宁修仁. 南海北部浮游植物生物量的研究特点及影响因素[J]. 海洋学研究, 2006, 24(2): 60-69. LE Feng-Feng, NING Xiu-Ren. Variations of the phytoplankton biomass in the northern South China Sea[J]. Journal of Marine Science, 2006, 24(2): 60-69. (  0) 0) |
| [24] |
徐宗军, 孙萍, 朱明远, 等. 南海北部春季网采浮游植物群落结构初步研究[J]. 海洋湖沼通报, 2011(2): 100-106. XU Zong-Jun, SUN Ping, ZHU Ming-Yuan, et al. The preliminary study of netz-phytoplankton community structure in north of South China Sea in spring[J]. Transactions of Oceanology and Limnology, 2011(2): 100-106. (  0) 0) |
| [25] |
柯志新, 黄良民, 谭烨辉, 等. 2007年夏季南海北部浮游植物的物种组成及丰度分布[J]. 热带海洋学报, 2011, 30(1): 131-143. KE Zhi-Xin, HUANG Liang-Min, TAN Ye-Hui, et al. Species composition and abundance of phytoplankton in the northern South China Sea in summer 2007[J]. Journal of Tropical Oceanography, 2011, 30(1): 131-143. (  0) 0) |
| [26] |
马威, 孙军, 薛冰, 等. 2010年秋季南海北部浮游植物群落结构研究[J]. 海洋学报, 2016, 38(4): 43-53. MA Wei, SUN Jun, XUE Bing, et al. Phytoplankton community structure of northern South China Sea in autumn of 2010[J]. Acta Oceanologica, 2016, 38(4): 43-53. (  0) 0) |
2. Laboratory of Marine Ecology and Environmental Science, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266200, China;
3. Key Laboratory of Marine Environment and Ecology, Ministry of Education, Ocean University of China, Qingdao 266100, China;
4. Sansha Trackline Institute of Coral Reef Environment Protection, Sansha 573199, China;
5. Key Laboratory of Submarine Geosciences and Prospecting Technique, Ministry of Education, Ocean University of China, Qingdao 266100, China;
6. Key Laboratory of Marine Chemistry Theory and Technology, Ministry of Education, Ocean University of China, Qingdao 266100, China
 2020, Vol. 50
2020, Vol. 50


