2. 中国科学院海洋研究所海洋生态与环境科学重点实验室,山东 青岛 266072;
3. 青岛海洋科学与技术国家实验室海洋生态与环境科学功能实验室,山东 青岛 266071;
4. 浙江环科环境咨询有限公司,浙江 杭州 311121
耳石作为硬骨鱼类内耳膜迷路内的结石,会在鱼类生长发育过程中持续生长。鱼类耳石形态(如轮纹的宽度、清晰度、颜色深浅、耳石外轮廓、长短轴比例等)常常会因鱼体生理或生存环境的胁迫表现出与正常个体间存在一定的特殊差异,进而有效地记录鱼类在生长和发育过程中所经历的某些重要节点及特殊生活事件,如孵化、初次摄食、变态、栖息地的迁入或迁出及生活环境的剧烈变化[1-2]。且同种鱼类的不同生态群体由于受外界环境因子的影响,生长发育常常存在显著性差异,从而影响耳石的沉积,形成群系特异性[3-4]。
小黄鱼作为中国近海重要的经济鱼类,其资源量在近几十年一直处于动态变化当中。目前,小黄鱼在各海域均遭受充分或过度开发,资源出现一定的衰退[5]。因此,科学的生物学研究方法对其资源的合理开发和可持续利用具有重要意义。耳石作为可以记录鱼体生长的特殊结构,其形态学研究已在鱼类生物学及渔业资源评估中得到广泛应用,且石首鱼科鱼类的耳石较其它科属的鱼类更为明显,预测具有更好的生物学意义。本研究探讨了10个耳石度量指标与鱼体体长、体质量的关系,耳石形态与小黄鱼特殊生活史阶段的关系,并对耳石形态在小黄鱼群体识别方面的应用做了初步探索,对丰富我国底层洄游型鱼类的生活史研究及对小黄鱼不同生态群体划分具有重要意义。
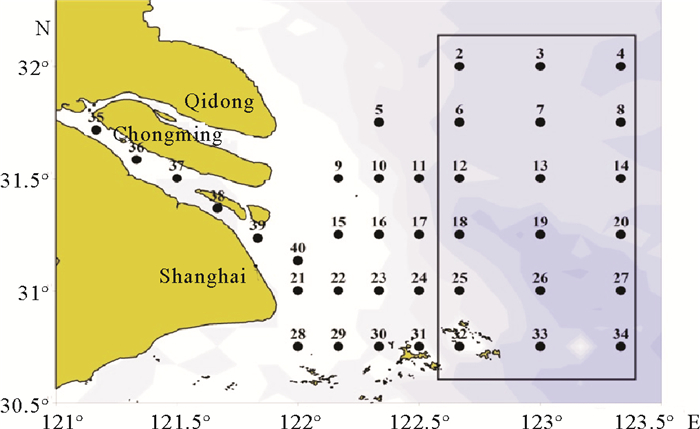
1 材料与方法 1.1 材料选取本研究的小黄鱼耳石取自中国科学院海洋研究所于长江口所采集的小黄鱼样本,调查采样租用底层双拖网渔船(300 HP),调查网具为150.5 m×96.5 m轻拖网,采样区域见图 1,样本组成见表 1,本研究左右耳石重量无显著性差异(t=-0.604,P=0.546),故统一采用右耳石作为研究材料。
|
图 1 长江口小黄鱼采样站位图(黑色实线内) Fig. 1 Stations of L.polyactis sampling from the Yangtze River Estuary(within black solid line) |
|
|
表 1 小黄鱼样本组成状况分布表 Table 1 Distribution of sample composition |
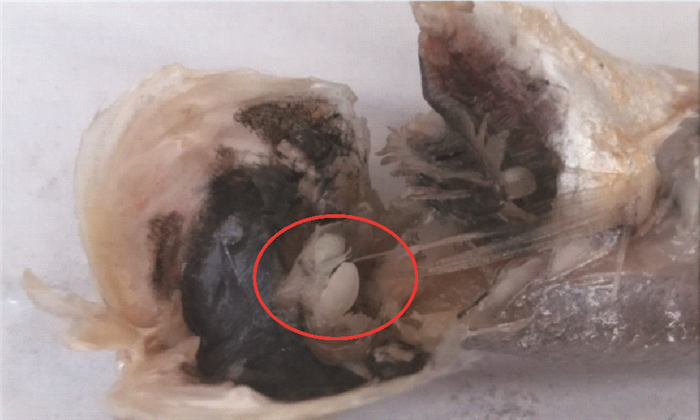
解剖小黄鱼头部,于内耳的球状囊内采集耳石(见图 2),置于离心管中。此时,需将离心管对应鱼体进行编码,以确保数据的对应性。向盛有耳石的离心管中加入蒸馏水,浸泡耳石24 h,再于超声波清洗器中50 ℃清洗30 min,而后50 ℃烘箱内干燥完全,置于室内冷却至恒温。将清洗、干燥后的小黄鱼耳石放于分析天平上进行称重(精确度0.1 mg),利用EXPLOIT游标卡尺测量耳石最大厚度(OT)(精确度为0.01 mm)(见图 3)。
|
图 2 小黄鱼耳石采集 Fig. 2 Otolith sampling for L. polyactis |

|
图 3 小黄鱼耳石厚度测量 Fig. 3 Otolith thickness measurement for L. polyactis |
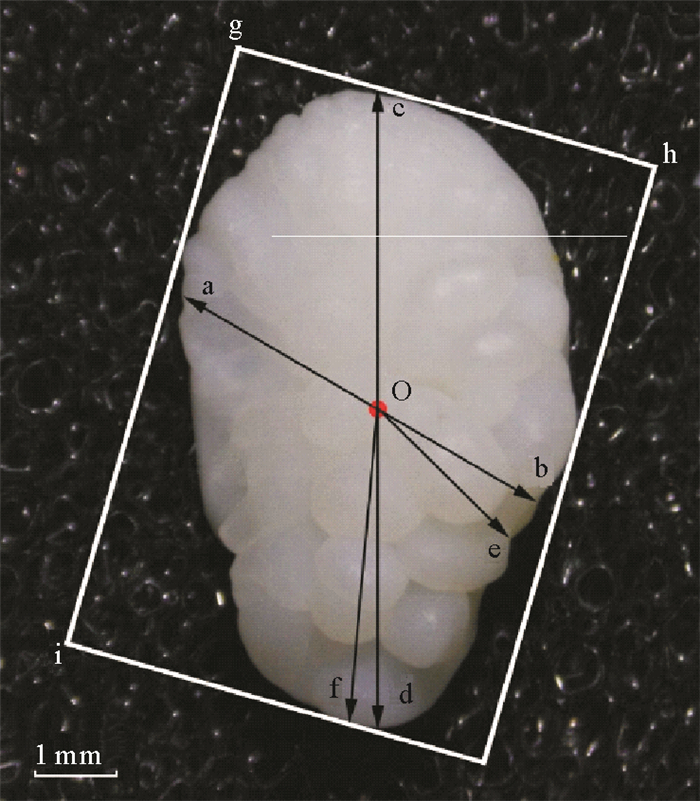
由于小黄鱼耳石属曲面型耳石,在进行耳石图像采集时会因为角度摆放不同而造成人工误差,为减小误差,本研究将耳石内侧面朝下,外侧面朝上,利用Motic三目体视显微镜仅对耳石外侧面进行图像拍摄。将拍摄完毕后的耳石图像利用软件Image-pro plus6.0进行图像分析,得到的耳石度量指标:耳石面积(OA)、耳石周长(OP)、耳石宽(OW)(ab);耳石长(OL)(cd);耳石最小半径(ORmin)(oe);耳石最大半径(ORmax)(of);耳石最小Feret径长(Fmin)(gh);耳石最大Feret径长(Fmax)(gi);O为几何中心[6] (见图 4)。再利用耳石度量指标换算得到耳石形态指标(见表 2)。
|
图 4 小黄鱼耳石度量指标 Fig. 4 Otolith measurement indexes of L. polyactis |
|
|
表 2 小黄鱼耳石度量指标和形态指标 Table 2 Otolith measurement indexes and shape indexes of L. polyactis |
在耳石形态指标中,环率和圆度表征耳石外轮廓趋近于圆形的程度,环率越小或是圆度越大,表明耳石外轮廓更趋近于圆形;矩形趋近率表征耳石轮廓与其最小外接矩形的关系;椭圆率表示外缘点到长短轴间的距离是否成比例;耳石密度描述了单位面积内耳石的质量,值越大,表明耳石越厚,反映了耳石的三维特征;形态因子描述了耳石轮廓的规则程度,值越大,耳石轮廓越规则;幅形比、F比、半径比都是表示耳石长轴与短轴的生长差异。以上耳石形态指数在一定程度上消除了因耳石本身大小不同或是人为摆放位置的差异等各种客观因素对耳石形态分析的影响(见表 2)。
本研究还探讨了耳石绝对尺寸和耳石相对尺寸与鱼体生长的关系。其中耳石绝对尺寸是指直接利用标尺度量的耳石指标,耳石相对尺寸=100%×耳石绝对尺寸/体长
1.3 数据分析所有数据分析都是利用软件shape、spss20.0、sigmaplot12.5、Image-Pro Plus 6.0及excel 2010完成。
利用Image-pro plus6.0图像处理软件得到小黄鱼10项耳石度量指标后,利用线性函数、幂函数和指数函数探讨其与体长、体质量的关系,并分析耳石绝对尺寸和耳石相对尺寸随鱼体生长的变化关系。
利用SPSS20.0对10项耳石形态指标进行主成分分析(PCA),得到最具代表性的耳石形态指标并用于描述小黄鱼的耳石形态特征,分析其与鱼体体长的关系[7]。
利用shape软件对小黄鱼进行耳石外轮廓的傅里叶分析,其中需将前3个固定系数(a1=1,b1=c1=0)剔除,仅保留77个系数值用于耳石外轮廓的后续分析。最后利用SPSS20.0中的Fisher逐步判别法对小黄鱼不同生态群体进行判别,得到判别成功率。群体判别成功率%=(判别正确个体数/群体总个体数)×100%。
在利用耳石形态进行群体判别时,为消除体长及年龄对耳石生长的影响,本文选取的小黄鱼样本为体长范围130~140 mm的1龄个体(t=-1.221,P=0.223),且T检验发现不同性别间的10项耳石形态指标无显著差异(P=0.150~0.912)。同时,对春秋两季群体分别进行各年份间配对样本T检验,发现同一群体在不同年份间并无显著性差异,排除因年份不同而带来的群体差异(见表 3)。而后,对所有的耳石形态指标进行对数[log(X+1.1)]转换,以提高数据分析的准确度[8]。
|
|
表 3 小黄鱼春秋两季群体不同年份间耳石形态指标差异性比较(体长范围130~140 mm,1龄) Table 3 Comparison of otolith shape indexes of L. polyactisbetween different groups(Body length range from 130 mm to 140 mm, 1 year) |
在进行耳石度量指标与鱼体体长、体质量关系函数拟合之前,先对数据进行异常值检验,剔除异常值。本研究分别利用线性函数、幂函数及指数函数3个函数模型拟合耳石度量指标与体长、体质量间的关系,得到相关系数R2(见表 4)。
|
|
表 4 耳石度量指标与体长、体质量相关性分析 Table 4 Correlation analysis between otolith measurement indexes and body length、body weight respectively |
观察20组关系式发现,幂函数在20组关系间拟合效果最佳。耳石质量和耳石最大半径与体长和体质量的拟合效果较好(R2=0.781~0.833)。同时发现,耳石长轴(耳石最大半径、耳石长、耳石最大Feret径长)与体长、体质量的关系拟合度较短轴(耳石最小半径、耳石宽、耳石最小Feret径长)更佳(见表 4)。
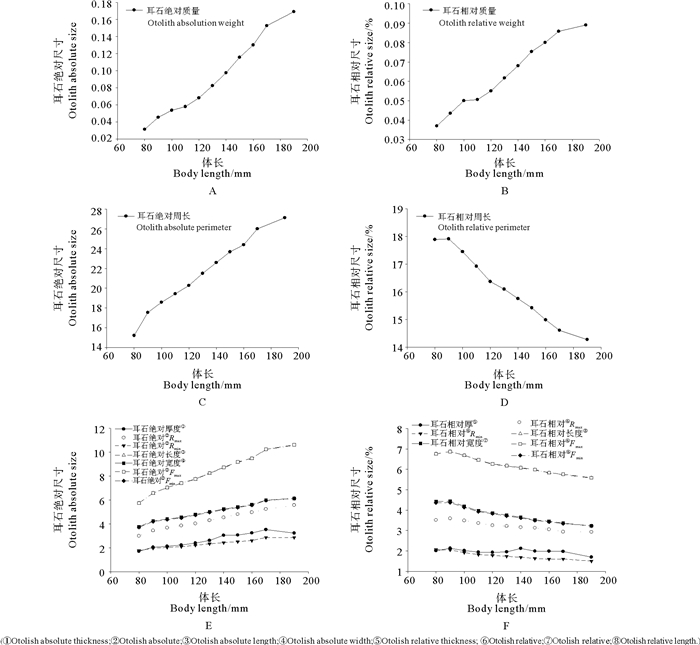
2.2 耳石绝对尺寸和相对尺寸与体长的关系耳石绝对尺寸随鱼体的生长不断增大(见图 5A、C、E),其中耳石绝对厚度在体长110~170 mm之间出现波动,表现为快速增大的趋势(见图 5E)。
|
图 5 耳石绝对尺寸和耳石相对尺寸与体长的关系 Fig. 5 Relationship between body length and absolute size and relative size of otolith for L. polyactis |
耳石相对尺寸中,只有耳石相对质量(OW/L)随体长的增加逐渐增大,从体长为80 mm时的0.037%上升至体长为190 mm时的0.089%(见图 7B);耳石相对周长(OP/L)、耳石相对厚度(OT/L)、耳石相对最大半径(ORmax/L)、耳石相对最小半径(ORmin/L)、耳石相对长度(OL/L)、耳石相对宽度(OW/L)、耳石相对最大Feret径长(Fmax/L)、耳石相对最小Feret径长(Fmin/L)都随体长的增加逐渐减小,分别从体长为80 mm时的17.886%、2.012%、3.514%、2.065%、6.757%、4.423%、6.756%、4.364%下降至体长为190 mm时的14.279%、1.700%、2.929%、1.506%、5.575%、3.229%、5.596%、3.227%(见图 5D、F)。观察发现,耳石相对厚度在体长110~170 mm时出现大幅增长,随后有所下降(见图 5F)。
|
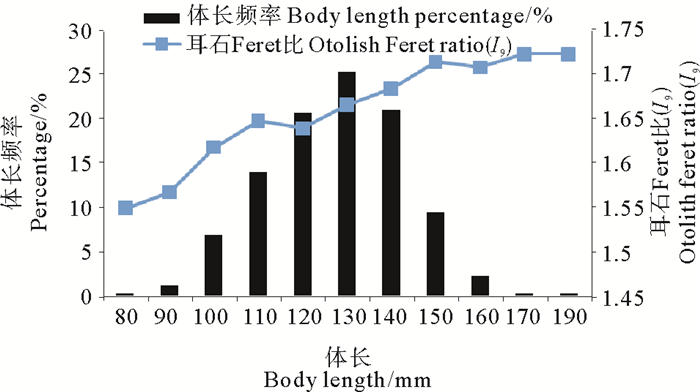
图 7 耳石Feret比(I9)与鱼体体长的关系 Fig. 7 Relationship between otolith Feret ratio(I9) and body length of L. polyactis |
对小黄鱼10个耳石形态指标进行主成分分析,发现前3个主成分(特征值>1)累积贡献率达80.414%(见表 5)。根据主成分载荷系数(见表 6)发现,耳石圆度(I2)、F比(I9)与第一主成分的关系最为密切,主要反映了耳石的长、短轴差异。所以本研究利用耳石圆度(I2)、F比(I9)来代表 10项耳石形态参数并用于描述小黄鱼的耳石形态特征,分析其与鱼体生长的关系。
|
|
表 5 主成分分析累积结果 Table 5 Accumulation results of PCA |
|
|
表 6 耳石形态指标主成分分析 Table 6 PCA results of otolith shape indexes |
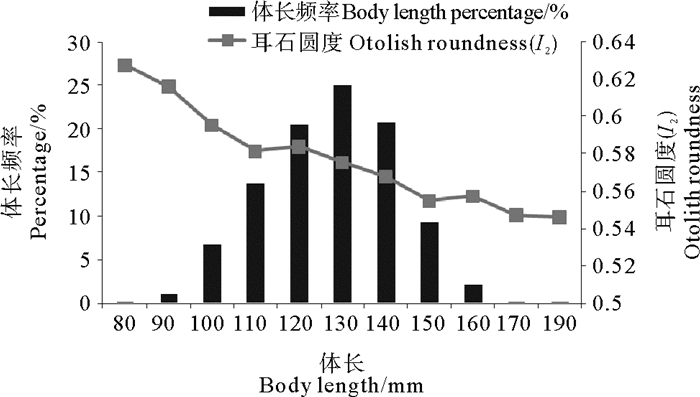
耳石圆度(I2)随鱼体体长的增加逐渐减小,当体长为80~110 mm时,耳石圆度(I2)下降趋势明显,当体长为110~160 mm时,耳石圆度(I2)下降趋势变缓,当体长大于160 mm时,耳石圆度(I2)下降趋势逐渐趋向平稳(见图 6)。
|
图 6 耳石圆度(I2)与鱼体体长的关系 Fig. 6 Relationship between otolith roundness(I2) and body length of L. polyactis |
耳石Feret比(I9)随鱼体体长的增大逐渐增大,当体长为80~110 mm时,耳石Feret比(I9)上升趋势明显,当体长为110~160 mm时,耳石Feret比(I9)上升趋势变缓,当体长大于160 mm时,耳石Feret比(I9)上升趋势逐渐趋向平稳(见图 7)。
2.4 耳石形态与生态群体判别 2.4.1 耳石形态指标法利用10项耳石形态指标进行小黄鱼春秋2个生态群体识别时,利用T-test分析去除2个生态群体中不存在显著差异的圆度(I2)(t=0.51,P=0.608)和耳石密度(I5)(t=-0.399,P=0.690),只保留其他8项耳石形态指标进行不同生态群体间的判别分析,得到以6个耳石形态指标(I1、I6、I7、I8、I9、I10)为自变量的判别方程,且春秋2个生态群体的判别成功率分别为85.4%和81.7%。
Y春季群体=42 783.165 I1+450.512 I6+807 511.473 I7+46 415.586 I8+22 840.093 I9+932.460 I10-693 903.941。
Y秋季群体=42 770.327 I1+444.129 I6+807 241.230 I7+46 566.987 I8+22 864.692 I9+951.066 I10-693 642.020。
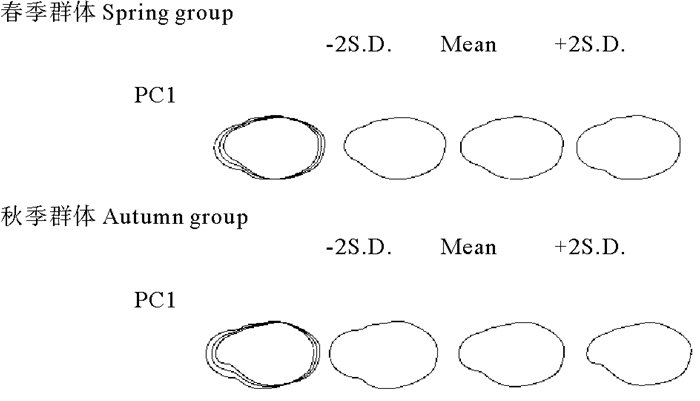
2.4.2 傅里叶分析法利用傅里叶分析法进行小黄鱼春秋两个生态群体识别时,首先利用shape软件提取耳石外轮廓(见图 8),得到描述耳石外轮廓的77个傅里叶谐值,利用T-test分析去除2个生态群体中不存在显著差异的49个傅里叶谐值(P>0.05),仅保留28个谐值进行后续的Fisher判别分析,最终得到以11个傅里叶谐值(C6、C25、C30、C43、C45、C46、C53、C56、C62、C64、C77)为自变量的判别方程,且春秋两个生态群体的判别成功率分别为84.8%和85.2%。
|
图 8 小黄鱼耳石外轮廓(春季群体(上)、秋季群体(下) Fig. 8 Outer contour of otolith of L. polyactis spring group(up), autumn group(down) |
Y春季群体=-120.979 C6+132.162 C25+134.023 C30-40.525 C43+103.203 C45+2.939 C46-84.282 C53-20.134 C56+110.447 C62-98.148 C64-412.498 C77-4.211。
Y秋季群体=-320.662 C6+30.355 C25+301.533 C30-120.716 C43+272.818 C45+144.579 C46-459.547 C53-228.838 C56+166.620 C62-191.374 C64-843.904 C77-9.807。
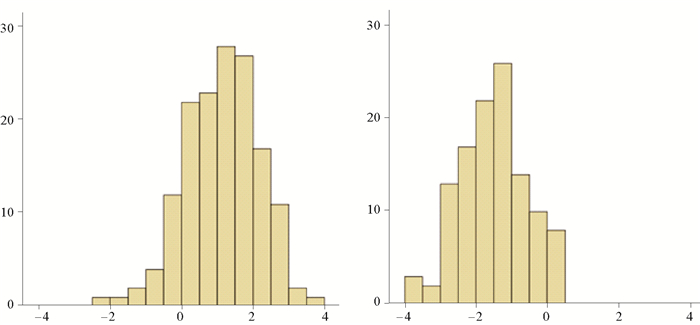
2.4.3 综合指标法最后本研究利用8个耳石形态指标和28个傅里叶谐值综合判别小黄鱼春秋2个生态群体,得到判别成功率分别为92.7%和91.3%(见图 9、表 7)。
|
(左:春季群体;右:秋季群体。Left:spring group; Right:autumn group.) 图 9 小黄鱼群体判别分析图 Fig. 9 Discriminant analysis of different groups of L. polyactis) |
|
|
表 7 小黄鱼春季群体和秋季群体判别结果比较 Table 7 Comparison of discriminant analysis results of spring group and autumn group of L.polyactis |
耳石随鱼体发育会呈现一定的生长规律,当观察鱼体生长受限时,常可通过耳石来评估鱼体的生长,因此,耳石与鱼体生长关系的研究一直是国内外鱼类学研究的热点[9-12],在渔业资源评估及管理中具有一定的意义。
很多研究认为,耳石尺寸与鱼体大小之间一般存在显著的线性相关,如太湖新银鱼(Neosalanx taihuensis)、中华沙鳅(Botia superciliaris)、赤鼻棱鳀(Thryssa kammalensis)、细条天竺鲷(Apogon lineatus)等[13-15]。本研究统计发现,除了耳石厚度以外,其余小黄鱼各耳石形态指标与体长(R2=0.639~0.833)、体质量(R2=0.555~0.801)基本呈显著的幂函数关系。通过比较分析发现,耳石长轴(耳石最大半径、耳石长、耳石最大Feret径长)与体长、体质量的关系拟合度较短轴(耳石最小半径、耳石宽、耳石最小Feret径长)更好。且在耳石相对尺寸中,长轴的变化趋势相对稳定,因此在近海小黄鱼的渔业资源评估中,利用耳长轴来推算鱼体体长及体质量更为合理。
本研究结果发现,小黄鱼耳石圆度(I2)和耳石Feret比(I9)随鱼体体长的增加分别逐渐减小和增大,且减小和增大的趋势逐渐变缓。在体长为110和160 mm时,耳石圆度(I2)分别出现减小速率变缓的拐点,Feret比(I9)分别出现增大速率变缓的拐点。通常认为,耳石形态的特殊变化常常是因为鱼体经历了生长发育中的特殊时期,如生长阶段的转变、栖息地的改变及生存环境的突变等[16]。小黄鱼耳石圆度(I2)和耳石Feret比(I9)的2个变化拐点恰好分别与性成熟体长(108 mm)和生长速率变缓的拐点体长(169.2 mm)接近。小黄鱼生长速率变缓的拐点年龄(2龄)落后于性成熟年龄(一般为当龄鱼) [17-18],会在性成熟后仍有一段快速生长的阶段[19]。推测此时耳石形态受鱼体生长率的影响,表现出一定的特殊性。同时,耳石绝对厚度和耳石相对厚度在性成熟体长和生长速率变缓的拐点体长之间出现异常快速增长的现象。可见,耳石二维特征和三维特征都可有效记录小黄鱼特殊生长阶段的变化,这为今后研究小黄鱼的生长发育及生活史研究提供有效依据,丰富了底层洄游性鱼类生物学研究。
相关研究已表明,在小黄鱼仔稚鱼期,耳石半径与体长就已存在显著的生长一致性[20]。因此,加强小黄鱼整个生长阶段的耳石形态学研究可为了解小黄鱼生长发育特征、生活史、渔业资源管理提供有效依据。
3.2 耳石形态在群体识别中的应用合理有效地筛选表征性强的耳石形态参数对提高鱼类群体识别能力至关重要,使用单一耳石形态参数一般会造成较大的误差,如Longmore利用单一耳石参数对北大西洋的4个圆吻突吻鳕(Coryphaenoides rupestris)群体进行判别,发现判别成功率仅为43%[21];Petursdottir研究了冰岛3个大西洋鳕(Gadus morhua)群体,发现利用单一耳石形态进行群体判别时,判别率仅为21.1%~60.3%,而多个耳石形态参数使判别成功率达到50.9%~79.5%[22],所以通常认为多个耳石形态参数往往更有利于进行鱼类物种及群体间的判别分析。
本研究仅利用耳石形态指数得到小黄鱼5月春季群体及11月秋季群体的判别率分别85.4%和81.7%,10个耳石形态指数有6个纳入最终判别分析,信息有效占比60.0%;利用傅里叶分析得到的判别率分别为84.8%和85.2%,矢耳石提取77个椭圆傅里叶谐值中有28个谐值经筛选纳入判别分析,信息有效占比36.4%[23];结合2个形态指标得到的判别率达92.7%和91.3%。可见,无论是耳石形态指标还是耳石傅里叶指数,都可有效地进行小黄鱼不同群体的判别分析,而综合指标能有效地提高判别成功率。如果单用一种耳石形态指标进行群体判别时,耳石形态指数可更有效地提取耳石信息。因此,在今后小黄鱼耳石形态研究中,应合理挑选耳石有效参数,准确、高效地提高群体间的判别结果。
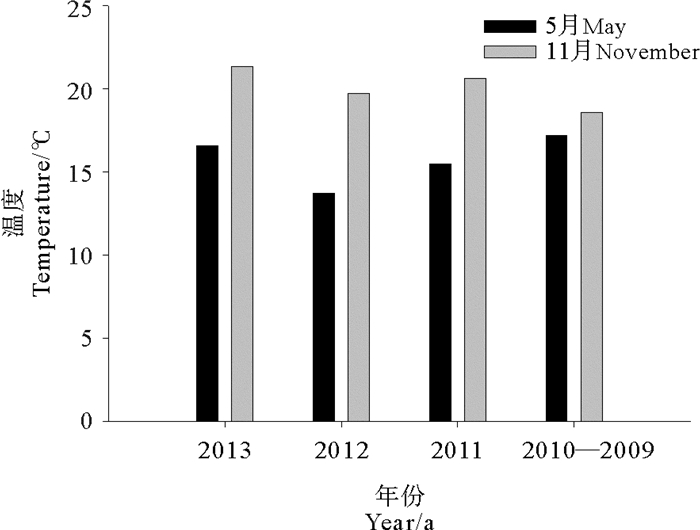
以往利用小黄鱼耳石进行判别分析多关注于不同地理区域的群体[24-25],鲜有应用于同一区域不同季节的生态群体。相关研究已表明,鱼类生存环境的异质性可导致同一鱼种的不同群体之间产生个体耳石形态差异[26]。本研究中,耳石形态在春秋两季生态群体中有较高的识别率,个体耳石形态差异较大,认为这与长江口不同季节的环境变化有关。王茂林(2009)发现,鱼类耳石的生长与海水中钙浓度有直接关系[27],河口区碳酸钙的沉降作用与悬浮泥沙的沉积存在关联[28],而悬浮泥沙的季节性变化主要受径流量的影响[29]。12~5月为枯季,长江口输沙量较少,碳酸钙沉降作用较弱,5月春季群体所处环境中碳酸钙浓度较低;相反,6~11月为雨季,长江口输沙量增多,碳酸钙沉降作用明显,小黄鱼秋季群体所处环境中碳酸钙浓度较高。同时,有研究表明,高温能加快耳石的沉积速率[30]。小黄鱼属底层洄游型鱼类,因此本研究比较了不同月份间研究区域底层的平均温度,发现11月温度明显高于5月(见图 10),且经T-test发现两个月份间的温度存在极显著性差异(P < 0.01),这可能也是导致11月耳石形态异于5月的原因之一。因此,在利用耳石进行小黄鱼不同地理群体判别时,需要考虑同一区域内不同季节的样本异质性,以免带来判别误差。
|
图 10 5月及11月底层平均温度比较 Fig. 10 Comparison of bottom average temperature between May and November |
| [1] |
Wright P J, Woodroffe D A, Gibb F M, et al. Verification of first annulus formation in the illicia and otoliths of white anglerfish, Lophius piscatorius using otolith microstructure[J]. ICES Journal of Marine Science: Journal du Conseil, 2002, 59(3): 587-593. DOI:10.1006/jmsc.2002.1179
(  0) 0) |
| [2] |
TabetaO, tanaka K, Yamada J. Aspects of the early life history of the Japanese eel Anguilla japonica determined from otolith microstructure[J]. Bull Jap Soc scient Fish, 1987, 53(10): 1727-1334. DOI:10.2331/suisan.53.1727
(  0) 0) |
| [3] |
Stransky C, Murta A G, Schlickeisen J, et al. Otolith shape analysis as a tool for stock separation of horse mackerel (Trachurus trachurus) in the Northeast Atlantic and Mediterranean[J]. Fisheries Research, 2008, 89(2): 159-166. DOI:10.1016/j.fishres.2007.09.017
(  0) 0) |
| [4] |
王英俊, 叶振江, 杨永桓, 等. 耳石形态在黄海蓝点马鲛群体鉴别方面的应用[J]. 中国海洋大学学报(自然科学版), 2007, 37(sup.): 155-158. Wang Y J, Ye Z J, Yang Y H, et al. Stock identification of Spanish mackerel (Scoberomorus Niphonius) in the Yellow Sea using otolith morphology[J]. Periodical of Ocean University of China, 2007, 37(sup.): 155-158. (  0) 0) |
| [5] |
严利平, 刘尊雷, 张辉, 等. 小黄鱼生物学特征与资源数量的演变[J]. 海洋渔业, 2014, 36(6): 481-488. Yan L P, Liu Z L, Zhang H, et al. On the evolution of biological characteristics and resources of small yellow croaker[J]. Marine Fisheries, 2014, 36(6): 481-488. (  0) 0) |
| [6] |
潘晓哲, 高天翔. 基于耳石形态的鱼喜属鱼类鉴别[J]. 动物分类学报, 2010, 35(4): 799-805. Pan X Z, Gao T X. Sagittal otolith shape used in the discrimination of fishes of the genus sillago in China[J]. Acta Zootaxonomica Sinica, 2010, 35(4): 799-805. (  0) 0) |
| [7] |
王旭, 韩志强, 朱柏军, 等. 东海小黄鱼耳石形态特征研究[J]. 浙江海洋学院学报(自然科学版), 2012, 31(6): 492-496. Wang X, Han Z Q, Zhu B J, et al. Morphologic features of statolith for Pseudosciaena polyactis in the East China Sea[J]. Journal of Zhejiang Ocean University(Natural Science), 2012, 31(6): 492-496. (  0) 0) |
| [8] |
窦硕增, 于鑫, 曹亮. 鱼类矢耳石形态分析及其在群体识别中的应用实例研究[J]. 海洋与湖沼, 2012, 43(4): 702-712. Dou S Z, Yu X, Zao L. Otolith shape analysis and its application in fish stock disceimination: A case study[J]. Oceanologia Et Limnologia Sinica, 2012, 43(4): 702-712. DOI:10.11693/hyhz201204003003 (  0) 0) |
| [9] |
Meekan M G, Dodson J J, Good S P, et al. Otolith and fish size relationships, measurement error, and size-selective mortality during the early life of Atlantic salmon (Salmo salar)[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1998, 55(7): 1663-1673. DOI:10.1139/f98-047
(  0) 0) |
| [10] |
Battaglia P, Malara D, Romeo T, et al. Relationships between otolith size and fish size in some mesopelagic and bathypelagic species from the Mediterranean Sea (Strait of Messina, Italy)[J]. Scientia Marina, 2010, 74(3): 605-612. DOI:10.3989/scimar.2010.74n3
(  0) 0) |
| [11] |
刘伟, 战培荣, 赵春刚, 等. 黑龙江秋大麻哈鱼耳石形态发育研究[J]. 水生生物学报, 2010, 34(6): 1069-1076. Liu W, Zhan P R, Zhao C G, et al. Study on morphological development of fall chum salmon(oncorhynchus keta) otolitn in Heilongjiang River[J]. Acta Hydrobiologica Sinica, 2010, 34(6): 1069-1076. (  0) 0) |
| [12] |
区又君, 廖锐, 李加儿, 等. 珠江口棘头梅童鱼耳石的生长特性[J]. 动物学杂志, 2012, 47(1): 88-95. Qu Y J, Liao R, li J E, et al. Otolith growth characteristics of Collichthys lucidusfrom the Pearl River estuary[J]. Chinese Journal of Zoology, 2012, 47(1): 88-95. (  0) 0) |
| [13] |
杨青瑞, 刘建虎, 吴强, 等. 三峡水库太湖新银鱼耳石日轮与生长的研究[J]. 淡水渔业, 2007, 37(3): 59-62. Yang Q R, Liu J H, Wu Q, et al. salmoniformes studies on daily-growth increment of otolith and growth of Taihu icefish, Neosalanx taihuensis[J]. Freshwater Fisheries, 2007, 37(3): 59-62. (  0) 0) |
| [14] |
赵天, 刘建虎. 长江江津江段中华沙鳅耳石及年龄生长的初步研究[J]. 淡水渔业, 2008, 38(5): 46-50. Zhao T, Liu J H. The initial study of the otolith, age and growth of botia superciliaris gǜnther in the Jiangjin segment of Yangtze River[J]. Freshwater Fisheries, 2008, 38(5): 46-50. (  0) 0) |
| [15] |
麻秋云, 薛莹, 徐宾铎, 等. 胶州湾12种饵料鱼类耳石大小与体长的关系[J]. 水生生物学报, 2013, 37(3): 481-487. Ma Q Y, Xue Y, Xu B Z, et al. Relationships between otolith size and fish size for twelve prey fish species from JiaoZhou Bay[J]. Acta Hydrobiologica Sinica, 2013, 37(3): 481-487. DOI:10.7541/2013.47 (  0) 0) |
| [16] |
廖锐, 区又君. 鱼类耳石研究和应用进展[J]. 南方水产科学, 2008, 4(1): 69-74. Liao R, Qu Y J. Present status of studies and applications on otolith of fishes[J]. South China Fisheries Science, 2008, 4(1): 69-74. (  0) 0) |
| [17] |
林龙山, 程家骅, 凌建忠, 等. 东海区主要经济鱼类开捕规格的初步研究[J]. 中国水产科学, 2006, 13(2): 250-256. Lin L S, Cheng J Y, Ling J Z. First capture sizes of major commercial fishes in the East China Seas region[J]. Journal of Fishery Sciences of China, 2006, 13(2): 250-256. (  0) 0) |
| [18] |
林龙山. 黄海南部和东海小黄鱼渔业生物学及其管理策略研究[D]. 青岛: 中国海洋大学, 2009. Lin L S. Study on the Fishery Biology and Managemengt Strategy of Larimichthys polyactis in the Southern Yellow Sea and the East China Sea[D]. Qingdao: Ocean University of China, 2009. (  0) 0) |
| [19] |
殷名称. 鱼类生态学[M]. 北京: 中国农业出版社, 1995. YAN M C. Fish Ecology[M]. Beijing: China Agriculture Press, 1995. (  0) 0) |
| [20] |
刘志远. 基于耳石形态及微结构特征的大黄鱼和小黄鱼早期生长发育研究[D]. 上海: 上海海洋大学, 2012. Liu Z Y. Early Growth and Eevelopment of Big Yellow Croaker (Larimichthys crocea) and Small Yellow Croaker (Larimichthys polyactis) Based on Morphological Development and Microstructure of Otolith[D]. Shanghai: Shanghai Ocean University, 2012. (  0) 0) |
| [21] |
Longmore C, Fogarty K, Neat F, et al. A comparison of otolith microchemistry and otolith shape analysis for the study of spatial variation in a deep-sea teleost, Coryphaenoides rupestris[J]. Environmental Biology of Fishes, 2010, 89: 591-605. DOI:10.1007/s10641-010-9674-1
(  0) 0) |
| [22] |
Petursdottir G, Begg G A, Marteinsdottir G. Discrimination between Icelandic cod (Gadus morhua L.) populations from adjacent spawning areas based on otolith growth and shape[J]. Fisheries Research, 2006, 80(2): 182-189.
(  0) 0) |
| [23] |
侯刚, 冯波, 颜云榕, 等. 北部湾金线鱼, 深水金线鱼与日本金线鱼矢耳石形态识别的初步研究[J]. 中国海洋大学学报(自然科学版), 2012, 42(3): 27-35. Hou G, Feng B, Yan Y R, et al. The study on using otolith morphology to identify three Nemipterus fish species, Nemipterus virgatus, N. barhybius and N. japonicus in Beibu Gulf[J]. Periodical of Ocean University of China, 2012, 42(3): 27-35. (  0) 0) |
| [24] |
Zhang C, Ye Z, Wan R, et al. Investigating the population structure of small yellow croaker (Larimichthys polyactis) using internal and external features of otoliths[J]. Fisheries Research, 2014, 153: 41-47. DOI:10.1016/j.fishres.2013.12.012
(  0) 0) |
| [25] |
韩真. 小黄鱼群体的形态学, 遗传学研究及其与大黄鱼的种间比较[D]. 青岛: 中国海洋大学, 2012. Han Z. Studies of Morphological Characteristics and Genetic Diversity on Populations of Small Yellow Croaker (Larimichthys polyactis) and the Difference between Small Yellow Croaker and Large Yellow Croaker (Larimichthys crocea)[D]. Qingdao: Ocean University of China, 2012. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2212332 (  0) 0) |
| [26] |
Cardinale M, Doering-Arjes P, Kastowsky M, et al. Effects of sex, stock, and environment on the shape of known-age Atlantic cod (Gadus morhua) otoliths[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2004, 61(2): 158-167. DOI:10.1139/f03-151
(  0) 0) |
| [27] |
王茂林. 海水中钙镁离子对褐牙鲆幼鱼生长和生理影响的实验研究[D]. 青岛: 中国海洋大学, 2009. Wang M L. The Research of Effects of Ca2+ and Mg2+ in Seawater on the Growth and Physiology of Juvenile Paralichthys olivaceus[D]. Qingdao: Ocean University of China, 2009. (  0) 0) |
| [28] |
张向上. 黄河口碳输运过程及其对莱州湾的影响[D]. 青岛: 中国海洋大学, 2007. Zhang X S. The Transport of Inorganic and Organic Carbon in the Yellow River estuary and Its Effect on Laizhou Bay[D]. Qingdao: Ocean University of China, 2007. (  0) 0) |
| [29] |
李云驹, 常庆瑞, 杨晓梅, 等. 长江口悬浮泥沙的MODIS影像遥感监测研究[J]. 西北农林科技大学学报(自然科学版), 2005, 33(4): 117-121. Li Y J, Chang Q R, Yang X M, et al. Remote sensing detection of suspended sediment in the Yangtse River Estuary by MODIS images[J]. Jour of Northwest Sci-Tech Univ of Agri and For (Nat Sci Ed), 2005, 33(4): 117-121. (  0) 0) |
| [30] |
Brothers E B. What can otolith microstructure tell us about daily and subdaily events in the early life history of fish[J]. Rapp P-v Réun Cons Int Explor Mer, 1981, 178: 393-394.
(  0) 0) |
2. Key Laboratory of Marine Ecology & Environmental Sciences, CAS, Qingdao 266072, China;
3. Laboratory of Marine Ecology and Environmental Science, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China;
4. Zhejiang Huanke Environment Consultancy Co., Ltd., Hangzhou 311121, China
 2018, Vol. 48
2018, Vol. 48


