2. 青岛海洋科学与技术试点国家实验室, 海洋渔业科学与食品产出过程功能实验室, 山东 青岛 266237
山东南部近海栖息环境优越,是黄、渤海渔业资源的主要繁衍育肥场所。自1970年代以来,山东南部近海渔业捕捞赖以依靠的传统优质渔业对象资源严重衰退,种群结构逐渐小型化、低龄化,短生命周期、低营养级的小型中上层鱼类、头足类和小型虾蟹类取代了原有的大型优质经济种类,成为山东南部近海的优势种类[1]。脊腹褐虾(Crangon affinis)隶属于甲壳动物纲(Crustacean)十足目(Decapoda)褐虾科(Crangonidae)褐虾属(Crangon),为冷水性小型虾类[2]。作为山东南部近海的优势种类,脊腹褐虾是众多底层和近底层鱼类的主要饵料生物。对山东南部近海59种鱼类进行的胃含物分析结果表明,至少有36种鱼类捕食脊腹褐虾[3]。因此,脊腹褐虾是山东南部近海鱼类食物链和食物网系统中一个比较重要的物种,其资源变动会影响主要捕食者的生物量波动和生态系统的稳定,了解脊腹褐虾的时空变动规律可为有效地管理和保护渔业资源提供科学依据。
作为一种具有移动性的海洋生物资源,脊腹褐虾种群动态特征明显,其时空分布随着环境的改变不断变化[4]。常见的物种分布模型包括广义线性模型(Generalized linear model,GLM)、分类与回归树模型(Classification and regression tree,CART)、人工神经网络(Artificial neural network,ANN)等[5],广义加性模型(Generalized additive model,GAM)作为广义线性模型的扩展,可以处理高维数据中响应变量与解释变量之间的非线性关系,反映各环境因子对生物资源量的影响效应,应用于多个物种的时空分布研究[6-8]。
以往关于脊腹褐虾的研究多是以脊腹褐虾为媒介,间接分析海洋污染状况[9]和其他物种的分布[10],或是将其视为生物群落组成的种类之一,分析群落资源结构与多样性[11],针对其单一物种的分布特征研究较少。本研究采用广义加性模型,利用山东南部近海4个航次的渔业资源和环境调查数据,分析脊腹褐虾的时空分布特征及其与环境因子间的关系,探究脊腹褐虾分布的季节变动规律,可以为脊腹褐虾的资源开发提供科学参考,为山东南部近海渔业资源评估及管理提供基础支撑。
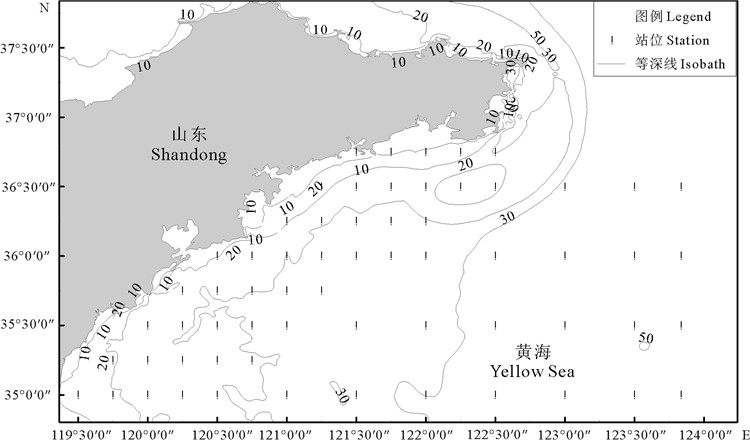
1 材料与方法 1.1 数据来源本研究中各季节的脊腹褐虾生物量及海域环境数据均来自于2016年10月、2017年1、5和8月在山东半岛南部海域进行的渔业资源及环境调查。调查区域范围为35°N~37°N、124°E以西,调查海域内共设置63个站位(见图 1)。调查用船为底拖网渔船,功率为220 kW。拖网网具网口高度7.53 m,网口宽度15 m,囊网网目大小17 mm。拖网调查均在白天进行,拖速约3.0 kn,每站拖网时间1 h左右。每调查站位同步使用温盐深仪(CTD型号,CTD75M/1167)测量并记录各站位的水温、盐度、水深等环境数据。各站位底质数据参考李广雪等于2014年的研究结果[12],底质类型包括淤泥质粉砂、砂-粉砂-黏土、粉砂质黏土等[12]。本次调查及样品分析均依照《海洋渔业资源调查规范》(SC/T 9403—2012)等[13]进行。在数据处理前,依据拖网时间1.0 h和拖速3.0 kn对网获脊腹褐虾的生物量进行标准化处理,最终得到每站位的脊腹褐虾单位捕捞努力量渔获量(Catch Per Unit Effort,CPUE,单位kg/h),使用Surfer和ArcGIS软件绘制山东半岛南部近海调查站位分布图和脊腹褐虾时空分布图。
|
(图中各点表示拖网取样站位,数字表示等深线(m)。Each point in the figure indicates a trawl station and the numbers represent depth(m) of the isobaths. ) 图 1 山东南部近海渔业资源与环境调查站位 Fig. 1 Fishery resources and environmental survey stations in the south waters of Shandong |
广义加性模型最早是由Hastie和Tibshirani提出的一种非参数化的广义多元非线性回归方法[14],可以处理高维数据中响应变量与解释变量之间的非线性关系,拓展了GLM的适用范围,其一般表达式为[15]:
| $ g\left( \mu \right) = \beta + \sum\limits_{i = 1}^k {{f_i}\left( {{x_i}} \right) + \varepsilon } \circ $ |
式中:函数g(μ)为连接函数(Link function);μ为响应变量;xi为解释变量;β为常数截距项;ε为误差项;fi(xi)是用来描述g(μ)与第i个解释变量关系的非参数函数,可以通过样条平滑得到。本研究中,连接函数为自然对数,μ为每站位的脊腹褐虾CPUE,为了避免对数转化零值的错误出现,将CPUE加1,再进行对数化处理,xi为环境因子数据,误差分布估计则为正态分布。
利用AIC准则对模型进行筛选[16]。其公式如下:
| $ {\rm{AIC = }}2k - 2\ln \hat L \circ $ |
式中:k为模型参数的数量;
依照AIC准则筛选模型,在AIC最小的单因子预测函数的基础上依次加入其他影响因子作为解释变量,得到AIC值最小的双因子预测模型,依次增加模型中的因子数,直到模型的AIC值不会随着新的因子的加入而减小为止,AIC值最小的模型即为所得拟合效果最好的模型。筛选过程如表 1所示。
|
|
表 1 GAM变量筛选过程 Table 1 The variables screening process for GAM |
在广义加性模型中,如果某两个或者多个解释变量之间出现了相关性,称之为多重共线性(Multicollinearity),利用Pearson相关性分析和方差膨胀因子(Variance inflation factor,VIF)可以识别变量间的多重共线性特征。若任意两因子间相关性系数大于0.6,应结合脊腹褐虾生物学特性,去除多余因子[17],VIF大于3的环境因子需在模型构建中予以去除[18]。经过变量筛选,排除海水表层温度和海水表层盐度2个因子,本研究最终以脊腹褐虾CPUE作为响应变量,以季节、底质类型、水深、海水底层温度和海水底层盐度5个影响因子作为解释变量构建模型并分析,分析结果见表 2。
|
|
表 2 方差膨胀因子检验结果 Table 2 Test results of variance inflation factors |
本研究运用方差分析的方法(Analysis of variance,ANOVA)[19],通过残差值判断模型的拟合值同实际值的偏差,并以此求得偏差解释率来判断模型最终拟合效果。GAM的构建和检验在R软件中利用gam程序包[20]完成。
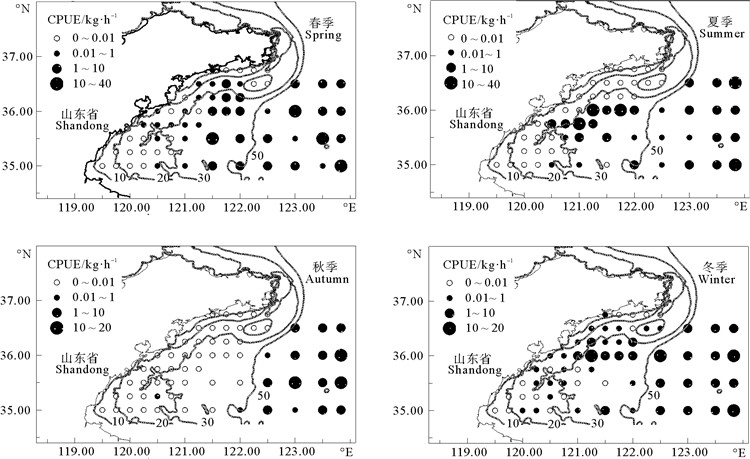
2 结果与分析 2.1 脊腹褐虾的时空分布山东南部近海脊腹褐虾CPUE时空分布存在明显的季节差异。脊腹褐虾全年平均CPUE为2.07 kg/h,CPUE季节间排序为夏季>春季>冬季>秋季。其中,脊腹褐虾春季CPUE为2.43 kg/h,夏季CPUE为2.47 kg/h,秋季CPUE为1.18 kg/h,冬季CPUE为2.19 kg/h。脊腹褐虾四季空间分布模式相似,均为近岸CPUE低、远岸CPUE高(见图 2)。其中,50 m以深的海域中,脊腹褐虾四季CPUE均较高;在50 m以浅的海域内,春、冬季脊腹褐虾分布较均匀,夏季集中分布于中部水域,秋季几乎无分布。
|
图 2 山东南部近海脊腹褐虾时空分布 Fig. 2 Spatio-temporal distribution of Crangon affinis in the south waters of Shandong |
利用季节、水深、海水底层温度、底层盐度和底质类型5个因子和脊腹褐虾CPUE构建GAM。利用AIC原则,筛选得到最优GAM,最优模型表达式为:
| $ \lg \left( {{\rm{CPUE + 1}}} \right){\rm{ = }}s\left( {{\rm{depth}}} \right) + s\left( {{\rm{sbt}}} \right) + {\mathop{\rm int}} {\rm{ercept}} \circ $ |
式中:CPUE为脊腹褐虾单位捕捞努力量渔获量,连接函数为以10为底的对数函数,将脊腹褐虾CPUE加1,使模型适用于零值的情况;s(x)为处理环境因子数据的样条平滑函数;s(depth)为水深效应;s(sbt)为海水底层温度(Sea bottom temperature)效应;intercept为截距项。
对最优GAM方差分析表明,水深和海水底层温度的偏差解释率分别为50.78%和3.53%,所选因子对脊腹褐虾CPUE的累积偏差解释率为54.31%。水深和海水底层温度的影响均极显著(P < 0.01)(见表 3)。
|
|
表 3 最优GAM中影响因子的参数分析 Table 3 Parameters analysis of influential factors in the optimal GAM |
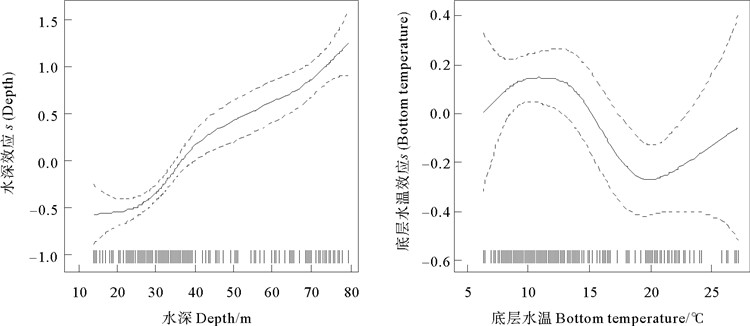
水深和海水底层温度对山东南部近海脊腹褐虾CPUE分布的影响如图 3所示。脊腹褐虾CPUE受水深影响极显著,水深对CPUE的影响范围为15~80 m,在15~80 m时脊腹褐虾CPUE随水深的增大呈不断增大的趋势。海水底层温度对脊腹褐虾CPUE分布的影响极显著,其影响范围为6~25 ℃。在6~12 ℃,CPUE随海水底层温度的上升呈上升趋势;在12~20 ℃时,CPUE随海水底层温度上升呈下降趋势;在20~25 ℃时,CPUE随海水底层温度升高呈上升趋势。海水底层温度为12 ℃时,脊腹褐虾CPUE最高;在20 ℃时,CPUE最低。
|
(图中实线为影响效应的变化曲线,虚线为95%置信区间,图中下方竖线表示原始调查数据分布。The solid lines in the figure are the variation curves of the influential effects, the dotted lines are the 95% confidence intervals, and the vertical line at the bottom of the figure represents the distribution of the original survey data. ) 图 3 水深和海水底层温度对山东南部海域脊腹褐虾渔获率的影响效应 Fig. 3 Effects of depth and sea bottom temperature on catch rate of Crangon affinis in the southern waters of Shandong |
Surfer分析脊腹褐虾CPUE的结果表明,山东南部近海脊腹褐虾CPUE的季节排序为8月(夏季)>5月(春季)>1月(冬季)>10月(秋季),10月CPUE明显低于其它3个季节,这一现象可能由脊腹褐虾繁殖习性和渔业活动的变动等因素共同决定。脊腹褐虾繁殖期很长,终年几乎均可捕到抱卵亲虾[3],这使得脊腹褐虾种群四季均有新生个体补充,保持相对稳定的高CPUE。5和8月脊腹褐虾CPUE较高可能与其繁殖特性有关,脊腹褐虾一年中有2次繁殖高峰期,第一次为3—4月,第二次为8月前后[2],幼体发育至成为补充群体经历时间约为4~5个月,当年夏二世代新生个体快速生长,8月前后补充到脊腹褐虾种群中,使得CPUE增高,秋二世代经历越冬期后于次年补充到群体中。此外,8月较高CPUE可能与禁渔期有关,在捕捞强度下降时,脊腹褐虾CPUE上升。同时,脊腹褐虾为一年生的小型虾类,部分越年生殖群体在8月产卵后死亡,导致了10月脊腹褐虾CPUE降低。
脊腹褐虾四季空间分布模式均表现为近岸CPUE低,远岸CPUE高的特征,但在50 m以浅海域CPUE季节变化明显。夏季分布范围与春季相比,由近岸浅水区向远岸深水区集中;秋季与夏季相比,脊腹褐虾由调查海域西部向东部迁移,在50 m以深海域形成高CPUE分布区,在30 m以浅海域分布极少;冬季的分布范围较秋季相比,扩大至几乎覆盖整个调查海域。脊腹褐虾空间分布的季节差异可能与其生态学习性有较大关系,作为小型冷水性虾类[1],脊腹褐虾在春、冬温度较低的季节中,分布范围较广,在夏、秋温度较高的季节趋向深水区域分布。同时,黄海冷水团的季节变化也可能影响脊腹褐虾的空间分布[21],夏、秋季黄海冷水团势力强大,由近岸至远岸底层水温和底层盐度分别呈现逐渐降低和逐渐升高的趋势,50 m以深水域受黄海冷水团影响,水温较低盐度较高,为脊腹褐虾提供了较为理想的生存环境,脊腹褐虾CPUE较高。
3.2 水深对脊腹褐虾分布的影响应用GAM分析环境因子与脊腹褐虾CPUE的关系表明,水深对山东南部近海脊腹褐虾的分布的影响极显著,脊腹褐虾CPUE随水深的增大呈现不断增大的趋势,在80 m附近水深海域CPUE达到最高值,这种分布规律可能与其洄游特性有关。脊腹褐虾在虾类中游泳能力较弱,仅作短距离移动,有研究表明[3],在水深大于50 m的黄海中部海域,除2月底3月初由外海的深水区向近岸浅水区进行生殖洄游外,夏、秋两季脊腹褐虾主要栖息在黄海的深水海域,冬季12月至翌年2月主要在水深大于30 m的海域越冬,分布也比较均匀[3]。本研究中山东南部近海脊腹褐虾四季CPUE均为近岸低、远岸高,春、冬两季分布较均匀,夏季脊腹褐虾迁移至30 m水深附近,秋季迁移至水深50 m以深的海域,与以往研究结果基本相同。脊腹褐虾在黄渤海水域属于广分布类群,渔场分布范围较大。本研究调查海域覆盖山东南部近岸50 m以浅水域,反映了脊腹褐虾在沿岸浅水区春季和冬季分布较均匀、夏季分布于30 m以深、秋季分布较少的特征,补充和完善了脊腹褐虾时空分布研究。
3.3 海水底层温度对脊腹褐虾分布的影响海水底层温度对脊腹褐虾分布的影响极显著,脊腹褐虾适宜的海水温度约为12 ℃。在6~12 ℃,CPUE随海水底层温度升高呈上升趋势;在12~20 ℃时,CPUE随海水底层温度升高呈下降趋势;在20~25 ℃时,CPUE随海水底层温度升高呈上升趋势。海水底层温度为12 ℃时,脊腹褐虾CPUE最高;在20 ℃时,CPUE最低。脊腹褐虾是冷温种小型虾类,秋季调查海域底层水温约为8~22 ℃。本研究中,秋季脊腹褐虾在近岸海域几无分布,主要分布于海水底层温小于15 ℃的深水区。冬季调查海域底层水温整体降低至6~12 ℃,脊腹褐虾较秋季分布范围扩大至几乎整个调查海域。脊腹褐虾是山东南部近海诸多小型虾类中唯一的冷温性种类[21],多种底层经济鱼类以其为主要饵料,包括小眼绿鳍鱼(Chelidonichthy kumu)、高眼鲽(Cleisthenes herzensteini)、褐牙鲆(Paralichthys olivaceus)、黄鮟鱇(Lophius litulon)、以及部分石首鱼科和鲷科鱼类[3]。海水底层温度影响着脊腹褐虾的分布,而饵料生物数量分布影响着捕食者分布,关系着经济物种渔汛变动[22-23],作为一种重要的饵料生物,脊腹褐虾在山东南部近海渔业生态系统底层生物食物网中占据优势种地位,对底层生物群落结构及多样性的稳定起着关键作用。
4 结语本研究运用GAM分析了脊腹褐虾的季节变动规律,探究了脊腹褐虾的时空分布特征及其与环境因子间的关系,结果表明水深和海水底层温度对山东南部近海脊腹褐虾的分布影响显著。近年来,山东近海主要经济种渔业资源出现了严重的衰退,在主要经济虾类资源受到较高捕捞强度影响的情况下,脊腹褐虾资源较为乐观,其较长的繁殖周期和较多的补充群体一定程度上可以保障季节间种群资源密度维持在相对稳定水平[3]。作为重要的兼捕渔获物和饵料生物,脊腹褐虾的分布在受到环境变化影响的同时,也影响着经济鱼类的数量和分布。因此,深入探讨气候变化以及人为捕捞等因素对脊腹褐虾分布的影响,了解脊腹褐虾资源变动状况,以脊腹褐虾等饵料生物为媒介分析经济渔获物种群动态分布,在未来的研究中,考虑捕食者数量和种类、捕捞强度等影响因子对脊腹褐虾分布的影响,分析脊腹褐虾分布与其他饵料生物分布的关系,探究山东南部近海诸多饵料生物的时空变动规律,为渔业资源的监控和管理提供科学资料。
| [1] |
陈大刚.黄渤海渔业生态[M].北京: 海洋出版社, 1991: 1-3. Chen D G. Fisheries Ecology of Yellow Sea and Bohai Sea[M]. Beijing: China Ocean Press, 1991: 1-3. (  0) 0) |
| [2] |
金显仕, 程济生, 邱盛尧, 等.黄渤海渔业资源综合研究与评价[M].北京: 海洋出版社, 2006: 350-357. Jin X S, Cheng J S, Qiu S Y, et al. The General Study and Evaluation of Fisheries Resources in Yellow Sea and Bohai Sea[M]. Beijing: Ocean Press, 2006: 350-357. (  0) 0) |
| [3] |
唐启升.中国专属经济区海洋生物资源与栖息环境[M].北京: 科学出版社, 2006: 899-900. Tang Q S. Marine Living Resources and Habitat Environment in China's Exclusive Economic Zone[M]. Beijing: Science Press, 2006: 899-900. (  0) 0) |
| [4] |
金显仕, 赵宪勇, 孟田湘, 等.黄渤海生物资源与栖息环境[M].北京: 科学出版社, 2005: 1-3. Jin X S, Zhao X Y, Meng T X, et al. Biological Resources and Habitat Environment in Bohai Sea[M]. Beijing: Science Press, 2005: 1-3. (  0) 0) |
| [5] |
许仲林, 彭焕华, 彭守璋. 物种分布模型的发展及评价方法[J]. 生态学报, 2015, 35(2): 557-567. Xu Z L, Peng H H, Peng S Z. Development and evaluation of species distribution models[J]. Acta Ecologica Sinica, 2015, 35(2): 557-567. (  0) 0) |
| [6] |
李明坤, 张崇良, 李敏, 等. 山东南部近海秋、冬季星康吉鳗分布与环境因子的关系[J]. 中国水产科学, 2018, 25(5): 1115-1122. Li M K, Zhang C L, Li M, et al. Relationship between the spatiotemporal distribution of Conger myriaster and environmental factors in the southern waters off the Shandong Peninsula during autumn and winter[J]. Journal of Fishery Sciences of China, 2018, 25(5): 1115-1122. (  0) 0) |
| [7] |
李敏, 李增光, 徐宾铎, 等. 时空和环境因子对海州湾方氏云鳚资源丰度分布的影响[J]. 中国水产科学, 2015, 22(4): 812-819. Li M, Li Z G, Xu B D, et al. Effects of spatiotemporal and environmental factors on the distribution and abundance of Pholis fangi in Haizhou Bay using a generalized additive model[J]. Journal of Fishery Sciences of China, 2015, 22(4): 812-819. (  0) 0) |
| [8] |
邢磊, 徐宾铎, 张崇良, 等. 环境因子对海州湾及邻近海域大泷六线鱼分布影响的分析[J]. 中国海洋大学学报(自然科学版), 2015, 45(6): 45-50. Xing L, Xu B D, Zhang C L, et al. Environmental influence on the distribution of Hexagrammos otakii inhabiting Haizhou Bay and its adjacent waters[J]. Periodical of Ocean University of China, 2015, 45(6): 45-50. (  0) 0) |
| [9] |
Ji C, Yu D, Wang Q, et al. Impact of metal pollution on shrimp Crangon affinis by NMR-based metabolomics[J]. Marine Pollution Bulletin, 2016, 106(1-2): 372-376. DOI:10.1016/j.marpolbul.2016.02.052
(  0) 0) |
| [10] |
Asahida T, Yamashita Y, Kobayashi T. Identification of consumed stone flounder, Kareius bicoloratus (Basilewsky), from the stomach contents of sand shrimp, Crangon affinis (De Haan) using mitochondrial DNA analysis[J]. Journal of Experimental Marine Biology and Ecology, 1997, 217(2): 153-163. DOI:10.1016/S0022-0981(97)00039-7
(  0) 0) |
| [11] |
程济生. 黄海无脊椎动物资源结构及多样性[J]. 中国水产科学, 2005, 12(1): 68-75. Cheng J S. Structure and diversity of invertebrate resources in the Yellow Sea[J]. Journal of Fishery Sciences of China, 2005, 12(1): 68-75. DOI:10.3321/j.issn:1005-8737.2005.01.013 (  0) 0) |
| [12] |
Li G, Li P, Liu Y, et al. Sedimentary system response to the global sea level change in the East China Seas since the last glacial maximum[J]. Earth-Science Reviews, 2014, 139: 390-405. DOI:10.1016/j.earscirev.2014.09.007
(  0) 0) |
| [13] |
中国国家重量监督检验检疫总局. GB/T 12763. 6-2007, 海洋调查规范第6部分: 海洋生物调查[S].北京: 中国标准出版社, 2007. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. GB/T 2763. 6-2007, Specifications for Oceanographic Survey-Part 6: Marine Biological Survey[S]. Beijing: Standards Press of China, 2007. (  0) 0) |
| [14] |
Hastie T, Tibshirani R. Generalized Additive Models[M]. New York: Springer US, 1985: 371-386.
(  0) 0) |
| [15] |
Burnham K P, Anderson D R. Model Selection and Multimodal Inference: A Practical Information-Theoretic Approach[M]. New York: Springer Science and Business Media, 2003: 488.
(  0) 0) |
| [16] |
Akaike H. A new look at the statistical model identification[J]. IEEE Transactions on Automatic Control, 1974, 19(6): 716-723. DOI:10.1109/TAC.1974.1100705
(  0) 0) |
| [17] |
Wintle A, Elith J, Potts M. Fauna habitat modelling and mapping:A review and case study in the Lower Hunter Central Coast Region of NSW[J]. Austral Ecol, 2005, 30(7): 719-738. DOI:10.1111/j.1442-9993.2005.01514.x
(  0) 0) |
| [18] |
Sagarese R, Frisk G, Cerrato M, et al. Application of generalized additive models to examine ontogenetic and seasonal distributions of spiny dogfish (Squalus acanthias) in the Northeast (US) shelf large marine ecosystem[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2014, 71(6): 847-877. DOI:10.1139/cjfas-2013-0342
(  0) 0) |
| [19] |
Fisher R A. Statistical Methods for Research Workers[M]. Edinburgh: Oliver and Boyd, 1954, 118(4): 66-70.
(  0) 0) |
| [20] |
Wood N. Generalized Additive Models: An Introduction with R[M]. New York: Chapman and Hall/CRC, 2006.
(  0) 0) |
| [21] |
逄志伟, 李显森, 应一平, 等. 黄海夏季虾类群落结构及其与环境因子的关系[J]. 应用生态学报, 2015, 26(11): 3509-3515. Jiang Z W, Li X S, Ying Y P, et al. Shrimp community structure and its relationships with environmental factors in the Yellow Sea in summer[J]. Journal of Applied Ecology, 2015, 26(11): 3509-3515. (  0) 0) |
| [22] |
Punt E, MacCall D, Essington E, et al. Exploring the implications of the harvest control rule for Pacific sardine, accounting for predator dynamics:A MICE model[J]. Ecological Modelling, 2016, 337: 79-95. DOI:10.1016/j.ecolmodel.2016.06.004
(  0) 0) |
| [23] |
Zeug S C, Feyrer F V, Brodsky A, et al. Piscivore diet response to a collapse in pelagic prey populations[J]. Environmental Biology of Fishes, 2017, 100(8): 947-958. DOI:10.1007/s10641-017-0618-x
(  0) 0) |
2. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China
 2020, Vol. 50
2020, Vol. 50

