2. 上海海洋大学水产与生命学院,上海 201306;
3. 大连富谷水产有限公司,辽宁 大连 116400
盐度是水生动物生活环境中重要的理化因子, 盐度的变化会导致鱼体产生不同程度的应激反应, 引发机体一系列生理变化进而影响内环境的稳定[1]。盐度通过渗透调节影响鱼类的新陈代谢等生理活动和各项生理机能[2]。除了生活在等渗环境中,盐度对鱼类产生的影响首先是对其渗透压的胁迫。鱼类渗透压的主动调节过程需要肝脏和肾脏等器官的参与,需要消耗大量的能量,从而影响鱼类消化生理活动。鱼类对营养物质的消化吸收需要消化酶的参与,酶活力的高低可以反映鱼类消化吸收能力[3],鱼类赖以生存水体中的盐度能够影响其消化器官中消化酶活力,最终影响鱼类对食物的消化吸收[4]。脂肪酶存在于消化系统的各个部分,它主要通过消化分解脂肪为机体运动提供能量;蛋白酶则将蛋白质分解为氨基酸;淀粉酶活力的大小与生物的食性有很大的关系[5-6]。目前国内外在盐度渐变对消化酶活力影响机制方面的研究报道较少,仍需进行进一步探索。在鱼类养殖过程中,水体盐度改变常引起多种生理应激反应。盐度变化引起的鱼体应激反应与自由基(O2-)的过量生成有关,过多的O2-会影响鱼类正常生长[7],SOD是鱼类体内重要的抗氧化酶,SOD可清除O2-后产生H2O2,通过清除过多的O2-保护细胞免受氧化损伤[8]。盐度变化引起的生理应激反应又受到内分泌激素的介导;其中T4是鱼类适应淡水生活的重要内分泌激素,参与渗透压调节,能够促进细胞的呼吸作用,使机体耗氧量和代谢率增加,对鱼类适应盐度起积极作用[9]。通过研究盐度渐变对鱼类各种生长及生理生化指标的影响及鱼类的响应,可以为鱼类在合适的水域进行大规模人工养殖提供理论依据。
黄条鰤(Seriola aureovittata)属鲈形目(Perciformes)鲹科(Carangidae)鰤属(Seriola),世界范围内鰤属鱼类共有9种,根据地域性差异可分为3个形态相似的地理亚种:亚洲种群、加利福尼亚种群和南部(南非—澳洲)种群[10]。黄条鰤适宜于深远海抗风浪网箱养殖和陆基工厂化养殖,具有生长速度较快、肉质鲜嫩、养殖产量高等优点,是支持全球温带地区商业渔业的重要品种[11-14]。近年来,黄条鰤繁育及养殖技术研究在我国刚刚起步,有关黄条鰤养殖生物学方面的研究报道很少,尚未见黄条鰤环境适应机理方面的研究报道。本研究以黄条鰤幼鱼为材料,通过检测和分析盐度向高或向低渐变条件下的脂肪酶、蛋白酶和淀粉酶活性、SOD活性、T4浓度等指标的变化,以研究这些因子在黄条鰤对高渗环境和低渗环境适应过程的可能作用,为深入认识黄条鰤对环境的应激和适应机制提供基础资料。
1 材料和方法 1.1 实验材料与设计实验用鱼为2013年在黄海北部捕获的黄条鰤鱼苗,经海上网箱驯化养殖和室内工厂化越冬培育成熟,2017年产卵后人工培育出的体长19~23 cm,体重80~120 g黄条鰤幼鱼,用于本实验。实验在大连富谷水产有限公司进行,苗种养殖期间海水的水温为20~27 ℃、盐度29,每天投喂鲜杂鱼3~4次,投喂量为鱼体重的3%~5%。实验开始前所有暂养的实验用鱼停食24 h,实验期间不投饵。各实验组的盐度调节:低盐度组采用自然海水(盐度29)加自来水调节,使用的自来水用1 000 L塑料桶作为自来水曝气池,连续充气、曝气24 h以上使用;高盐度实验组的海水使用自然海水加海水晶进行人工配置后使用。
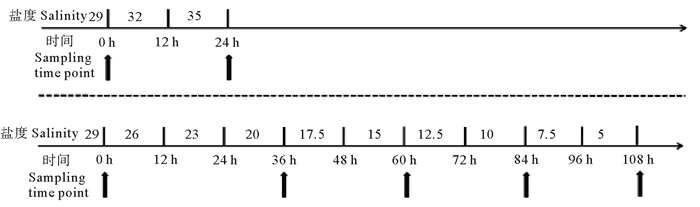
盐度渐变的处理方法:将暂养在自然海水中的80尾黄条鰤幼鱼,分为2个实验组,每组分别放入40尾实验鱼。一组由正常海水向高盐度过渡,另一组由正常海水向低盐度过渡。高盐度组设置盐度35为最高盐度渐变点,盐度的变化为每12 h将盐度升高3个盐度,并处理12 h,直至升高到盐度35,每个盐度渐变点处理12 h后随机选取黄条鰤幼鱼3尾。低盐度渐变处理组,共设置4个低盐度梯度测试点,盐度分别为20,15,10,5,每12 h降低3个盐度,连续3次降到盐度20,并处理12 h后随机选取黄条鰤幼鱼3尾;之后,每12 h降低2.5个盐度,分别在盐度15,10,5的盐度时间点时,随机选取实验鱼3尾取样。实验期间各实验组的水质控制在水温23~24 ℃、pH 7.9~8.1、DO 6~7 mg/L、NH4+-N:0.1~0.3 mg/L。盐度升降梯度、处理时间及取样时间点如图 1所示。盐度计算公式如下:
|
(黑色箭头代表取样时间点。0 h时盐度为29;24 h时盐度35;36 h时盐度为20;60 h时盐度为15;84 h时盐度为10;108 h时盐度为5。The black arrows represent the sampling time point.The salinity at 0 hours is 29.The salinity at 24 hours is 35.The salinity at 36 hours is 20.The salinity at 60 hours is 15. The salinity at 84 hours is 10.The salinity at 108 hours is 5. ) 图 1 盐度渐变示意图 Fig. 1 Schematic diagram of the gradual salinity change |
水温高于17.5℃,S(‰)=1 305(比重-1)+(t-17.5)×0.3。
1.2 取样过程在盐度逐渐过渡到盐度35,20,15,10和5,并在此盐度点经12 h处理后,随机选取3条实验鱼取样。用麻醉剂将鱼麻醉,用无菌1 mL注射器快速从尾部取血,直接置于多个1.5 mL无菌离心管中,在冰水混合液中静置30 min后,4 ℃、5 000 r/min离心10 min,取上清即为血清。分离出的血清用来检测SOD,T4。用液氮保存胃、肠、肝脏、幽门盲囊,测定消化酶包括脂肪酶、蛋白酶、淀粉酶,分析盐度变化对消化酶活力的影响。
1.3 检测过程使用脂肪酶测试盒(A054,50T/48样,南京建成生物工程研究所)测定了黄条鰤胃、肠、肝脏和幽门盲囊的脂肪酶含量;使用蛋白酶测试盒(A080,50T/24样,南京建成生物工程研究所)测定了黄条鰤胃、肠、肝脏和幽门盲囊的蛋白酶含量。使用碘-淀粉比色法测定了黄条鰤胃、肠、肝脏和幽门盲囊的淀粉酶含量(C016,南京建成生物工程研究所淀粉酶测试盒)。使用超氧化物歧化酶(SOD)测试盒(A001-1,南京建成生物工程研究所)测定了血清总SOD含量;使用Fish T4 ELISA Kit(96T,CK-E90004F)测定了血清中甲状腺激素(T4)的含量。
1.4 数据处理使用SPSS 17.0软件的单因素方差分析(One-way ANOVA)和Duncan’s多重比较分析。P>0.05为差异显著。做图数据均表示为平均值±标准差(Mean±SD)。
2 结果与分析 2.1 脂肪酶活性变化在盐度逐渐降低的过程中,黄条鰤胃脂肪酶活性总体呈降低的趋势,盐度从29降低到20时,胃脂肪酶活性显著降低(P<0.05),降低到15时则变化不显著(P>0.05),之后,随着盐度进一步降低,每个盐度点胃脂肪酶活性均显著降低(P<0.05);在盐度从29逐渐升高的过程中,胃脂肪酶活性也显著降低(P<0.05)(见图 2)。肠脂肪酶活性随着盐度的逐渐降低,每个盐度点均显著降低(P<0.05);盐度从29升高到35时,肠脂肪酶活性也显著降低(P<0.05)(见图 2)。肝脏脂肪酶活性随着盐度的降低呈降低的趋势,盐度从29降低到15的过程中,肝脏脂肪酶活性显著降低(P<0.05),降低到10时则变化不显著(P>0.05),盐度进一步降低到5时又显著降低(P<0.05);盐度从29升高到35时,肝脏脂肪酶活性变化不显著(P>0.05)(见图 2)。幽门盲囊脂肪酶活性在盐度降低过程中的变化与肝脏脂肪酶活性变化呈现相似的趋势;而从盐度29升高到35时幽门盲囊脂肪酶活性则显著降低(P<0.05)(见图 2)。总体来看,随着盐度的升高和降低,各组织脂肪酶活性均呈降低的趋势;且在不同盐度渐变点时肠脂肪酶活性均为最高(见图 2)。

|
(所有样品重复3次,酶活力值用平均值±标准差(X ±SD)表示; 不同字母表示同一组织在不同处理组之间差异显著(P<0.05)。0 h时盐度为29;24 h时盐度35;36 h时盐度为20;60 h时盐度为15;84 h时盐度为10;108 h时盐度为5。Different letters denote significant differences between different treatment groups at the same tissue (P < 0.05).The salinity at 0 hours is 29.The salinity at 24 hours is 35. The salinity at 36 hours is 20.The salinity at 60 hours is 15. The salinity at 84 hours is 10. The salinity at 108 hours is 5.n=3, X ±SD. ) 图 2 盐度渐变过程中胃、肠、肝脏和幽门盲囊的脂肪酶活性变化 Fig. 2 Lipase activity vary among stomach, intestinal, liver and pyloric caecum during the gradual salinity change |
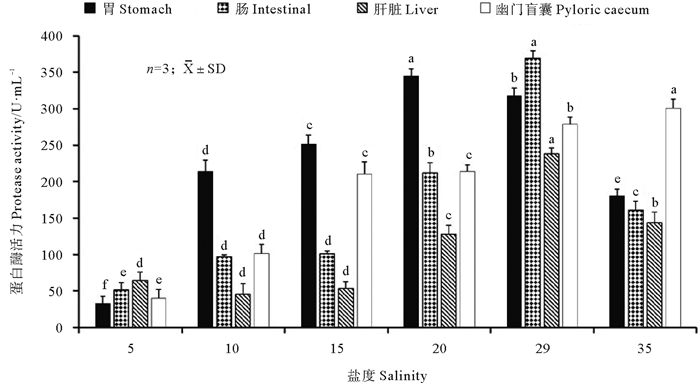
黄条鰤胃蛋白酶随着盐度的降低呈先升高后降低的趋势,盐度从29降低到20时,胃蛋白酶活性显著上升达到峰值(P<0.05);之后,随着盐度的逐渐降低,15,10,5盐度点的胃蛋白酶活性均显著降低(P<0.05),其中盐度5渐变点胃蛋白酶活性迅速降低,显著低于其他盐度渐变点(P<0.05);在盐度从29逐渐升高的过程中,胃蛋白酶活性显著降低(P<0.05)(见图 3)。在盐度逐渐降低的过程中,黄条鰤肠蛋白酶活性随着盐度的降低而降低,盐度从29降低到15的过程中,肠蛋白酶活性显著降低(P<0.05),继续降低到10时则变化不显著(P>0.05),盐度进一步降低到5时又显著降低(P<0.05);在盐度从29逐渐升高的过程中,肠蛋白酶活性也显著降低(P<0.05),且降低幅度很大(见图 3)。肝脏蛋白酶活性在盐度从29降低的过程中呈现降低的趋势,盐度从29降低到15的过程中,肝脏蛋白酶活性显著降低(P<0.05),之后,随着盐度的进一步降低,肝脏蛋白酶活性趋于稳定,虽有小幅波动,但无显著变化(P>0.05);盐度从29升高到35时,肝脏蛋白酶活性也显著降低(见图 3)。在盐度逐渐降低的过程中,黄条鰤幽门盲囊蛋白酶活性总体呈降低的趋势,盐度从29降低到20时,幽门盲囊蛋白酶活性显著降低(P<0.05),降低到15时则变化不显著(P>0.05),之后,随着盐度进一步降低,每个盐度点幽门盲囊蛋白酶活性均显著降低(P<0.05);在盐度从29逐渐升高的过程中,幽门盲囊蛋白酶活性则显著升高(P<0.05)(见图 3)。
|
(所有样品重复3次,酶活力值用平均值±标准差(X ±SD)表示;不同字母表示同一组织在不同处理组之间差异显著(P<0.05)。0 h时盐度为29;24 h时盐度35;36 h时盐度为20;60 h时盐度为15;84 h时盐度为10;108 h时盐度为5。Different letters denote significant differences between different treatment groups at the same tissue (P < 0.05).The salinity at 0 hours is 29. The salinity at 24 hours is 35. The salinity at 36 hours is 20. The salinity at 60 hours is 15. The salinity at 84 hours is 10. The salinity at 108 hours is 5.n=3, X ±SD. ) 图 3 盐度渐变过程中胃、肠、肝脏和幽门盲囊的蛋白酶活性变化 Fig. 3 Protease activity vary among stomach, intestinal, liver and pyloric caecum during the gradual salinity change |
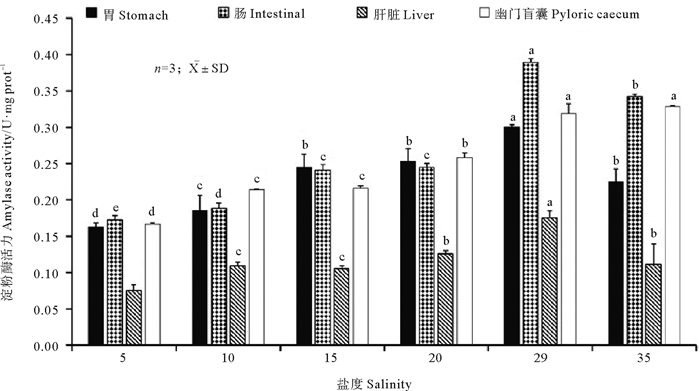
在盐度逐渐降低的过程中,黄条鰤胃淀粉酶活性随盐度降低而呈降低的趋势,盐度从29降低到20时,胃淀粉酶活性显著降低(P<0.05),降低到15时则变化不显著(P>0.05),之后,随着盐度进一步降低,盐度点10和5胃淀粉酶活性均显著降低(P<0.05);在盐度从29逐渐升高的过程中,胃淀粉酶活性显著降低(P<0.05) (见图 4)。肠淀粉酶活性在盐度从29降低的过程中逐渐降低,盐度降低到20时,肠淀粉酶活性显著降低(P<0.05),且降低幅度很大,降低到15时则变化不显著(P>0.05),之后,随着盐度降低肠淀粉酶活性降低幅度变小,但盐度点10和5肠淀粉酶活性变化仍显著(P<0.05);在盐度从29升高到35时,肠淀粉酶活性显著降低(P<0.05)(见图 4)。黄条鰤肝脏淀粉酶活性在各盐度渐变点均显著低于胃、肠和幽门盲囊淀粉酶活性;在盐度从29降低的过程中,肝脏淀粉酶活性逐渐降低,整体变化幅度较小,盐度降到15时,各盐度点肝脏淀粉酶活性均显著降低(P<0.05),继续降低到10时则变化不显著(P>0.05),盐度进一步降低到5时又显著降低(P<0.05);在盐度从29逐渐升高的过程中,肝脏淀粉酶活性也显著降低(P<0.05)(见图 4)。幽门盲囊淀粉酶活性随着盐度的降低呈降低的趋势,盐度从29降低到15的过程中,幽门盲囊淀粉酶活性显著降低(P<0.05),降低到10时则变化不显著(P>0.05),盐度进一步降低到5时幽门盲囊淀粉酶活性又显著降低(P<0.05);盐度从29升高到35时,肝脏脂肪酶活性变化不显著(P>0.05)(见图 4)。
|
(所有样品重复3次,酶活力值用平均值±标准差(X ±SD)表示;不同字母表示同一组织在不同处理组之间差异显著(P<0.05)。0 h时盐度为29;24 h时盐度35;36 h时盐度为20;60 h时盐度为15;84 h时盐度为10;108 h时盐度为5。Different letters denote significant differences between different treatment groups at the same tissue (P < 0.05).The salinity at 0 hours is 29. The salinity at 24 hours is 35. The salinity at 36 hours is 20. The salinity at 60 hours is 15. The salinity at 84 hours is 10. The salinity at 108 hours is 5. n=3, X ±SD. ) 图 4 盐度渐变过程中胃、肠、肝脏和幽门盲囊的淀粉酶活性变化 Fig. 4 Amylase activity vary among stomach, intestinal, liver and pyloric caecum during the gradual salinity change |
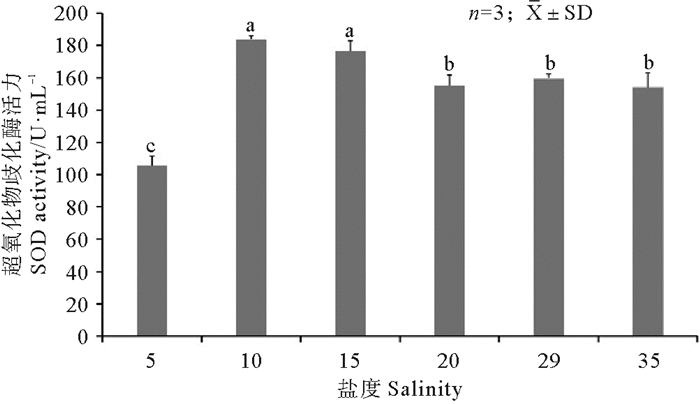
如图 5所示,黄条鰤血清中SOD活性随着盐度的降低总体呈先升高后降低的趋势,盐度渐变到20时,血清中SOD活性变化不显著(P>0.05),之后,随着盐度的逐渐降低,盐度15和10渐变点血清中SOD活性升高,显著高于其他盐度渐变点(P<0.05);随着盐度的进一步降低,盐度5渐变点血清中SOD活性迅速下降,显著低于其他盐度渐变点(P<0.05)。在盐度从29逐渐升高的过程中,血清中SOD活性没有出现显著性变化(P>0.05)。
|
(所有样品重复3次,酶活力值用平均值±标准差(X ±SD)表示;不同字母表示同一组织在不同处理组之间差异显著(P<0.05)。0 h时盐度为29;24 h时盐度35;36 h时盐度为20;60 h时盐度为15;84 h时盐度为10;108 h时盐度为5。Different letters denote significant differences between different treatment groups at the same tissue (P < 0.05).The salinity at 0 hours is 29. The salinity at 24 hours is 35. The salinity at 36 hours is 20. The salinity at 60 hours is 15. The salinity at 84 hours is 10. The salinity at 108 hours is 5.n=3, X ±SD. ) 图 5 盐度渐变过程中血清的SOD活性变化 Fig. 5 SOD activity vary among serum during the gradual salinity change |
盐度从29逐渐向低渐变的过程中,甲状腺素浓度呈逐渐升高的趋势;盐度从29降低到盐度20时甲状腺激素浓度变化不显著(P>0.05),而盐度10和5渐变点甲状腺激素则显著高于其他盐度渐变点(P<0.05)。在盐度从29向高渐变的过程中,甲状腺激素浓度也随之升高,盐度35与盐度29渐变点甲状腺激素浓度有显著性差异(P<0.05)。从总体趋势看,盐度降低或升高,甲状腺激素浓度均升高;盐度5时甲状腺激素浓度最高(见图 6)。

|
(所有样品重复3次,激素值用平均值±标准差(X ±SD)表示; 不同字母表示同一组织在不同处理组之间差异显著(P<0.05);0 h时盐度为29;24 h时盐度35;36 h时盐度为20;60 h时盐度为15;84 h时盐度为10;108 h时盐度为5。Different letters denote significant differences between different treatment groups at the same tissue (P < 0.05);The salinity at 0 hours is 29. The salinity at 24 hours is 35. The salinity at 36 hours is 20. The salinity at 60 hours is 15. The salinity at 84 hours is 10. The salinity at 108 hours is 5. n=3, X ±SD. ) 图 6 盐度渐变过程中血清的T4含量变化 Fig. 6 T4 content vary among serum during the gradual salinity change |
消化酶是由消化系统分泌的具有消化作用的酶类,不同消化酶在不同消化器官中分布不均[15]。脂肪酶存在于消化系统的各个部分,它主要通过消化分解脂肪为鱼类运动提供能量。对日本蟳(Scylla serrata)的研究表明盐度升高可以刺激胃、肠和幽门盲囊脂肪酶活性升高,但随着盐度进一步升高脂肪酶活性受到抑制[16]。在本研究中超过盐度29渐变点后黄条鰤胃、肠、肝脏和幽门盲囊的脂肪酶活性降低,可能是因为盐度过高抑制了脂肪酶活力。有研究表明盐度从25降低到15过程中斜带石斑鱼(Epinephelus coiodies)的胃、肠和幽门盲囊脂肪酶活性下降[17]。与斜带石斑鱼研究结果相似,在本研究中从盐度29渐变点降低时黄条鰤脂肪酶活力也随之降低,可能是由于盐度降低后,盐度对脂肪酶的激活作用较弱,从而导致脂肪酶活力降低。
在史氏鲟(Acipenser schrenckii)、点篮子鱼(Siganus guttatas)和奥尼罗非鱼(O. niloticus♀×O. aureus ♂)胃、肠、肝脏和幽门盲囊蛋白酶与盐度变化关系的研究结果显示随盐度升高蛋白酶活力均减小了[18-20]。本研究中超过盐度29的高盐度渐变点时,黄条鰤肠蛋白酶活力随盐度的升高而减小。海水中部分无机离子对蛋白酶具有激活或抑制作用,无机离子直接作用于蛋白酶是盐度影响鱼体内蛋白酶活力的主要原因[21],结合本研究结果分析,可能是因为在高盐度环境中,某些无机离子进入黄条鰤体内达到了一定的浓度进而抑制了蛋白酶的活性。在低盐度渐变点黄条鰤胃、肠、肝脏和幽门盲囊蛋白酶活性均随盐度升高而增加了,可能由于盐度降低,对蛋白酶有激活作用的离子含量也相对减少,影响了蛋白酶的活性。
消化器官中淀粉酶活力的大小与生物的食性有很大的关系,一般杂食性或草食性动物的淀粉酶活性较高[15]。影响鱼类淀粉酶活力的因素还有很多,包括温度、pH及离子浓度等[22]。本研究中盐度对黄条鰤淀粉酶活力影响显著,在高盐度渐变点胃和肝脏淀粉酶活性随盐度升高而减小,表明随盐度增加黄条鰤对淀粉类物质的消化能力减弱。在高盐度时,黄条鰤淀粉酶活性较低,这可能是因为黄条鰤渗透调节时血浆中Cl-浓度升高[23],对淀粉酶的活性产生抑制作用;这与星洲红鱼(Oreochromis sp. red tilapia)的研究结果一致[24]。有研究表明淀粉酶原需要在肠道中经过肠激活酶的进一步激活才有酶活力[25],黄条鰤肝脏淀粉酶活性在每个盐度渐变点相比胃、肠和幽门盲囊都是最弱的,可能是由于肝脏主要分泌淀粉酶原,所以淀粉酶在肝脏中并不活跃。
3.2 盐度渐变对黄条鰤幼鱼超氧化物歧化酶(SOD)活性的影响SOD作为重要的抗氧化防御系统酶,能够有效转化环境盐度变化时鱼体产生的大量活性氧自由基从而保护机体细胞内环境稳定[26],因此SOD活性变化可以准确反映机体内自由基的代谢情况[27]。有研究结果表明适当降低水体盐度可以激活和增强银鲳(Pampus argenteus)幼鱼肝脏SOD活性以消除机体中过多的活性氧自由基[28];黑鲷(Acanthopagrus schlegeli)从盐度30转移到盐度10中SOD活性也显著升高[29]。本研究结果与上述两个研究结果类似,当盐度降低到15和10渐变点时黄条鰤血清SOD活性显著升高,预示着黄条鰤产生了大量的自由基有待清除。当鱼体受重度逆境胁迫时,鱼体SOD活性被抑制[30]。本研究中盐度5时黄条鰤SOD活性显著低于其他渐变点,说明盐度5对黄条鰤来说属于重度胁迫,难以较快适应。而盐度20和35渐变点黄条鰤血清SOD活性与盐度29时差异不明显,表明黄条鰤受到较轻胁迫,说明黄条鰤在一定盐度范围内,自由基的产生与机体抗氧化防御过程处于动态平衡中。因此血清SOD变化可以作为黄条鰤养殖生产中对盐度变化的应激反应指标。
3.3 盐度渐变对黄条鰤幼鱼甲状腺激素(T4)浓度的影响多种激素控制鱼体的器官参与渗透调节,维持鱼体在不同盐度环境下的体内水份和矿物质的平衡;影响和干扰鱼类体内离子平衡状态的外界条件,都会相应的引起参与渗透调节的激素水平的改变。甲状腺激素是鱼类下丘脑-垂体-甲状腺轴主要分泌的激素,具有广泛的生理学功能;甲状腺激素协同皮质醇激素、生长激素等在调控鱼类发育、生长、新陈代谢和渗透调节方面具有重要的作用[31]。T4在盐度发生变化时能够作用于肝脏、肾脏等器官,使肝糖分解血糖升高;促进细胞的呼吸作用,使机体耗氧量和代谢率增加[32]。Rahim等对草鱼(Ctenophayngodon idella)的研究结果表明盐度12,8和4组T4浓度显著高于淡水组T4浓度[31]。与之类似,本研究中盐度35时黄条鰤血清T4浓度显著高于盐度29血清T4浓度。在本研究中随着盐度的升高和降低,黄条鰤血清T4浓度均升高,这可能是盐度变化刺激了鱼体甲状腺的活动,增加了血清中T4的水平;这也可能是在较高盐度条件下黄条鰤鳃丝Na+-K+-ATPase酶活力相应升高,通过T4水平升高以适应鱼体在盐度变化过程中进行渗透调节时对能量的需要。因此黄条鰤通过血清中T4的变化对环境盐度变化进行自主适应,T4对黄条鰤渗透压调节起到一定作用,有利于维持鱼体的正常存活。
4 结语本研究采用实验生态学的方法,分析了盐度渐变对黄条鰤消化生理、抗氧化水平和T4浓度变化的影响,探讨了黄条鰤对盐度渐变的应激响应机制。研究发现,胃、肠、肝脏和幽门盲囊的脂肪酶活性均在盐度29渐变点最高;肠和肝脏的蛋白酶活性在盐度29渐变点达到峰值,而幽门盲囊的蛋白酶活性在盐度35渐变点最高;胃、肠、肝脏的淀粉酶活性在盐度29渐变点最高,而幽门盲囊的淀粉酶活性在盐度35渐变点最高,但与盐度29渐变点无显著性差异;3种消化酶活性在4种组织整体变化趋势是随着盐度升高或降低,表现为降低的趋势。血清中SOD活性和T4浓度整体变化趋势是随着盐度的升高或降低,呈上升的趋势。本研究中观察到黄条鰤生存和繁衍的自然海水盐度29是幼鱼存活的适宜盐度,在略低的盐度20~29均能较快适应,而在较低或者较高盐度渐变点时消化酶活力和抗应激指标出现显著的异常;黄条鰤对外界盐度变化表现出较强的适应性。研究结果为解析黄条鰤对环境的应激和适应机制及商业养殖开发提供理论依据。
| [1] |
Peter L, James S B. Metabolic responses to salinity acclimation in juvenile shortnose sturgeon Acipenser brevirostrum[J]. Aquaculture, 2003, 219(1-4): 891-909.
(  0) 0) |
| [2] |
郭勤单, 王有基, 吕为群. 温度和盐度对褐牙鲆幼鱼渗透生理及抗氧化水平的影响[J]. 水生生物学报, 2014, 38(1): 58-67. Guo Q D, Wang Y J, LÜ W Q. Combined effects of temperature and salinity on the physiological osmotic induction and antioxidant responses in the juvenile Japanese flounder (Paralichthys olivaceus)[J]. Acta Hydrobiologica Sinica, 2014, 38(1): 58-67. (  0) 0) |
| [3] |
罗鸣钟, 关瑞章, 靳恒. 盐度对花鳗鲡和太平洋双色鳗鲡幼鳗生长性能及消化酶活力的影响[J]. 水生生物学报, 2015, 39(4): 653-660. Luo M Z, Guan R Z, Jin H. Effects of the salinity on the growth performance and digestive enzyme activities of Anguilla marmorata elver and A. bicolor pacifica elver[J]. Acta Hydrobiologica Sinica, 2015, 39(4): 653-660. (  0) 0) |
| [4] |
邓平平, 施永海, 汪洋, 等. 盐度对长江刀鲚幼鱼非特异性免疫酶和消化酶活力的影响[J]. 大连海洋大学学报, 2016, 31(5): 533-537. Deng P P, Shi Y H, Wang Y, et al. Effects of salinity on activities of non-specific immune and digestive enzymes in juvenile estuarine tapertail anchovy Coilia nasus[J]. Journal of DaLian Ocean University, 2016, 31(5): 533-537. (  0) 0) |
| [5] |
Agrawal V P, Sastry K V, Kaushab S K. Digestive enzymes of three teleost fishes[J]. Acta Physiologica Acdemiae Scientiarum Hungaricae, 1975(46): 93-98.
(  0) 0) |
| [6] |
Das K M, Tripathi S D. Studies on the digestive enzymes of Ctenopharyngodon idella (Val)[J]. Aquaculture, 1991(165): 311-312.
(  0) 0) |
| [7] |
Sinha A K, Abdelgawad H, Zinta G, et al. Nutritional status as the key modulator of antioxidant responses induced by high environmental ammonia and salinity stress in European Sea Bass(Dicentrarchus labrax)[J]. PLoS ONE, 2015, 10(8): e0135091.
(  0) 0) |
| [8] |
Sui Y M, Huang X Z, Kong H, et al. Physiological responses to salinity increase in blood parrotfish(Cichlasoma synspilum♀×Cichlasoma citrinellum ♂)[J]. SpringerPlus, 2016, 5: 1246.
(  0) 0) |
| [9] |
Ruiz-Jarabo I, Klaren P H M, Louro B, et al. Characterization of the peripheral thyroid system of Gilthead seabream acclimated to different ambient salinities[J]. Comparative Biochemistry and Physiology, 2017, 203: 24-31.
(  0) 0) |
| [10] |
Chai X L, Li X X, Lu R M, et al. Karyotype analysis of the yellowtail kingfish Seriola lalandi lalandi (Perciformes: Carangidae) from South Australia[J]. Aquculture Research, 2009, 40(15): 1735-1741.
(  0) 0) |
| [11] |
柳学周, 徐永江, 李荣, 等. 黄条鰤(Seriola aureovittata)肌肉营养组成分析与评价[J]. 渔业科学进展, 2017, 38(1): 128-135. Liu X Z, Xu Y J, Li R, et al. Analysis and evaluation of nutritional composition of the muscle of yellowtail kingfish(Seriola aureovittata)[J]. Progress in Fishery Sciences, 2017, 38(1): 128-135. (  0) 0) |
| [12] |
史宝, 刘永山, 柳学周, 等. 黄条鰤(Seriola aureovittata)染色体核型分析[J]. 渔业科学进展, 2017, 38(1): 136-141. Shi B, Liu Y S, Liu X Z, et al. Study on the karyotype of yellowtail kingfish (Seriola aureovittata)[J]. Progress in Fishery Sciences, 2017, 38(1): 136-141. (  0) 0) |
| [13] |
李荣, 徐永江, 柳学周, 等. 黄条鰤(Seriola aureovittata)形态度量与内部结构特征[J]. 渔业科学进展, 2017, 38(1): 142-149. Li R, Xu Y J, Liu X Z, et al. Morphometric analysis and internal anatomy of yellowtail kingfish(Seriola aureovittata)[J]. Progress in Fishery Sciences, 2017, 38(1): 142-149. (  0) 0) |
| [14] |
Bronwyn M G, Douglas J F, Neil L A. Aging methods for yellowtail kingfish, Seriola lalandi, and results from age-and size-based growth models[J]. Fishery Bulletin, 1999, 97: 812-827.
(  0) 0) |
| [15] |
沈永龙, 戈贤平, 黄金田, 等. 盐度对瘤背石磺(Onchidium struma)消化酶活性的影响[J]. 动物营养学报, 2012, 24(9): 1839-1846. Sheng Y L, Ge X P, Huang J T, et al. The effect of salinity on digestive enzyme activity of Onchidium struma[J]. Chinese Journal of Animal Nutrition, 2012, 24(9): 1839-1846. (  0) 0) |
| [16] |
许星鸿, 阁斌伦, 徐加涛, 等. 盐度对日本蟳免疫生理指标及消化酶活力的影响[J]. 水产科学, 2013, 32(7): 373-377. Xu X H, Ge B L, Xu J T, et al. Effects of salinity on immune physiological indexes and digestive enzyme activity of Scylla serrata[J]. Fisheries Science, 2013, 32(7): 373-377. (  0) 0) |
| [17] |
成永洲.海水盐度对斜带石斑鱼幼鱼生长及生理生化的影响[D].南京: 南京农业大学, 2015: 1-71. Cheng Y Z. The Effect of Salinity on Growth and Physiolgy Biochemical of Juvenile Epinephelus coiodies Reared in the Seawater[D]. Nanjing: Nanjing Agricultural University, 2015: 1-71. (  0) 0) |
| [18] |
庄平, 章龙珍, 田宏杰, 等. 盐度对史氏鲟幼鱼消化酶活力的影响[J]. 中国水产科学, 2008, 15(2): 198-203. Zhuang P, Zhang L Z, Tian H J, et al. The effect of salinity on digestive enzyme activity of Acipenser schrenckii[J]. Journal of Fishery Sciences of China, 2008, 15(2): 198-203. (  0) 0) |
| [19] |
罗集光, 章龙珍, 庄平, 等. 盐度对点篮子鱼消化酶活性的影响[J]. 海洋渔业, 2011, 33(1): 33-38. Luo J G, Zhang L Z, Zhuang P, et al. Effect of salinity on digestive enzyme zctivity in Siganus guttatas[J]. Marine Fisheries, 2011, 33(1): 33-38. (  0) 0) |
| [20] |
强俊, 王辉, 李瑞伟, 等. 盐度对奥尼罗非鱼仔、稚鱼生长、存活及其消化酶活力的影响[J]. 南方水产, 2009, 10(5): 8-14. Qiang J, Wang H, Li R W, et al. The effects of salinity on the growth, survival and digestive enzyme activity of Larval hybrid tilapia (Orechromis nifocoticus×O.aureus)[J]. South China Fisherise Science, 2009, 10(5): 8-14. (  0) 0) |
| [21] |
田相利, 任晓伟, 董双林, 等. 温度和盐度对半滑舌鳎幼鱼消化酶活性的影响[J]. 中国海洋大学学报(自然科学版), 2008, 38(6): 895-901. Tian X L, Ren X W, Dong S L, et al. Studies on the Specific activities of digestive enzymes of Cynoglossus semilaevis Günther at different salinities and temperatures[J]. Periodical of Ocean University of China, 2008, 38(6): 895-901. (  0) 0) |
| [22] |
辛碧芬, 谢进金, 左巧阳, 等. 几种金属离子对鲢肝胰脏淀粉酶的影响[J]. 水生态学杂志, 2009, 2(3): 91-95. Xi B F, Xie J T, Zuo Q Y, et al. The effects of several metal ions on the liver pancreatic amylase of Silver carp[J]. Journal of water ecology, 2009, 2(3): 91-95. (  0) 0) |
| [23] |
史宝, 柳学周, 刘永山, 等. 盐度渐变过程对黄条鰤(Seriola aureovittata)幼鱼渗透调节的影响[J]. 海岸工程, 2019, 38(1): 63-70. Shi B, Liu X Z, Liu Y S, et al. Effects of the gradual salinity change on the osmotic regulation of juvenile yellowtail kingfish (Seriola aureovittata)[J]. Coastal Engineering, 2019, 38(1): 63-70. (  0) 0) |
| [24] |
康自强.盐度胁迫对星洲红鱼生长、消化酶和免疫因子活性及肌肉品质的影响[D].厦门: 集美大学, 2014: 1-53. Kang Z Q. Study on the Influences of Salinity on Growth, Digestive Enzyme and Immue Factor Activities and Muscle Quality of Red tilapia[D]. Xiamen: Jimei University, 2014: 1-53. (  0) 0) |
| [25] |
Fang L S, ChIou S F. Effect of salinity on the activities of digestive protease from the Tilapia fish, Oreochromis ruloticus, in different culture environments[J]. Comparative Biochemistry & Physiology, 1989, 93(2): 439-443.
(  0) 0) |
| [26] |
王妤, 庄平, 章龙珍, 等. 盐度对点篮子鱼的存活、生长及抗氧化防御系统的影响[J]. 水产学报, 2011, 135(1): 66-73. Wang Y, Zhuang P, Zhang L Z, et al. Effects of salinity on survival, growth and antioxidant defense system of Siganus guttatus[J]. Journal of Fisheries of China, 2011, 135(1): 66-73. (  0) 0) |
| [27] |
Martínez R M, Morales A E, Sanz A. Antioxidant defenses in fish: Biotic and abiotic factors[J]. Reviews in Fish Biology and Fisheries, 2005, 15(1-2): 75-88.
(  0) 0) |
| [28] |
尹飞, 孙鹏, 彭士明, 等. 低盐度胁迫对银鲳幼鱼肝脏抗氧化酶、鳃和肾脏ATP酶活力的影响[J]. 应用生态学报, 2011, 22(4): 1059-1066. Yin F, Sun P, Peng S M, et al. Effects of low salinity stress on the antioxidant enzyme activities in juvenile Pampus argenteus liver and the ATPase activities in its gill and kidney[J]. Chinese Journal of Applied Ecology, 2011, 22(4): 1059-1066. (  0) 0) |
| [29] |
An K W, Kim N N, Shin H S, et al. Profiles of antioxidant gene expression and physiological changes by thermal and hypoosmotic stresses in black porgy (Acanthopagrus schlegeli)[J]. Comparative Biochemistry and Physiology, 2010, 156(2): 262-268.
(  0) 0) |
| [30] |
MHR J R, Sved D W, Felton S P. Temporal changes in feral AHH and SOD activity in feral spot from the Elizabeth river a polluted sub-estuary[J]. Marine Environmental Research, 1987, 23: 89-101.
(  0) 0) |
| [31] |
Peyghan R, Enayati A, Sabzevarizadeh M. Effect of salinity level on TSH and thyroid hormones of grass carp, Ctenophayngodon idella[J]. Veterinary Research Forum, 2013, 4(3): 175-178.
(  0) 0) |
| [32] |
王义强, 黄世蕉, 赵维信, 等. 鱼类生理学[M]. 上海: 上海科学技术出版社, 1990: 188-191. Wang Y Q, Huang S J, Zhao W X, et al. Fish Physiology[M]. Shanghai: Shanghai Scientific & Technical Publishers, 1990: 188-191. (  0) 0) |
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China;
3. Dalian Fugu Fishery Co., Ltd., Dalian 116400, China
 2020, Vol. 50
2020, Vol. 50


