污泥作为污水处理过程中污染物的承载体,包含大量的有机物、病原微生物和重金属等物质,一方面,污泥可以作为肥料[1];另一方面,污泥中部分污染物易对环境造成污染[2],所以如何合理处理处置污泥是急待解决的问题。厌氧消化技术是目前污泥资源化利用的研究热点,但由于污泥是多相介质组成的复杂絮体,污泥中胞外聚合物(EPS)能够对厌氧消化过程中污泥的增溶和水解阶段造成不利影响[3],而预处理技术能够提高有机物溶出率,其中水热预处理在工艺、能耗和脱水效果等方面具有良好优势。Phothilangka等[4]研究发现,污泥经180 ℃的热水解预处理后,固体含量从25.20%增至32.70%。杨鹏等[5]发现污泥在120~210 ℃、30~75 min水热预处理条件下总固体(TS)和挥发性固体(VS)分别降低了4.45%和3.99%,表明水热预处理能够提高污泥固溶率,实现污泥的减量化。
烷基糖苷(APG)是绿色的表面活性剂,可以促进污泥颗粒有机化合物的溶解、水解和酸化,并提高污泥处理过程中底物的C/N[6]。目前APG被用于促进污泥厌氧消化过程挥发性脂肪酸(VFAs)的生成和有机物的降解。Zhao等[7]研究发现APG用量为0.2 g·g-1 TSS时,污泥厌氧消化产生的脂肪酸是原始污泥的3.1倍;Chen等[8]研究了不同碳链长度的APG对VFAs产量的影响,研究表明,APG可以促进污泥的水解和酸化,同时抑制甲烷生成,在污泥厌氧发酵过程中,不同碳链长度的APG对短链脂肪酸和中链脂肪酸的产量的影响不同,并且APG具有可生物降解的优点,不会产生二次污染,在增强污泥厌氧发酵产酸能力方面具有较大潜力。
目前,水热预处理一般多采用低温水热预处理,而低温水热预处理所需时间长,污泥水解效率慢,而高温水热预处理可在较短时间提高污泥的水解效率,节约成本,但高温水热预处理多应用于污泥的脱水和减量方面,对污泥有机质溶出影响的研究较少;而单一的APG增强脂肪酸生成的效能并不高,本研究采用APG联合水热预处理技术用于增强污泥有机质的水解,从污泥上清液中可溶性蛋白、可溶性碳水化合物和可溶性化学需氧量(SCOD)等参数的变化探讨了水热和APG联合水热预处理技术对污泥水解的影响,并分析联合预处理对污泥产酸的影响和厌氧发酵过程中微生物群落结构的变化,从生物学角度为该预处理促进产酸机理提供参考。
1 材料与方法 1.1 实验污泥采用青岛某污水处理厂的二次沉淀池污泥作为实验污泥,污泥特性如下:上清液中SCOD、氨氮(NH4+-N)、多糖和蛋白质分别为874.0、100.3、19.5和200.7 mg·L-1,总化学需氧量(TCOD)为25.33 g·L-1,TS为25.51 g·L-1,污泥取回后于4 ℃冰箱中保存备用。
1.2 实验方法水热预处理污泥将等体积污泥置于高压反应釜中,将反应釜分批次放入120、140、160、180和200 ℃的烘箱中反应10、20、30、40和50 min,冷却至室温取样,测定污泥的SCOD、多糖、蛋白质和氨氮浓度。
APG联合水热预处理污泥水热反应时间、温度以及APG的加入量在污泥热解过程时都是可控的操作条件,本研究选取这三个因素,根据水热预处理污泥实验和相关研究[7-9],每个因素设计三个水平,以SCOD、多糖、蛋白质和NH4+-N四个主要的评价指标,采用极差分析法和SPSS软件对正交实验数据分析,得到APG联合水热预处理对污泥的最佳水解条件,并在该条件下考察APG联合水热预处理对污泥厌氧消化产酸的影响。表 1为APG联合水热预处理污泥实验正交因素水平表。
|
|
表 1 正交实验因素水平表 Table 1 Factor level design for orthogonal experiment |
经过预处理后的污泥在转速6 000 r/min下离心10 min,上清液经过0.45 μm滤膜过滤,滤液经过一定倍数的稀释,采用重铬酸钾法、Lowry-Folin法、蒽酮-硫酸比色法、钠氏试剂光度法[10]分别测定SCOD、蛋白质、多糖和NH4+-N,TS和VS采用重量法进行测定。
溶解性化学需氧量溶出率(DDSCOD)表征污泥的破解程度,DDSCOD值越大,污泥的絮体破坏严重,有机物释放越多。DDSCOD[11]按下式计算:
| $ {\rm{D}}{{\rm{D}}_{{\rm{SCOD}}}} = \frac{{{\rm{SCO}}{{\rm{D}}_{{\rm{after}}}} - {\rm{SCO}}{{\rm{D}}_{\rm{O}}}}}{{{\rm{TCO}}{{\rm{D}}_{\rm{O}}} - {\rm{SCO}}{{\rm{D}}_{\rm{O}}}}} \times 100\% {\rm{。}} $ |
式中:SCODafter为经过预处理后污泥的SCOD值;SCODO为未经过预处理污泥的SCOD值;TCODO为未经过预处理污泥的TCOD值。
通过气相色谱(GC-2010plus)测定挥发性脂肪酸的含量。样品经离心过滤后用3%的磷酸调节上清液pH至4以下,置于气相棕色小瓶中,于低温保存。色谱条件[12]:载气为高纯氮气,载气流速为1.5 mL/min,进样口温度为200 ℃,检测器(FID)温度为270 ℃,分流比是20∶1,色谱柱为DB-FFAP(30 m×0.25 mm×0.25 μm),程序升温条件为初始温度80 ℃,保持5 min,以8 ℃/min的速率升温,最终达到220 ℃,保持8 min。六种酸出峰顺序分别为:乙酸、丙酸、异丁酸、正丁酸、异戊酸和正戊酸,保留时间分别为:9.34、9.91、10.44、12.65、13.35和14.54 min。
16S rDNA测序技术对样品中细菌群落组成进行分析,样品由青岛睿博兴科有限公司进行检测。检测流程包括样品准备、DNA提取与检测、PCR扩增、产物纯化、文库制备与库检及Novasep上机测序等。对原始数据进行拼接、过滤后得到有效数据,并基于有效数据以97%的一致性进行可操作分类单元(OTUs)聚类和物种分类分析。
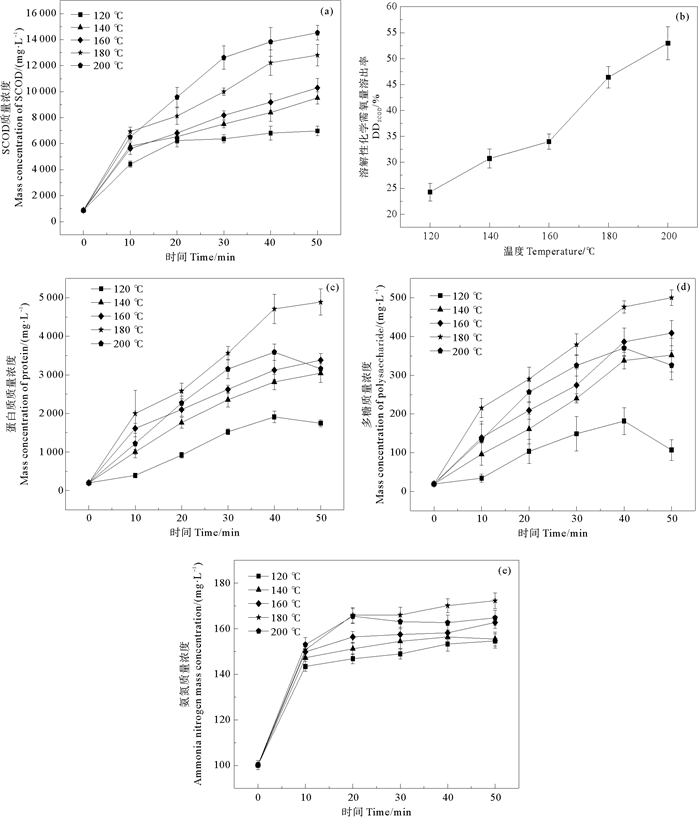
2 结果与讨论 2.1 温度和时间对污泥有机质水解的影响在水热过程中污泥絮体的细胞壁被破坏,有机质从固相转移至液相。图 1为不同温度和时间水热预处理污泥中SCOD、DDSCOD、蛋白质和多糖的变化情况。
|
图 1 不同水热预处理条件下污泥有机质的变化 Fig. 1 Changes of sludge organic matter with time at different hydrothermal pretreatment conditions |
由图 1(a)可知,污泥中SCOD与温度和时间呈正相关,这一结果与Xue等[13]研究中污泥水热预处理后有机质的变化趋势相近;在温度120、140、160、180和200 ℃水热预处理反应50 min条件下,SCOD在原始污泥的874.0 mg·L-1的基础上分别增加了6 103.2、8 644.2、9 419.8、11 931.4和13 657.4 mg·L-1,最终DDSCOD达到56%,尽管该值在200 ℃水热处理50 min高于其它条件,但是由图 1(a)和(b)可以看出,污泥SCOD在温度为180 ℃水热处理40 min时显著溶出,为12 011.0 mg·L-1,DDSCOD为48%,在预处理40 min之后SCOD的增幅相对变缓。高温条件能够破坏蛋白质和多糖等成分与水的键合,使有机质得到释放,提高了污泥的SCOD。与低温过程中对污泥有机质水解[10]情况相比,高温水热预处理可使污泥有机质在较短的时间里快速溶出,SCOD浓度增长速率加快。
糖类和蛋白质是污泥EPS中的主要有机物,污泥有机质经水解成为小分子有机物,才能被微生物利用。图 1(c)和(d)可知,当温度为120、140、160和180 ℃,多糖和蛋白质浓度随时间增加而增加,在180 ℃,40 min时,蛋白质和多糖浓度分别提高了23和24倍。而200 ℃水热预处理蛋白质和多糖浓度均低于180 ℃预处理后的浓度,并在50 min时浓度呈下降趋势,实验过程中污泥上清液色度由棕色变为黑褐色,这是由于过高温度会使蛋白质和还原糖发生美拉德反应[14]。
污泥中氮元素存在的主要形式是蛋白质,在水热温度提高至100 ℃后,污泥中蛋白质等含氮有机物在蛋白酶的作用下分解,氨氮浓度有明显增幅(见图 1(e));Wilson等[9]研究发现氨氮浓度在160~180 ℃得到释放,本实验可以看出温度在最初对氨氮浓度影响较大,并且随着温度和时间的增加,氨氮浓度也呈上升趋势。相比其他温度,在温度180 ℃、反应时间为40 min时对氨氮浓度的增幅最大,剩余污泥的氨氮由原来的100.3 mg/L增加到172.0 mg/L,说明水热预处理促进了污泥中蛋白质的水解过程,进而提高了上清液中NH4+-N浓度。
2.2 APG联合水热预处理对污泥有机质水解的影响实验中选取预处理过程中APG用量、温度和反应时间3个反应参数构建三因素三水平的正交实验,正交实验表L9(34),如表 2所示;以氨氮、蛋白质、多糖和SCOD为指标,采用极差法对其进行分析,结果如表 3所示。
|
|
表 2 正交实验表 Table 2 Results of the orthogonal experiment |
|
|
表 3 正交实验极差分析表 Table 3 Range analysis for the orthogonal experiment |
根据表 3极差和相伴概率可知,污泥所释放有机物的最佳水热温度、APG用量以及水热时间的参数为180 ℃、0.4 g·g-1 TS和40 min。
对于氨氮和蛋白质,三个因素的显著性影响顺序为:温度>APG用量>时间,对多糖和SCOD,三个因素对其显著性影响顺序为:APG用量>温度>时间,时间对四个指标来说均为非显著性因素,可能是因为其它因素的影响太大,掩盖了时间造成的影响;温度和APG用量两个因素对四个指标的影响显著性顺序不一致,这可能是因为高温可能破坏了污泥结构,提高溶液中粒子运动速度,同时APG分子糖基可能发生自降解,从而使多糖浓度增多,SCOD值增加[8]。
污泥在最佳预处理条件下,其上清液中SCOD、多糖、蛋白质和氨氮的浓度分别为2 0421.4、683.3、6 343.2和210.1 mg·L-1,DDSCOD为80%,多糖和蛋白质浓度分别为原始污泥的35和31倍。联合预处理有机质的溶出效果优于单一的水热预处理。并且研究发现,APG联合水热处理使污泥释放的可溶性蛋白和多糖等有机质远优于单一的APG预处理和APG协同嗜热细菌预处理技术[8, 15],说明APG联合水热预处理更利于污泥有机质的溶解,促进污泥释放生物可利用的物质。
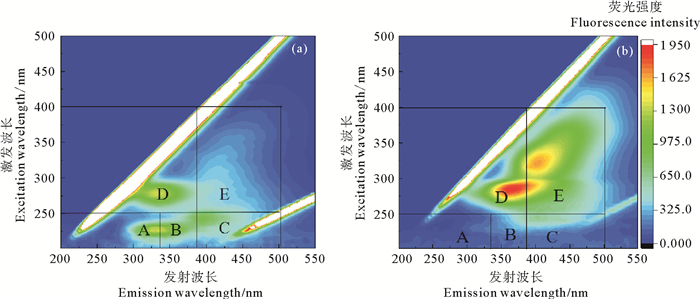
图 2和3分别为原始污泥和APG联合水热预处理后污泥的扫描电镜图(SEM)和三维荧光光谱。

|
( (a)原始污泥;(b)联合预处理污泥。(a) The raw sludge; (b) Combined pretreatment sludge. ) 图 2 不同预处理污泥扫描电镜图 Fig. 2 SEM photograms for different pretreated sludge |
|
( (a)原始污泥;(b)联合预处理污泥。(a) The raw sludge; (b) Combined pretreatment sludge. ) 图 3 不同预处理污泥的三维荧光光谱 Fig. 3 Three-dimensional fluorescence spectra for different pretreated sludge |
由扫描电镜图 2(a)可以看出,原始污泥部分呈块状,结构致密且表面光滑;由图 2(b)可知,经过APG联合水热预处理后,污泥胞外聚合物破坏,结构变得更加松散,联合预处理使污泥出现了较多的物质交流孔洞,一是增加了生物菌群与污泥基质的接触面积,二是有利于污泥发酵过程物质的运输和交换。
根据先前研究[16],通过对溶解有机物荧光光谱分析,获得了五个组分的三维荧光图谱,它们分别为:A区所代表的类酪氨酸蛋白质物质、B区所代表的类色氨酸蛋白质物质、C区所代表的富里酸类物质、D区所代表的可溶性微生物副产物类物质、E区所代表的类腐殖酸物质。图 3(a)可以看出,原始污泥主要以色氨酸、酪氨酸类蛋白质物质以及可溶性微生物副产物类物质(具有共轭双键结构的核酸和氨基酸等)三种有机物为主;由图 3(b)可知,污泥经APG联合水热预处理,污泥中类蛋白质物质发生化学键断裂,转化成小分子化合物,使上清液中可溶性微生物副产物类物质增加,这也说明联合预处理可以促进了污泥有机质的溶出速率,为厌氧发酵提供丰富底物。
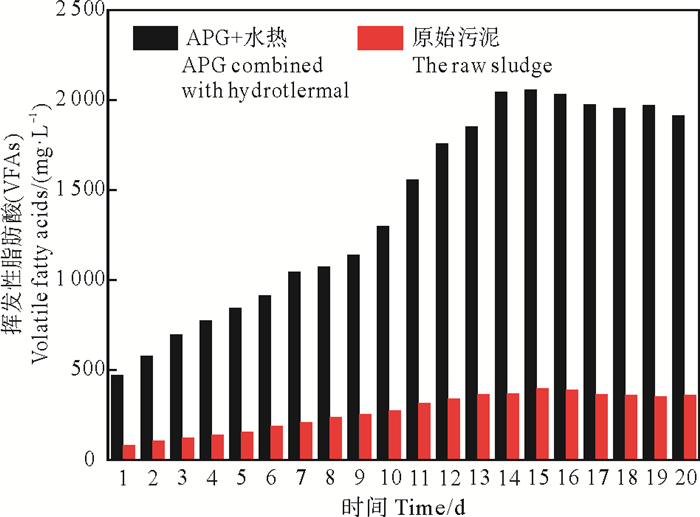
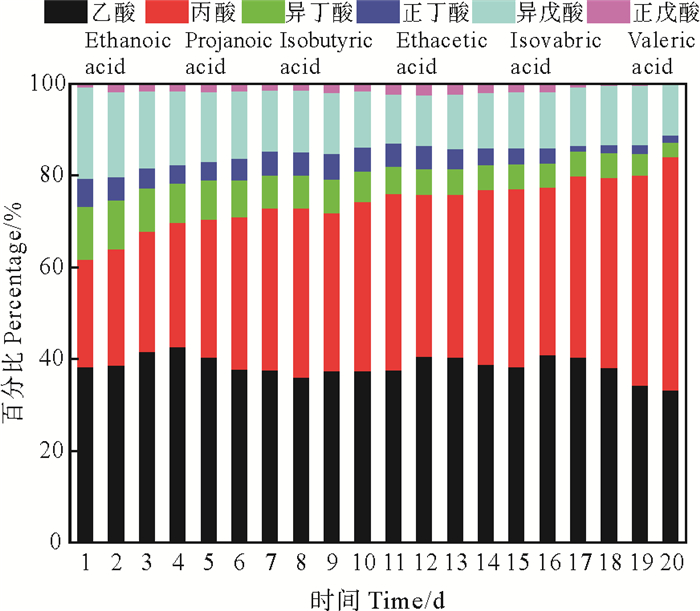
2.3 APG联合预处理对污泥发酵产酸的影响图 4为原始污泥和APG联合水热预处理后污泥厌氧发酵中日产酸量,图 5为联合预处理后污泥厌氧消化过程中挥发性脂肪酸组分变化,可以明显看到经过联合预处理后污泥的产酸量远优于原始污泥发酵产酸量,一方面是因为APG联合水热预处理为发酵提供了丰富的底物,另一方面是因为APG降低了污泥表面-界面张力,携带的极性基团可发生电离产生带有电荷的离子,与污泥中带电荷物质(金属粒子)相互作用,使得污泥的絮凝结构变得分散[17],增大了微生物和有机质的接触面,从而促进了污泥厌氧发酵体系中有机质的转化。当污泥经过预处理后,短链脂肪酸产量先增加后稍有下降,其趋势与Dearman[18]研究结果一致,这是由于预处理提供的丰富底物在水解菌和产酸菌作用下先生成VFAs,部分VFAs在产甲烷菌作用下转化成甲烷,导致脂肪酸含量下降。其中APG自降解生成VFAs的最大含量远低于APG预处理污泥发酵产酸量[19-20],因此APG自身降解对酸的贡献量可不计。本实验中原始污泥在发酵第15天时产酸量达到最大,为420.03 mg COD·L-1,VFAs组分为乙酸;而APG联合水热预处理后污泥发酵日产酸量为2 058.35 mg COD·L-1,各酸所占百分比大小为:乙酸>丙酸>异戊酸>异丁酸>正丁酸>正戊酸,其中丙酸和乙酸产量占比大于60%,且APG的加入可以提高辅酶A转移酶(CoAT)和草酰乙酸转羧酶(OAATC)两种酶的活性[6],使得丙酸的占比逐渐增大,因此,APG联合水热预处理不仅能够提高有机质水解率,而且利于有机酸的富集,为厌氧消化产甲烷阶段提供丰富的底物。
|
图 4 原始污泥和联合预处理发酵体系日产酸量 Fig. 4 Daily acid production for the raw sludge and combined pretreatment fermentation system |
|
图 5 联合预处理发酵体系挥发性脂肪酸组分分布 Fig. 5 Composition distribution of volatile fatty acids for the combined pretreatment fermentation system |
在门水平上(见图 6(a)),联合预处理厌氧发酵污泥中厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)具有绝对的优势,能促进有机质的水解和酸化。由于APG联合水热预处理为生物发酵提供了丰富的可水解和可利用产酸的有机质,并且厚壁菌门对极端环境的耐受性较强[21],能适应不断酸化的环境,其所占的比例在该厌氧发酵体系中增加到38.82%,厚壁菌门类的大多数微生物与碳水化合物的水解和产酸活性相关,能够将纤维素等复杂碳水化合物降解为乙酸和丁酸等小分子有机物。拟杆菌门能够产生纤维素酶、蛋白酶等水解酶,将有机物降解产生CO2、纤维二糖、葡萄糖和乙酸,这也是两种发酵体系产生乙酸的主要原因。相比原始污泥,联合预处理发酵污泥中变形菌门(Proteobacteria)的占比下降,而脂肪酸浓度增加,变形菌门在厌氧消化过程中会消耗生成的短链脂肪酸[22],变形菌门丰度的降低有利于脂肪酸的累积。

|
图 6 微生物群落在门(a)、纲(b)、属(c)水平的分布 Fig. 6 Taxonomic classification of microbial communities at (a) phyla, (b) class, (c) genus levels |
在纲水平上(见图 6(b)),经过联合预处理后的污泥厌氧发酵体系中拟杆菌纲(Bacteroidia)、梭状芽孢杆菌纲(Clostridia)和厌氧绳菌纲(Anaerolineae)为优势菌纲。拟杆菌纲在APG联合水热预处理的发酵污泥中由原始污泥的14.14%增至18.83%,该菌纲能将有机质转化成丁酸和乙酸[24],有利于乙酸和丁酸产量增加。梭状芽孢杆菌纲,一般以糖类为底物[25],具有很强的水解能力,可以通过斯提柯兰反应生成短链脂肪酸[26],促进污泥中乙酸和丙酸生成,经过APG联合水热预处理后,该菌纲百分比由5.53%增加到30.06%,说明联合预处理发酵环境利于该菌纲的富集,印证了污泥发酵液中丙酸浓度增加的结果。Zou等[27]发现,Synergistia菌纲能促进VFAs向乙酸转变,Synergistia菌纲经过联合预处理丰度增加,直观表现为联合预处理后污泥发酵产乙酸能力增强。
由属水平上(见图 6(c))可以看出,不同的发酵底物会使厌氧消化过程微生物群落分布发生明显变化。屠场杆状菌属(Macellibacteroides)是拟杆菌属的一种,葡萄糖和多种碳水化合物在该微生物作用下产生乳酸盐、乙酸、正丁酸和异丁酸[23],经过联合预处理后,其丰度由0.16%增加到7.17%,提高了该发酵体系中的正丁酸、异丁酸等脂肪酸的产量,丰富了污泥中挥发性脂肪酸的组分;Petrimonas和Sedimentibacter均为产氢产乙酸菌属的优势菌属,能够代谢多种碳水化合物生成乙酸、丁酸等有机酸,且具有生成H2和CO2的能力,两种菌属在联合预处理污泥后相对丰度分别累计达到1.99%和1.38%,而在原始污泥发酵体系中未检出;鲸杆菌属(Cetobacterium)在污泥发酵过程中可以产生蛋白酶和脂肪酶,促进了污泥有机质向脂肪酸转化过程;克里斯藤森菌属R-7(Christensenellaceae_R-7)属于厚壁菌属,该菌属在APG联合水热预处理发酵体系中相对丰度增加,提高了污泥有机质的水解效率。
3 结语水热预处理技术能够有效破坏污泥的絮体结构,可使污泥EPS中有机质的快速溶出,在180 ℃水热条件下,DDSCOD约为48%,污泥上清液中多糖和蛋白质浓度显著提高。通过正交实验得到APG联合水热预处理污泥最佳条件为温度180 ℃、APG用量为0.4 g·g-1 TS,时间40 min,在该条件下,污泥液相中蛋白质和多糖浓度分别为原始污泥的31和35倍,DDSCOD达到80%,为厌氧发酵提供丰富的底物,并且污泥的结构变得松散,出现孔隙,利于污泥中有机质的交换和运输,提高了微生物对有机质降解效率。在APG联合水热预处理的污泥厌氧发酵体系中,VFAs最大日产酸量约为原始污泥产酸量的4.9倍,挥发性脂肪酸主要以乙酸和丙酸为主;该联合预处理厌氧发酵环境使污泥中水解菌群和产酸菌群的相对丰度增加,促进了有机物的水解,有利于有机质向VFAs的转化,提高了脂肪酸中戊酸、异戊酸和异丁酸等酸的含量,为产甲烷阶段提供基质,实现污泥的资源化利用。
| [1] |
Fang W, Zhang X D, Zhang P Y, et al. Overview of key operation factors and strategies for improving fermentative volatile fatty acid production and product regulation from sewage sludge[J]. Journal of Environmental Sciences, 2020, 87: 93-111. DOI:10.1016/j.jes.2019.05.027 (  0) 0) |
| [2] |
郑莹, 李杰, 豆宁龙, 等. 不同价态铁对活性污泥性能的影响[J]. 中国给水排水, 2018, 34(9): 26-32. Zheng Y, Li J, Dou N L, et al. Effect of different valent iron on performance of activated sludge[J]. China Water & Wastewater, 2018, 34(9): 26-32. (  0) 0) |
| [3] |
Yuan Y Y, Hu X Y, Chen H B, et al. Advances in enhanced volatile fatty acid production from anaerobic fermentation of waste activated sludge[J]. Science of the Total Environment, 2019, 694: 133741. DOI:10.1016/j.scitotenv.2019.133741 (  0) 0) |
| [4] |
Phothilangka P, Schoen M A, Wett B. Benefits and drawbacks of thermal pre-hydrolysis for operational performance of wastewater treatment plants[J]. Water Science and Technology, 2008, 58(8): 1547-1553. DOI:10.2166/wst.2008.500 (  0) 0) |
| [5] |
杨鹏, 李伟, 袁彧, 等. 不同热水解条件下污泥固相组成变化研究[J]. 中国沼气, 2020, 38(4): 13-19. Yang P, Li W, Yuan Y, et al. Study on solid phase composition changes of excess sludge under different thermal hydrolysis conditions[J]. China Biogas, 2020, 38(4): 13-19. DOI:10.3969/j.issn.1000-1166.2020.04.004 (  0) 0) |
| [6] |
Luo J Y, Feng L Y, Chen Y G, et al. Alkyl polyglucose enhancing propionic acid enriched short-chain fatty acids production during anaerobic treatment of waste activated sludge and mechanisms[J]. Water Research, 2015, 73: 332-341. DOI:10.1016/j.watres.2015.01.041 (  0) 0) |
| [7] |
Zhao J W, Yang Q, Li X M, et al. Enhanced production of short-chain fatty acid from food waste stimulated by alkyl polyglycosides and its mechanism[J]. Waste Management, 2015, 46: 133-139. DOI:10.1016/j.wasman.2015.09.001 (  0) 0) |
| [8] |
Chen Y D, Yang Z K, Ren N Q, et al. Optimizing the production of short and medium chain fatty acids (SCFAs and MCFAs) from waste activated sludge using different alkyl polyglucose surfactants, through bacterial metabolic analysis[J]. Journal of Hazardous Materials, 2020, 384: 121384. DOI:10.1016/j.jhazmat.2019.121384 (  0) 0) |
| [9] |
Wilson C A, Novak J T. Hydrolysis of macromolecular components of primary and secondary wastewater sludge by thermal hydrolytic pretreatment[J]. Water Research, 2009, 43(18): 4489-4498. DOI:10.1016/j.watres.2009.07.022 (  0) 0) |
| [10] |
李健弟, 张伟, 张小玲, 等. 超声预处理污泥发酵液作为反硝化聚磷补充碳源研究[J]. 中国给水排水, 2019, 35(9): 9-15. Li J D, Zhang W, Zhang X L, et al. Additional carbon source for dentrifying phosphorus removal based on hydrolysis acidification of sludge pretreated by ultrasound[J]. China Water & Wastewater, 2019, 35(9): 9-15. (  0) 0) |
| [11] |
张珣, 于静洁, 王少坡, 等. 高铁酸钾及低温热水解预处理污泥对污泥水解效果的影响[J]. 天津城建大学学报, 2019, 25(5): 344-348. Zhang X, Yu J J, Wang S P, et al. Effects of potassium ferrate and low-temperature thermal hydrolysis pretreatment on sludge hydrolysis[J]. Journal of Tianjin Chengjian University, 2019, 25(5): 344-348. (  0) 0) |
| [12] |
顾福权, 徐红娟, 柳展飞, 等. 气相色谱法测定废水中6种挥发性脂肪酸含量[J]. 能源环境保护, 2014, 28(3): 62-66. Gu F Q, Xu H J, Liu Z F, et al. Content of 6 volatile fatty acids of wastewater by gas chromato graphy c Gc[J]. Energy Environmental Protection, 2014, 28(3): 62-66. DOI:10.3969/j.issn.1006-8759.2014.03.019 (  0) 0) |
| [13] |
Xue Y G, Liu H J, Chen S S, et al. Effects of thermal hydrolysis on organic matter solubilization and anaerobic digestion of high solid sludge[J]. Chemical Engineering Journal, 2015, 264: 174-180. DOI:10.1016/j.cej.2014.11.005 (  0) 0) |
| [14] |
Kim J, Yu Y, Lee C. Thermo-alkaline pretreatment of waste activated sludge at low-temperatures: Effects on sludge disintegration, methane production, and methanogen community structure[J]. Bioresource Technology, 2013, 144: 194-201. DOI:10.1016/j.biortech.2013.06.115 (  0) 0) |
| [15] |
Gao P T, Guo L, Sun J, et al. Accelerating waste sludge hydrolysis with alkyl polyglucose pretreatment coupled with biological process of thermophilic bacteria: Hydrolytic enzyme activity and organic matters transformation[J]. Journal of Environmental Management, 2019, 247(1): 161-168. (  0) 0) |
| [16] |
Yang J N, Liu X R, Wang D B, et al. Mechanisms of peroxymonosulfate pretreatment enhancing production of short-chain fatty acids from waste activated sludge[J]. Water Research, 2019, 148: 239-249. DOI:10.1016/j.watres.2018.10.060 (  0) 0) |
| [17] |
Zhang B, Zhang L L, Zhang S C, et al. The influence of pH on hydrolysis and acidogenesis of kitchen wastes in two-phase anaerobic digestion[J]. Environmental Technology Letters, 2005, 26(3): 329-340. DOI:10.1080/09593332608618563 (  0) 0) |
| [18] |
Dearman B, Bentham R H. Anaerobic digestion of food waste: Comparing leachate exchange rates in sequential batch systems digesting food waste and biosolids[J]. Waste Management, 2007, 27(12): 1792-1799. DOI:10.1016/j.wasman.2006.08.006 (  0) 0) |
| [19] |
杨中凯. 烷基糖苷促进污泥厌氧发酵产挥发酸的效能与机理研究[D]. 哈尔滨: 哈尔滨工业大学, 2018. Yang Z K. Research on Efficiency and Mechanism of Alkyl Glucosides Promoting Anaerobic Fermentation of Sludge for Volatile Fatty Acid Production[D]. Harbin: Harbin Institute of Technology, 2018. (  0) 0) |
| [20] |
Liu Y, Zhao J W, Li X M, et al. Synergistic effect of free nitrite acid integrated with biosurfactant alkyl polyglucose on sludge anaerobic fermentation[J]. Waste Management, 2018, 78: 310-317. DOI:10.1016/j.wasman.2018.05.053 (  0) 0) |
| [21] |
Huang X, Mu T, Shen C, et al. Effects of bio-surfactants combined with alkaline conditions on volatile fatty acid production and microbial community in the anaerobic fermentation of waste activated sludge[J]. International Biodeterioration & Biodegradation, 2016, 114: 24-30. (  0) 0) |
| [22] |
Yang Y, Xia Y, Yu K, et al. Metagenomic analysis of sludge from full-scale anaerobic digesters operated in municipal wastewater treatment plants[J]. Applied Microbiology and Biotechnology, 2014, 98(12): 5709-5718. DOI:10.1007/s00253-014-5648-0 (  0) 0) |
| [23] |
Linda J, Hana G, Jean-Luc C, et al. Macellibacteroides fermentans gen. nov., sp. nov., a member of the family porphyromonadaceae isolated from an upflow anaerobic filter treating abattoir wastewaters[J]. International Journal of Systematic & Evolutionary Microbiology, 2012, 62(10): 2522-2527. (  0) 0) |
| [24] |
Ai S J, Liu H Y, Wu M J, et al. Roles of acid-producing bacteria in anaerobic digestion of waste activated sludge[J]. Frontiers of Environmental Science & Engineering, 2018, 12(6): 1-11. (  0) 0) |
| [25] |
Kato S, Haryta S, Cui J C, et al. Clostridium straminisolvens sp. nov. a moderately thermophilic, aerotolerant and cellulolytic bacterium isolated from a cellulose-degrading bacterial community[J]. International Journal of Systematic and Evolutionary Microbiology, 2004, 54(6): 2043-2047. DOI:10.1099/ijs.0.63148-0 (  0) 0) |
| [26] |
Li T, Laurent M, Sghir A, et al. Insights into networks of functional microbes catalysing methanization of cellulose under mesophilic conditions[J]. Environmental Microbiology, 2010, 11(4): 889-904. (  0) 0) |
| [27] |
Zou H J, Chen Y D, Shi J H, et al. Mesophilic anaerobic co-digestion of residual sludge with different lignocellulosic wastes in the batch digester[J]. Bioresource Technology, 2018, 268: 371-381. DOI:10.1016/j.biortech.2018.07.129 (  0) 0) |
 2022, Vol. 52
2022, Vol. 52


