2. 海洋国家实验室海洋生态与环境科学功能实验室,山东 青岛 266071
近年来,随着青岛市社会经济的高速发展和人类活动的高强度作用,有机物污染严重,近海正面临潜在的生态健康风险。氮在海洋生态系统中是决定海洋初级生产力的主要因素,在近海环境中也有着举足轻重的作用[1-3]。其中溶解有机氮(DON)占比较大并且逐渐成为氮的主要存在形式,以前人们对溶解无机氮(DIN)研究较多而DON曾长期被人们忽视,因此,基于DON在海洋中的重要性,有必要开展针对DON生物可利用性对近海富营养化进行研究[4-6]。
近海生态系统中DON的来源分为外源性和内源性两种,DON内源相对较为复杂,主要是由于海洋生态系统的复杂性和生物的多样性导致的,包括细菌、病毒、浮游植物、浮游动物代谢释放等过程[7-9]。外源性输入主要包括陆源输入和大气沉降,其中陆源DON占比达到了20%~90%,主要通过降雨对土壤的冲刷和地表径流等途径输入,为海洋的初级生产提供营养物质,是细菌等的重要食物来源,并且有10%~70%可被生物利用[10-17]。DON的来源是影响DON含量动态变化的关键因素。不同陆源DON组成结构、浓度和生物可利用性有差异,对近海的影响也不同[4, 18]。陆源DON有森林源、农业源、工业源、生活源等不同来源[2, 13, 19]。海水中DON的转化过程也有很多,如直接被初级生产者利用,通过光和微生物作用降解成DIN,形成沉积物或被颗粒物质吸附[7, 20-21]。
围绕高强度人类活动的压力,针对近海DON浓度升高存在潜在的生态健康风险问题,有必要开展典型陆源DON生物可利用性的研究,本文选取环胶州湾典型的陆源污染源水样进行微生物培养实验,借助三维荧光、紫外等手段,从DON生物可利用占比(BDON%)和动力学两个方面,深入理解陆源DON的生物可利用性,研究结果可为量化陆源DON排放对胶州湾富营养化的影响提供支撑。
1 材料与方法 1.1 样品采集为使陆源DON能够基本涵盖胶州湾典型入海DON来源,探讨不同陆源DON生物利用性,实验分别于2017年10月采集海泊河污水处理厂(HW)(36°6′0″N, 120°19′12″E)、啤酒厂(PJ)(36°8′8″N, 120°24′21″E)、大沽河(DR)(36°22′22″N, 120°7′39″E)和李村河(LR)(36°10′38″N, 120°28′52″E)水样,取样点如图 1所示,其中,海泊河污水处理厂代表城镇生活源;啤酒厂水样用于研究工业污水中的DON;在降雨后取自李村河的水样代表城镇面源;大沽河以农业污染排放为主,代表农业源。所取水样均置于5 L塑料桶中并迅速转移至实验室。
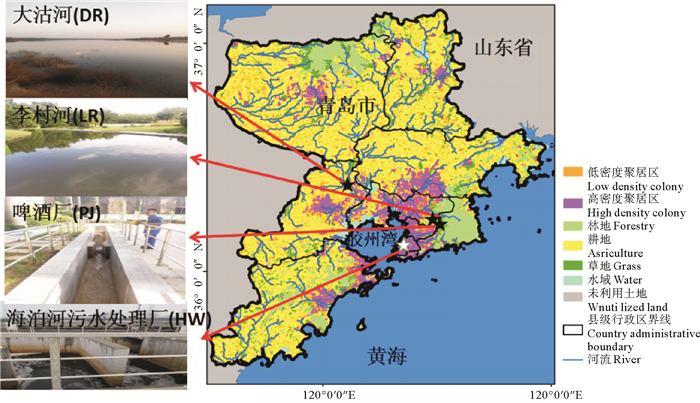
|
图 1 取样点位置 Fig. 1 Locations of the sampling stations |
海水取自胶州湾近海海域,培养实验中将海水分为陈化海水和新鲜海水,陈化海水置于实验室避光低温保存半年左右以除去海水中的有机物,用孔径为0.22 μm的醋酸纤维膜(用2 mol/L的盐酸浸泡4 h后用Milli-Q水冲洗至中性)过滤以除去颗粒物和细菌,目的主要是提供海水环境,海水中低浓度有机物有利于减少对陆源有机物的干扰。新鲜海水通过1.2 μm GF/C玻璃纤维膜(Whatman公司,450 ℃下灼烧4 h)过滤除去颗粒物,接入海洋菌群。陆源水样用孔径为0.22 μm的醋酸纤维膜过滤以除去水体中的颗粒物和细菌,然后采用切向流技术(Minimate切向流系统, Pall公司)通过1K Da的聚醚砜超滤滤膜(Omega,Pall公司)进行浓缩,浓缩比为1:10,DON回收率为39%,将浓缩陆源水、新鲜海水和陈化海水按1:1:8比例在10 L容器中进行混合,并将混合水样置于18个300 mL棕色玻璃瓶(浓硫酸冲洗后用Milli-Q水冲洗至中性)中避光培养,培养体积为250 mL,瓶口用滤纸封口以避免其他源细菌进入,置于20 ℃下恒温培养箱中,试验周期40天,分别于第0、1、2、3、5、8、14、22、40天13点开始取样,每次每组2瓶作为平行样,样品通过0.7 μm GF/F玻璃纤维膜(Whatman公司,450 ℃下灼烧4 h)过滤后,将滤液分别装入3个60 mL色谱瓶储存并置于冰箱中冷冻保存,用于测定DOC(溶解态有机碳)、TDN、DIN、紫外吸收光谱和三维荧光光谱。另取2 mL样品通过1.2 μm GF/C玻璃纤维膜过滤用于细菌的培养和计数。实验设置详见表 1。
|
|
表 1 培养实验设置 |
通过总碳/总氮自动分析仪(Multi N/C 3100, Jena, Germany)采用高温催化氧化法测定TDN和DOC[22],分析精度为2.89%。采用营养盐自动分析仪(Bran-LubbeAAⅢ,Germany)测定DIN(包括NH4—N, NO3—N, NO2—N)[23],分析精度为4.3%,DON浓度是通过TDN和DIN的差值获得的(DON=TDN-DIN)。DON和DOC的降解符合一级降解动力学,方程如下:
| $ \begin{array}{l} {\rm{DON}}(t) = {\rm{BDON}}\cdot\exp ( - {k_{{\rm{DON}}}} \cdot t) + {\rm{RDON, }}\\ {\rm{DOC}}(t) = {\rm{BDOC}}\cdot\exp ( - {k_{{\rm{DOC}}}} \cdot t) + {\rm{RDOC}}{\rm{。}} \end{array} $ |
式中:kDON和kDOC分别表示DON和DOC的降解速率常数(1/d);t代表时间(d); DON(t)和DOC(t)是t时刻的浓度(μmol·L-1);BDON和BDOC是可生物利用的浓度(μmol·L-1);RDON和RDOC是难降解的浓度(μmol·L-1);方程拟合遵循Marquardt-Levenberg法则。
DON和DOC的生物可利用占比(BDON%和BDOC%)计算公式如下:
| $ \begin{array}{l} {\rm{BDON\% = }}\frac{{{\rm{BDON}}}}{{{\rm{BDON + RDON}}}} \times 100\% 。\\ {\rm{BDON\% = }}\frac{{{\rm{BDON}}}}{{{\rm{BDON + RDON}}}} \times 100\% 。\end{array} $ |
细菌总数的测定采用平板计数法[24]:取0.1 mL水样滴于培养基上,用灭菌玻璃刮棒将菌液涂抹均匀,将此培养皿置于25 ℃培养箱内培养24 h,取出后用菌落自动计数仪(Scan300,法国interscience公司)对菌落进行计数。
紫外吸收光谱的测定:采用日本岛津的UV-2550仪器,设置波长扫描范围为200~300 nm,在室温下以Milli-Q水作为空白。紫外吸收特征值是指在特定波长处的单位吸光度值(特定波长吸光值/DOC浓度),本文选取254 nm波长下的单位吸光度值SUVA254进行分析,用以表征DOM的芳香性强弱。SUVA254计算方法[25]如下:
| $ {\rm{SUV}}{A_{254}} = \frac{{a\left( {254} \right)}}{{{\rm{DOC}}}}。$ |
a(254)计算方法如下:
| $ a\left( {254} \right) = 2.30 \times \frac{{D\left( {254} \right)}}{r}。$ |
其中:D(254)表示254 nm波长下的紫外吸光度;r表示光程(m)。
三维荧光光谱测定:样品解冻后用孔径为0.22 μm聚醚砜膜过滤,采用Fluorolog-3荧光计(F4500, France)扫描其荧光光谱,以氙灯作为光源,设定激发波长范围为240~480 nm, 发射波长范围为250~580 nm, 激发发射波长带宽为5 nm, 扫描速度为1 200 nm/min,以Milli-Q水作为空白,用0.01 mg/L硫酸奎宁定标。腐殖化指数(HIX)是在254 nm激发波长下,发射波长435~480 nm间积分面积除以300~345 nm间积分面积与435~480 nm间积分面积之和。
利用SPSS软件(IBM Corp.19.0.Armonk,NY:IBM Corp.,USA)进行ANOVA单因素方差分析。通过分析结果确定城镇生活源、城镇面源、工业源和农业源之间DON生物可利用性是否存在显着差异,如果p < 0.05,则认为存在显著性差异。
2 结果 2.1 DON的生物可利用性陆源DON培养实验发现,TDN浓度在培养周期内基本保持不变(见图 2),变化幅度分别为±2.76%(DR)、±3.46%(LR)、±2.58%(PJ)、±2.31%(HW),与TDN分析精度(±2.90%)相差不大,由此可以将氮的变化看做是DON和DIN的相互转化引起的。
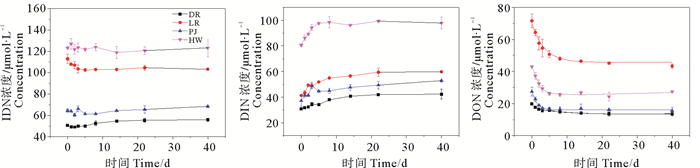
|
图 2 培养实验中TDN、DIN和DON浓度的变化 Fig. 2 The temporal variation of TDN, DIN and degradation fitting curves of DON concentrations in culture experiments |
不同来源DIN浓度变化如图 2所示,在培养过程前期DIN浓度呈上升趋势,而在达到最大值后保持相对稳定。其中,HW组初始DIN浓度最高,在培养过程中DIN增加约20 μmol·L-1;PJ组和LR组DIN变化规律相似,均增加约18 μmol·L-1;DR组DIN增加最为缓慢,浓度升高仅约11 μmol·L-1。
不同陆源DON浓度变化及拟合曲线如图 2所示,所有实验组DON浓度随时间均表现出先快后慢的下降趋势,最后DON浓度趋于稳定,这一趋势与DIN变化趋势正好相反。将DR、LR、PJ、HW组DON降解过程进行拟合发现:PJ组DON降解最快,其次是HW组和LR组,DR组降解最慢,降解速率常数分别为(0.67±0.08)d-1 (PJ)、(0.51±0.08)d-1 (HW)、(0.32±0.03)d-1 (LR)、(0.29±0.06)d-1 (DR) (见表 2)。通过ANOVA单因素显著性分析结果表明:DR组和LR组k值不存在显著性差异(p>0.05),其余各组间均存在显著性差异(p < 0.05)。基于DON的降解速率常数,可以得到DON的周转时间(1/k)[26]分别为1.5 d(PJ)、2.0 d(HW)、3.1 d(LR)、3.4 d(DR),不同来源DON周转时间均存在显著性差异(p < 0.05)。通过拟合得到BDON和RDON的值,根据DON生物可利用占比计算公式得出各组DON生物可利用占比(BDON%)(见表 2)。其中:HW组(41%±8%)和PJ组(41%±7%)最高,LR组DON生物可利用占比(37%±10%)略低,DR组DON生物可利用占比(29%±6%)最低。HW组、PJ组和LR组DON生物可利用性无显著性差异(p>0.05),其余各组组间均存在显著性差异(p < 0.05)。
|
|
表 2 DON降解速率常数和生物可利用占比 Table 2 DON bioavailable fraction and degradation rate constant |
图 3是不同陆源培养实验过程中细菌数量变化曲线。总体上看,初始细菌数量相差不大,均为404 CFU·mL,细菌数量在培养开始时便迅速增加,并在达到最大值后维持在一定水平上,可能是细菌的繁殖和死亡达到动态平衡。采用Logistic生长模型[27],拟合发现,PJ组细菌最大生长速率最快(457 CFU·mL·t-1),终止生物量为2 611 CFU/mL;HW组最大生长速率为200 CFU/mL/t,终止生物量为2 454 CFU/mL;LR组最大生长速率为95 CFU/mL/t,终止生物量为1 186 CFU/mL;DR组最大生长速率最低(59 CFU/mL/t),终止生物量为868 CFU/mL。
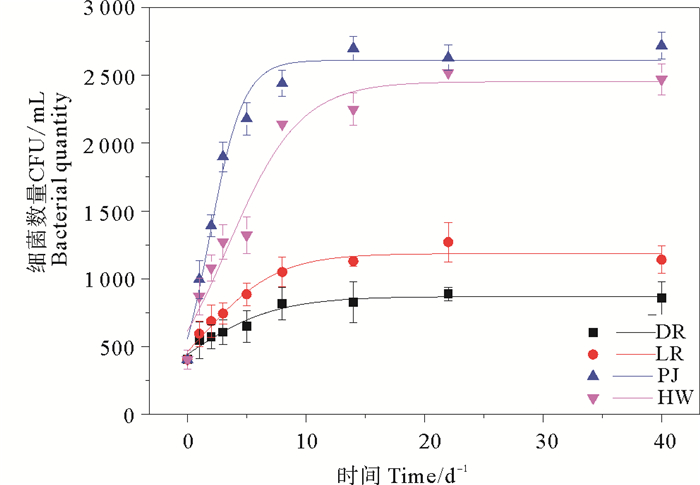
|
图 3 细菌数量变化曲线 Fig. 3 Variation curve of bacterial quantity |
培养实验中DOC的浓度随时间变化如图 4所示,与DON变化相似,DOC浓度也是呈现先快后慢的下降趋势,并在最终趋于稳定。通过4组不同陆源DOC降解实验发现:DR组和PJ组DOC降解最快,降解速率常数分别为(0.56±0.15)d-1和(0.53±0.14)d-1,HW((0.39±0.11)d-1)组次之,而LR((0.18±0.02)d-1)组DOC降解速率最低(见表 3)。显著性分析结果显示,DR与PJ组降解速率常数无显著性差异(p>0.05),而其余各组组间均存在显著性差异(p < 0.05)。DR组、LR组、PJ组和HW组DOC生物可利用占比大小相当,分别为(23±7)%、(22±5)%、(19±7)%和(19±17)%,显著性分析结果显示,各组DOC生物可利用占比均无显著性差异(p>0.05)。
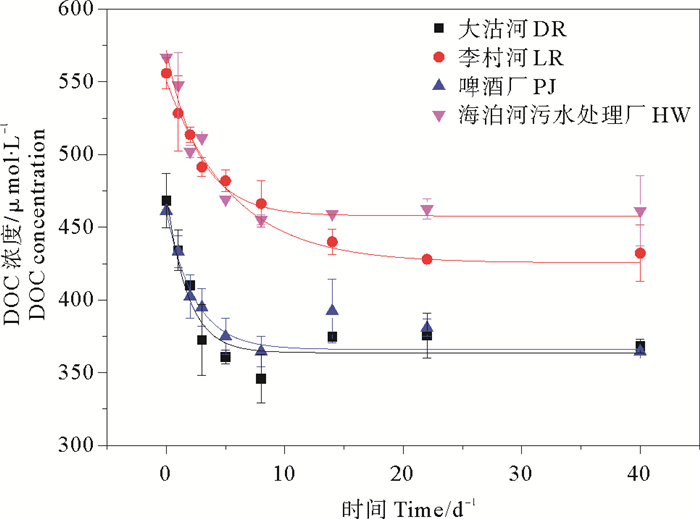
|
图 4 微生物培养实验中DOC浓度的变化 Fig. 4 The degradation fitting curves of DOC concentrations (μmol/L)in culture experiments |
|
|
表 3 DOC生物可利用占比和降解速率常数 Table 3 DOC nd degradation rate constant |
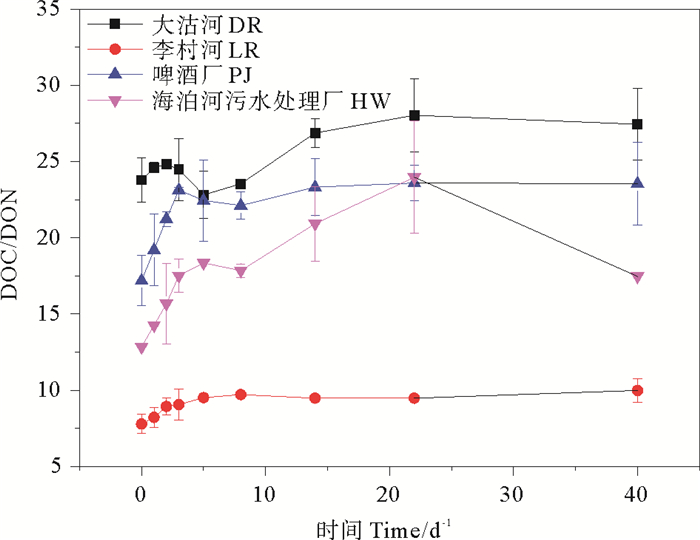
不同实验组DOC/DON均呈现出先快后慢的上升趋势,并最终趋于稳定。不同陆源DOC/DON变化结果表明(见图 5),啤酒厂DOC/DON在培养实验中增加最多,增幅为6.35,海泊河污水处理厂增加4.62,大沽河增加3.66,李村河增幅(2.20)最低。DOC/DON值在实验过程中增加表明微生物利用DON比DOC更多。
|
图 5 不同来源培养实验中DOC/DON值的变化情况 Fig. 5 The temporal variation of DOC/DONin culture experiments |
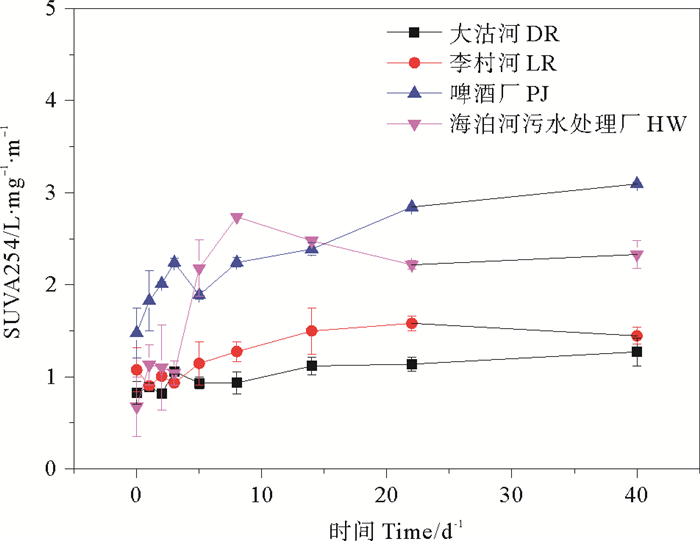
SUVA254在不同培养实验过程中变化如图 6所示,呈现出先快后慢的上升趋势,并最终趋于稳定。海泊河污水处理厂和啤酒厂SUVA254在培养实验中增加最多,分别为1.66和1.62 L·mg-1·m-1,大沽河增加0.44,李村河增加0.37。
|
图 6 培养实验中SUVA254的变化情况 Fig. 6 The temporal variation of SUVA254 in culture experiments |
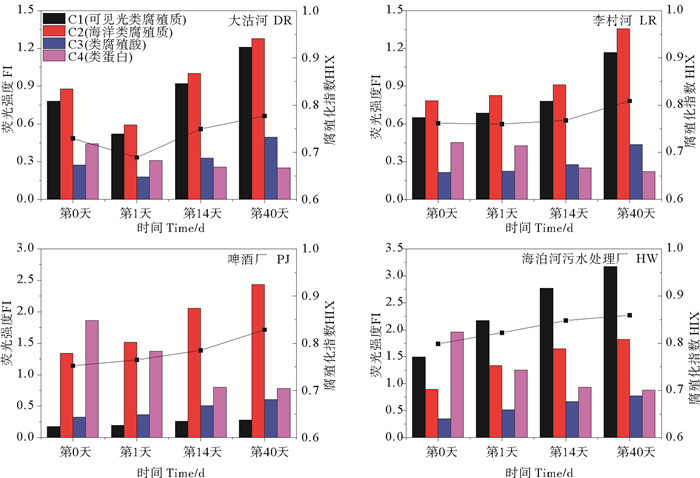
在微生物培养实验中分别取第0天、第1天、第14天和第40天培养的样品分析其三维荧光特征(见图 7),海泊河污水处理厂、啤酒厂、大沽河和李村河的水体中CDOM均主要含有4种荧光组分,分别为可见光类腐殖质C1(Ex/Em 355/440)、海洋类腐殖质C2(Ex/Em 330/390)、类腐殖酸C3(Ex/Em 395/495)以及一个类蛋白峰C4(Ex/Em 285/340)。DR实验组通过40天培养实验可见光类腐殖质增加幅度为55.2%,海洋类腐殖质增加45.4%,类腐殖酸增加80.7%,而蛋白质减少43.2%,腐殖化指数增加6.55%。LR组培养实验中可见光类腐殖质增加幅度为79.6%,海洋类腐殖质增加72.6%,类腐殖酸增加101%,而蛋白质减少51.2%,腐殖化指数增加6.22%。PJ组培养实验中可见光类腐殖质增加幅度为58.0%,海洋类腐殖质增加81.3%,类腐殖酸增加86.9%,而蛋白质减少57.9%,腐殖化指数增加10.1%。HW组培养实验中可见光类腐殖质增加幅度为112%,海洋类腐殖质增加104%,类腐殖酸增加123%,而蛋白质减少55.2%,腐殖化指数增加7.59%。
|
图 7 大沽河、李村河、啤酒厂、海泊河污水处理厂水样在培养实验中荧光强度和腐殖化指数的变化 Fig. 7 Temporal variations in fluorescence intensity (FI)andHIXof the degradation experiments for the different fluorophores from Dagu River (DR), Licun River (LR), Tsingtao Breweryand the Haibo River sewage treatment plant water (HWWTP) |
培养实验过程中高浓度的DIN使培养体系中营养盐充足,DON主要供微生物降解利用。而且不同陆源DON生物可利用性结果表明,城镇生活源和工业源DON生物可利用占比最大,而农业源较低。对于不同来源DON降解速率常数存在工业源>城镇生活源>农业源的关系,这一关系与戴爱泉和马云鹏的研究结果相一致[25, 28]。不同陆源DON的生物可利用性与其组成有关,农业源中的肥料等易被微生物利用,但除此之外还含有腐殖质,不易被微生物利用。而啤酒厂这类食品工业源、污水处理厂集污的城镇生活源和李村河受纳的城镇面源中含有的蛋白质和糖类等有机物较多,易被微生物较快利用。相较于DOC,DON的生物可利用性要高一些,也与其组成结构有关。其中,DOC的生物可利用性与其疏水性组分有关,主要由脂肪族、芳香族和腐殖质类化合物组成,而DON生物可利用性则主要与其亲水性组分有关,如蛋白质和氨基酸中的氨基,后者相对于前者更满足生物利用的需求[4]。
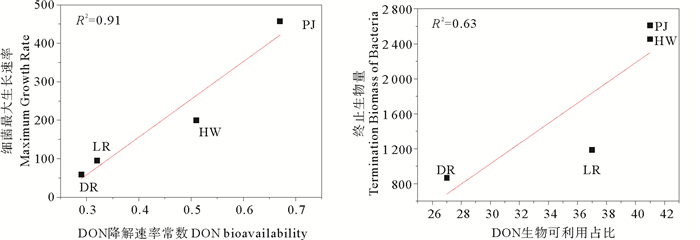
细菌最大生长速率与DON降解速率常数显著正相关(R2=0.91,p < 0.05),同时终止生物量与DON生物可利用占比也显著正相关(R2=0.63,p < 0.05)(图 8)。表明细菌的生长与DON生物可利用性有关,细菌在指数期内,DON不断降解向体系内释放出无机营养盐,进入稳定期后,各来源DON含量维持在一定水平上,细菌数量也变化不明显,这是细菌繁殖和死亡达到动态平衡的缘故[29-33]。
|
(DOH降解速率常数。DOH bioavailability.) 图 8 细菌最大生长速率和终止生物量与DON生物可利用性相关性分析 Fig. 8 Linear regression showing the relationships between the Maximum Growth Rate, Termination Biomass of Bacteria and DON Bioavailability |
通过三维荧光分析发现不同来源的类蛋白的含量均呈下降趋势,说明类蛋白生物可利用性较高,在DON降解中起主导作用,而类腐殖质含量呈上升趋势,说明类腐殖质是微生物降解过程中的伴生产物,表现为腐殖化指数升高。将SUVA254和HIX值与培养实验中DON的生物可利用性进行比较分析发现二者均呈负相关(见图 9),由此可以用SUVA254和HIX表征DON的生物可利用性,HIX可以表征DON的腐殖化程度,SUVA254表征DON的芳香性,SUVA254值和HIX越高,DON的生物可利用性越小。这种负相关关系与有机物的结构有关,有机物芳香性越强,腐殖化程度越高,有机物结构越稳定,不易矿化,生物可利用性较低[34-35]。
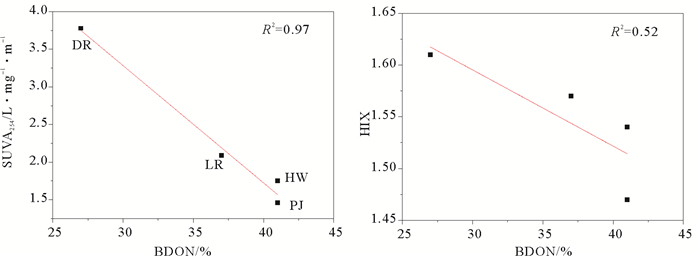
|
图 9 SUVA254、HIX与DON生物可利用性关系 Fig. 9 Linear regression showing the relationships betweenSUVA254, HIX and DON Bioavailability |
通过微生物培养实验研究了环胶州湾4个不同陆源DON生物可利用性和光谱学信号特征,实验结论如下:
(1) 不同来源DON生物可利用性存在显著差异(p < 0.05),其中,城镇生活源和工业源DON生物可利用占比(41%±8%)和降解速率常数(啤酒厂(0.67±0.08)) d-1,海泊河污水处理厂(0.51±0.08)d-1最高,城镇面源DON生物可利用占比(37%±10%)和降解速率((0.32±0.03)d-1)均较低,而农业源DON生物可利用占比(29%±6%)和降解速率(0.29±0.06)d-1均最低。
(2) 细菌的生长与DON生物可利用性有关,DON生物可利用性越高,细菌增长量也越大。
(3) SUVA254可以用以表征DON的生物可利用性。利用三维荧光光谱可以将陆源DON分为类蛋白和类腐殖质组分,陆源DON生物可利用差异,与类蛋白质和类腐殖质组分含量有关,前者易被微生物利用,并有可能转化为后者,表现为腐殖化指数升高。
| [1] |
Wang Y, Liu D, Dong Z, et al. Temporal and spatial distributions of nutrients under the influence of human activities in Sishili Bay, northern Yellow Sea of China[J]. Marine Pollution Bulletin, 2012, 64(12): 2708-2719. DOI:10.1016/j.marpolbul.2012.09.024
(  0) 0) |
| [2] |
Killberg-Thoreson L, SiplerR E, Bronk D A. Anthropogenic nutrient sources supplied to a Chesapeake Bay tributary support algal growth: a bioassay and high-resolution mass spectrometry approach[J]. Estuaries & Coasts, 2013, 36(5): 966-980.
(  0) 0) |
| [3] |
Benner R, Biddanda B, Black B, et al. Abundance, size distribution, and stable carbon and nitrogen isotopic compositions of marine organic matter isolated by tangential-flow ultrafiltration[J]. Marine Chemistry, 1997, 57(3): 243-263.
(  0) 0) |
| [4] |
Petrone K C, Richards J S, Grierson P F. Bioavailability and composition of dissolved organic carbon and nitrogen in a near coastal catchment of south-western Australia[J]. Biogeochemistry, 2009, 92(1-2): 27-40. DOI:10.1007/s10533-008-9238-z
(  0) 0) |
| [5] |
Lønborg C, Søndergaard M. Microbial availability and degradation of dissolved organic carbon and nitrogen in two coastal areas[J]. Estuarine Coastal & Shelf Science, 2009, 81(4): 513-520.
(  0) 0) |
| [6] |
Badr E S A, Tappin A D, Achterberg E P. Distributions and seasonal variability of dissolved organic nitrogen in two estuaries in SW England[J]. Marine Chemistry, 2008, 110(3-4): 153-164. DOI:10.1016/j.marchem.2008.04.007
(  0) 0) |
| [7] |
Bronk D A, Gilbert P M, Ward B B. Nitrogen uptake, dissolved organic nitrogen release, and new production[J]. Science, 1994, 265(5180): 1843-1846. DOI:10.1126/science.265.5180.1843
(  0) 0) |
| [8] |
Benner R. Molecular Indicators of the Bioavailability of Dissolved Organic Matter[M]. Beijina: Academic Press, 2003.
(  0) 0) |
| [9] |
Lønborg C, Davidson K, álvarez Salgado X A, et al. Bioavailability and bacterial degradation rates of dissolved organic matter in a temperate coastal area during an annual cycle[J]. Marine Chemistry, 2009, 113(3): 219-226.
(  0) 0) |
| [10] |
SeitzingerS, Sanders R. Contribution of dissolved organic nitrogen from rivers to estuarine eutrophication[J]. Marine Ecology Progress, 1997, 159: 1-12. DOI:10.3354/meps159001
(  0) 0) |
| [11] |
Ducklow H W. Biogeochemistry of Marine Dissolved Organic Matter[M]. Beijing: Academic Press, 2002.
(  0) 0) |
| [12] |
SeitzingerS P, Sanders R W, Styles R. Bioavailability of DON from natural and anthropogenic sources to estuarine plankton[J]. Limnology and Oceanography, 2002, 47(2): 353-366. DOI:10.4319/lo.2002.47.2.0353
(  0) 0) |
| [13] |
Loague K, Corwin D L. Point and NonPoint Source Pollution[M]. USA: dohn Wiley & Sons, 2006.
(  0) 0) |
| [14] |
Kroeger K D, Cole M L, Valiela I. Groundwater-transported dissolved organic nitrogen exports from coastal watersheds[J]. Limnology & Oceanography, 2006, 51(5): 2248-2261.
(  0) 0) |
| [15] |
Jickells T. Atmospheric inputs of metals and nutrients to the oceans: their magnitude and effects[J]. Marine Chemistry, 1995, 48(3-4): 199-214.
(  0) 0) |
| [16] |
Ramūnas S, Lars L, Tranvik L J. Bioavailability of wetland-derived DON to freshwater and marine bacterioplankton[J]. Limnology & Oceanography, 1999, 44(6): 1477-1485.
(  0) 0) |
| [17] |
Wiegner T N, Seitzinger S P, Glibert P M, et al. Bioavailability of dissolved organic nitrogen and carbon from nine rivers in the eastern United States[J]. Aquatic Microbial Ecology, 2006, 43(3): 277-287.
(  0) 0) |
| [18] |
Pellerin B A, Kaushal S S, Mcdowell W H. Does anthropogenic nitrogen enrichment increase organic nitrogen concentrations in runoff from forested and human-dominated watersheds?[J]. Ecosystems, 2006, 9(5): 852-864. DOI:10.1007/s10021-006-0076-3
(  0) 0) |
| [19] |
Czerwionka K. Influence of dissolved organic nitrogen on surface waters[J]. Oceanologia, 2016, 58(1): 39-45. DOI:10.1016/j.oceano.2015.08.002
(  0) 0) |
| [20] |
Hedges J I, Keil R G. Organic geochemical perspectives on estuarine processes: sorption reactions and consequences[J]. Marine Chemistry, 1999, 65(1-2): 55-65. DOI:10.1016/S0304-4203(99)00010-9
(  0) 0) |
| [21] |
Mesfioui R, Abdulla H A N, Hatcher P G. Photochemical alterations of natural and anthropogenic dissolved organic nitrogen in the York River[J]. Environmental Science & Technology, 2015, 49(1): 159-167.
(  0) 0) |
| [22] |
Ogawa H, Fukuda R, Koike I. Vertical distributions of dissolved organic carbon and nitrogen in the Southern Ocean[J]. Deep Sea Research Part Ⅰ Oceanographic Research Papers, 1999, 46(10): 1809-1826. DOI:10.1016/S0967-0637(99)00027-8
(  0) 0) |
| [23] |
Strickland J D H, Parsons T R. A practical handbook of seawater analysis[M]. Canada: Fisheries Research Board of Canada, 1972.
(  0) 0) |
| [24] |
国家质量技术监督局发布. 海洋监测规范第7部分:近海污染生态调查和生物监测: GB 17378. 7-1998[M]. 北京: 中国标准出版社出版, 1999. Issued by the State Bureau of Quality and Technical Supervision. Marine Monitoring Regulations Part 7: Offshore Pollution Ecology Survey and Biomonitoring: GB 17378. 7-1998[M]. Bejing: China Standard Press, 1999. (  0) 0) |
| [25] |
马云鹏.胶州湾陆源溶解有机氮的生物可利用性及其动力学研究[D].青岛: 中国海洋大学, 2017. Ma Y P. Bioavailability and Dynamics of Land-Based Dissolved Organic Nitrogen in Jiaozhou Bay[D]. Qingdao: Ocean University of China, 2017. (  0) 0) |
| [26] |
Kang P G, Mitchell M J. Bioavailability and size-fraction of dissolved organic carbon, nitrogen, and sulfur at the Arbutus Lake watershed, Adirondack Mountains, NY[J]. Biogeochemistry, 2013, 115(1-3): 213-234. DOI:10.1007/s10533-013-9829-1
(  0) 0) |
| [27] |
张洪林, 刘永军, 南照东, 等. 应用微量热法构建限制性条件下微生物生长模型[J]. 生物工程学报, 1994, 10(4): 333-337. Zhang H L, Liu Y J, Nan Z D, et al. Microorganism growth model under restrictive conditions by microcalorimetry[J]. Chinese Journal of Biotechnology, 1994, 10(4): 333-337. (  0) 0) |
| [28] |
戴爱泉.渤海陆源TN和COD污染物分配容量指标体系计算方法及应用[D].青岛: 中国海洋大学, 2015. Dai AQ. Calculation Method and Application of TN and COD Pollutant Distribution Capacity Index System in Bohai Land Source[D]. Qingdao: Ocean University of China, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10423-1015712696.htm (  0) 0) |
| [29] |
Sipler R E, Bronk D A. Dynamics of dissolved organic nitrogen[M]. Burlington: Academic press, Biogeochemistry of Marine Dissolved Organic Matter (Second Edition), 2014: 127-232.
(  0) 0) |
| [30] |
Mulholland M R, Lomas M W. Nitrogen uptake and assimilation[J]. Nitrogen in the Marine Environment, 2008, 303-384.
(  0) 0) |
| [31] |
Garcia J C, Ketover R D J, Loh A N, et al. Influence of freshwater discharge on the microbial degradation processes of dissolved organic nitrogen in a subtropical estuary[J]. Antonie van Leeuwenhoek, 2015, 107(2): 613-632. DOI:10.1007/s10482-014-0357-3
(  0) 0) |
| [32] |
周德庆. 微生物学教程[M]. 北京: 高等教育出版社, 1993: 186-190. Zhou D Q. Microbiology Course[M]. Beijing: Higher Education Press, 1993: 186-190. (  0) 0) |
| [33] |
王江涛, 赵春霞, 尹晓楠, 等. 细菌对海水中各形态氮的影响[J]. 中国海洋大学学报(自然科学版), 2006, 36(3): 468-472. Wang J T, Zhao C X, Yin X N, et al. Effects of Bacteria on Various Forms of Nitrogen in Seawater[J]. Pcriodical of Ocean University of China, 2006, 36(3): 468-472. (  0) 0) |
| [34] |
Qin C, Liu H, Liu L, et al. Bioavailability and characterization of dissolved organic nitrogen and dissolved organic phosphorus in wastewater effluents[J]. Science of the Total Environment, 2015, 511: 47-53. DOI:10.1016/j.scitotenv.2014.11.005
(  0) 0) |
| [35] |
Dilling J, Kaiser K. Estimation of the hydrophobic fraction of dissolved organic matter in water samples using UV photometry[J]. Water Research, 2002, 36(20): 5037-5044. DOI:10.1016/S0043-1354(02)00365-2
(  0) 0) |
2. Marine National Laboratory of Marine Ecology and Environmental Science, Ocean University of China, Qingdao 266071, China
 2018, Vol. 48
2018, Vol. 48


