2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室, 山东 青岛 266100;
3. 中国海洋大学海洋化学研究所, 山东 青岛 266100
挥发性卤代烃(Volatile halocarbons, VHCs)是大气中挥发性有机物(Volatile organic compound, VOC)的一部分,是一类重要的痕量温室气体,在全球气候变化中扮演着重要的角色。一方面,大气中的VHCs在太阳光的作用下,会发生化学降解或者光化学分解产生卤素自由基,进而与大气中的臭氧反应,造成臭氧层破坏[1]。Read等[2]提出热带对流层中50%的臭氧层破坏由卤素自由基造成的。此外,有研究表明平流层和对流层中的臭氧消耗有20%~30%是由短寿命溴代烃(大气寿命小于6个月,如CHBr3和CH2Br2)造成的[3]。同时,VHCs产生的卤素自由基还可以通过反应影响大气中温室气体(如CH4和N2O)的浓度[4],从而直接或间接的影响全球气候变化。另一方面,作为温室气体,VHCs可以吸收从地表产生的红外光辐射使大气升温,从而引起温室效应[5]。研究表明,就单个分子而言,VHCs产生的辐射强迫远远大于CO2;CFC-12、CFC-113和CFC-11的全球变暖潜能值(GTPs)分别可达8 590、4 860和2 920[6]。自前工业时代以来,损耗平流层臭氧的氯氟碳化物(CFCs)以及微量卤化气体(如CCl4和CH3CCl3)对长寿命温室气体的辐射强迫贡献率约为11%[7]。于1987年签署的《蒙特利尔议定书》将CFC-11、CFC-12等氟氯烃作为消耗臭氧层物质进行严格管控[7]。此外,近年来的研究发现,短寿命VHCs造成的臭氧损失对辐射的影响大约是长寿命VHCs的1/2;它们对全球辐射强迫的贡献总计约为-0.02 W·m-2;因不受《蒙特利尔议定书》制约,近年来短寿命VHCs的大气浓度正在不断升高[8],文献报道2016年对流层中短寿命氯代烃的浓度已经从2012年的90×10-12增长到110×10-12[7],因而尽管大气中VHCs的浓度较小,其产生的环境效应也不容小觑。
自从1970年代发现氟氯碳化物的臭氧消耗作用以来,VHCs的来源及产生机制一直是大气环境领域的研究热点。大气中的VHCs主要有人为来源和天然来源。人为来源是指人类生产生活过程中产生释放的VHCs,天然来源主要有海洋和陆地的释放,包括生物作用释放、海-气交换作用释放以及火山活动等天然过程的释放。其中海洋生物的产生释放是大气中VHCs特别是短寿命VHCs的主要天然来源,以单卤代烃为例,全球海洋产生释放的氯甲烷(CH3Cl)、溴甲烷(CH3Br)和碘甲烷(CH3I)对全球总量的贡献可达10%~50%、35%和70%[9]。研究表明,全球来自开阔大洋区和沿海地区的CH3I释放量分别为240和60 Gg·yr-1[10]。来自热带地区和开阔大洋区的溴仿(CHBr3)释放量分别为213和19~304 Gg·yr-1[11-12],而Gschwend等[13]发现,仅温带大型藻类(褐藻、绿藻和红藻)对全球大气中有机溴和有机碘的贡献量就达1010和108 g·yr-1。海洋中生成释放的VHCs可以通过海-气交换作用进入大气,因而海水中VHCs的产生释放过程对大气中VHCs的源汇平衡具有不可替代的作用。目前国际上进行的许多大型研究计划都涉及到VHCs,其中有关海洋中VHCs的源与汇的变化、分布和通量以及循环机制的研究是上层海洋-底层大气研究(SOLAS)的核心研究内容之一。已有的研究结果表明近岸海域海水中VHCs的浓度以及海气通量的绝对值一般大于大洋区[14-15]。另外,各国学者针对海洋中VHCs的来源及产生机制进行了初步的探讨和研究,初步提出了酶促反应生成机制,光化学反应生成机制,取代反应生成机制等[16-17]。但是目前国内对于海洋中VHCs的研究仍处于初级阶段,针对海洋中VHCs的研究大多集中在其分析方法和浓度分布规律领域,并对海洋微藻释放VHCs及其影响进行了初步研究[18-22],而对于海洋中VHCs的产生机制及其影响因素的研究还很匮乏。本文主要对海洋中VHCs的来源、分布及迁移转化进行综述,为进一步完善海洋中VHCs的研究提供参考。
1 海洋中VHCs的来源海洋中的VHCs主要有两个来源:一个是人为源,一个是天然源。人为源是指人类进行生产生活活动产生的VHCs,经过河流及湖泊的输送或者是海-气交换最终进入海洋。天然源主要包括海洋和陆地生物、微生物、藻类经过生物作用或者化学作用合成释放以及火山爆发等自然过程释放。
1.1 人为源环境中的VHCs可以根据其大气寿命的长短分为长寿命VHCs和短寿命VHCs,其中大部分长寿命的VHCs(大气寿命大于6个月)是由人为合成释放的[23]。氯氟烃(CFCs)是一类重要的人为来源的长寿命VHCs,被广泛用做制冷剂以及发泡剂和喷雾剂等的生产过程中。近年来由于CFCs在《蒙特利尔议定书》中被列为主要受控物质,CFCs在大气中的浓度逐年降低。但是有学者通过对近二十年来大气中CFCs的监测结果进行分析,发现CFC-12和CFC-113的释放量持续下降,而CFC-11的释放量从2012年开始重新出现上升趋势,导致CFC-11的大气浓度下降速率比之前降低了1/3,这些新增的释放量主要来源于东亚地区的工业生产[24]。由于VHCs可以通过多种化学反应产生,因而人类在进行生产生活的过程中,会不可避免的产生释放VHCs。四氯化碳(CCl4)是氯甲烷(CMs)和四氯乙烯(PCE)生产过程中十分重要的副产物,每年通过CMs和PCE生产释放到大气中的CCl4可达13 Gg[25]。氯气(Cl2)生产过程(如氯碱工业)也会贡献一部分CCl4,Fraser等[26]估算每年通过氯碱工业以及垃圾填埋场和受污染的土壤释放到大气中的CCl4可达10~30 Gg。环境中短寿命VHCs的来源通常包括人为来源和天然来源,对于大部分氯代烷而言,其工业排放大于天然来源[27]。以二氯乙烷(CH2ClCH2Cl)为例,其在人类活动频繁的北半球的浓度为(10~20)×10-12,而在南半球的浓度仅为其北半球浓度的17%左右[28]。在水的氯化消毒过程中,消毒剂中的氯会将水中的腐殖质、藻类以及小分子有机物转化成氯仿(CHCl3)、氯乙烷(C2H3Cl)等氯化物[29],当水中溴离子达到一定浓度时,还会产生有机溴化物[30]。其中,三卤甲烷是最常见的消毒副产物,包括CHCl3、CHBr3和一氯二溴甲烷(CHBr2Cl)等[31]。除此之外,核电站海水冷却,造纸以及生物燃料燃烧过程中也会产生一些含氯或含溴的VHCs[32]。这些由人类生产生活活动产生释放的VHCs最终会通过陆地输送,海-气交换等过程进入海洋,进而参与生物地球化学循环。
1.2 天然源 1.2.1 生物作用海洋生物的生物作用是海水中VHCs的重要的天然来源。大型藻类如红藻、褐藻、绿藻等都是海洋中VHCs的重要来源[33]。Lovelock在1975年用气相色谱法首次检出海水中含有卤代烃,并测得其在近岸区浓度远大于开阔大洋区,因此推测近岸区海藻会产生释放卤代烃[34]。后来许多研究者通过培养实验等方法证实了这一推测,大量的研究结果表明热带、亚热带、温带以及极地海洋中的大型藻类能生产释放多种VHCs,但是大型海藻在不同条件在对VHCs的释放速率不同。以CH3I为例,研究表明亚热带、温带甚至极地地区的大型海藻都能产生释放CH3I,但是不同海藻类型在不同条件下对其释放速率不同,例如亚热带海藻Falkenbergia hillebrandii(红藻)对CH3I的释放速率为8.5 ng·g-1·h-1,而温带海藻Sargassum horneri对CH3I的释放速率仅为0.17 ng·g-1·h-1[35-36]。另外,尽管大型海藻对不同类型的VHCs的释放速率不同,但是不同学者一致认为藻类释放的主要物质为氯仿[37]。Gschwend于1985年研究了褐藻和绿藻以及红藻对VHCs的生物生成,结果表明释放速率最大的3种VHCs分别是CHBr3、CHBr2Cl和CH2Br2[13]。Nightingale等人通过实验室培养发现,苏格兰地区的多种褐藻、绿藻及红藻可以产生释放CHCl3、CHBr3、CHBr2Cl和CHBrCl2[38]。除了大型海藻外,海洋中的微藻,浮游动物,细菌和真菌[39],尤其是微藻也能产生释放VHCs[40],由于其数量多且分布广泛,因而对生源VHCs的贡献甚至要大于大型海藻。大型海藻主要分布于沿海地区,这些地区仅占全球海洋表面的0.3%。而Leedham等[41]估算来源于热带开阔大洋区的短寿命VHCs大约贡献全球卤代烃预算的75%,表明在开阔大洋区广泛存在的微藻对VHCs的贡献十分显著。以溴甲烷(CH3Br)为例,微藻每年产生的CH3Br要比大型海藻高近两个数量级[42]。
由于生物体内的化学及生物化学作用十分复杂,因而不同海洋生物产生VHCs的机制也大不相同,目前初步的研究指出海洋生物合成VHCs的机制是卤过氧化酶(Haloperoidase,HPO)催化作用下的生物合成[43-44],认为大量存在于环境中的HPO可以起到催化作用,使卤阴离子(X-)与H2O2发生氧化还原反应,形成具有反应活性的亲电卤化物次卤酸(HClO),次卤酸不稳定,因而会继续与有机亲核体(R)发生反应,生成有机卤化物(RX)。其反应通式为
| $ \text{R-H+}{{\text{H}}_{2}}{{\text{O}}_{2}}\text{+}{{\text{H}}^{+}}\text{+}{{\text{X}}^{-}}\to \text{R-X+}2{{\text{H}}_{2}}{{\text{O}}_{\circ }} $ |
其中卤阴离子(X-)包括氯(Cl)、溴(Br)和碘(I),但是氟(F)并不能通过上述机理形成含氟卤代烃。后来研究者通过培养实验获得海水中VHCs的释放速率与海水中H2O2含量以及海洋生物中过氧化氢酶的含量之间的关系,发现随着海水中H2O2含量的升高,海洋生物产生释放溴化物和碘化物的产量也不断增加,从而证实海水中的CHBr3、CH3I和CH3Br等VHCs是通过HPO催化作用下的生物合成机制产生的,但是实验过程中没有发现CH3Cl的生产与HPO酶有明显的相关性[45]。
由于没有发现通过HPO催化作用下的生物合成机制产生的CH3Cl,有学者提出海洋生物可能首先产生CH3I,随后这些生物成因的CH3I会与海水中的Cl—、Br—发生化学反应,从而形成相应的卤代甲烷(CH3Cl和CH3Br)。然而Wuosmaa通过培养实验发现,当用海水培养红藻及其细胞提取物时,它们产生释放的一卤代甲烷中只有CH3Cl,只有使用特殊的含有卤阴离子(X—)的海水进行培养时才会产生释放CH3Br和CH3I,与上述机制不符。Wuosmaa通过进一步实验从红藻中分离出并纯化得到甲基转换酶,进而提出了一种新的VHCs的生物合成机制—转换酶机制,认为在甲基转化酶的作用下,底物S-腺苷蛋氨酸(SAMe)会与卤离子反应生成单氯代烃[44]。目前,转化酶机制主要涉及两种路径,一种是在甲基转移酶的促进下,卤离子与SAMe上的甲基发生亲核取代,从而生成单卤甲烷。另一种是在以SAMe为底物的酶的作用下,卤素先与SAMe的L-蛋氨酸发生取代反应生成卤代腺苷,随后再通过反应生成卤代甲烷[46]。
1.2.2 非生物作用除了海洋生物作用会产生释放VHCs外,海洋中一些化学及光化学反应也会贡献一部分VHCs,早期的研究表明,海洋上空的活泼氯(如Cl2,HClO)可以被分解为氯自由基,这些氯自由基可以与海洋中的有机物反应,生成有机氯化物,海水中的有机氯可以进一步与有机物反应生成VHCs[47]。
但是目前对于海洋中VHCs的非生物成因的研究相对匮乏,VHCs的光化学合成机制是该领域的研究热点。光化学反应一般发生在海水表面,是环境中有机卤化物重要的非生物来源[17, 48]。海洋中的腐殖质(HA)、溶解有机质(DOM)和有色溶解有机物(CDOM)都可以在太阳光的作用下产生VHCs。海洋中VHCs的光化学合成最早由Mooer和Zaifrinu提出,他们通过模拟实验研究CH3I的生成与自然光照之间的关系,发现光照条件会对海洋中CH3I的生成产生显著的影响,并提出了CH3I的光化学合成机制,认为海洋中的腐殖质、DOM和CDOM等可以通过光化学作用产生甲基自由基(CH3·),而CH3I是由碘自由基(I·)和甲基自由基(CH3·)结合生成的[49]。后来许多研究者的测定结果为VHCs的光化学合成机制提供了数据支持,Moore[50]的研究表明在光照条件下,海水中的溶解有机质可以在含氯的溶液中发生光化学反应生成CH3Cl,Riemer等[51]发现大气中的非甲烷烃类物质有一部分来源于海水的光化学反应,这些烷烃类物质可能与活性氯反应生成VHCs。还有学者发现,DOM在阳光照射下会形成激发态,包括激发单重态和激发三重态,激发态的DOM会氧化卤离子形成卤素自由基,为卤代有机物的形成提供原料[52]。
另外,研究表明海水中CH3Cl和CH3Br的浓度与CDOM的浓度有一定的相关性[53],次表层海水中CDOM能够与氯离子发生光化学反应产生CH3Cl。而表层海水中的卤素物质则可以被羟基自由基(·OH)氧化形成自由基和非自由基的活性卤素物质,其中自由基的活性卤素物质可以通过自由基重组形成卤代有机物,而非自由基的活性卤素物质可以通过亲电子替换或置换形成卤代有机物[54-55]。
海洋中还有一部分VHCs是由硫化物转化而来的,一般认为是由藻类、浮游植物等产生的β-二甲巯基丙酸内盐(β-DMS)和二甲基硫(DMS)与卤阴离子反应得到,反应过程中二甲基硫化物提供甲基[56],以CH3I为例,反应式为
| $ \begin{align} & {{(\text{C}{{\text{H}}_{3}})}_{2}}{{\text{S}}^{+}}\text{C}{{\text{H}}_{2}}\text{C}{{\text{H}}_{2}}\text{CO}{{\text{O}}^{-}}~+\text{ }{{\text{I}}^{-}}\to \text{ C}{{\text{H}}_{3}}\text{I, } \\ & \ \ \ \ \ \ \ \ \ \ \ \ \text{C}{{\text{H}}_{3}}\text{SC}{{\text{H}}_{3~}}\text{+ }{{\text{I}}^{-}}\to \text{ C}{{\text{H}}_{3}}{{\text{I}}_{{}^\circ }} \\ \end{align} $ |
海洋中VHCs的天然释放受多种因素影响,包括光照、温度、营养盐浓度、pH、溶解有机质(DOM)以及铁离子浓度等。光照在海水生成VHCs的过程中起着至关重要的作用,已有的研究结果表明,在光照条件下CH3Cl以及CH3I的生成速率明显增大[49]。DOM可以发生光化学反应生成VHCs,在太阳光的照射下,DOM的降解速度会迅速加快[57],从而发生化学键的断裂产生VHCs等小分子物质。同时,许多学者通过培养实验发现,光照条件会影响大型藻类及微藻释放VHCs的速率。巨型红藻Solieria chordalis能够释放包括CH3I和CH3CH2I在内的9种VHCs,而这些VHCs的释放速率都有一定的光依赖性,黑暗条件下的释放速率低于光照条件下的释放速率[58]。而Orlikowska等[59]通过在南波罗的海沿岸和Raunefjord(北海)海域的围隔实验指出环境中的紫外辐射(UVR)水平对围隔生态系统内浮游植物产生的六种VHCs(CH3I、CHCl3、CH2Br2、CH2ClI、CHBr3和CH2I2)的量没有显著的影响。由此可见,光照条件对海水中VHCs生成的影响规律和作用机制还有待进一步研究。
温度和营养盐浓度对海洋中VHCs的天然释放的影响主要表现在影响浮游植物产生释放VHCs。无论浮游植物是通过酶促反应还是化学反应生成VHCs,其反应过程都会在一定程度上受温度影响。Abe等[60]通过对海洋硅藻的培养实验发现,硅藻生产释放CH3Cl的速率会随温度升高,其在25 ℃时的CH3Cl释放速率是15 ℃时的2.6~3倍。同时Sato等[39]通过对海洋细菌的培养实验得到了相似的结论,培养温度从20 ℃升高至30 ℃,海洋细菌的CH3Cl释放量也随之增大。但是实验并未发现CH3I的释放量与温度之间存在明显的正相关,温度对海洋生产释放VHCs的影响规律及作用机制还有待进一步研究。营养盐浓度主要是通过影响浮游植物的生物量间接影响VHCs的释放。Smythe-Wright等[61]通过培养实验发现,浮游植物的生物量对VHCs释放量的影响十分显著,在磷酸盐浓度一定的情况下,将氮磷比从16:1提高到48:1,浮游植物对碘甲烷(CH3I)的释放量提高了60%。徐志法等[62]指出碘代甲烷生成量与总氮(TN)和总磷(TP)具有显著正相关。此外,有学者通过西太平洋添加营养盐的培养实验发现,氮磷营养盐的添加对三氯乙烯(C2HCl3)、四氯乙烯(C2Cl4)、一氯二溴甲烷(CHBr2Cl)和三溴甲烷(CHBr3)的释放量同样具有显著的促进作用[22]。
pH对海洋中VHCs的生物生成以及非生物生成都有一定的影响。Moore等[50]的研究结果表明,CH3Cl的光化学合成受pH的显著影响,较高的pH对CH3Cl的合成具有明显的促进作用。这主要是由于当pH>8时,DOM的去甲基化效率最高,有助于CH3Cl的合成[63]。此外,实验室研究和船基围隔培养实验调查表明VHCs的释放对CO2浓度的变化很敏感。Wingenter等[64]的研究结果表明高浓度CO2(760×10-6和1 150×10-6)的处理组比对照组中的CH2ClI浓度分别升高了46%和131%;而Hopkins等[65]的研究结果证明高浓度的CO2会显著抑制CH3I及其他碘代烃的产生量(浓度降低28%~41%)。同时Hopkins等[66]指出CH3I产量与CO2的浓度间没有直接的相关关系。高浓度CO2通过改变浮游植物群落组成及影响产生碘代烃的DOM和细菌的组成,间接影响碘代烃的浓度。总的来说,pH对碘代烃(CH3I和CH2I2等)的产生有影响,但对氯代烃产生的影响未见报道。引起上述不同结果的原因可能是所研究的浮游植物不同。因此,海洋酸化对VHC释放的影响机制尚无定论。
许多研究证实了DOM在控制天然海水中VHCs生成方面的作用。Manley和Barbero的研究表明,从天然海水中去除DOM会明显降低CHBr3的产量[67]。值得注意的是,DOM对海水中VHCs的生成过程并不仅仅表现为促进作用,由于DOM能够与自由基发生反应,与VHCs的生成产生竞争,因而也会表现出一定的抑制作用[68]。除此之外,研究表明海水中铁离子的浓度也会在一定程度上影响VHCs的生成。微量元素作为限制性的营养物质,对海洋初级生产力有十分重要的影响,而铁元素作为微量元素的一种,参与叶绿素的合成、光合作用、呼吸作用等过程,是浮游植物(海藻)生长的主要限制因素[69]。海洋中海藻的生物作用是海洋中VHCs的主要来源之一,因而海洋中铁离子的浓度会通过制约浮游植物的生长来影响VHCs的形成。但是由于铁离子对不同藻类生长的影响不尽相同,因而铁离子与藻类的生成VHCs并不是简单地正相关。研究还发现海洋中VHCs的产生释放有明显的地理分布特征,VHCs的产生释放会随纬度发生变化,对于CH3Cl和CHCl3而言,其在热带、亚热带海域的释放量要远高于温带、寒带地区的释放量[70]。而Lim等[23]通过对不同温度带藻类释放VHCs的情况进行汇总,发现热带、亚热带地区的海藻大多能够释放CH3Cl和CHCl3,这说明VHCs生产释放的地理分布特征有一定的物种依赖性,但是不同地理环境对VHCs释放的影响机制还有待进一步研究。
2 海水中VHCs的分布目前,国际上针对VHCs的研究主要集中于其源汇变化、分布、通量以及循环机制,已有的研究结果表明海洋中VHCs的浓度分布存在时空差异。通常情况下,海水中VHCs分布具有明显的空间差异,一般表现从近岸到远海浓度逐渐降低。Kolusu等[71]测得北大西洋海水中CH3Cl的浓度为74~166 pmol·L-1,而Singh等[72]测得其在近岸海区的浓度为125~828 pmol·L-1,大于其在远海区的浓度。Yuan等[19]发现夏季长江口及其邻近海域表层海水中3种CFCs浓度由河口到外海逐渐降低。而Yang等[73]的研究结果表明C2HCl3在南黄海和东海的浓度要高于南大西洋的浓度[74]。这主要是因为近岸区其浓度受藻类生物活动及人类活动影响较大,并且由于近岸区藻类的生物作用,浓度的最大值通常出现在海藻生长带。例如在挪威的Spizbergen海湾,CH3I在海藻生长带、近岸和海湾中部的平均浓度分别为7.3、4.2和2.3 pmol·L-1[75]。
对于同一研究区域,研究结果通常会随研究时间发生变化,VHCs在海水中的分布具有明显的时间差异。例如King的研究发现,在北大西洋CH3Br是不饱和的[76],而Groszko和Moore的研究却表明,CH3Br在该调查区域的是过饱和的[77]。这主要是因为海水中VHCs的来源受各种因素制约,其中光照条件、藻类及浮游生物的生长情况都会影响VHCs的生物和非生物合成,进而影响海水中VHCs的浓度。同时还有研究表明,这些影响因素与VHCs分布的季节变化以及周日变化有一定的关系,有学者对中国东海和南海海域VHCs的分布情况进行研究,发现VHCs的水平分布特征基本呈近岸高、远海低的趋势,但是不同的季节其水平分布表现出不同的特征。例如受浮游植物生物合成的影响,春季VHCs在长江口海域浓度较高,而在黑潮水的影响下,VHCs在秋季一般呈点状分布。并且春秋两季VHCs的分布也呈现周日变化的趋势,在中午和午夜分别出现高值和次高值,推测这与VHCs的生物合成及非生物合成密切相关[37]。Shimizu等[78]通过对日本富卡湾海域调查发现,海水中CH2I2、CH2-ClI、CH3I和C2H5I的浓度有明显的季节变化规律,表现为在夏末秋初出现峰值,在春季和冬季出现低值。这主要是因为春季(4月初)硅藻繁殖期结束后,会有大量有机物沉积,这些有机物分解为VHCs的形成提供原料,而秋季(10月)随着Tsugaru暖流水注入海湾,海湾内外水交换使VHCs浓度逐渐降低。此外,Wei等[20]则发现在北黄海和渤海地区秋季CHCl3、C2Cl4、CHBr2Cl和CHBr3浓度均高于春季,认为秋季浓度升高主要受人为因素影响,每年的汛期(6~9月),大量携带营养物质的淡水会由鸭绿江和黄河注入北黄海和渤海。而对于CHCl3而言,其春季浓度大约是秋季的1.5倍,这与叶绿素(Chl-a)的季节分布恰好一致,说明CHCl3浓度的季节变化主要受浮游植物生长情况的影响。
目前的研究尚未发现海水中VHCs垂直分布的明显的统一规律,其垂直分布随研究海域的不同以及海水深度的变化而变化,并且不同VHCs也会表现出不同的垂直分布规律。在东海、黄海海域CH3Br的浓度会在0~75 m混合层中出现最大值,之后会随深度增加而减小,但是具体深度会因为采样点的不同而发生变化。这主要是因为CH3Br在该研究区域的垂直分布受水团混合运动、光照条件以及其生物合成作用的影响[79]。而Moore[80]的研究则发现,在北大西洋海域海水中C2HCl3和C2Cl4的浓度会随着海水深度的增加而不断增大,通过随后的研究推测这是由于这两种VHCs的寿命较长引起的。在分析影响VHCs的垂直分布的因素时通常涉及到温度、盐度、叶绿素浓度等各种参数,通过相关参数的对比来进一步分析影响因素。一般情况下,如果出现水温和盐度的变化,则可能是由于不同水团的混合引起的浓度变化;如果深海处VHCs的浓度较高,而相关参数没有明显异常,则可能是底层沉积物或底栖生物释放而引起浓度变化;如果海底深处浓度很低,则可能是由于VHCs在缺氧条件下发生水解引起的。另外,VHCs在海水中的分布与藻的种类以及光照强度也有一定的相关性。
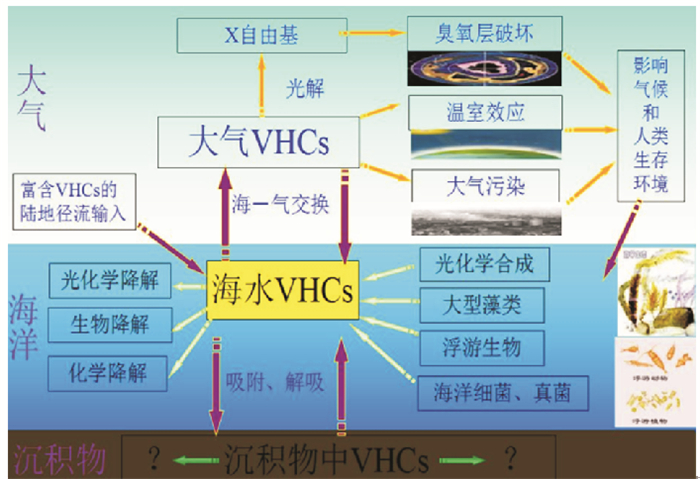
3 海水中VHCs的主要迁移转化过程作为一种重要的痕量温室气体,VHCs与全球气候变化有着密切的联系,因而对VHCs的迁移转化规律进行研究对于研究全球气候有十分重要的影响。根据已有的关于VHCs迁移转化的相关文献,可以粗略的绘制出海水中VHCs的循环示意图,如图 1所示。
海水中VHCs的一个重要去除路径是通过海-气交换过程进入大气,其海气通量主要取决于气体在表层海水中的浓度和输送速率,计算海水中VHC的海气通量对于评价海洋释放VHCs对全球气候的影响具有十分重要的意义。但是现阶段尚未发现能够精确计算气体海气通量的方法,因而研究者通常用由Liss和Slater提出的双层膜模型来粗略的估算VHCs的海气通量[82]。根据双层膜模型,可以得到海气通量的计算公式为:
| $ F=\text{ }{{K}_{w}}~{{({{C}_{w}}-{{C}_{a~}}\text{/ }H\text{ })}_{\circ }} $ |
式中:Cw和Ca分别为气体在海水和大气中的浓度(pmol·L-1);H为亨利常数,会随温度(T)的变化而发生变化,可以通过Moore等[83]学者提出的亨利常数经验公式进行求算;Kw为气体交换常数,是风速(u)和气体Sc(Schmidt number)常数的函数,通常使用LM86法[84]、W92法[85]或E93[86]法进行求算, 其中最常用的是W92法。选用不同的经验公式求得的海气通量不同,并且由于海水中VHCs的浓度分布具有时空差异,最终求得的海气通量也会呈现一定的时空差异。
海水中的VHCs除了通过海气交换迁移之外,还会通过生物降解、化学降解以及光化学降解等过程去除。Roy[87]的研究表明,底层微生物的呼吸作用会导致海水中CCl4浓度出现低值。而Hopkins等[88]通过围隔实验发现,CHBr3的浓度与细菌密度呈现显著的负相关,表明细菌的分解作用可以消耗CHBr3。VHCs的化学降解过程包括水解反应、取代反应以及氧化还原反应等,水解反应是其中十分重要的一种去除过程。卤代甲烷(如CH3I和CH3Br)一般具有较高的水解活性,这些VHCs可以通过水解反应转化为甲醇(CH3-OH)而被去除[89]。另外,有研究表明,海水中的CH3I可以在表层海水中发生光降解反应产生甲基自由基(CH3·)和碘自由基(I·),由于该反应受光照条件影响,因而其反应速率会随海水深度的增加而减小。同时Liu等[90]的研究结果表明,海水中CHBr3存在光解损失。Shi等[91]通过培养实验发现,光照条件下海水样品中VHCs的去除速率要高于黑暗条件下的去除速率,推测可能是因为CH3I与光致生成过程中产生的未知活性物质反应所致,但这需要进一步的研究证实。总体而言,目前针对于海水中VHCs的转化途径及原理的研究相对匮乏,有待进一步探究。
4 结语VHCs的生物地球化学循环涉及海洋、大气、沉积物和陆地生态系统等,它们之间存在复杂的迁移转化过程。目前,关于VHCs浓度分布特征的研究基本覆盖大洋、陆架海域、河口以及极地海域。国外研究海域大部分是受人类活动影响相对较小的开阔大洋,而国内的研究区域主要集中在水文条件复杂的陆架海域。VHCs具有复杂的来源和去除途径,仅研究其分布及来源特征是远远不够的。近年来,国外针对VHCs来源开展了大量研究,但VHCs的非生物成因及其生成机制研究较少,已有的研究结果难以对海洋中VHCs的海洋化学行为进行完整的表述,甚至还有许多问题的研究处于空白阶段。此外,国内外针对海洋大气中VHCs的研究相对海水研究比较匮乏,而且同步观测时存在大气取样站位远少于水样站位的问题,导致研究海域VHCs海-气通量的估算存在很大的不确定性及全球VHCs收支预算与实际情况存在一定偏差。结合上述分析,在未来工作中加强海洋VHCs收支过程的深入研究是非常必要的。我们需要加强对海洋中VHCs来源及其产生机制的研究,深入探索影响其生成的因素;开展更多、更大范围内海洋大气及海水中VHCs浓度的时空的大数据调查研究,并完善VHCs的海气通量的计算方法,准确估算并预测全球各海域VHCs释放对大气中VHCs的贡献量;我们还需要进一步研究VHCs的迁移转化机制,揭示其迁移转化过程对全球气候的作用机制,进而准确评估海洋VHCs排放对海洋环境和全球气候变化的影响。这不仅有利于填补开展VHCs研究过程中的理论空白,还能有助于增强对包括VHCs在内的生源活性气体的生物地球化学循环的认识,为深入探索全球气候变化情况提供依据。
| [1] |
Solomon S, Mills M, Heidt L E, et al. On the evaluation of ozone depletion potentials[J]. Journal of Geophysical Research, 1992, 97: 825-842. DOI:10.1029/91JD02613
(  0) 0) |
| [2] |
Read K A, Mahajan A S, Carpenter L J, et al. Extensive halogen-mediated ozone destruction over the tropical Atlantic Ocean[J]. Nature, 2008, 453(7199): 1232. DOI:10.1038/nature07035
(  0) 0) |
| [3] |
Punitha T, Phang S M, Juan J C, et al. Environmental control of vanadium haloperoxidases and halocarbon emissions in macroalgae[J]. Marine Biotechnology, 2018, 20(3): 282-303. DOI:10.1007/s10126-018-9820-x
(  0) 0) |
| [4] |
Molina M J, Rowland F S. Stratospheric sink for chlorofluoromethanes: Chlorineatom-catalysed destruction of ozone[J]. Nature, 1974, 249(5460): 810-812. DOI:10.1038/249810a0
(  0) 0) |
| [5] |
Reifenhauser W, Heumann K G. Bromo- and bromochloromethanes in the Antarctic atmosphere and the South Polar Sea[J]. Chemosphere, 1992b, 24(9): 1293-1300. DOI:10.1016/0045-6535(92)90054-U
(  0) 0) |
| [6] |
World Meteorological Organization (WMO), Scientificassessment of ozone depletion[R]. Global Ozone Research and MonitoringProject-Report No. 56, Switzerland: [s.n.], 2014.
(  0) 0) |
| [7] |
World Meteorological Organization (WMO). Scientific Assessment of Ozone Depletion[R]. Global Ozone Research and Monitoring Project-Report No. 58, Geneva, Switzerland: [s.n.], 2018.
(  0) 0) |
| [8] |
Beane, Chipperfield M P, Montzka S A, et al. Efficiency of short-lived halogens at influencing climate through depletion of stratospheric ozone[J]. Nature Geoscience, 2015, 8(3): 186. DOI:10.1038/ngeo2363
(  0) 0) |
| [9] |
Moore R M. Marine sources of volatile organohalogens[M]. 2003: 85-101.
(  0) 0) |
| [10] |
Jones C E, Hornsby K E, Sommariva R, et al. Quantifying the contribution of marine organic gases to atmospheric iodine[J]. Geophysical Research Letters, 2010, 37(18). DOI:10.1029/2010GL043990
(  0) 0) |
| [11] |
Liu Y, Yvon-Lewis S A, Thornton D C O, et al. Spatial and temporal distributions of bromoform and dibromomethane in the Atlantic Ocean and their relationship with photosynthetic biomass[J]. Journal of Geophysical Research: Oceans, 2013, 118(8): 3950-3965. DOI:10.1002/jgrc.20299
(  0) 0) |
| [12] |
Ashfold M J, Harris N R P, Manning A J, et al. Estimates of tropical bromoform emissions using an inversion method[J]. Atmospheric Chemistry and Physics, 2014, 14(2): 979-994.
(  0) 0) |
| [13] |
Gschwend P M, MacFarlane J K, Newman K A. Volatile halogenated organic compounds released to seawater from temperate marine macroalgae[J]. Science, 1985, 227(4690): 1033-1035. DOI:10.1126/science.227.4690.1033
(  0) 0) |
| [14] |
Moore R M, Groszko W. Methyl iodide distribution in the ocean and fluxes to the atmosphere[J]. Journal of Geophysical Research, 1999, 104(C5): 11163. DOI:10.1029/1998jc900073
(  0) 0) |
| [15] |
Yokouchi Y, Saito T, Zeng J, et al. Seasonal variation of bromocarbons at Hateruma Island, Japan: Implications for global sources[J]. Journal of Atmospheric Chemistry, 2017, 74(2): 171-185. DOI:10.1007/s10874-016-9333-9
(  0) 0) |
| [16] |
Wever R, van der Horst M A. The role of vanadium haloperoxidases in the formation of volatile brominated compounds and their impact on the environment[J]. Dalton Transactions, 2013, 42(33): 11778-11786. DOI:10.1039/c3dt50525a
(  0) 0) |
| [17] |
Yang Q, Guo Y, Yue E, et al. Methyl chloride produced during UV254 irradiation of saline water[J]. Journal of Hazardous Materials, 2020, 384. DOI:10.1016/j.jhazmat.2019.121263
(  0) 0) |
| [18] |
He Z, Liu S, Ni J, et al. Spatio-temporal variability and sources of volatile halocarbons in the South Yellow Sea and the East China Sea[J]. Marine Pollution Bulletin, 2019, 149. DOI:10.1016/j.marpolbul.2019.110583
(  0) 0) |
| [19] |
Yuan D, Yang G, He Z. Spatio-temporal distributions of chlorofluorocarbons and methyliodide in the Changjiang (Yangtze River) estuary and its adjacent marine area[J]. Marine Pollution Bulletin, 2016, 103(1-2): 247-259. DOI:10.1016/j.marpolbul.2015.12.012
(  0) 0) |
| [20] |
Wei Y, He Z, Yang G P. Seasonal and spatial variations of chloroform, trichloroethylene, tetrachloroethylene, chlorodibromomethane and bromoform in the Northern Yellow Sea and Bohai Sea[J]. Environmental Chemistry, 2019, 16(2): 114-124. DOI:10.1071/EN18222
(  0) 0) |
| [21] |
He Z, Liu Q L, Zhang Y J, et al. Distribution and sea-to-air fluxes of volatile halocarbons in the Bohai Sea and North Yellow Sea during spring[J]. Science of the Total Environment, 2017, 584: 546-553.
(  0) 0) |
| [22] |
刘珊珊, 杨桂朋, 高旭旭, 等. 西太平洋添加营养盐培养实验中挥发性卤代烃含量动态变化[J]. 中国环境科学, 2019, 39(10): 4313-4320. Liu S S, Yang G P, Gao X X, et al. Variation of volatile halocarbon concentrations in the incubation experiments with the addition of nutrients in the western Pacific Ocean[J]. China Environmental Science, 2019, 39(10): 4313-4320. DOI:10.3969/j.issn.1000-6923.2019.10.034 (  0) 0) |
| [23] |
Lim Y K, Phang S M, Abdul Rahman N, et al. Halocarbon emissions from marine phytoplankton and climate change[J]. International Journal of Environmental Science and Technology, 2017, 14(6): 1355-1370. DOI:10.1007/s13762-016-1219-5
(  0) 0) |
| [24] |
Montzka S A, Dutton G S, Yu P, et al. An unexpected and persistent increase in global emissions of ozone-depleting CFC-11[J]. Nature, 2018, 557(7705): 413-417. DOI:10.1038/s41586-018-0106-2
(  0) 0) |
| [25] |
Sarah, Javed, Bushra, et al. Current sources of carbon tetrachloride (CCl4) in our atmosphere[C].[s.l.]: UKSim-AMSS 20th International Conference on Modelling and Simulation, 2018.
(  0) 0) |
| [26] |
Fraser P J, Dunse B L, ManningA J, et al. Australian carbon tetrachloride emissions in a global context[J]. Environmental Chemistry, 2014, 11(1): 77-88. DOI:10.1071/EN13171
(  0) 0) |
| [27] |
World Meteorological Organization (WMO), Scientific assessment of ozone depletion[R]. Global Ozone Research and Monitoring Project-Report No. 51, Switzerland: [s.n.], 2011.
(  0) 0) |
| [28] |
Hossaini R, Chipperfield M P, Alfonso Saiz-Lopez, et al. A global model of tropospheric chlorine chemistry: Organic versus inorganic sources and impact on methane oxidation[J]. Journal of Geophysical Research: Atmospheres, 2016, 121. DOI:10.1002/2016JD025756
(  0) 0) |
| [29] |
Kim J, Yong C, Shin D, et al. Chlorination by-products in surface Water treatment process[J]. Desalination, 2003, 151(1): 1-9. DOI:10.1016/S0011-9164(02)00967-0
(  0) 0) |
| [30] |
Singer P C. Humic substances as precursors for potentially harmful disinfection by-products[J]. Water Science and Technology, 1999, 40(9): 25-30. DOI:10.2166/wst.1999.0434
(  0) 0) |
| [31] |
Beane Freeman L E, Cantor K P, Baris D, et al. Bladder cancer and water disinfection by-product exposures through multiple routes: A population-based case-control study (New England, USA)[J]. Environmental Health Perspectives, 2017, 125(6). DOI:10.1289/EHP89
(  0) 0) |
| [32] |
Ziska F, Quack B, Abrahamsson K, et al. Global sea-to-air flux climatology for bromoform, dimethyl bromide and methyl iodide[J]. Atmospheric Chemistry and Physics, 2013, 13(17): 8915-8934. DOI:10.5194/acp-13-8915-2013
(  0) 0) |
| [33] |
Quack B, Wallace D W R. Air-sea flux of bromoform: Controls, rates, and implications[J]. Global Biogeochemical Cycles, 2003, 17(1): 1023. DOI:10.1029/2002GB001890
(  0) 0) |
| [34] |
Lovelock J E, Maggs R G, Wade R J. Halogenated hydrocarbons in and over the Atlantic[J]. Nature, 1973, 241: 194-196. DOI:10.1038/241194a0
(  0) 0) |
| [35] |
Baker J M, Sturges W T, Sugier J, et al. Emissions of CH3Br, organochlorines, and organoiodines from temperate macroalgae[J]. Chemosphere-Global Change Science, 2002, 3(1): 93-106.
(  0) 0) |
| [36] |
Mtolera M S P, Collen J, Pedersén M, et al. Stress-induced production of volatile halogenated organic compounds in Eucheuma denticulatum (Rhodophyta) caused by elevated pH and high light intensities[J]. British Phycological Bulletin, 1996, 31: 89-95. DOI:10.1080/09670269600651241
(  0) 0) |
| [37] |
何真.中国陆架海挥发性卤代烃的分布、来源与海-气通量研究[D].青岛: 中国海洋大学, 2013. He Z. Studies on Distribution, Sources and Sea-to-Air Flux of Volatile Halocarbons in the China Shelf Seas[D]. Qingdao: Ocean University of China, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10423-1013348302.htm (  0) 0) |
| [38] |
Nightingale P D, Malin G, Liss P S. Production of chloroform and other low-molecular-weight halocarbons by some species of macroalgae[J]. Limnology and Oceanography, 1995, 40(4): 680-689. DOI:10.4319/lo.1995.40.4.0680
(  0) 0) |
| [39] |
Sato N, Hamamoto K, Kurihara M, et al. Methyl halide production by cultures of marine thraustochytrids, Aurantiochytrium sp[J]. Marine Chemistry, 2019, 208: 95-102. DOI:10.1016/j.marchem.2018.11.009
(  0) 0) |
| [40] |
Lim Y K, Phang S M, Sturges W T, et al. Emission of short-lived halocarbons by three common tropical marine microalgae during batch culture[J]. Journal of applied phycology, 2018, 30(1): 341-353. DOI:10.1007/s10811-017-1250-z
(  0) 0) |
| [41] |
Leedham E C, Hughes C, Keng F S L, et al. Emission of atmospherically significant halocarbons by naturally occurring and farmed tropical macroalgae[J]. Biogeosciences, 2013, 10(6): 3615-3633. DOI:10.5194/bg-10-3615-2013
(  0) 0) |
| [42] |
杜慧娜, 谢文霞, 崔育倩, 等. 海洋中溴甲烷的研究进展[J]. 应用生态学报, 2014, 25(12): 3694-3700. Du H N, Xie W X, Cui Y Q, et al. Research advances in methyl bromide in the ocean[J]. Chinese Journal of Applied Ecology, 2014, 25(12): 3694-3700. (  0) 0) |
| [43] |
Gribble G W. The natural production of chlorinated compounds[J]. Applied Catalysis B Environmental, 1994, 5(7): 310A. DOI:10.1021/es00056a712
(  0) 0) |
| [44] |
Wuosmaa A M, Hager L P. Methyl chloride transferase: A carbocation route for biosynthesis of halometabolites[J]. Science, 1990, 249(4965): 160-162. DOI:10.1126/science.2371563
(  0) 0) |
| [45] |
Abraharasson K, Choo K M, Johansson G, et al. Effects of temperature on the production of hydrogen peroxide and volatile halocarbons by brackish-Water algae[J]. Phytochemistry, 2003, 64(3): 725-734. DOI:10.1016/S0031-9422(03)00419-9
(  0) 0) |
| [46] |
Atashgahi S, Liebensteiner M G, Janssen D B, et al. Microbial synthesis and transformation of inorganic and organic chlorine compounds[J]. Frontiers in Mcrobiology, 2018, 9. DOI:10.3389/fmicb.2018.03079
(  0) 0) |
| [47] |
向武, 邓南圣. 海水中挥发性卤代烃产生机制研究进展[J]. 海洋科学, 2001, 25(9): 21-23. Xiang W, Deng N S. Advances in research of natural formation of volatile halohydrocarbon in seawater[J]. Marine Sciences, 2001, 25(9): 21-23. DOI:10.3969/j.issn.1000-3096.2001.09.008 (  0) 0) |
| [48] |
Méndez-Díaz J D, Shimabuku K K, Ma J, et al. Sunlight-driven photochemical halogenation of dissolved organic matter in seawater: A natural abiotic source of organobromine and organoiodine[J]. Environmental Science and Technology, 2014, 48(13): 7418-7427. DOI:10.1021/es5016668
(  0) 0) |
| [49] |
Moore R M, Zafiriou O C. Photochemical production of methyl iodide in seawater[J]. Journal of Geophysical Research, 1994, 99(D8): 16415. DOI:10.1029/94jd00786
(  0) 0) |
| [50] |
Moore R M. A photochemical source of methyl chloride in saline waters[J]. Environmental Science and Technology, 2008, 42(6): 1933-1937. DOI:10.1021/es071920l
(  0) 0) |
| [51] |
Riemer D D, Milne P J, Zika R G, et al. Photoproduction of nonmethane hydrocarbons (NMHCs) in seawater[J]. Marine Chemistry, 2000, 71(3): 177-198.
(  0) 0) |
| [52] |
Brigante M, Minella M, Mailhot G, et al. Formation and reactivity of the dichloride radical (Cl2-) in surface waters: A modelling approach[J]. Chemosphere, 2014, 95: 464-469. DOI:10.1016/j.chemosphere.2013.09.098
(  0) 0) |
| [53] |
毕雪薇.海水中挥发性卤代烃的光化学生成[D].大连: 大连海事大学, 2017. Bi X W. Photochemical Generation of Volatile Halogenated Hydrocarbons in Seawater[D]. Dalian: Dalian Maritime University, 2017. (  0) 0) |
| [54] |
Martino M, Mills G P, Woeltjen J, et al. A new source of volatile organoiodine compounds in surface seawater[J]. Geophysical Research Letters, 2009, 36(1): 329-342.
(  0) 0) |
| [55] |
Grebel J E, Pignatello J J, Mitch W A. Effect of halide ions and carbonates on organic contaminant degradation by hydroxyl radical-based advanced oxidation processes in saline waters[J]. Environmental Science and Technology, 2010, 44(17): 6822-6828. DOI:10.1021/es1010225
(  0) 0) |
| [56] |
陆小兰, 杨桂朋, 宋贵生, 等. 碘甲烷的海洋化学研究进展[J]. 海洋通报, 2008, 27(2): 103-110. Lu X L, Yang G P, Song G S, et al. Advances in the studies on the marine chemistry of methyl iodine[J]. Marine Science Bulletin, 2008, 27(2): 103-110. DOI:10.3969/j.issn.1001-6392.2008.02.016 (  0) 0) |
| [57] |
Tamtam F, Chiron S. New insight into photo-bromination processes in saline surface waters: The case of salicylic acid[J]. Science of the Total Environment, 2012, 435(none): 345-350.
(  0) 0) |
| [58] |
Bondu S, Cocquempot B, Deslandes E, et al. Effects of salt and light stress on the release of volatile halogenated organic compounds by Solieria chordalis: A laboratory incubation study[J]. Botanica Marina, 2008, 51(6): 485-492.
(  0) 0) |
| [59] |
Orlikowska A, Stolle C, Pollehne F, et al. Dynamics of halocarbons in coastal surface waters during short term mesocosm experiments[J]. Environmental Chemistry, 2015, 12(4): 515-525. DOI:10.1071/EN14204
(  0) 0) |
| [60] |
Abe M, Nagai T, Kurihara M, et al. Effect of temperature on the methyl chloride production rate in a marine phytoplankton, Phaeodactylum tricornutum[J]. Journal of Atmospheric Chemistry, 2017, 74(2): 157-169. DOI:10.1007/s10874-016-9332-x
(  0) 0) |
| [61] |
Smythe-Wright D, Peckett C, Boswell S, et al. Controls on the production of organohalogens by phytoplankton: Effect of nitrate concentration and grazing[J]. Journal of Geophysical Research Biogeosciences, 2010, 115: G03020. DOI:10.1029/2009JG001036
(  0) 0) |
| [62] |
徐志法, 赵卫佳, 张睿, 等. 太湖部分地区碘代三卤甲烷分布特征及其与藻类有机物的关系初探[J]. 环境化学, 2017, 36(12): 2541-2549. Xu Z F, Zhao W J, Zhang R, et al. Distribution of iodinated trihalomethanes in part of Taihu Lake and correlation analysis between iodinated trihalomethanes and algal organic matter[J]. Environmental Chemistry, 2017, 36(12): 2541-2549. DOI:10.7524/j.issn.0254-6108.2017012007 (  0) 0) |
| [63] |
Dallin E, Wan P, Krogh E, et al. New pH-dependent photosubstitution pathways of syringic acid in aqueous solution: Relevance in environmental photochemistry[J]. Journal of Photochemistry and Photobiology A: Chemistry, 2009, 207(2-3): 297-305. DOI:10.1016/j.jphotochem.2009.07.023
(  0) 0) |
| [64] |
Wingenter O W, Haase K B, Zeigler M, et al. Unexpected consequences of increasing CO2 and ocean acidity on marine production of DMS and CH2ClI: Potential climate impacts[J]. Geophysical Research Letters, 2007, 34(L05710). DOI:10.1029/2006GL028139
(  0) 0) |
| [65] |
Hopkins F E, Turner S M, Nightingale P D, et al. Ocean acidification and marine trace gas emissions[J]. Proceedings of the National Academy of Sciences, 2010, 107(2): 760-765. DOI:10.1073/pnas.0907163107
(  0) 0) |
| [66] |
Hopkins F E, Kimmance S A, Stephens J A, et al. Response of halocarbons to ocean acidification in the Arctic[J]. Biogeosciences (BG), 2013, 10(4): 2331-2345. DOI:10.5194/bg-10-2331-2013
(  0) 0) |
| [67] |
Manley S L, Barbero P E. Physiological constraints on bromoform (CHBr3) production by Ulva lactuca (Chlorophyta)[J]. Limnology and Oceanography, 2001, 46(6): 1392-1399. DOI:10.4319/lo.2001.46.6.1392
(  0) 0) |
| [68] |
Ge L, Chen J, Qiao X, et al. Light-source-dependent effects of main water constituents on photodegradation of phenicol antibiotics: Mechanism and kinetics[J]. Environmental Sscience & Technology, 2009, 43(9): 3101-3107.
(  0) 0) |
| [69] |
He H, Chen F, Li H, et al. Effect of iron on growth, biochemical composition and paralytic shellfish poisoning toxins production of Alexandrium tamarense[J]. Harmful Algae, 2010, 9(1): 98-104. DOI:10.1016/j.hal.2009.08.006
(  0) 0) |
| [70] |
Khalil M A K, Moore R M, Harper D B, et al. Natural emissions of chlorine-containing gases: Reactive chlorine emissions inventory[J]. Journal of Geophysical Research, 1999, 104(D7): 8333. DOI:10.1029/1998jd100079
(  0) 0) |
| [71] |
Kolusu S R, Schlünzen K H, Grawe D, et al. Chloromethane and dichloromethane in the tropical Atlantic Ocean[J]. Atmospheric Environment, 2017, 150: 417-424. DOI:10.1016/j.atmosenv.2016.11.037
(  0) 0) |
| [72] |
Singh H B, Salas L J, Stiles R E. Methyl halides in and over the eastern Pacific (40 N-32 S)[J]. Journal of Geophysical Research: Oceans, 1983, 88(C6): 3684-3690. DOI:10.1029/JC088iC06p03684
(  0) 0) |
| [73] |
Yang G P, Li L, Lu X L, et al. Distributions and sea-to-air fluxes of volatile halocarbons in the southern yellow sea and the East China Sea[J]. Acta Oceanologica Sinica, 2015b, 34(2): 9-20. DOI:10.1007/s13131-015-0622-y
(  0) 0) |
| [74] |
Karlsson A, Auer N, Schulz-Bull D, et al. Cyanobacterial blooms in the Baltic—A source of halocarbons[J]. Marine Chemistry, 2008, 110(3-4): 129-139. DOI:10.1016/j.marchem.2008.04.010
(  0) 0) |
| [75] |
Schall C, Heumann K G. GC determination of volatile organoiodine and organobromine compounds in Arctic seawater and air samples[J]. Fresenius Journal of Analytical Chemistry, 1993, 346(6): 717-722.
(  0) 0) |
| [76] |
King D B, Butler J H, Montzka S A, et al. Implications of methyl bromide supersaturations in the temperate North Atlantic Ocean[J]. Journal of Geophysical Research, 2000, 105(D15): 19763. DOI:10.1029/2000jd900251
(  0) 0) |
| [77] |
Groszko W, Moore R M. Ocean-atmosphere exchange of methyl bromide: NW Atlantic and Pacific Ocean studies[J]. Journal of Geophysical Research, 1998, 103(D13): 16737. DOI:10.1029/98jd00111
(  0) 0) |
| [78] |
Shimizu Y, Ooki A, Onishi H, et al. Seasonal variation of volatile organic iodine compounds in the water column of Funka Bay, Hokkaido, Japan[J]. Journal of Atmospheric Chemistry, 2017, 74(2): 205-225. DOI:10.1007/s10874-016-9352-6
(  0) 0) |
| [79] |
Lu X L, Yang G P, Song G S, et al. Distributions and fluxes of methyl chloride and methyl bromide in the East China Sea and the Southern Yellow Sea in autumn[J]. Marine Chemistry, 2010, 118(1-2): 75-84. DOI:10.1016/j.marchem.2009.11.002
(  0) 0) |
| [80] |
Moore R M. Trichloroethylene and tetrachloroethylene in Atlantic waters[J]. Journal of Geophysical Research, 2001, 106(C11): 27135. DOI:10.1029/2000jc000374
(  0) 0) |
| [81] |
魏英.东海挥发性卤代烃的来源与时空分布特征研究[D].青岛: 中国海洋大学, 2019. Wei Y. Studies on the Sources and Spatiotemporal Distribution Characteristics of Volatile Halocarbons in the East China Sea[D]. Qingdao: Ocean University of China, 2019. (  0) 0) |
| [82] |
Liss P S, Slater P G. Flux of gases across the air-sea interface[J]. Nature, 1974, 247: 181-184. DOI:10.1038/247181a0
(  0) 0) |
| [83] |
Moore R M. The solubility of a suite of low molecular weight organochlorine compounds in seawater and implications for estimating the marine source of methyl chloride to the atmosphere[J]. Chemosphere-Global Change Science, 2000, 2(1): 95-99. DOI:10.1016/S1465-9972(99)00045-8
(  0) 0) |
| [84] |
Liss P S, Merlivat L. Air-sea gas exchange rates: Introduction and synthesis[J]. The Role of Air-Sea Exchange in Geochemical Cycling, 1986, 185: 113-127.
(  0) 0) |
| [85] |
Wanninkh of R. Relationship between wind speed and gas exchange over the ocean[J]. Journal of Geophysical Research, 1992, 97(C5): 7373. DOI:10.1029/92JC00188
(  0) 0) |
| [86] |
Erickson D J. A stability dependent theory for air-sea gas exchange[J]. Journal of Geophysical Research, 1993, 98(C5): 8471. DOI:10.1029/93jc00039
(  0) 0) |
| [87] |
Roy R. Short-term variability in halocarbons in relation to phytoplankton pigments in coastalwaters of the central eastern Arabian Sea[J]. Estuarine, Coastal and Shelf Science, 2010, 88(3): 311-321. DOI:10.1016/j.ecss.2010.04.011
(  0) 0) |
| [88] |
Hopkins F E, Kimmance S A, Stephens J A, et al. Response of halocarbons to oceanacidification in the Arctic[J]. Biogeosciences, 2013, 10(4): 2331-2345. DOI:10.5194/bg-10-2331-2013
(  0) 0) |
| [89] |
Zafirou O C. Reaction of methyl halides with seawater and marine aerosols[J]. Journal of Marine Research, 1975, 33(1): 75-81.
(  0) 0) |
| [90] |
Liu Y N, Yvon-Lewis S A, Hu L, et al. CHBr3, CH2Br2, and CHClBr2 in U.S. coastal watersduring the Gulf of Mexico and East Coast Carbon cruise[J]. Journal of Geophysical Research, 2011, 116(C10): 1-10.
(  0) 0) |
| [91] |
Shi Q, Marandino C, Petrick G, et al. A time series of incubation experiments to examine theproduction and loss of CH3I in surface seawater[J]. Journal of Geophysical Research: Oceans, 2014, 119(12): 8242-8254. DOI:10.1002/2014JC010223
(  0) 0) |
2. The Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266100, China;
3. Institute of Marine Chemistry, Ocean University of China, Qingdao 266100, China
 2020, Vol. 50
2020, Vol. 50