2. 青岛海洋科学与技术国家实验室,山东 青岛 266235;
3. 广州金水动物保健品有限公司,广东 广州 510510
凡纳滨对虾(Litopenaeus vannamei)俗称南美白对虾,因其具有环境适应性强、生长速度快、抗病能力强等优势,成为我国养殖范围最广、产量最高的对虾种类[1]。凡纳滨对虾于1988年引进我国后,其养殖便迅速遍及全国[2]。然而,随着对虾集约化养殖的迅速发展,养殖水环境恶化、病害频发等诸多问题日益严峻,严重影响了对虾养殖业的可持续发展。
目前,国际上将微生态制剂分成3个类型:益生菌(Probitics)、益生元(Prebiotics)和合生素(Synbiotics)[3]。益生菌是指一类对宿主有益的活性微生物,能在一定范围内增进动物健康的活体微生物制剂,其作为抗生素的替代品,近几年已得到迅速发展[4-5]。研究表明,益生菌不仅能够降低养殖水体的氨氮、亚硝酸氮含量,改善水质[6-7];还可以通过与有害微生物竞争营养物质及生存繁殖空间等机制,抑制有害微生物的生长繁殖,从而维持机体肠道微生态平衡[5]。与此同时,益生菌还可有效提高养殖生物体有关免疫酶活性,促进养殖生物体对饲料中蛋白营养物质的消化吸收,增强抗病性,提高成活率及增长率。目前益生菌在水产养殖中备受广大学者和养殖户所青睐,被视为抗生素的有力替代品之一[8-9]。而一般认为,微生态制剂与酶制剂间具有一定的协同作用[10-11]。饲用酶制剂具有高效、安全、环保等特点,在饲料工业中受到越来越多的重视。复合酶一般由一种或几种单一酶制剂为主体,加上其他单一酶制剂混合而成,或者由一种或几种微生物发酵获得[12]。复合酶制剂能够弥补胃肠道内源酶不足,促进养殖生物体对饲料中营养物质的消化吸收,解除饲料中多种抗营养因子,进而提高饲料的利用率[13-15]。同时,还能够改善胃肠机能,有效抑制肠道中病原菌的繁殖,并且能够提高机体免疫力[16-17]。
微生态制剂已在凡纳滨对虾养殖中得到广泛应用。然而,由于益生菌和酶制剂无法耐受对虾配合饲料制粒过程中的高温,导致在常规对虾制粒工艺中通常难以进行添加。而在实际使用中,手工或通过拌料机现场拌料的方式不仅操作麻烦,使用中也存在溶失严重的缺点。本研究比较了几种不同复合微生态制剂添加形式对凡纳滨对虾的生长、血清非特异性免疫酶活性及抗病力的影响,以期为微生态制剂科学复配及其在凡纳滨对虾养殖中合理应用提供一定的理论依据。
1 材料与方法 1.1 微生态制剂添加方式设计本研究分别设计了4个不同处理和1个对照,具体如下:
A为对照组,即基础饲料组。仅投喂对虾配合饲料(粗蛋白含量42%),不添加任何微生态制剂。饲料为由某厂家提供的凡纳滨对虾全价配合饲料,粗蛋白含量42%,生产工艺为挤压成型,后熟化调质。主要成分见表 1。
|
|
表 1 基础饲料和添加固体发酵制剂的饲料主要成分 Table 1 Composition of the basic and micro-ecological feed |
B为拌服复合菌制剂组,即将液体复合菌制剂均匀拌到基础饲料中,于干燥通风处自然阴干后储存于4℃环境下备用。其中,复合菌由芽孢杆菌(Bacillus spp.)、嗜酸乳杆菌(Lactobacillus acidophilus)、酪酸菌(Clostridium butyricum)等组成,均为活菌。
C为后喷涂复合菌制剂组,即饲料制粒挤出经干燥后,在 < 90℃温度下,由后喷涂工艺将复合菌制剂均匀喷涂到基础饲料中制成,干燥后水分含量 < 12%。复合菌组成和比例同上。其中,芽孢杆菌和酪酸菌为芽孢形式,嗜酸乳杆菌经过包埋工艺处理。
D为复合菌酶颗粒制剂组,由复合菌与复合酶复配后经低温制粒而成(制粒时温度 < 45℃,干燥后水分含量 < 12%),与配合饲料粒径、形态上均保持一致。其中,复合菌组成及比例同上。芽孢杆菌和酪酸菌为芽孢,嗜酸乳杆菌经过包埋工艺处理;复合酶由消化酶和非淀粉多糖酶等组成,包括蛋白酶、淀粉酶、甘露聚糖酶和木聚糖酶等。使用时菌酶颗粒制剂添加比例为配合饲料的5%,简单掺加即可。
E为固体发酵制剂组,即在凡纳滨对虾配合饲料配方组分中添加乳酸菌、酵母和芽孢杆菌等复合菌固体发酵培养物,之后挤压成型(< 90℃),但未经后熟化调质,为全价饲料。主要成分详见表 1。
B、C和D组最终投喂饲料中复合菌浓度为109cfu/g。
1.2 实验用虾及日常养殖管理本研究于青岛瑞滋海珍品有限公司阳光棚进行。实验所用凡纳滨对虾购于青岛市宝荣水产科技发展有限公司对虾养殖场,养殖用水盐度17。实验对虾购买后暂养于400 L白色塑料桶中,进行驯化暂养,暂养时间为10天。暂养期间保持合适充氧,定时测定水温、溶氧,定时投喂适量基础饲料。同时,每天将养殖桶中用水的盐度提升2,逐渐驯化直到盐度升至青岛瑞滋海珍品有限公司养殖用水的自然盐度31。驯化暂养结束后稳定3天,进行正式实验。
驯化暂养结束后,将实验用虾饥饿一天。之后选取规格一致、无病无伤、健康活泼的凡纳滨对虾(2.66±0.02)g随机放入15个相同规格的塑料桶(容积400 L)中,进行相关养殖实验,每个水桶分别养殖80尾凡纳滨对虾虾苗,每个处理分别设置了3个重复。整个养殖实验一共持续54天。
每天上午8:30及下午5:00定时投喂,将饲料投喂到直径为50 cm饵料盘中,日投喂量为对虾体重的3%~5%(根据对虾的摄食情况调节投喂量)。每次投喂前吸出并收集养殖桶和饵料盘中的残饵和粪便,并换水1/3~2/3。每天检查并记录对虾的摄食和死亡情况。
实验期间,水温平均在23 ℃左右,溶氧5mg/L以上,盐度31,pH=8.0±0.1。
1.3 样品的采集与处理实验结束后,将对虾饥饿处理24 h,然后对每个养殖桶中的对虾进行收获、计数、称重。
同时,每个养殖桶中随机抽取15尾对虾进行血清采集。首先,用1 mL无菌注射器从凡纳滨对虾腹部血窦中缓慢抽取血淋巴置于1.5 mL无菌离心管中。然后,于4 ℃环境下静置过夜后,3000 r/min离心机中离心15 min。离心完毕,使用灭菌移液器将上层血清转移至新的无菌离心管中,置于-80 ℃冰箱中保存待测。
1.4 指标测定 1.4.1 生长指标实验开始前称重并记录每个养殖桶中对虾的初始重量。养殖实验结束后,清点、记录对虾的末数量,并称重、记录每个养殖桶中对虾的末重量。在养殖过程中记录各处理组每天的投饵量、收集记录残饵量、记录死虾的数量和重量。部分生长相关指标计算如下:
成活率=(实验结束时虾的末数量/实验开始前虾的初数量)×100%;
特定生长率(SGR)= [(ln W末-ln W初) / t]×100%;
饵料系数=M/(W初+WS-W末)。
式中:W初、W末、WS分别为对虾平均初体重、对虾平均末体重、养殖过程中死亡的对虾的质量;t为养殖时间;M为养殖过程中投饵量。
1.4.2 血清中非特异性免疫指标对各处理对虾血清中超氧化物歧化酶(Superoxide dismutse, SOD)、碱性磷酸酶(Alkaline phosphatase, AKP)、酸性磷酸酶(Acid phosphatase, ACP)、溶菌酶(Lysozyme, LSZ)、总一氧化氮合酶(Total Nitric Oxide Synthase, TNOS)和诱导型一氧化氮合酶(Inducible Nitric Oxide Synthase, iNOS)活性进行相关测定。以南京建成生物工程研究所生产的相关试剂盒进行具体测定,参照试剂盒说明书进行操作。
1.4.3 攻毒实验养殖实验结束后,保持养殖条件不变,将取样后剩余的对虾正常饲喂3天后进行副溶血弧菌(Vibrio parahaemolyticus)攻毒实验。其中,每个处理分别设置3个重复,每个重复15尾虾。所用副溶血弧菌由中国水产科学院黄海水产研究所提供。副溶血弧菌经活化后接种于胰蛋白胨大豆肉汤培养基(TSB),在28℃条件下振荡培养18~24 h。之后,显微镜下血球计数板计算有效活菌数。最后,将一定量培养菌液离心5min,用灭菌海水重悬后泼洒到各处理组养殖桶中。攻毒过程中保证各处理组养殖桶中副溶血弧菌的终浓度为1×108 cfu/mL。
攻毒实验持续2周,攻毒期间养殖条件不变。每天观察记录对虾的活力、摄食及死亡情况。
1.5 数据统计分析实验数据采用SPSS Statistics 22软件进行单因素方差分析(One-way ANOVA)和Duncan's多重比较进行差异显著性检验,以P < 0.05为差异显著水平,统计结果用平均值±标准误(Mean ± S.E.)表示。
2 结果 2.1 生长指标不同处理对虾的生长情况见表 2。可以看出,各处理组对虾成活率在实验期间差异不大(P>0.05)。与对照相比,除拌服复合菌制剂组外,其余3个处理组均能够显著提高对虾的增重率和特定生长率(P < 0.05)。其中,固体发酵制剂组对虾的增重率及特定生长率均最高。后喷涂复合菌制剂组、复合菌酶颗粒制剂组和固体发酵制剂组饵料系数均显著低于对照组(P < 0.05),但拌服复合菌制剂组饵料系数与对照组差异不显著(P>0.05)。
|
|
表 2 不同复合微生态制剂对凡纳滨对虾生长的影响 Table 2 Growth performance of L. vannamei fed with different omnibiotics |
由图 1看出,复合菌酶制剂和固体发酵制剂组对虾血清的超氧化物歧化酶(SOD)活性均显著高于对照组(P < 0.05),但拌服与后喷涂复合微生态制剂处理组与对照组差异均不显著(P>0.05)。不同处理组相比较,以生态饲料组对虾SOD活性最高。
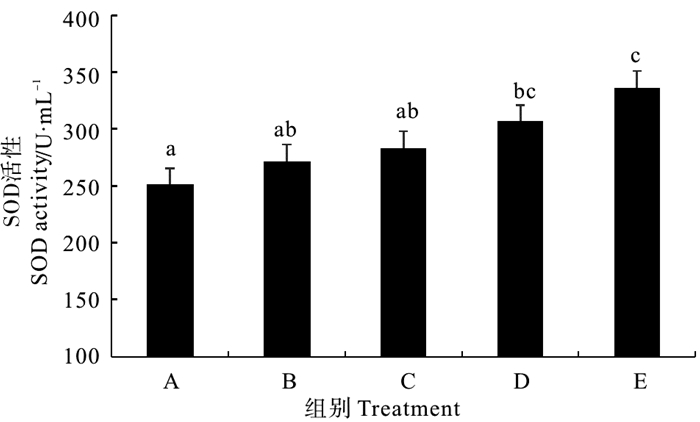
|
(A为对照组,B为拌服复合菌制剂组,C为后喷涂复合菌制剂组,D为复合菌酶制剂组,E为固体发酵制剂组。图中不同字母间表示显著差异(P < 0.05)。下同。A is the control group, B is hand-mixed composite probiotics group, C is spray coating techniques group, D is compound probiotics and enzyme preparation group, E is micro-ecological feed group. Data with different letters at the same column mean significant difference each other (P < 0.05). The same as below.) 图 1 不同复合微生态制剂对凡纳滨对虾血清超氧化物歧化酶(SOD)活性的影响 Fig. 1 Effects of different omnibiotics on the activity of superoxide dismutase (SOD) in the serum of L.vannamei |
由图 2可以看出,复合菌酶制剂和固体发酵制剂组对虾血清碱性磷酸酶(AKP)活性显著高于对照组(P < 0.05),但拌服与后喷涂复合微生态制剂处理组与对照组差异均不显著(P>0.05)。不同处理组相比较,复合菌酶制剂和固体发酵制剂组对虾血清AKP活性差异不大(P>0.05),但均显著高于其他处理组(P < 0.05)。
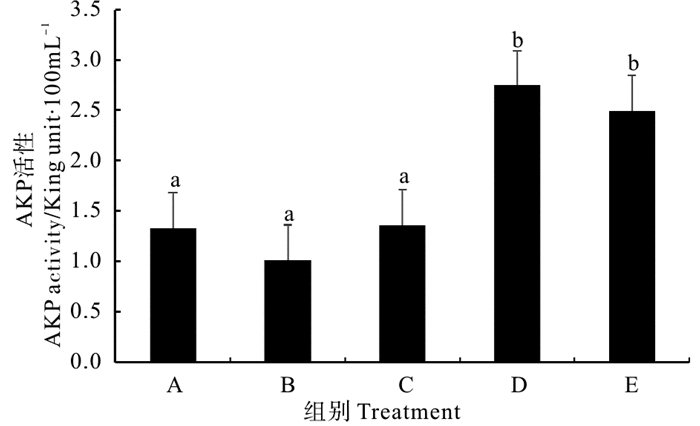
|
图 2 不同复合微生态制剂对凡纳滨对虾血清碱性磷酸酶(AKP)活性的影响 Fig. 2 Effects of different omnibiotics on the activity of alkaline phosphatase(AKP)in the serum of L.vannamei |
由图 3可以看出,固体发酵制剂组和复合菌酶制剂组对虾血清酸性磷酸酶(ACP)活性显著高于对照组(P < 0.05),但拌服与后喷涂复合微生态制剂处理组与对照组差异均不显著(P>0.05)。不同处理组相比较,复合菌酶制剂和固体发酵制剂组对虾血清ACP活性差异不大(P>0.05),但显著高于后喷涂复合微生态制剂处理组(P < 0.05)。
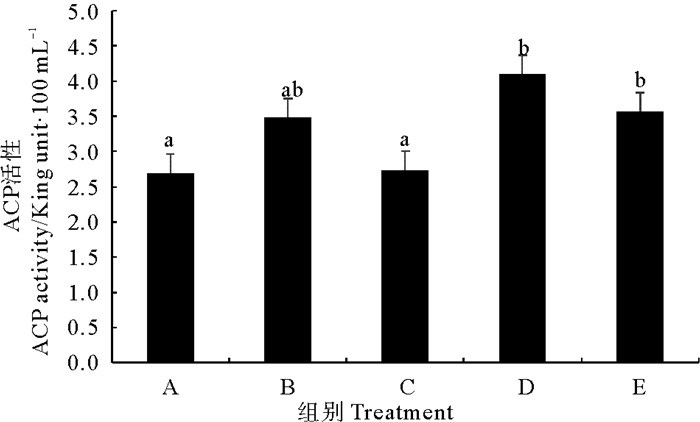
|
图 3 不同复合微生态制剂对凡纳滨对虾血清酸性磷酸酶(ACP)活性的影响 Fig. 3 Effects of different omnibiotics on the activity of acid phosphatase (ACP) in the serum of L.vannamei |
由图 4可以看出,各处理组对虾血清溶菌酶(LSZ)活性均显著高于对照组(P < 0.05)。不同处理组之间相比较,以固体发酵制剂组对虾LSZ活性最高,但其他处理组之间差异不显著(P>0.05)。
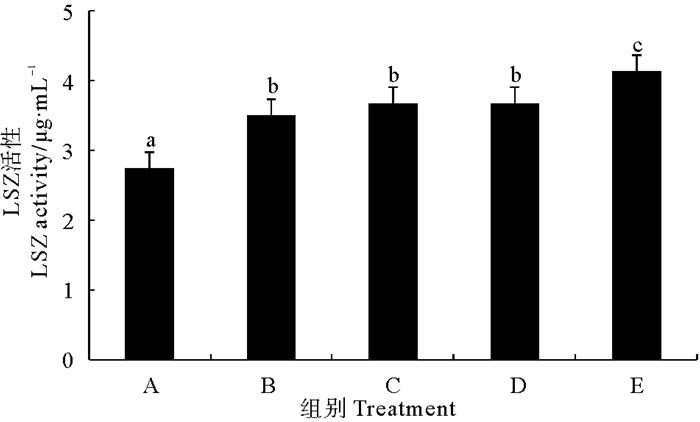
|
图 4 不同复合微生态制剂对凡纳滨对虾血清溶菌酶(LSZ)的影响 Fig. 4 Effects of different omnibiotics on the activity of lysozyme (LSZ) in the serum of L.vannamei |
由图 5可以看出,后喷涂微生态制剂组与固体发酵制剂组对虾血清总一氧化氮合酶(TNOS)活性显著高于对照组(P < 0.05),但其他2个处理组与对照差异不大(P>0.05)。不同处理组相比较,以拌服复合菌制剂组对虾TNOS活性最低,显著低于其他处理组(P < 0.05)。
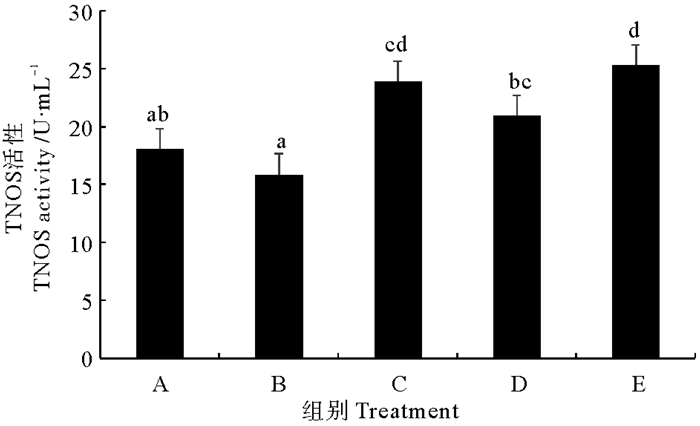
|
图 5 不同复合微生态制剂对凡纳滨对虾血清总一氧化氮合酶(TNOS)的影响 Fig. 5 Effects of different omnibiotics on the activity of total nitric oxide synthase (TNOS) in the serum of L.vannamei |
由图 6可以看出,除拌服复合菌制剂组以外,其他各处理组对虾血清诱导型一氧化氮合酶(iNOS)活性均显著高于对照组(P < 0.05)。不同处理组之间相比较,以固体发酵制剂组对虾血清iNOS活性最高,而后喷涂复合菌制剂组和复合菌酶制剂组之间差异不大(P>0.05),但均显著高于拌服复合菌制剂组(P < 0.05)。
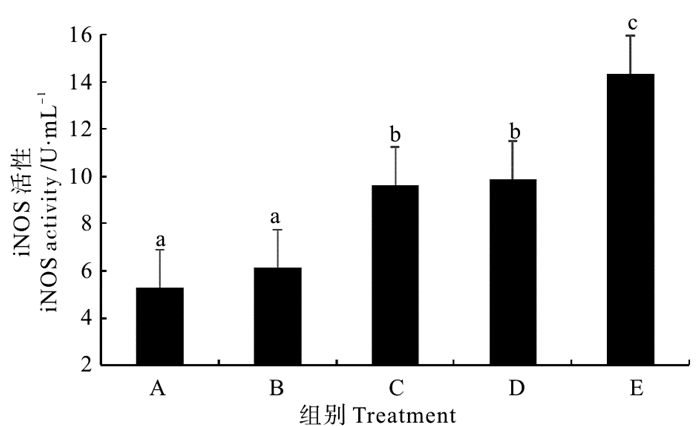
|
图 6 不同复合微生态制剂对凡纳滨对虾血清诱导型一氧化氮合酶(iNOS)活性的影响 Fig. 6 Effects of different omnibiotics on the activity of inducible nitric oxide synthase (iNOS) in the serum of L. vannamei |
泼洒副溶血弧菌后,被感染的对虾表现为摄食量下降、附肢发红、空胃、肝胰腺肿大、不好动或沿养殖桶壁漫游,活力弱,直至最后死亡。
图 7显示了泼洒副溶血弧菌后各处理组对虾的累积死亡率情况。从图 7中可看出,各处理组对虾在攻毒后陆续出现死亡,持续不同时间之后又逐渐停止死亡。其中,各处理组在攻毒开始后3~4天对虾开始出现死亡,而对照组在第2天即出现死亡。固体发酵制剂组对虾在攻毒后第7天停止死亡,其他处理组对虾在第9~10天逐渐停止死亡。
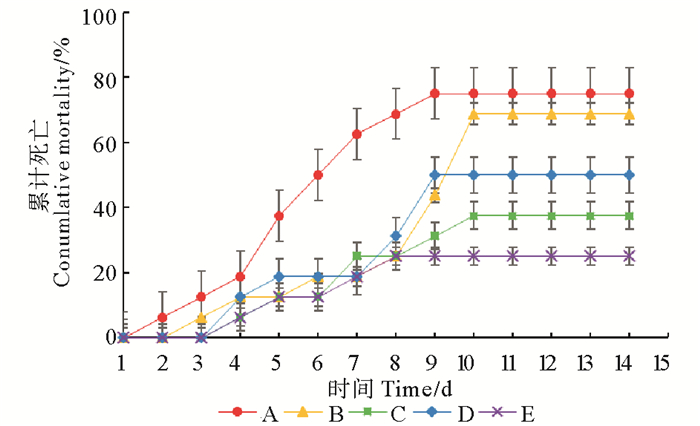
|
图 7 泼洒副溶血弧菌后各处理组凡纳滨对虾的累计死亡率 Fig. 7 The cumulative mortality of L. vannamei challenged with V. parahaemolvticus |
整个攻毒实验期间,固体发酵制剂组、后喷涂微生态制剂组和复合菌酶制剂组对虾累积死亡率分别为25.0%、37.5%和50.0%,均显著低于对照组(75%)(P < 0.05),而拌服微生态制剂组对虾累积死亡率(68.8%)则与对照组差异不大(P>0.05)。各处理组之间比较,固体发酵制剂组对虾累积死亡率为最低,拌服微生态制剂组最高。
3 讨论 3.1 不同复合微生态制剂及其添加方式对凡纳滨对虾生长的影响目前,微生态制剂在水产养殖中已得到广泛应用。研究表明,益生菌及其代谢产物可改善动物肠道菌群结构,增强动物肠道对营养物质的消化、吸收,从而能够有效促进动物的生长[18-19]。例如,王子彦等发现,微生物添加剂可显著提高养殖鱼类肠道淀粉酶和蛋白酶的活性[3, 20-21]。丁贤等的研究表明,饲喂芽孢杆菌可显著促进凡纳滨对虾肠道蛋白酶活性,提高对虾成活率[22]。然而,目前关于微生态制剂的不同添加形式对其作用效果的影响少见报道。本研究比较了常用的液体拌服与饲料制粒后喷涂工艺两种方式对同种复合菌制剂作用效果的影响。可以看出,液体拌服处理组对虾增重率和特定生长率与对照组之间差异不显著(P>0.05),而饲料后喷涂工艺处理组均显著高于液体拌服工艺处理组和对照组(P < 0.05)。究其原因,可能主要与拌服不均匀,且由于附着性差,易使益生菌在水体中溶失而导致对虾无法有效摄食有关。而采取饲料制粒后喷涂工艺,既可避免饲料在制粒过程中高温、高湿对菌活性产生的破坏[9],也可将益生菌更均匀的喷洒并渗透到饲料内部,避免有效成分的溶失和配方失效[23],从而能够使益生菌更有效地被对虾所摄食。
酶制剂作为外源性酶制剂添加到饲料中可弥补消化道内源性酶的不足。一方面,幼龄动物消化道发育尚不完善,酶的分泌能力相对较弱,适量补充一些消化酶,对此阶段的生长有突出的促进作用[24]。另一方面,外源性地补充动物自身不能分泌的非淀粉多糖酶(甘露聚糖酶、葡聚糖酶、木聚糖酶等),可以消除日粮中植物细胞壁的“屏蔽效应”,释放养分[14],还可以有效消除饲料中抗营养因子和某些毒素的有害作用[25],从而提高对饲料中各种养分的消化率和吸收率,降低饵料系数[26]。例如,周小秋等发现,在鲤鱼(Cyprinus carpio)饲料中添加复合酶制剂能够明显促进鲤鱼生长,降低饵料系数[27]。研究表明,酶制剂可以作为一种益生协同剂,可与益生菌联合使用,二者具有良好的协同性[28]。在本研究中,复合菌酶制剂由芽孢杆菌、酪酸菌和嗜酸乳杆菌等益生菌以及蛋白酶、淀粉酶等消化酶和甘露聚糖酶、木聚糖酶等非淀粉多糖酶等酶制剂复配后经低温制粒工艺而制成。可以看出,与对照组相比,低温制粒的复合菌酶制剂可显著提高对虾的增重率和特定生长率,显著降低饵料系数(P < 0.05),效果优于拌服复合菌制剂组。尹君等研究表明,微生态制剂与酶制剂共同作用提高了异育银鲤的消化酶活性[3]。因此,推测酶与菌制剂协同使用有效提高了对虾对营养物质的消化吸收,促进了对虾的生长。
近年来,微生物发酵培养物的功能受到广泛关注,例如,酵母培养物目前已在畜禽行业得到广泛应用[29-30]。本研究中的固体发酵制剂组在饲料中适量添加了部分由乳酸菌、酵母和芽孢杆菌等菌种复合发酵培养物。由于此饲料挤压成型温度低于90℃,且未经后熟化调质,因此在它的成分里,不仅含有部分存活的芽孢杆菌芽孢,还含有乳酸菌、酵母和芽孢杆菌等微生物细胞内的营养物,以及发酵后产生的微生物代谢产物,甚至很多未知活性因子。从养殖实验结果看,尽管生态饲料蛋白含量(36%)较对照组基础饲料蛋白含量低(42%),但对虾的增重率和特定生长率却显著高于其他处理和对照组(P < 0.05),显示了最优的养殖效果。推测这可能与添加的微生物复合发酵培养物可更有效地改善对虾肠道的微生态环境、增强肠道消化吸收功能、促进对虾的健康生长有关。
3.2 不同复合微生态制剂对凡纳滨对虾非特异性免疫指标及抗病力的影响与脊椎动物不同,凡纳滨对虾不具有获得性免疫系统,主要依靠非特异性免疫系统作为抵御细菌和疾病的保护屏障,维持机体的正常生理平衡[31]。隋大鹏等研究认为,对虾的溶酶体酶主要来源于血细胞和血淋巴,在对虾的体液免疫中发挥重要作用[32]。其中,血淋巴中超氧化物歧化酶(SOD)、碱性磷酸酶(AKP)、酸性磷酸酶(ACP)、溶菌酶(LSZ)、总一氧化氮合酶(TNOS)和诱导型一氧化氮合酶(iNOS)等活性是主要的评价指标[33]。
研究表明,益生菌及其代谢物可以作为良好的免疫激活剂,通过激发机体的体液免疫和细胞免疫来增强机体免疫机能[4],其作用机理可能是通过细菌本身或细胞壁成分刺激非特异性免疫系统使其发挥作用,从而提高动物免疫力[25]。本研究中,不同复合微生态制剂添加形式对凡纳滨对虾血清非特异免疫能力影响有所差别。其中,拌服复合菌制剂仅对虾血清LSZ活性有提高作用,后喷涂复合菌制剂显著提高了血清SOD、LSZ、TNOS和iNOS活性,而饲料中添加复合菌酶制剂则能够显著提高SOD、AKP、ACP、LSZ和iNOS的活性。而相比较,固体发酵制剂组在所有非特异免疫指标中几乎都显示出最佳的效果。分析其原因,后喷涂工艺使复合菌有效渗入饲料内部,避免了益生菌在水体中的溶失,促进了对虾对益生菌的有效摄入,从而体现出比拌服较好的效果。复合菌酶制剂的作用效果则表明了益生菌和酶制剂之间的协同作用可能对增强凡纳滨对虾的非特异性免疫能力具有更佳的效果。而固体发酵制剂组的效果则可能与多方面有关。一方面,固体发酵培养物中含有芽孢杆菌等益生菌,也含有多种微生物菌体营养物以及发酵产生的复杂代谢产物,这些均可能更为有效地提高对虾的机体免疫力;另一方面,相对于普通的高蛋白饲料(粗蛋白含量42%,C/N 6.4),添加固体发酵物的饲料蛋白含量较低(粗蛋白含量36%)、C/N较高(7.4),可能更有助于促进肠道土著有益微生物的生长繁殖,从而有效改善肠道的微生态环境和肠道功能,提高机体免疫力。当然,鉴于发酵培养物成分组成非常复杂,关于这一功能制剂的作用机理尚需进一步深入研究。
3.3 不同复合微生态制剂作用效果综合比较关于微生态制剂的作用机理,目前有很多不同解释[34]。然而,由于微生态制剂组成、工艺等诸多方面存在的差异,不同的微生态制剂的实际作用机制可能更复杂。从本研究的结果看,与对照组相比,不同微生态制剂对凡纳滨对虾生长性能改善程度的排序为固体发酵制剂组>复合菌酶制剂组>后喷涂复合菌制剂组>拌服复合菌制剂组,基本上与其对虾血清非特异性免疫酶活性提高效果是一致的。但副溶血弧菌攻毒的实验结果则存在一定的差异。副溶血弧菌是发现最早的对虾EMS主要致病菌之一,被感染的对虾可能出现红腿病、红体病和败血症等,发病迅速[35-36]。在本研究攻毒实验中,固体发酵制剂组对虾对副溶血弧菌的抗病力最强,后喷涂复合菌制剂次之,再次为复合菌酶制剂组,但拌服复合菌制剂组则与对照组相比差异不大。综合来看,固体发酵制剂组在各方面均显示出了最佳的效果。
除了几种复合微生态制剂在成分组成的差别,其添加形式和生产工艺存在的差异也值得关注。本研究设置的4种不同的微生态制剂,实际上不同程度涉及了微生态制剂在添加形式和生产工艺等方面存在的不同,也反映了目前微生态制剂行业在产品使用、设计思路和工艺路线上存在的诸多差异。拌服是微生态制剂最常见的使用方式,不仅麻烦,由于溶失严重,其效果也难以保证。本研究结果在一定程度上验证了这一缺陷。相比较,饲料生产后喷涂工艺则是一种添加微生态制剂的较好选择。这种工艺过程规范,喷涂均匀,但对喷涂设备和干燥工艺要求相对较高。复合菌酶制剂在成分组成上具有较大的创新,使用上也比较方便,简单掺合混匀即可。其成分配伍、颗粒形状、规格等完全模仿配合饲料,对虾在摄食上也不存在明显的差异。但由于采用低温制粒工艺,对生产设备和工艺要求也较高。一般来讲,由于益生菌和酶制剂等无法耐受对虾饲料加工过程的高温,因此无法直接添加在饲料原料中制粒。在本研究中,饲料中添加了以死亡微生物菌体和微生物发酵代谢产物为主的复合微生物发酵培养物,大大降低了饲料生产的工艺难度。从养殖实验结果看,不仅在较低的蛋白水平下获得了较高生长速率,而且对免疫和抗病能力的影响也最佳,甚至养殖水体的水质也明显改善(未发表数据)。尽管这一功能饲料的作用机理尚需进一步深入研究,但这一产品的配伍及生产工艺思路值得关注。
4 结论饲料中合理添加复合菌制剂、复合菌酶制剂及复合菌培养物能有效促进凡纳滨对虾的生长,提高对虾血清的非特异性免疫酶活性,增强对虾对副溶血弧菌的抗病力。总体比较,后喷涂添加复合菌制剂、复合菌酶颗粒制剂效果优于拌服复合菌制剂,而添加复合菌培养物的饲料效果最佳。
| [1] |
李桂英, 宋晓玲, 孙艳, 等. 几株肠道益生菌对凡纳滨对虾非特异免疫力和抗病力的影响[J]. 中国水产科学, 2011(6): 1358-1367. Li G Y, Song X L, Sun Y, et al. Effects of probiotics from the shrimp intestine on the non-specific immunity and antiviral capacity of Litopenaeus vannamei[J]. Fishery Sciences of China, 2011(6): 1358-1367. (  0) 0) |
| [2] |
王兴强, 马甡, 董双林. 凡纳滨对虾生物学及养殖生态学研究进展[J]. 海洋湖沼通报, 2004(4): 94-100. Wang X Q, Ma S, Dong S L. Studies on the biology and cultural ecology of Litopenaeus vannamei[J]. Transactions of Oceanology and Limnology, 2004(4): 94-100. DOI:10.3969/j.issn.1003-6482.2004.04.016 (  0) 0) |
| [3] |
尹君.微生态制剂和酶制剂对异育银鲫生长及消化生理的影响[D].南京: 南京农业大学, 2006. Yin J. Effects of Microbial Ecological Agents and Compound Enzyme Preparation on Performance and Digestive Physiology of Allogynogenetic crucian Carp[D]. Nanjing: Nanjing Agriculture University, 2006. http://cdmd.cnki.com.cn/article/cdmd-10307-2007010105.htm (  0) 0) |
| [4] |
胡毅, 谭北平, 麦康森, 等. 饲料中益生菌对凡纳滨对虾生长、肠道菌群及部分免疫指标的影响[J]. 中国水产科学, 2008, 15(2): 244-251. Hu Y, Tan B P, Mai K S, et al. Effects of dietary probiotic on growth, immunity and intestinal bacteria of juvenile Litopenaeus vannamei[J]. Journal of Fishery Sciences of China, 2008, 15(2): 244-251. DOI:10.3321/j.issn:1005-8737.2008.02.008 (  0) 0) |
| [5] |
Balcázar J L, De B I, Ruizzarzuela I, et al. The role of probiotics in aquaculture[J]. Veterinary Microbiology, 2006, 114(3-4): 173. DOI:10.1016/j.vetmic.2006.01.009
(  0) 0) |
| [6] |
高权新, 施兆鸿, 彭士明. 益生菌在水产养殖中的研究进展[J]. 海洋渔业, 2013, 35(3): 364. Gao Q X, Shi Z H, Peng S M. Probiotics in aquaculture: recent progress and outlook[J]. Marine Fisheries, 2013, 35(3): 364. DOI:10.3969/j.issn.1004-2490.2013.03.016 (  0) 0) |
| [7] |
何义进.微生态制剂降解养殖水体氨氮及亚硝酸盐的研究[D].南京: 南京农业大学, 2007. He Y J. Study on Ammonia and Nitrite Reducing in the Pond Using Microorganism[D]. Nanjing: Nanjing Agriculture University, 2007. http://cdmd.cnki.com.cn/Article/CDMD-10307-2008197449.htm (  0) 0) |
| [8] |
夏磊, 赵明军, 张洪玉, 等. 不同比例复合益生菌对凡纳滨对虾生长、免疫及抗氨氮能力的影响[J]. 中国水产科学, 2015, 22(6): 1299-1307. Xia L, Zhao M J, Zhang H Y, et al. Effects of different proportions of a group of compound bacteria on growth, innate immunity, and ammonia nitrogen resistance in Pacific white shrimp, Litopenaeus vannamei[J]. Journal of Fishery Sciences of China, 2015, 22(6): 1299-1307. (  0) 0) |
| [9] |
Aguirre-Guzmán G, Lara-Flores M, Sánchez-Martínez J G, et al. The use of probiotics in aquatic organisms: A review[J]. African Journal of Microbiology Research, 2012, 6(21): 4845-4857.
(  0) 0) |
| [10] |
丁轲, 倪学勤, 潘康成, 等. 益生菌剂与协同剂协同效应的研究[J]. 兽药与饲料添加剂, 2004, 9(4): 17-19. Ding K, Ni X Q, Pan K C, et al. Research on synergistic effect of probiotics and synergistic agents[J]. Veterinary Pharmaceuticals & Feed Additives, 2004, 9(4): 17-19. (  0) 0) |
| [11] |
林谦, 戴求仲, 宾石玉, 等. 益生菌与酶制剂对黄羽肉鸡血液生化指标和免疫性能影响的协同效应研究[J]. 饲料工业, 2012, 33(14): 31-36. Lin Q, Dai Q Z, Bin S Y, et al. Synergistic effect of probiotics and enzyme preparation on blood biochemical parameters and immune properties in yellow-feathered broilers[J]. Feed Industry, 2012, 33(14): 31-36. DOI:10.3969/j.issn.1001-991X.2012.14.008 (  0) 0) |
| [12] |
柴仙琦, 冷向军, 张民, 等. 酶制剂在水产饲料中的应用及研究进展[J]. 饲料工业, 2014, 35(2): 33-36. Chai X Q, Leng X J, Zhang M, et al. Application and research progress of enzyme preparation in aquatic feed[J]. Feed Industry, 2014, 35(2): 33-36. (  0) 0) |
| [13] |
黄燕华, 王国霞, 黄文庆, 等.酶制剂对南美白对虾幼虾生长、体组成及非特异免疫的影响[C]. //饲料酶制剂的研究与应用.广州: 中国畜牧兽医学会动物营养学分会, 2009. Huang Y H, Wang G X, Huang W Q, et al. Effects of enzyme preparation on growth, body composition and non-specific Immunity of Litopenaeus vannamei[C]. // Research and Application of Feed Enzyme Preparation. Guangzhou: China's Animal Husbandry and Veterinary Association Animal Nutrition Society, 2009. http://cpfd.cnki.com.cn/Article/CPFDTOTAL-SEKM200911001028.htm (  0) 0) |
| [14] |
Sajjadi M, Carter C. Dietary phytase supplementation and the utilisation of phosphorus by Atlantic salmon (Salmo salar) fed a canola meal-based diet[J]. Aquaculture, 2004, 240(1-4): 417-431.
(  0) 0) |
| [15] |
周金敏, 周樱. 不同蛋白水平下复合酶对草鱼生长和消化酶的影响研究[J]. 饲料工业, 2012, 33(8): 43-46. Zhou J M, Zhou Y. Effects of compound enzymes on the growth and digestive enzymes of Grass carp at different protein levels[J]. Feed Industry, 2012, 33(8): 43-46. (  0) 0) |
| [16] |
王国霞, 刘群芳, 黄文庆, 等. 复合酶制剂对黄颡鱼生长性能、血清生化和免疫指标的影响[J]. 南方水产科学, 2013, 9(6): 84-89. Wang G X, Liu Q F, Huang W Q, et al. Effects of complete enzyme preparation on growth performance, serum biochemical and immune indices of juvenile yellow catfish (Peltobagrus fulvidraco)[J]. South China Fisheries Science, 2013, 9(6): 84-89. DOI:10.3969/j.issn.2095-0780.2013.06.014 (  0) 0) |
| [17] |
吴志青, 吴华东. 饲用复合酶制剂的作用机理及其在动物生产中的应用[J]. 贵州畜牧兽医, 2012, 36(1): 21-24. Wu Z Q, Wu H D. Mechanisms and application of feed compound enzyme in animal production[J]. Guizhou Journal of Animal Husbandry & Veterinary Medicine, 2012, 36(1): 21-24. DOI:10.3969/j.issn.1007-1474.2012.01.007 (  0) 0) |
| [18] |
林黑着, 李卓佳, 郭志勋, 等. 益生菌对凡纳滨对虾生长和全虾营养组成的影响[J]. 南方水产科学, 2008, 4(6): 95-100. Lin H Z, Li Z J, Guo Z X, et al. Effects of dietary probiotics on growth and biochemical composition of whole body of juvenile shrimp, Litopenaeus vannamei[J]. South China Fisheries Science, 2008, 4(6): 95-100. DOI:10.3969/j.issn.2095-0780.2008.06.014 (  0) 0) |
| [19] |
Rengpipat S, Phianphak W, Piyatiratitivorakul S, et al. Effects of a probiotic bacterium on black tiger shrimp Penaeus monodon, survival and growth[J]. Aquaculture, 1998, 167(3-4): 301-313. DOI:10.1016/S0044-8486(98)00305-6
(  0) 0) |
| [20] |
胡东兴.鲤体内地衣芽孢杆蓖对气单孢菌生物拮抗及鱼免疫功能、酶活影响研究[D].雅安: 四川农业大学, 1996. Hu D X. Effects of Licorice of Bacillus licheniformis on the Biological Antagonism of Aeromonas and Fish Immune Function and Enzyme Activity in Cyprinus carpio[D]. Yaan : Sichuan Agriculture University, 1996. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y246913 (  0) 0) |
| [21] |
Sugita H, Hirose Y, Matsuo N, et al. Production of the antibacterial substance by Bacillus sp. strain NM 12, an intestinal bacterium of Japanese coastal fish[J]. Aquaculture, 1998, 165(3-4): 269-280. DOI:10.1016/S0044-8486(98)00267-1
(  0) 0) |
| [22] |
丁贤, 李卓佳, 陈永青, 等.芽孢杆菌对凡纳滨对虾生长和消化酶活性的影响[C]. //全国饲料添加剂大会.广州: 中国饲料工业协会, 2008. Ding X, Li Z J, Chen Y Q, et al. Effects of Bacillus on Growth and Activities of Digestive Enzymes in Litopenaeus vannamei[C]. // National Feed Additives Assembly. Guangzhou: China Feed Industry Association, 2008. http://www.wanfangdata.com.cn/details/detail.do?_type=conference&id=7780982 (  0) 0) |
| [23] |
孙培云. 饲料添加剂后喷涂工艺的类型与优点[J]. 养殖技术顾问, 2012(1): 64. Sun P Y. Feed additives after the spraying process types and advantages[J]. Breeding Technology Consultant, 2012(1): 64. DOI:10.3969/j.issn.1673-1921.2012.01.063 (  0) 0) |
| [24] |
王潇.膨化玉米与外源淀粉酶对断奶仔猪淀粉代谢的影响机理研究[D].武汉: 华中农业大学, 2005. Wang X. Effects of Extruded Corn and Exogenous Amylase on Starch Metabolism in Weaned Pigs[D]. Wuhan: Huazhong Agricultural University, 2005. http://cdmd.cnki.com.cn/Article/CDMD-10504-2006190224.htm (  0) 0) |
| [25] |
Zanella I, Sakomura N K, Silversides F G, et al. Effect of enzyme supplementation of broiler diets based on corn and soybeans[J]. Poultry Science, 1999, 78(4): 561-8. DOI:10.1093/ps/78.4.561
(  0) 0) |
| [26] |
王纪亭, 万文菊, 康明江, 等. 复合酶制剂对草鱼生长性能、饲料养分消化率及免疫力的影响[J]. 大连海洋大学学报, 2009, 24(5): 417-422. Wang J T, Wang W J, Kang M J, et al. Effects of multi-enzyme on growth, digestibility and immunity of grass carp Ctenopharyngodon idellus[J]. Journal of Dalian Fisheries University, 2009, 24(5): 417-422. DOI:10.3969/j.issn.1000-9957.2009.05.007 (  0) 0) |
| [27] |
周小秋. 几种酶制剂对鲤鱼生产性能的影响[J]. 饲料广角, 2001(15): 22-23. Zhou X Q. Influence of some enzyme preparation to carps performance[J]. Feed Landscape, 2001(15): 22-23. DOI:10.3969/j.issn.1002-8358.2001.15.010 (  0) 0) |
| [28] |
林谦.益生菌与酶制剂对黄羽肉鸡生产性能影响的协同机理研究[D].桂林: 广西师范大学, 2012. Lin Q. The Study on the Synergistic Mechanism of Probiotics and Enzyme Preparation on the Production Performance of Yellow Broiler[D]. Guilin: Guangxi Normal University, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10602-1012378078.htm (  0) 0) |
| [29] |
Shen Y B, Piao X S, Kim S W, et al. Effects of yeast culture supplementation on growth performance, intestinal health, and immune response of nursery pigs[J]. Journal of Animal Science, 2009, 87(8): 2614. DOI:10.2527/jas.2008-1512
(  0) 0) |
| [30] |
Tripathi M K, Karim S A. Effect of individual and mixed live yeast culture feeding on growth performance, nutrient utilization and microbial crude protein synthesis in lambs[J]. Animal Feed Science & Technology, 2010, 155(2): 163-171.
(  0) 0) |
| [31] |
Duan Y, Liu P, Li J, et al. Molecular responses of calreticulin gene to Vibrio anguillarum and WSSV challenge in the ridgetail white prawn Exopalaemon carinicauda[J]. Fish & Shellfish Immunology, 2014, 36(1): 164.
(  0) 0) |
| [32] |
隋大鹏.微生态制剂对南美白对虾生长和非特异性免疫因子影响的研究[D].青岛: 中国海洋大学, 2003. Sui D P. The Research of Effects of Probiotics on Growth and Non-Special Immunity Factors of Litopenaeus vannamei[D]. Qingdao: Ocean University of China, 2003. http://cdmd.cnki.com.cn/article/cdmd-10423-2003093447.htm (  0) 0) |
| [33] |
Rengpipat S, Rukpratanporn S, Piyatiratitivorakul S, et al. Immunity enhancement in black tiger shrimp (Penaeus monodon) by a probiont bacterium (Bacillus, S11)[J]. Aquaculture, 2000, 191(4): 271-288. DOI:10.1016/S0044-8486(00)00440-3
(  0) 0) |
| [34] |
Ziaei-Nejad S, Rezaei M H, Takami G A, et al. The effect of Bacillus, spp. bacteria used as probiotics on digestive enzyme activity, survival and growth in the Indian white shrimp Fenneropenaeus indicus[J]. Aquaculture, 2006, 252(2-4): 516-524. DOI:10.1016/j.aquaculture.2005.07.021
(  0) 0) |
| [35] |
雷爱莹. 南美白对虾败血病病原菌(副溶血弧菌)的研究[J]. 广西水产科技, 2005(1): 9-12. Lei A Y. Research Penaeus septicemia pathogen (Vibrio parahaemolyticus) of Litopenaeus vannamei[J]. Guangxi Fisheries Science and Technology, 2005(1): 9-12. (  0) 0) |
| [36] |
宋春华, 孟庆显. 副溶血弧菌引起中国对虾红腿病的组织病理及防治[J]. 齐鲁渔业, 1998(3): 24-27. Song C H, Meng Q X. Studies on prevention, treatment and tissue pathology of the red leg-disease of penaeus orientalis caused by Vibrio parahaemolyticus[J]. Shandong Fisheries, 1998(3): 24-27. (  0) 0) |
2. Qingdao National Laboratory for Marine Science and Technology, Qingdao 266235, China;
3. Guangzhou Jinshui Animal Health Products Co., Ltd, Guangzhou 510510, China
 2018, Vol. 48
2018, Vol. 48


