2. 青岛海洋科学与技术试点国家实验室,山东 青岛 266237
在水产养殖中,氮污染是导致养殖水质恶化的重要因素之一,严重威胁水生生物的生存。微生物在氮转化中具有重要的作用,其可通过氨化、硝化以及反硝化作用,将水体中有害的氮污染物转化为气态物质排除水体。生物脱氮因其经济高效、绿色环保而备受关注[1-2]。传统的生物脱氮通常包含两个过程:第一步为硝化作用,即硝化细菌在好氧条件下将NH4+-N经NO2--N转化为NO3--N的过程;第二步是反硝化细菌在厌氧条件下将NO3--N、NO2--N还原为气态氮的过程[3-7]。由于参与这两个过程的细菌对氧气和有机物的耐受程度不同,因此传统的生物脱氮系统包含两个单独的体系,导致脱氮效率低下和脱氮成本升高[8-12]。随着研究的深入,异养硝化细菌逐渐被发现和分离[13-14],其能够在利用水体中有机物进行自身生长的同时,将水体中含氮化合物通过硝化作用,转化为NH2OH、NO2--N或NO3--N等;与此同时,大部分细菌还可同时进行好氧反硝化作用,将NO2--N或NO3--N转化为含氮气体[5, 15-19]。脱氮副球菌(Paracoccu denitrificans)(最初命名为Thiosphaera pantotropha)是首株被报道的具有好氧反硝化作用的菌株,其可以将NO3--N或NO2--N反硝化为N2[20-21]。此后,越来越多的异养硝化-好氧反硝化细菌被分离和深入研究,例如施氏假单胞菌(Pseudomonas stutzeri)[22]、粪产碱杆菌(Alcaligenes faecalis)[3, 23]、恶臭假单胞菌(P. putida)[24]、醋酸钙不动杆菌(Acinetobacter calcoaceticus)[25]、枯草芽孢杆菌(Bacillus subtilis)A1[26]、肺炎克雷伯氏菌(Klebsiella pneumonia)CF-S9[16]、贪铜菌属(Cupriavidus sp.)S1[27]和阴沟肠杆菌(Enterobacter cloacae)CF-S27[28]等。
异养硝化-好氧反硝化细菌的发现,为生物脱氮提供了新的研究方向。在微生物氮代谢过程中,硝酸盐还原酶可以促使NO3--N向NO2--N的转化,亚硝酸盐还原酶来促使NO2--N向NOx的转化,羟胺氧化还原酶可以促进NH2OH向NOx的转化[29],通过对异养硝化-好氧反硝化细菌脱氮过程中关键酶的研究,有助于阐明菌株的脱氮途径。对于异养硝化-好氧反硝化细菌的代谢途径虽尚未达成共识,但目前公认的代谢途径主要包括两种:一种认为硝化作用和反硝化作用的结合点在NO2--N,NH4+-N首先转化为NH2OH,再由NH2OH转化为NO2--N,然后经反硝化作用转化为N2;另一种途径认为,NH4+-N转化为NH2OH后,可直接被还原为NO或N2O等气体产物,而不产生NO2--N的积累[30-31]。两条途径的区别在于细菌对NH2OH的利用和转化,因此研究细菌对于不同形式氮的利用过程,对于阐明菌株的脱氮机制具有重要的意义。但是,上述两种脱氮途径均是基于对脱氮过程中的氮平衡数据,由于对氮转化过程中中间产物不可避免的测量误差,很难获得准确的结果[32-33]。因此,利用更为精确的15N同位素示踪方法,可获得更加准确的细菌脱氮过程[34],其将有利于对细菌脱氮机制的理解。
本研究中,分别以氯化铵、亚硝酸钠和硝酸钠作为唯一氮源,对一株分离自对虾养殖池塘底泥的地衣芽孢杆菌(Bacillus licheniformis)菌株MP15的脱氮特性进行了详细的研究。与此同时,通过测定菌株MP15脱氮过程中的关键酶活性,从酶学角度理解其脱氮途径。此外,本研究采用高精度的气相色谱-同位素比质谱(GC-IRMS)同位素示踪技术,研究菌株MP15的氮代谢路径,旨在阐明菌株MP15的异养硝化-好氧反硝化机制,为其在生物脱氮实践应用中提供一定的理论依据。
1 材料和方法 1.1 材料 1.1.1 样品来源本研究中所用的地衣芽孢杆菌菌株MP15分离自对虾养殖池塘底泥,目前保藏于中国海洋大学水产养殖生态实验室微生物保藏中心。菌株MP15的16S rRNA基因序列的GenBank登记号为MH569340[35]。
1.1.2 培养基2216E培养基:胰蛋白胨6.0 g、酵母提取物2.0 g、海水1 000 mL,pH=7.5。
异养硝化培养基(HNM):NH4Cl 0.16 g,葡萄糖1.73 g,海水1 000 mL,pH=7.5。
亚硝酸盐反硝化培养基(NDM):NaNO2 0.20 g,葡萄糖1.73 g,海水1 000 mL,pH=7.5。
硝酸盐反硝化培养基(DM):NaNO3 0.26 g,葡萄糖1.73 g,海水1 000 mL,pH=7.5。
上述HNM、NDM和DM培养基,使用前分别于高压灭菌锅115 ℃下高温蒸汽灭菌20 min;2216E培养基使用前于高压灭菌锅121 ℃下高温蒸汽灭菌20 min。
1.2 菌株MP15异养硝化-好氧反硝化性能研究菌株MP15在不同氮基础降解液中的异养硝化-好氧反硝化性能检测实验在28 ℃下进行。以不添加菌悬液的氮基础降解液作为对照组,以添加菌液的不同氮基础降解液作为不同的实验组,每个实验组设置3个重复。取对数期的菌液,按照5%(v:v)的接种量,接种于含有200 mL无菌基础降解液的三角烧瓶中,将各处理置于恒温摇床连续振荡(160 r/min)培养72 h。每天定时取样,分别测定培养液中的细菌生长OD值(OD600)、铵态氮(NH4+-N)、亚硝态氮(NO2--N)、硝态氮(NO3--N)和总氮(TN)的浓度。
1.3 对菌株MP15氨氧化过程的抑制研究在上述以NH4Cl为氮源的氮基础降解液中,添加烯丙基硫脲(ATU)[36],抑制NH4+-N的氧化,验证菌株MP15的异养硝化-好氧反硝化过程。以不添加ATU的氮基础降解液作为对照组,以添加0.3 mmol/L ATU[37]的氮基础降解液作为实验组,每个实验组设置3个重复。取对数期的菌液,按照5%(v:v)的接种量,接种于含有200 mL无菌基础降解液的三角烧瓶中,然后将各处理置于恒温摇床连续振荡(160 r/min)培养24 h,每隔2 h取样。测试的指标主要包括:OD600、NH4+-N、NO2--N、NO3--N、NH2OH和TN浓度。
1.4 菌株MP15脱氮过程中关键酶活性研究将活化后的菌株MP15接种于2216E液体培养基,培养12 h后收集菌体,3 000 r/min离心10 min。用10 mmol/L磷酸缓冲液(pH=7.5)洗涤菌体3次后用10 mmol/L PBS缓冲液将菌体重悬,并用超声波破碎仪进行菌体破碎。将破碎后的菌体于4 ℃、11 150×g离心15 min,取上清做为粗酶液[38]。测定粗酶液的硝酸盐还原酶(Nar)、亚硝酸盐还原酶(Nir)和羟胺氧化还原酶(Hao)的活性。其中测定Nar和Nir活性所用的反应体系为1 mL:无菌水、50 mmol/L磷酸缓冲液、100 μmol/L NaNO3/NaNO2和200 μL粗酶液。测定Hao所用的反应体系为1 mL:无菌水、10 mmol/L Tris-HCl缓冲液、1 mmol/L NH2OH和200 μL粗酶液。其中Nar酶活性通过测定NO3--N存在条件下,NO2--N的生成量;Nir酶活性的测定根据NO2--N存在条件下,NO2--N的减少量[39];Hao活性的通过测定NH2OH存在条件下,NH2OH的减少量。利用Lowry法[40]测定粗酶液蛋白含量。定义酶每分钟催化转移1 mol基质为单位酶活;定义单位酶活量/粗酶液中蛋白的浓度为酶比活性。
1.5 15N同位素示踪测定含氮气体研究在本实验中,分别用15NH4Cl、Na15NO2和Na15NO3(Sigma Corp., USA)替代上述基础降解液中的NH4Cl、NaNO2和NaNO3。其中以不添加菌液的基础降解液作为对照组,以添加菌液的不同氮基础降解液作为不同的实验组,每个实验组设置3个重复。取对数期的菌液,按照5%(v:v)的接种量,接种于含有100 mL无菌基础降解液的500 mL用橡皮塞紧密密封的医用输液瓶中[7],然后将各处理置于恒温(28 ℃)摇床连续振荡(160 r/min)培养72 h。实验结束后,检测顶空气体中氮的气体化合物。样品的稳定同位素比值是在深圳市华科精信检测科技有限公司与清华大学深圳研究生院共建的稳定同位素实验室测定,仪器型号为同位素比率质谱仪(Thermo Fisher Finnigan DELTA V Advantage,美国)。氮稳定同位素的自然丰度表示为:
| $ \delta N = \left( {\frac{{{R_{样品}}}}{{{R_{标准}}}} - 1} \right) \times {10^3}。$ |
式中:N为样品15N;R为15N/14N;δ15N是相对于N2-atm,分析精度为δ15N < 0.3‰。
1.6 实验方法和计算菌体生长量采用吸光度法,用可见分光光度计于600 nm处测量吸光度值(OD600)[13];利用靛酚蓝法测定培养液中NH4+-N的浓度;利用盐酸萘乙二胺法测定培养液中NO2--N的浓度;利用紫外分光光度法测定培养液中NO3--N的浓度;利用碱性过硫酸钾氧化紫外分光光度法测定培养物中的TN浓度[41];利用分光光度法[42]测定培养液中的羟胺的浓度。
实验组NH4+-N、NO2--N、NO3--N、NH2OH-N和TN的去除率和最大去除速率分别根据以下公式计算:
| $ \begin{array}{l} N = \frac{{{C_i} - {C_t}}}{{{C_i}}} \times 100\% ;\\ {N_1}_{234} = \frac{{{C_i} - {C_t}}}{t}。\end{array} $ |
式中:Ci和Ct分别代表实验第0和t小时降解溶液中的NH4+-N、NO2--N、NO3--N、NH2OH-N和TN的浓度;t代表MP15的培养时间。通过氮平衡计算来分析菌株MP15的氮代谢路径。
1.7 统计分析实验数据以平均值±标准差(Means±SD)表示。数据使用SPSS(SPSS 19.0 version for windows,SPSS,Inc.,Chicago,USA)进行统计分析。通过Kolmogorov-Smirnov检验和Levene’s检验进行数据的正态分布检测。若数据符合正态分布,则进行进一步的分析,若不符合,则首先进行数据转换。通过单因素方差分析(ANOVA)和Duncan多重比较,对实验数据进行比较分析以P<0.05表示各组间存在显著性差异。
2 实验结果 2.1 异养硝化-好氧反硝化性能当菌株MP15在以NH4+-N作为唯一氮源(HNM)时,其脱氮特性见图 1。菌株MP15对NH4+-N的氧化作用与生长密切相关。在实验的前30 h内,随着菌株MP15的快速生长,菌株MP15对NH4+-N的去除作用明显,其可去除HNM中约68.55%的初始NH4+-N(42.39±0.52) mg/L。在实验的6~24 h内,可检测到明显的NH4+-N浓度降低,此时菌株MP15对HNM中NH4+-N的最大去除速率为1.03 mg NH4+-N(L·h)。随后,菌株MP15进入生长稳定期,但其可继续利用基础降解液中的NH4+-N。在实验的第72小时,菌株MP15可去除HNM中约83.95%的初始NH4+-N。经72 h培养后,通过氮平衡分析,HNM中约33.79%的初始氮被菌株MP15同化为有机氮,约47.62%的初始氮可能被菌株MP15通过硝化作用转化为某种含氮气体。在实验的72 h内,未检测到明显的NO2--N和NO3--N的积累。
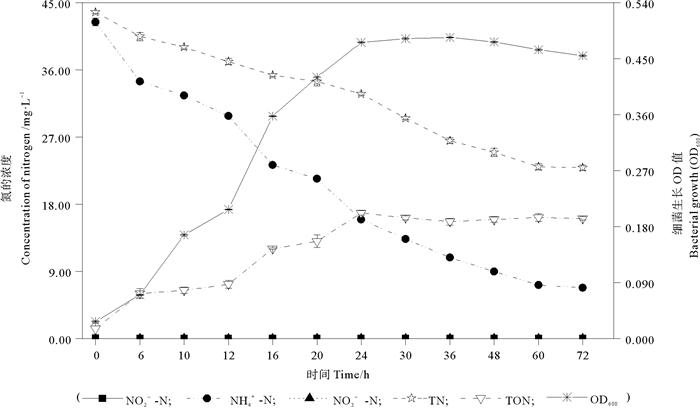
|
图 1 地衣芽孢杆菌MP15以氯化铵作为唯一氮源时的脱氮特性 Fig. 1 Nitrogen removal characteristic of B. licheniformis MP15 with ammonium chloride served as the sole N-source |
由图 2可见,当菌株MP15以NO2--N作为唯一氮源(NDM)时,在实验的前36 h内,随着菌株MP15的生长,基础降解液中的NO2--N和TN浓度也不断降低。NO2--N浓度在实验的第36小时达到最低,此时菌株MP15可去除NDM中约95.21%的初始NO2--N((42.33±0.19) mg/L),与此同时,其对NDM中初始TN的去除率为50.94%。此外,在实验的12~24 h,检测到明显的NO2--N浓度降低,此时菌株MP15对基础降解液中NO2--N的最大去除速率为1.74 mg NO2--N/(L·h)。在实验中,NDM中从第10小时开始出现NO3--N的积累,约2.32 mg/L;NO3--N的积累在实验的第30小时达到最大,为9.97 mg/L;随后其浓度开始降低,至实验结束,基础降解液中积累的NO3--N的浓度为4.95 mg/L。在实验的第72小时,氮平衡分析结果表明,基础降解液中约21.64%的初始氮被菌株MP15同化为有机氮,约56.84%的初始氮可能以氮的某种气态形式存在。
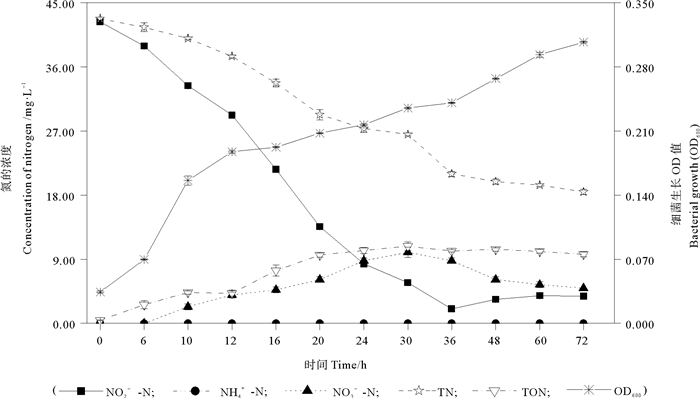
|
图 2 地衣芽孢杆菌MP15以亚硝酸钠作为唯一氮源时的脱氮特性 Fig. 2 Nitrogen removal characteristic of B. licheniformis MP15 with sodium nitrite served as the sole N-source |
当以NO3--N作为唯一氮源(DM)时,菌株MP15的好氧反硝化性能见图 3。在实验的72 h内,菌株MP15的生长OD600持续升高。随着菌株的生长,DM中的NO3--N和TN浓度呈下降趋势,特别是在实验的第6~24小时内,检测到明显的NO3--N浓度的降低,此时菌株MP15对NO3--N的最大去除速率为1.02 mg NO3--N/(L·h)。同时,在实验的第10小时,在DM中检测到NO2--N的积累,并持续呈上升趋势,在实验的第72小时,DM中积累的NO2--N达到最大,为6.97 mg/L。在实验的第72小时,菌株MP15可去除DM中约65.08%的初始NO3--N((42.25 ±0.72)mg/L)。此时,通过氮平衡计算,基础降解液中约25.36%的初始氮被菌株MP15同化为有机氮,约22.41%的初始氮通过菌株MP15的反硝化作用,以气体的形式逸散出去。
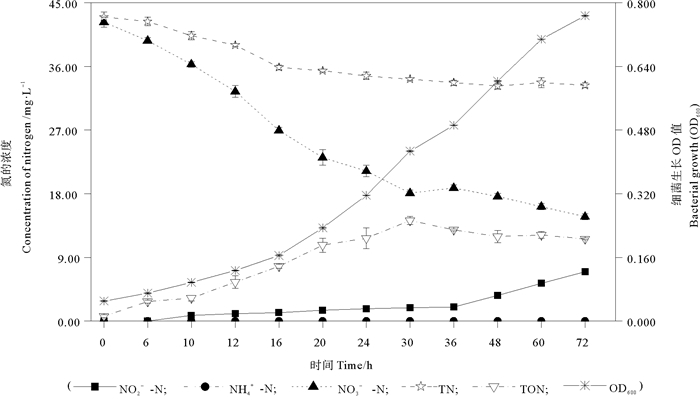
|
图 3 地衣芽孢杆菌MP15以硝酸钠作为唯一氮源时的脱氮特性 Fig. 3 Nitrogen removal characteristic of B. licheniformis MP15with sodium nitrate served as the sole N-source |
以NH4Cl作为唯一氮源时,研究了菌株MP15的氨氧化过程,同时研究了添加氨氧化抑制剂烯丙基硫脲(ATU)时对菌株MP15的氨氧化过程的影响,其中菌株MP15在两种不同基础降解液中对NH4+-N和TN的去除特性见图 4A,在NH4+-N氧化过程NH2OH的变化特征见图 4B。研究结果显示,ATU的存在对菌株MP15的生长没有显著影响,但可明显改变菌株对NH4+-N的去除过程。当菌株MP15在不含抑制剂ATU的氮基础降解液中,在实验的第4小时,降解液中检测到NH2OH的积累,约为0.27 mg/L,随后NH2OH的积累逐渐增高(见图 4B);与此同时,基础降解液中的NH4+-N和TN也明显减少。在实验的第24小时,菌株MP15可以去除基础降解液中约62.52%的初始NH4+-N和24.93%的初始TN(见图 4A)。当基础降解液中添加了抑制剂ATU后,在实验的前20 h,
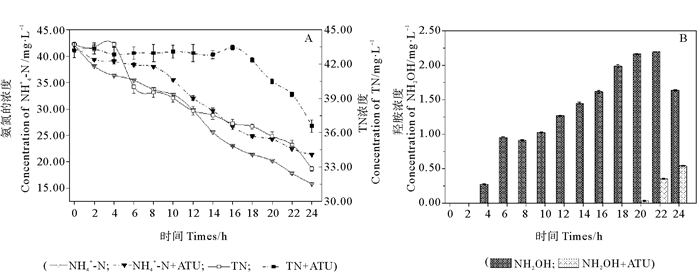
|
( 图 4A为基础降解液中NH4+-N和TN的浓度变化;图 4B为NH4+-N氧化过程NH2OH的浓度变化。Fig. 4A, Change of NH4+-N and TN concentrations in different culture media; Fig. 4B, Change of concentration of NH2OH during ammonium oxidation. ) 图 4 地衣芽孢杆菌MP15的氨氧化过程 Fig. 4 Ammonium oxidation by B. licheniformis MP15 |
菌株MP15对NH4+-N氧化过程受到明显的抑制作用,此时基础降解液中未检测到NH2OH、NO2--N和NO3--N的积累,菌株对NH4+-N的利用量明显少于同时间未添加ATU时的去除量(见图 4A)。但是,实验进行20 h后,基础降解液中的ATU逐渐失去抑制作用,此时,基础降解液检测到NH2OH的积累和TN的减少,这一现象持续至实验结束。
2.3 菌株MP15脱氮过程中关键酶活性对菌株MP15脱氮过程中关键酶活的测定主要包括粗酶液中的硝酸盐还原酶(Nar)、亚硝酸盐还原酶(Nir)和羟胺氧化还原酶(Hao),测定结果见表 1。在菌株MP15脱氮过程中,Nar、Nir和Hao均具有一定量的表达,在粗酶液中,检测到菌株MP15的Nar、Nir和Hao的酶比活力分别为0.160 9、0.157 8和0.540 6 U/mg。
|
|
表 1 地衣芽孢杆菌MP15的脱氮关键酶活性 Table 1 Key enzyme activity of B. licheniformis MP15 |
通过上述实验,根据氮平衡计算,菌株MP15在不同的氮基础降解液中可能通过不同的硝化-反硝化途径,分别将基础降解液中的NH4+-N、NO2--N和NO3--N等转化成了气态氮化合物,因此利用15N同位素标记,通过GC-IRMS检测实验结束时不同实验组和对照组顶空气体中的15N2和15N2O,其中15N2和15N2O的GC-IRMS气体检测结果见表 2。由表 2可见,当菌株MP15以Na15NO2和Na15NO3作为唯一氮源时,N2和N2O的δ15N值均显著高于对照,表明菌株MP15可通过好氧反硝化作用将NO2--N和NO3--N转化为N2和N2O。当以15NH4Cl作为唯一氮源时,仅检测到15N2O的产生,表明菌株可通过硝化作用将NH4+-N转化为5N2O。
|
|
表 2 地衣芽孢杆菌MP15在不同氮基础降解液中15N2和15N2O的GC-IRMS检测结果 Table 2 GC-IRMS results of 15N2 and 15N2O of B. licheniformis MP15 |
氮循环是水陆生态系统中重要的生物地球化学循环。传统观点认为,在微生物参与的氮循环中,首先是自养微生物在好氧条件下对氨氮的硝化过程[7, 10]。随着研究的深入,研究者发现,异养微生物可以在好氧和缺氧的条件下发生异养硝化现象。1972年,Verstraete等[13]从污泥中分离到了具有硝化作用的异养节杆菌属(Arthrobacter sp.)细菌;随后,Witzel等[14]研究了不同生长条件下的乙酸代谢对异养硝化节杆菌9006的影响。此外,研究者最初认为反硝化细菌只有在严格厌氧的条件下才能发生反硝化作用,因为在有氧条件下,氧气是比NO3--N或NO2--N更好的电子受体,这样就会抑制反硝化作用的发生[43]。但是,1983年Robertson等[21]首次分离并研究了好氧反硝化细菌。异养硝化-好氧反硝化细菌因其经济高效、绿色环保,在生物脱氮中得到广泛应用和研究。
本研究中,分离自对虾养殖池塘底泥的地衣芽孢杆菌菌株MP15具有高效的异养硝化-好氧反硝化性能。在仅含有NH4+-N的氮基础降解液(HNM)中,菌株MP15对NH4+-N的最大去除速率为1.03 mg NH4+-N/(L·h),显著高于芽孢杆菌LY(0.44 mg NH4+-N/(L·h))[44]对NH4+-N的最大去除速率。整个实验中未检测到NO2--N和NO3--N的积累。在实验的第4小时,随着菌株MP15的生长,基础降解液中具有NH2OH的积累,与此同时,TN的浓度随之降低。对菌株MP15粗酶液中羟胺氧化还原酶(Hao)的研究结果显示,菌株MP15的Hao酶比活力显著高于肺炎克雷伯氏菌CF-S9[16](0.051 U/mg蛋白)和不动杆菌(Acinetobactersp.)Y1[19](0.067 U/mg蛋白),表明菌株MP15可经羟胺氧化酶进行NH4+-N的氧化。15N2O的产生,进一步证明了菌株MP15可以通过异养硝化作用产生将NH4+-N转化为N2O。值得注意的是,N2O为一种温室气体,其排放对环境具有一定的危害作用[45]。在污水处理中,生物脱氮普遍会产生一定量的N2O,如何有效降低N2O的排放量也是污水处理工艺的一个较大的挑战[46-49]。研究发现,N2O的产生不等于排放,其排放受被动扩散、混合作用、大气平流等多种因素影响[50]。而在实践应用中,通过控制曝气过程,例如优化曝气过程中的气泡大小或使用无泡曝气系统,均可有效的控制N2O的排放,减少其对环境的危害作用[50-51]。N2O的产生通常来自两条氮代谢途径:其一是作为NH4+-N氧化为NO2--N的中间产物;其二是来自于NO2--N的好氧反硝化过程[31]。然而,在整个NH4+-N氧化过程中,未检测到NO2--N的积累。与此同时,在添加ATU的氮基础降解液中,实验前20 h内,降解液中无NO2--N、NO3--N和NH2OH的积累,进一步揭示菌株MP15对NH4+-N的转化过程。综合上述结果,菌株MP15对NH4+-N的利用主要包括同化和异养硝化作用,其具体硝化途径为:NH4+-N→NH2OH→N2O[31]。
研究表明,菌株MP15可以经同化和反硝化作用,利用基础降解液中的NO2--N和NO3--N。在NDM(NO2--N作为唯一的氮源),菌株MP15的生长速度和生长量均低于其在HNM中的表现,其原因可能是基础降解液中大量的NO2--N诱导亚硝酸盐氧化酶的产生,导致很大一部分的NO2--N被氧化为NO3--N[52]。在NDM中,随着细菌的快速生长,基础降解液中的NO2--N浓度也随之降低,其对NO2--N的最大去除速率为1.74 mg NO2--N/(L·h)显著高于芽孢杆菌菌株LY(0.44 mg NO2--N/(L·h))[44]。此外,在实验的第10小时,基础降解液中检测到NO3--N的积累和TN的减少,由此可以推断菌株MP15具有一定反硝化性能。此外,将菌株MP15接种至DM(NO3--N作为唯一的氮源)中时,其同样具有高效的反硝化性能。特别是在实验的6~24 h内,检测到明显的NO3--N和TN浓度的降低,此时菌株MP15对NO3--N的最大去除速率为1.02 mg NO3--N/(L·h),高于芽孢杆菌N31(0.59 mg NO3--N/(L·h))[53]和芽孢杆菌菌株LY(0.35 mg NO3--N/(L·h))[44]。显然,菌株MP15对NO2--N的还原率高于其对NO3--N的还原速率,产生该现象的原因可能是由于NO2--N较低的氧化态,更利于细菌细胞的生长[54]。对菌株MP15亚硝酸盐还原酶(Nir)和硝酸盐还原酶(Nar)的测定结果也进一步证实了菌株的反硝化性能。菌株MP15粗酶液中的Nir酶比活性为0.157 8 U/mg,高于具有高效脱氮性能的雷氏普罗威登斯菌(Providencia rettgeri)菌株YL(0.041 U/mg)[55]。此外,菌株MP15具有高效的Nar活性,其酶比活力为0.160 9 U/mg,高于Diaphorobacter属菌株HPC 856(0.075 U/mg)[56]和蜡样芽胞杆菌(Bacillus cereus)GS5(0.043 U/mg)[29],其两者均具有高效的无机氮去除性能。通过15N同位素示踪,进一步验证了菌株MP15对NO2--N和NO3--N的代谢途径。在NDM中(以亚硝酸钠为唯一氮源)中检测到15N2O和15N2,进一步证实了菌株MP15具有同步硝化-反硝化性能。菌株MP15的亚硝酸盐代谢途径主要包括同化、硝化和反硝化,具体为NO3--N←NO2--N→N2O/N2。当硝酸盐作为唯一的氮源供应时,同样检测到15N2O和15N2的形成,进一步证明了菌株MP15对NO3--N的反硝化性能。菌株MP15对NO3--N的代谢途径主要包括同化和反硝化,其反硝化过程具体为NO3--N→NO2--N→N2O N2O/N2。
综合菌株M15在不同无机氮基础降解液中的脱氮特性、脱氮过程中的关键酶活性以及脱氮过程中的15N同位素示踪,菌株MP15具有高效的同步硝化-反硝化性能,其对无机氮的去除主要包括同化作用、硝化作用和反硝化作用。通过对异养硝化-好氧反硝化菌株MP15的脱氮特性和脱氮机制研究,将有助于其在生物脱氮和生物修复中的实践应用。
4 结语地衣芽孢杆菌菌株MP15具有高效的无机氮去除性能。当NH4Cl、NaNO2和NaNO3分别作为唯一氮源时,MP15对基础降解液中的NH4+-N、NO2--N和NO3--N的最高去除率分别为83.95%、95.21%和65.08%。此外,菌株MP15在脱氮过程中羟胺氧化还原酶、亚硝酸盐还原酶和硝酸盐还原酶均具有一定量的表达,其酶活力分别为0.034 2、0.001 0和0.010 2 U。15N标记的同位素示踪实验结果表明,菌株MP15可以通过硝化作用,将NH4+-N转化为15N2O。在去除NH4+-N的应用过程中,应注意控制曝气过程,以减少N2O排放量,降低其对环境的危害作用。菌株MP15可通过硝化或反硝化作用将NO2--N和NO3--N转化为15N2O和15N2。本研究表明,地衣芽孢杆菌菌株MP15对无机氮的代谢途径主要包括同化作用、硝化作用和反硝化作用,其在海水养殖氮污染处理中具有一定的应用价值。
| [1] |
Manju N J, Deepesh V, Achuthan C, et al. Immobilization of nitrifying bacterial consortia on wood particles for bioaugmenting nitrification in shrimp culture systems[J]. Aquaculture, 2009, 294(1-2): 65-75. DOI:10.1016/j.aquaculture.2009.05.008
(  0) 0) |
| [2] |
高存川, 张晓慧, 徐春厚, 等. 三株脱氮细菌脱氮特性的研究[J]. 广东畜牧兽医科技, 2012, 37(5): 25-28. Gao C C, Zhang X H, Xu C H, et al. Profiling the dcnitfiding characteristics of three dcnitrogcnation bacteria strains[J]. Guang Dong Journal of Animal and Veterinary Science, 2012, 37(5): 25-28. DOI:10.3969/j.issn.1005-8567.2012.05.012 (  0) 0) |
| [3] |
Joo H S, Hirai M, Shoda M. Characteristics of ammonium removal by heterotrophic nitrification-aerobic denitrification by Alcaligenes faecalis No. 4[J]. Journal of Bioscience & Bioengineering, 2005, 100(2): 184-191.
(  0) 0) |
| [4] |
Padhi S K, Tripathy S, Sen R, et al. Characterisation of heterotrophic nitrifying and aerobic denitrifying Klebsiella pneumoniae CF-S9 strain for bioremediation of wastewater[J]. International Biodeterioration & Biodegradation, 2013, 78: 67-73.
(  0) 0) |
| [5] |
Shoda M, Ishikawa Y. Heterotrophic nitrification and aerobic denitrification of high-strength ammonium in anaerobically digested sludge by Alcaligenes faecalis strain No. 4[J]. Journal of Bioscience and Bioengineering, 2014, 117(6): 737-741. DOI:10.1016/j.jbiosc.2013.11.018
(  0) 0) |
| [6] |
Zheng H, Liu Y, Sun G, et al. Denitrification characteristics of a marine origin psychrophilic aerobic denitrifying bacterium[J]. Journal of Environmental Sciences, 2011, 23(11): 1888-1893. DOI:10.1016/S1001-0742(10)60615-8
(  0) 0) |
| [7] |
Zheng H Y, Liu Y, Gao X Y, et al. Characterization of a marine origin aerobic nitrifying-denitrifying bacterium[J]. Journal of Bioscience and Bioengineering, 2012, 114(1): 33-37. DOI:10.1016/j.jbiosc.2012.02.025
(  0) 0) |
| [8] |
Kim J K, Park K J, Cho K S, et al. Aerobic nitrification-denitrification by heterotrophic Bacillus strains[J]. Bioresource Technology, 2005, 96(17): 1897-906.
(  0) 0) |
| [9] |
王业勤, 李勤生, 王若雪, 等. G1菌株人造生物膜异养硝化-好氧反硝化脱氮性能[J]. 净水技术, 2016, 35(A1): 118-121. Wang Y, Li Q, Wang R, et al. Simultaneous heterotrophic nitrification and aerobic denitrification by artificial biofilm with Bacillus sp. G1 strain[J]. Water Purification Technology, 2016, 35(A1): 118-121. (  0) 0) |
| [10] |
Yan L, He Y L, Kong H N, et al. Isolation of a new heterotrophic nitrifying Bacillus sp. strain[J]. Journal of Environmental Biology, 2006, 27(Suppl 2): 323-326. DOI:10.2112/04-0340.1
(  0) 0) |
| [11] |
Zhang Q L, Liu Y, Ai G M, et al. The characteristics of a novel heterotrophic nitrification-aerobic denitrification bacterium, Bacillus methylotrophicus strain L7[J]. Bioresource Technology, 2012, 108(3): 35-44.
(  0) 0) |
| [12] |
Silva L C F, Lima H S, Sartoratto A, et al. Effect of salinity in heterotrophic nitrification/aerobic denitrification performed by acclimated microbiota from oil-produced water biological treatment system[J]. International Biodeterioration&Biodegradation, 2018, 130: 1-7.
(  0) 0) |
| [13] |
Verstraete W, Alexander M. Heterotrophic nitrification by Arthrobacter sp.[J]. Journal of Bacteriology, 1972, 110(3): 955-961. DOI:10.1128/JB.110.3.955-961.1972
(  0) 0) |
| [14] |
Witzel K P, Overbeck H J. Heterotrophic nitrification by Arthrobacter sp. (strain 9006) as influenced by different cultural conditions, growth state and acetate metabolism[J]. Archives of Microbiology, 1979, 122(2): 137-143. DOI:10.1007/BF00411352
(  0) 0) |
| [15] |
Marazioti C, Kornaros M, Lyberatos G. Kinetic modeling of a mixed culture of Pseudomonas denitrificans and Bacillus subtilis under aerobic and anoxic operating conditions[J]. Water Research, 2003, 37(6): 1239-1251. DOI:10.1016/S0043-1354(02)00463-3
(  0) 0) |
| [16] |
Padhi S K, Tripathy S, Sen R, et al. Characterisation of heterotrophic nitrifying and aerobic denitrifying Klebsiella pneumoniae CF-S9 strain for bioremediation of wastewater[J]. International Biodeterioration & Biodegradation, 2013, 78(3): 67-73.
(  0) 0) |
| [17] |
Taylor S M, Yiliang H E, Zhao B, et al. Heterotrophic ammonium removal characteristics of an aerobic heterotrophic nitrifying-denitrifying bacterium, Providencia rettgeri YL[J]. Environment Science, 2009, 21(10): 1336-1341. DOI:10.1016/S1001-0742(08)62423-7
(  0) 0) |
| [18] |
Chen P, Li J, Li Q X, et al. Simultaneous heterotrophic nitrification and aerobic denitrification by bacterium Rhodococcus sp. CPZ24[J]. Bioresouresource Technology, 2012, 116: 266-270. DOI:10.1016/j.biortech.2012.02.050
(  0) 0) |
| [19] |
刘泽英, 吕永康, 刘玉香, 等. Acinetobacter sp. Y1的氨氮去除性能及其关键酶活性[J]. 微生物学通报, 2016, 43(9): 1931-1938. Liu Z Y, Lv Y K, Liu Y X, et al. Ammonia nitrogen removal characteristic and its key enzymes activity of Acinetobacter sp. Y1[J]. Microbiology, 2016, 43(9): 1931-1938. (  0) 0) |
| [20] |
Robertson L A, Kuenen J G. Heterotrophic nitrification in Thiosphaera pantotrophaoxygen uptake and enzyme studies[J]. Microbiology, 1988, 134(4): 857-863. DOI:10.1099/00221287-134-4-857
(  0) 0) |
| [21] |
Robertson L A, Kuenen J G. Aerobic denitrification: A controversy revived[J]. Archives of Microbiology, 1984, 139(4): 351-354. DOI:10.1007/BF00408378
(  0) 0) |
| [22] |
Su J J, Liu B Y, Liu C Y. Comparison of aerobic denitrification under high oxygen atmosphere by Thiosphaera pantotropha ATCC 35512 and Pseudomonas stutzeri SU2 newly isolated from the activated sludge of a piggery wastewater treatment system[J]. Journal of Applied Microbiology, 2001, 90(3): 457-462. DOI:10.1046/j.1365-2672.2001.01265.x
(  0) 0) |
| [23] |
Joo H S, Hirai M, Shoda M. Piggery wastewater treatment using Alcaligenes faecalis strain No. 4 with heterotrophic nitrification and aerobic denitrification[J]. Water Research, 2006, 40(16): 3029-3036. DOI:10.1016/j.watres.2006.06.021
(  0) 0) |
| [24] |
Kim M, Jeong S Y, Su J Y. Aerobic denitrification of Pseudomonas putida AD-21 at different C/N ratios[J]. Journal of Bioscience & Bioengineering, 2008, 106(5): 498-502.
(  0) 0) |
| [25] |
Zhao B, He Y L, Hughes J, et al. Heterotrophic nitrogen removal by a newly isolated Acinetobacter calcoaceticus HNR[J]. Bioresource Technology, 2010, 101(14): 5194-5200. DOI:10.1016/j.biortech.2010.02.043
(  0) 0) |
| [26] |
Yang X P, Wang S M, Zhang D W, et al. Isolation and nitrogen removal characteristics of an aerobic heterotrophic nitrifying-denitrifying bacterium, Bacillus subtilis A1[J]. Bioresource Technology, 2011, 102(2): 854-862. DOI:10.1016/j.biortech.2010.09.007
(  0) 0) |
| [27] |
Sun Z Y, Lv Y K, Liu Y X, et al. Removal of nitrogen by heterotrophic nitrification-aerobic denitrification of a novel metal resistant bacterium Cupriavidus sp. S1[J]. Bioresource Technology, 2016, 220: 142-150. DOI:10.1016/j.biortech.2016.07.110
(  0) 0) |
| [28] |
Padhi S K, Tripathy S, Mohanty S, et al. Aerobic and heterotrophic nitrogen removal by Enterobacter cloacae CF-S27 with efficient utilization of hydroxylamine[J]. Bioresource Technology, 2017, 232: 285-296. DOI:10.1016/j.biortech.2017.02.049
(  0) 0) |
| [29] |
Rout P R, Bhunia P, Dash R R. Simultaneous removal of nitrogen and phosphorous from domestic wastewater using Bacillus cereus GS-5 strain exhibiting heterotrophic nitrification, aerobic denitrification and denitrifying phosphorous removal[J]. Bioresource Technology, 2017, 244: 484-495. DOI:10.1016/j.biortech.2017.07.186
(  0) 0) |
| [30] |
Richardson D J, Wehrfritz J M, Keech A, et al. The diversity of redox proteins involved in bacterial heterotrophic nitrification and aerobic denitrification[J]. Biochemical Society Transactions, 1998, 26(3): 401-408. DOI:10.1042/bst0260401
(  0) 0) |
| [31] |
Robertson L A, Dalsgaard T, Revsbech N P, et al. Confirmation of 'aerobic denitrification' in batch cultures, using gas chromatography and 15N mass spectrometry[J]. Fems Microbiology Ecology, 1995, 18(2): 113-120. DOI:10.1111/j.1574-6941.1995.tb00168.x
(  0) 0) |
| [32] |
何环, 余萱, 韩亚涛, 等. 异养硝化好氧反硝化菌脱氮特性的研究进展[J]. 工业水处理, 2017, 37(4): 12-17. He H, Yu X, Han Y T, et al. Reserch progress in the denitrification characteristic of heterotrophic nitrification-aerobic denitrification bacteria[J]. Industrial Water Treament, 2017, 37(4): 12-17. (  0) 0) |
| [33] |
Ye J, Zhao B, An Q, et al. Nitrogen removal by Providencia rettgeri strain YL with heterotrophic nitrification and aerobic denitrification[J]. Environmental Technology, 2016, 37(17): 2206-2213. DOI:10.1080/09593330.2016.1146338
(  0) 0) |
| [34] |
Ai G M, Zheng H Y, Zhang M, et al. Isotopic confirmation of occurrence of microbial denitrification based on N2 and N2O production monitored by gas chromatography/isotope ratio mass spectrometry and gas chromatography/mass spectrometry[J]. Chinese Journal of Analytical Chemistry, 2011, 39(8): 1141-1146. DOI:10.1016/S1872-2040(10)60460-4
(  0) 0) |
| [35] |
赵坤, 田相利, 李咏梅, 等. 凡纳滨对虾养殖池塘高效脱氮芽孢杆菌的分离筛选及特性初步研究[J]. 中国海洋大学学报(自然科学版), 2020, 50(增Ⅰ): 17-29. Zhao K, Tian X L, Li Y M, et al. Isolation, screening and characterization of high efficiency nitrogen removal Bacillus from shrimp culture pond[J]. Perioducal of Ocean University of China, 2020, 50(Sup. Ⅰ): 17-29. (  0) 0) |
| [36] |
Patureau D, Bernet N, Bouchez T, et al. Biological nitrogen removal in a single aerobic reactor by association of a nitrifying ecosystem to an aerobic denitrifier, Microvirgula aerodenitrificans[J]. Journal of Molecular Catalysis B Enzymatic, 1998, 5(1-4): 435-439. DOI:10.1016/S1381-1177(98)00062-9
(  0) 0) |
| [37] |
Daims H, Lebedeva E V, Pjevac P, et al. Complete nitrification by Nitrospirabacteria[J]. Nature, 2015, 528(7583): 504-509. DOI:10.1038/nature16461
(  0) 0) |
| [38] |
Ge Q, Yue X, Wang G. Simultaneous heterotrophic nitrification and aerobic denitrification at high initial phenol concentration by isolated bacterium Diaphorobacter sp. PD-7[J]. Chinese Journal of Chemical Engineering, 2015, 23(5): 835-841.
(  0) 0) |
| [39] |
王瑶. 金属离子对粪产碱杆菌C16的脱氮和亚硝酸盐积累的影响[J]. 微生物学通报, 2014, 41(11): 2254-2263. Wang Y. Influence of metal ions on nitrogen removal and NO2--N accumulation by Alcaligenes faecalis C16[J]. Microbiology, 2014, 41(11): 2254-2263. (  0) 0) |
| [40] |
Lowery O H. Protein measurement with the Folin phenol reagent[J]. Jbiolchem, 1951, 193(1): 265.
(  0) 0) |
| [41] |
American Public Health Association. Standard Methods for the Examination of Water and Wastewater[M]. Washington DC, USA: [s.n.], 2012.
(  0) 0) |
| [42] |
卢光远, 宋秀贤, 俞志明. 利用分光光度法间接测定海水中的羟胺[J]. 海洋与湖沼, 2014, 45(5): 954-958. Lu G Y, Song X X, Yu Z M. Inderect determination of hydroxylamine in seawater in spectrophotometry[J]. Oceanologai et Limnologia Sinica, 2014, 45(5): 954-958. (  0) 0) |
| [43] |
Tavares P, Pereira A S, Moura J J, et al. Metalloenzymes of the denitrification pathway[J]. Journal of Inorganic Biochemistry, 2006, 100(12): 2087-2100. DOI:10.1016/j.jinorgbio.2006.09.003
(  0) 0) |
| [44] |
Zhao B, He Y L, Zhang X F. Nitrogen removal capability through simultaneous heterotrophic nitrification and aerobic denitrification by Bacillus sp. LY[J]. Environmental Technology, 2010, 31(4): 409-416. DOI:10.1080/09593330903508922
(  0) 0) |
| [45] |
Ravishankara A R, Daniel J S, Portmann R W. Nitrous oxide (N2O): The dominant ozone-depleting substance emitted in the 21st century[J]. Science, 2017, 326(5949): 123-125.
(  0) 0) |
| [46] |
Marques R, Rodriguez-Caballero A, Oehmen A, et al. Assessment of online monitoring strategies for measuring N2O emissions from full-scale wastewater treatment systems[J]. Water Research, 2016, 99: 171-179.
(  0) 0) |
| [47] |
Ahn J H, Kim S, Park H, et al. N2O emissions from activated sludge processes, 2008-2009: Results of a national monitoring survey in the United States[J]. Environmental Science and Technology, 2010, 44(12): 4505-4511.
(  0) 0) |
| [48] |
Foley J, De H D, Yuan Z, et al. Nitrous oxide generation in full-scale biological nutrient removal wastewater treatment plants[J]. Water Research, 2010, 44(3): 831-844.
(  0) 0) |
| [49] |
Kampschreur M J, Temmink H, Kleerebezem R, et al. Nitrous oxide emission during wastewater treatment[J]. Water Research, 2009, 43(17): 4093-4103.
(  0) 0) |
| [50] |
Desloover J, Vlaeminck S E, Clauwaert P, et al. Strategies to mitigate N2O emissions from biological nitrogen removal systems[J]. Current Opinion in Biotechnology, 2012, 23(3): 474-482. DOI:10.1016/j.copbio.2011.12.030
(  0) 0) |
| [51] |
Pellicer-NaCher C, Sun S, Lackner S, et al. Sequential aeration of membrane-aerated biofilm reactors for high-rate autotrophic nitrogen removal: Experimental demonstration[J]. Environmental Science&Technology, 2010, 44(19): 7628-7634.
(  0) 0) |
| [52] |
张培玉, 曲洋, 于德爽, 等. 菌株qy37的异养硝化/好氧反硝化机制比较及氨氮加速降解特性研究[J]. 环境科学, 2010, 31(8): 1819-1826. Zhang P Y, Qu Y, Yu D S, et al. Comparison of heterotrophic nitrification and aetobic denitrification system by strain qy37 and its acceierationg remaval characteristic of NH4+-N[J]. Chinese Journal of Environmental Science, 2010, 31(8): 1819-1826. (  0) 0) |
| [53] |
Huang F, Pan L, Lv N, et al. Characterization of novel Bacillus strain N31 from mariculture water capable of halophilic heterotrophic nitrification-aerobic denitrification[J]. Journal of Bioscience & Bioengineering, 2017, 124(5): 564-571.
(  0) 0) |
| [54] |
Yang L, Ren Y X, Liang X, et al. Nitrogen removal characteristics of a heterotrophic nitrifier Acinetobacter junii YB and its potential application for the treatment of high-strength nitrogenous wastewater[J]. Bioresource Technology, 2015, 193: 227-233. DOI:10.1016/j.biortech.2015.05.075
(  0) 0) |
| [55] |
Zhao B, He Y L, Huang J, et al. Heterotrophic nitrogen removal by Providencia rettgeri strain YL[J]. Journal of Industrial Microbiology & Biotechnology, 2010, 37(6): 609-616. DOI:10.1007/s10295-010-0708-7
(  0) 0) |
| [56] |
Khardenavis A A, Atya K, Purohit H J. Simultaneous nitrification and denitrification by diverse Diaphorobacter sp.[J]. Applied Microbiology & Biotechnology, 2007, 77(2): 403-409.
(  0) 0) |
2. Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China
 2020, Vol. 50
2020, Vol. 50


