2. 中国水产科学研究院黄海水产研究所, 山东 青岛 266071
反硝化是氮循环中的重要环节,也是一种重要的脱氮方式,指硝酸盐在微生物的作用下相继被还原为NO2-、NO、N2O、N2的过程[1],实现了土壤、水域中的氮元素向大气中的转移。传统理论认为反硝化是严格厌氧的过程,O2会抑制反硝化还原酶基因的表达和反硝化还原酶的活性[1],此外,在有机物氧化的过程中,O2一般认为是首选的电子受体[2],在有氧条件下反硝化菌会优先利用溶解氧进行呼吸,这样就阻止了NO3-、NO2-作为最终电子受体[3]。20世纪80年代,Robertson和Kuenen首次发现了一种可以在有氧状态下进行反硝化的细菌Thiosphaera pantotropha(现更名为脱氮副球菌Paracoccus denitrification[4]),并将此现象命名为好氧反硝化[5]。此后,许多学者报道了好氧反硝化方面的研究[6-9]。Huang[10]和Chen[11]等学者的研究表明在氧气和硝酸盐都存在的情况下,电子可同时流向二者,在DO浓度比较低时,提高DO会显著提升电子流向氧气的比例,DO超过一定阈值后电子在氧气和硝酸盐间的分配趋于稳定[11],由于反硝化细菌的不同及环境条件的差异,脱氮效率会有不同水平的呈现[12]。
脱氮技术是水质净化、污水处理的重要手段,其中生物脱氮技术因不需要后续处理、无副产物产生而成为最经济的脱氮方法[13]。生物脱氮技术有着广泛的应用,其在循环水养殖系统中对于水质的控制发挥着重要作用,其中氨氮和亚硝酸盐因对养殖生物具有毒性而受到严格控制,一般是利用生物滤池中硝化细菌的硝化作用将氨氮和亚硝酸盐转化为低毒性的硝酸盐,但硝酸盐的持续积累最终也会导致系统的崩溃,所以将硝酸盐通过反硝化作用转化为气态氮,完成氮元素由水域向大气的转移仍然是必要的过程。循环水养殖系统内需要高溶氧以确保其高密度养殖的需求,而传统的反硝化过程是在厌氧的环境下进行的[1],这与循环水养殖的要求相矛盾,需要额外增加水处理环节以实现厌氧反硝化。厌氧反硝化会增加养殖成本、限制循环水养殖系统的生产,所以好氧反硝化的发现从根本上解决了这一矛盾。针对循环水养殖的特点开展好氧反硝化的相关研究,对于循环水养殖系统的脱氮、维持良好的水质状态具有重要意义。
生物滤池具有十分复杂的生态结构,在实现循环水养殖系统脱氮、控制养殖系统水质方面起着至关重要的作用。本研究尝试从循环水养殖系统中的生物滤池内分离好氧反硝化细菌,开展相关研究,并在此基础上进行好氧反硝化反应器的应用研究,以期为循环水养殖系统的脱氮技术工艺提供参考。
1 材料与方法 1.1 细菌分离 1.1.1 样品来源莱州明波公司珍珠龙胆(♀Epinephelus fuscoguttatus ×♂ Epinephelus lanceolatu)循环水养殖系统内的生物滤池。
1.1.2 培养基及试剂反硝化富集培养基[14]:牛肉膏3.0 g,蛋白胨5.0 g,KNO31.0 g,人工海水(30 ‰的NaCl溶液)1 000 mL,pH≈7.4。
溴百里酚蓝(BTB)分离培养基[15]:KNO3 1.0 g,C6H5Na3O2·2H2O 1.0 g,KH2PO4 1.0 g,FeSO4·7H2O 0.05 g,CaCl2 0.2 g,MgSO4·7H2O 1.0 g,溴百里酚蓝(1 %溶于酒精)1 mL,琼脂20.0 g,人工海水1 000 mL,pH=7.2。
活化培养基:KNO3 1.0 g,C6H5Na3O2·2H2O 1.0 g,KH2PO4 1.0 g,FeSO4·7H2O 0.05 g,CaCl2 0.2 g,MgSO4·7H2O 1.0 g,人工海水1 000 mL,pH≈7.4。
反硝化性能测定培养基(DM):C6H5Na3O2·2H2O 1.31 g,CH3COONa 1.10 g,KNO3 0.361 g,MgSO4·7H2O 0.2 g,KH2PO4 1.0 g,K2HPO4 5.0 g,NaCl 0.5 g,微量元素溶液1 mL,人工海水999 mL,pH≈7.4。
微量元素溶液[16]:EDTA 50.0 g,ZnSO4 2.2 g,CaCl2 5.5 g,MnCl2·4H2O 5.06 g,FeSO4·7H2O 5.0 g,(NH4)6Mo7O2·4H2O 1.1 g,CuSO4·5H2O 1.57 g,CoCl2·6H2O 1.61 g,去离子水1 L,pH= 7.0。
各培养基用前都在121 ℃条件下灭菌20 min。
1.1.3 细菌富集将从生物滤池中获取的滤料在无菌环境下剪碎后放入装有90 mL无菌人工海水的三角瓶中,在摇床200 r/min条件下震荡3 h。随后取上清液10 mL接种到90 mL富集培养基中,并于30 ℃、转速150 r/min条件下培养,每隔12 h分别用二苯胺试剂和格里斯试剂定性检验硝酸盐和亚硝酸盐含量,当硝酸盐明显降低且有亚硝酸盐产生时富集下一代。如此重复富集3次获得四代富集培养液。
1.1.4 细菌分离纯化及鉴定用无菌人工海水将四代富集培养液稀释成10-1、10-2、10-3、10-4、10-5、10-6、10-7和10-88个梯度,分别移取0.1 mL稀释液在BTB平板上稀释涂布,每个梯度做2个平行,之后在30 ℃恒温箱中培养2~3 d,待菌落长出后,选取变蓝的平板并挑取带蓝色晕圈的单菌落再次划线(每代皆做2个平行),如此纯化3次获得四代纯化菌落。将菌落一致、生长良好的平板上的菌株接种到斜面培养基上,4 ℃保藏。
提取菌株DNA进行16S rDNA序列分析,将测序结果与Genbank数据库进行Blast分析确定菌株种类。
1.2 反硝化性能测定用接种环从斜面培养基上刮取适量细菌接种到装有100 mL活化培养基的三角瓶内,30 ℃、180 r/min条件下活化2天。移取2 mL活化培养液接种到100 mL反硝化测定培养基中,30 ℃、180 r/min条件下培养,分别测定其48 h后的硝酸盐、亚硝酸盐、氨氮的浓度变化。
1.3 反硝化反应器的运行与控制 1.3.1 实验装置如图 1所示,人工污水通过蠕动泵以恒定流速(12.22 mL/min)由反应器底部入水口输送进反应器,然后从反应器上部出水口流出,进入废液缸,不再利用。反应器内填充190 g K1滤料,滤料为直径1 cm、高1 cm的内十字圆筒结构,外壁附有纵向突起条带;滤料密度约为0.96 g/cm3(堆积密度150 kg/m3),比表面积约850 m2/m3。反应器有效水容积为2.2 L,水力停留时间(HRT)为3 h。反应器浸入配有加热棒的水槽中施行水浴控温(水槽内持续充气搅拌以实现均匀加热),温度控制在(25+1)℃;反应器外壁贴有黑色壁纸以避光;24 h充气。
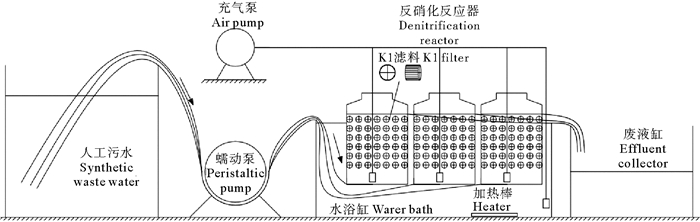
|
图 1 实验装置图 Fig. 1 The figure of experimental apparatus |
采用青岛近海海水配制(每天配制一次),NO3--N浓度约50 mg/L,C/N约为6,各成分配比如下:CH3COONa 0.878 7 g/L,KNO3 0.361 g/L,KH2PO4 0.0255 g/L,K2HPO4·3H2O 0.0427 g/L,微量元素溶液1 mL/L,pH≈7.3。
1.3.3 接种将分离、筛选的菌株分别在25 ℃、180 r/min条件下单独活化2天。移取每种菌的活化培养液(约3×1010CFU/mL)10 mL到装有2.2 L人工污水的反硝化反应器中混合接种,24 h充气,蠕动泵不启动,稳定2天。
1.3.4 水质监测在接种后的48 h中,每隔12 h对反应器内的水质进行取样分析,检测硝酸盐、亚硝酸盐、氨氮、总氮的浓度变化。接种2天后开启蠕动泵,每天从反应器的进出水口取样分析,检测上述4个指标的变化,直至出水口水质达到稳定。
1.4 水质分析方法氨氮检测方法为次溴酸盐氧化分光光度法,亚硝酸盐的检测方法为N-(1-萘基)-乙二胺分光光度法,硝酸盐检测方法为锌镉还原法,总氮检测方法为过硫酸钾氧化-紫外分光光度法。
2 结果与分析 2.1 细菌分离细菌富集阶段,经二苯胺和格里斯试剂定性检测,12 h后即有亚硝酸盐的产生,24 h后硝酸盐的含量明显降低。48 h后进行下一代富集。涂布平板后,10-3、10-4和10-53个稀释度平板上的菌落有利于单菌落的挑取,选取此3个稀释度平板进行下一代的纯化;重复划线,获得四代纯化菌株。最终分离出8株细菌,分别命名为Z1~Z8。
结合细菌反硝化性能测定结果,选择Z1、Z8 2株脱氮效果较好的细菌进行16S rDNA鉴定,结果显示Z1、Z8分别与弧菌属(Vibrio)的V. neocaledonicus和V. azureus相似度最高,同源性均达99%以上(Genbank序列登录号分别为KX037098、KX037099)。
2.2 细菌反硝化性能测定反硝化性能测定培养基NO2--N、NH4+-N和NO3--N初始浓度经测定分别为0、0.023和64.95 mg/L。对分离出的8株细菌进行反硝化性能测定,48 h后测定亚硝酸盐、氨氮、硝酸盐的浓度,计算硝酸盐的去除率,并用亚硝氮、氨氮、硝氮的浓度之和计算无机氮的去除情况,结果见图 2。
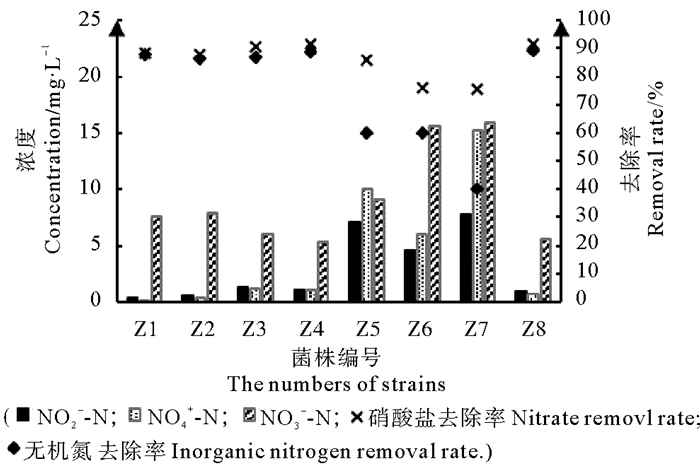
|
图 2 48 h反硝化性能测定结果 Fig. 2 The results of 48h denitrification test |
图 2显示,各菌株硝酸盐去除率都较高,但都存在一定的亚硝酸盐和氨氮积累。Z1、Z2、Z3、Z4、Z8菌株亚硝酸盐、氨氮积累较少,硝酸盐去除率90%左右、无机氮去除率87 %左右,效果良好;Z5、Z6、Z7亚硝酸盐、氨氮积累比较严重,且硝酸盐和无机氮去除率相对较低。
2.3 反硝化反应器的脱氮效果 2.3.1 接种后48 h反应器内水质变化将分离、筛选菌株Z1、Z8各自活化后混合接种入反应器。反应器接种后保持24 h充气,每隔12 h对反应器内污水进行取样分析,检测硝酸盐、亚硝酸盐、氨氮和总氮的变化,结果如图 3所示,相应硝酸盐和总氮的去除率见图 4。
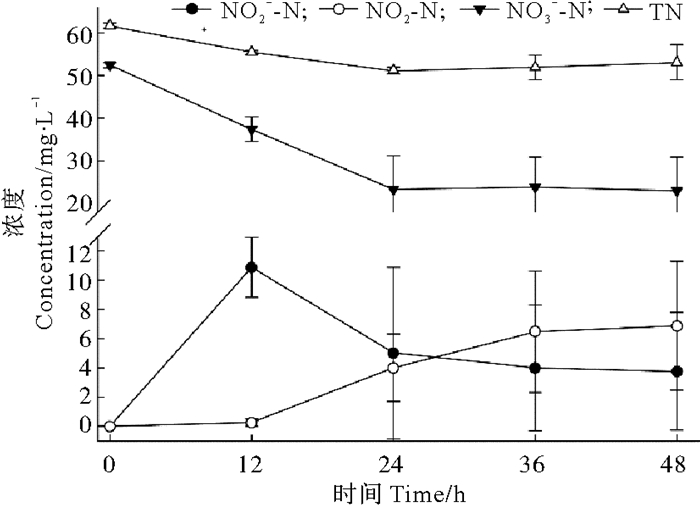
|
图 3 反应器接种后48 h内水质变化 Fig. 3 The changes of water quality in the bioreactor during the 48 h after inoculation |
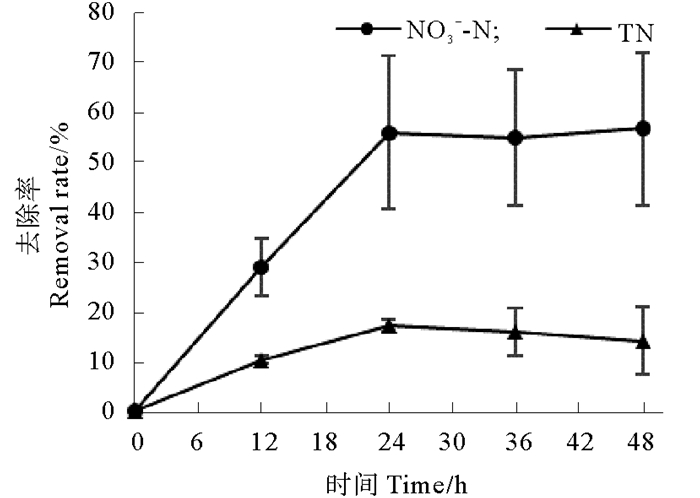
|
图 4 反应器接种后48 h内硝酸盐和总氮去除率变化 Fig. 4 The changes of nitrate and total nitrogen removal rates in the bioreactor during the 48 h after inoculation |
由图 3和4可知,48 h内硝酸盐的浓度大幅降低,最终去除率为56.26 %,但从误差线幅度可知,3个反应器之间差异较大;总氮去除效果微弱,48 h总氮去除率13.98 %;亚硝酸盐存在显著积累现象,且积累速率较快,12 h达到峰值(10.88 mg/L)后开始缓慢降低,并有趋于稳定的趋势;氨氮也存在积累现象,最终浓度达到6.87 mg/L。
2.3.2 系统运行后的水质检测结果接种2天后开启蠕动泵,从第二天开始每天检测反应器进、出水口水质变化。人工污水因添加了碳源,在室内放置期间会受到自然环境中微生物的作用而引起水质指标的变化,为降低因此导致的水质波动,人工污水每天配制一次,并且每天清洗人工污水容器。实验期间反应器进水口NO3--N、NO2--N、NH4+-N和TN的浓度变化分别为51.28±1.378、0.01±0.017、0.12±0.064和(58.60±1.403)mg/L。实验期间反应器进、出水口水质指标如图 5~8所示,图 9为相应硝酸盐和总氮的去除率。
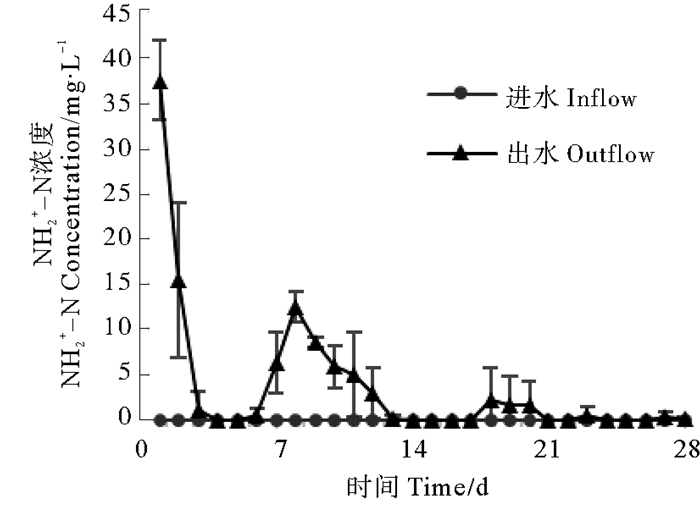
|
图 5 生物反应器进出水口亚硝酸盐变化 Fig. 5 Nitrite concentrations change of inlet and outlet water from the bioreactor |
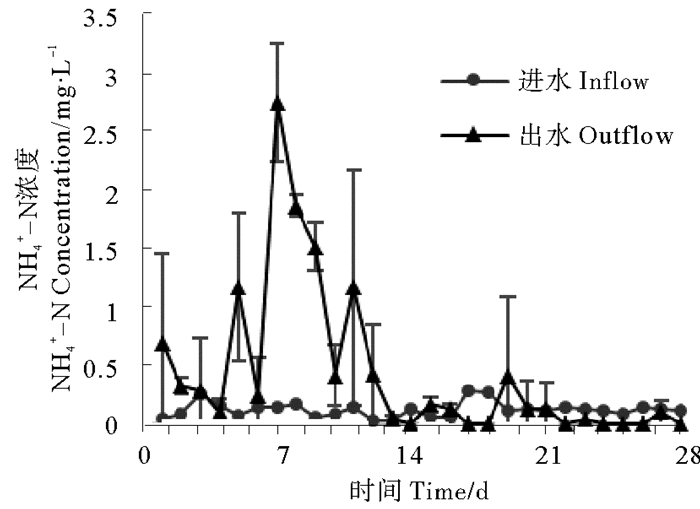
|
图 6 生物反应器进出水口氨氮变化 Fig. 6 Ammonia concentrations change of inlet and outlet water from the bioreactor |
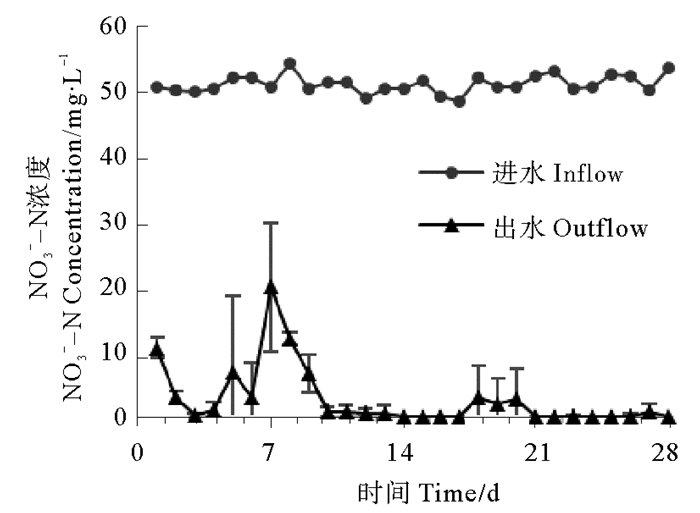
|
图 7 生物反应器进出水口硝酸盐变化 Fig. 7 Nitrate concentrations change of inlet and outlet water from the bioreactor |
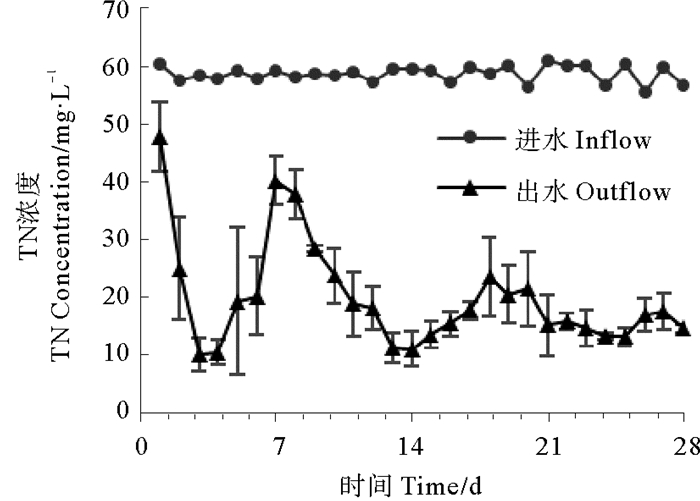
|
图 8 生物反应器进出水口总氮变化 Fig. 8 Total nitrogen concentrations change of inlet and outlet water from the bioreactor |
|
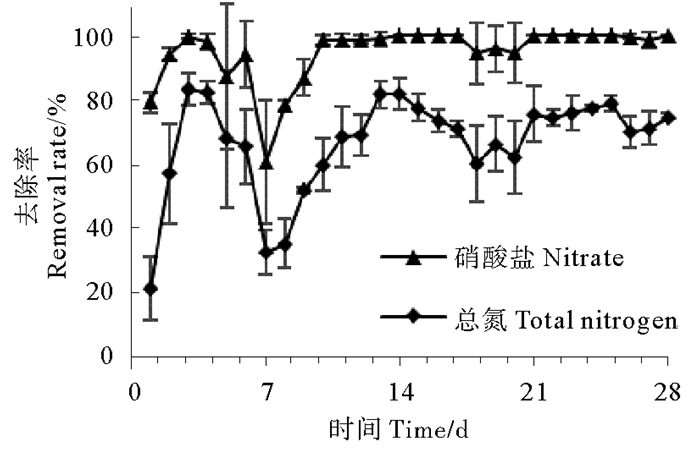
图 9 生物反应器对硝酸盐和总氮的去除率 Fig. 9 Nitrate and total nitrogen removal rates of the bioreactor |
系统启动一天后,亚硝酸盐积累十分严重,达到37.41 mg/L,说明反硝化过程的的第一阶段十分活跃,大量硝酸盐被还原为亚硝酸盐;之后亚硝酸盐浓度迅速降低,最低浓度为0 mg/L(第14天),在经历2次波动之后,逐渐趋于稳定,实验结束时亚硝酸盐浓度为0.18 mg/L。与反应器接种后48h相比,系统启动后氨氮积累情况大幅减弱,第一天氨氮浓度为0.69 mg/L,之后出现多次波动,第7天达到峰值2.75 mg/L,最低浓度为0.04 mg/L(第13天),20 d后逐渐趋于稳定,实验结束时氨氮浓度为0 mg/L。反应器对硝酸盐的去除效率非常高,系统启动后第一天去除率即达到79.04 %,此后历经几次起伏;9天后达到理想状态,除第18~20天去除率在95 %左右,其它时间硝酸盐去除率都在98 %以上。总氮在系统启动初去除效果较弱,第一天去除率只有20.94 %,此后迅速提升,第3天即达到去除率峰值83.17 %,此后历经多次波动,慢慢趋于稳定,实验结束时总氮去除率为74.40 %。总体来看,反硝化反应器对人工污水的脱氮效果良好,硝酸盐及总氮去除效果理想,氨氮和亚硝酸盐积累情况在后期稳定后较弱,具有一定的应用价值。
3 讨论好氧反硝化细菌的筛选方法分为3种[3]:一是间歇曝气法,利用好氧反硝化细菌可以同时利用O2和NO3-的特点,频繁转换富氧、缺氧条件使好氧反硝化细菌取得竞争优势,马放等即采用此种方法[17];二是使用选择性培养基或呼吸抑制剂,根据好氧反硝化细菌对培养条件的特殊要求制作选择培养基以抑制其它细菌的生长,如Meiberg[18]、孔庆鑫[19]等的做法;三是使用酸碱指示剂,即用溴百里酚蓝(BTB)来制作培养基,筛选因反硝化消耗亚硝酸盐或硝酸盐而显蓝色的菌落,如Takaya[15]等学者的做法。本文采用第三种方法筛选好氧反硝化细菌,这也是该领域当下使用较多的一种方法。
Vibrio neocaledonicus、Vibrio azureus都属于变形菌门(Proteobacteria)伽马变形菌纲(r-Proteobacteria)弧菌目(Vibrionales)弧菌科(Vibrionaceae)弧菌属(Vibrio);Vibrio neocaledonicus是Chalkiadakis[20]等学者于2013年发现的一株细菌,具有将硝酸盐转化为亚硝酸盐的代谢特性;Vibrio azureus是Yoshizawa等学者[21]2009年发现的一株细菌,同样具有将硝酸盐转化为亚硝酸盐的能力。好氧反硝化细菌一般存在于假单胞菌属(Pseudomonas);产碱杆菌属(Alcaligenes);副球菌属(Paracoccus);芽孢杆菌属(Bacillus)等[3],但弧菌属好氧反硝化细菌鲜有报道。
从分离出的8株菌的反硝化性能测定结果来看,各株菌都可大幅(70%以上)去除硝酸盐,但同时存在不同程度上的氨氮和亚硝酸盐的积累现象。关于亚硝酸盐的积累,一种解释认为与亚硝酸盐相比,硝酸盐作为电子受体时基质释放的能量较高,因此微生物优先利用硝酸盐作为反硝化作用的电子受体,导致亚硝酸盐浓度升高;另一解释认为硝酸盐还原酶的合成要早于亚硝酸盐还原酶,因而导致亚硝酸盐因转化延时而积累[22]。Körner等学者则指出,在任何条件下亚硝酸盐还原酶对氧气都是最敏感的[23],这也可能是在富氧条件下亚硝酸盐积累的又一原因。上述一系列的影响因素使得硝酸盐还原到亚硝酸盐的速率大于亚硝酸盐还原到氮气的速率,导致亚硝酸盐的积累[24]。硝酸盐的还原方式存在2种,一种是反硝化,NO3-—NO2-—NO—N2O—N2,另一种是硝酸盐异化还原成铵(DNRA),NO3-—NO2-—NH4+[25]。过去认为硝酸盐异化还原成铵是厌氧过程[26-28],后来发现DNRA在富氧条件下也能发生[29-30]。反硝化和DNRA的第一步都是硝酸盐在硝酸盐还原酶(Nar)的作用下还原为亚硝酸盐,但在下一环节亚硝酸盐的还原上出现了差异,问题在于二者的亚硝酸盐还原酶(Nir)的显著区别:反硝化的Nir分为含铜的(Cu-dNir)以及含c-型和d-型细胞色素的(cd1-dNir);DNRA过程的Nir则分为溶解性酶和胞围酶两类[31-33]。无论是富氧环境还是缺氧环境,反硝化和硝酸盐异化还原成铵是两个同时存在又相互竞争的过程[34],由此解释了反硝化性能测定过程中氨氮的积累现象。DNRA有利于土壤中氮素的保持[35],但在水产养殖领域,氨氮是有害的,传统生物滤池即通过硝化作用实现氨氮的转化,若DNRA过程太强、氨氮积累过多则硝酸盐的还原就失去意义。硝酸盐异化还原成铵无法避免,而且受多种因素的交互影响[33],如何通过条件调控来促进反硝化同时抑制DNRA亟待研究。
在反应器接种后2天的稳定期内,硝酸盐的去除效果明显,总氮去除率较低,氨氮、亚硝酸盐积累明显。但系统运转后发生显著改变,硝酸盐迅速降低,第一天硝酸盐去除率79.04%,之后大多数时间维持在99%以上;总氮去除情况波动较大,随着实验的进行逐渐平稳,13天后去除率维持在73%左右;氨氮积累现象在实验期间逐渐减弱;亚硝酸盐积累现象在系统启动之初与接种后2天相比更加剧烈,这可能是由于大多数反硝化微生物都能将硝酸盐还原为亚硝酸盐,而还原亚硝酸盐和一氧化二氮的微生物相对较少[33],使得这一阶段硝酸盐还原酶活性较强,而亚硝酸盐还原酶不足导致的,随着实验的进行,亚硝酸盐的积累现象逐渐减弱。根据反应器的脱氮效果及滤料规格推算,整个实验期间反应器硝酸盐去除效率约为0.794 g NO3--N /(m2·d),总氮去除效率约为0.636 g TN /(m2·d);反应器稳定后,即系统启动2周后,反应器硝酸盐去除效率约为0.827 g NO3--N /(m2·d),总氮去除效率约为0.687 g TN /(m2·d)。反应器接种后的稳定速度较快,可以迅速的发挥作用,且亚硝酸盐、氨氮积累现象在稳定后变得微弱,脱氮效果良好。氨氮、亚硝酸盐积累情况与菌株反硝化性能测定的结果有较大差异,分析原因可能有三方面:一是反硝化性能测定培养基组成结构太简单且测定时间较短,限制了反硝化过程的进行;二是反应器中接种的2种细菌之间可能存在协同作用,促进了脱氮过程;三是自然环境中的细菌在反应器内挂膜,促进了脱氮过程。
实验期间生物反应器出水口水质出现多次波动,而且从对应时间的误差线幅度也可以看出3个反应器在波动期会出现较大差异。反硝化细菌属于异养微生物,而人工污水C/N较高,营养物质丰富,利于微生物的繁殖;另一方面,反应器直接暴露在室内,自然环境中的微生物也会在其中大量繁殖,使得反应器内的群落结构变得十分复杂,再加上反应器容积太小,很容易受到外界环境的影响。实验期间观察到反应器内滤料表面生物膜逐渐增多,后期滤料表面附着了大量生物膜,微生物生命周期短,大量死亡后可能导致水质恶化,引起水质波动。
4 结语本文通过BTB培养基分离出8株细菌,皆可高效去除硝酸盐,但存在不同程度的氨氮和亚硝酸盐的积累。选择Z1、Z8两株脱氮效果较好的菌株进行好氧反硝化反应器的试验,接种后反应器反应迅速、高效,接种2周后即达到相对稳定的高效脱氮状态。反应器启动2周后,硝酸盐去除率超过98.8 %(约0.827 g NO3--N /(m2·d)),总氮去除率超过71.8 %(约0.687 g TN /(m2·d)),亚硝酸盐和氨氮积累微弱,脱氮效果良好,具有一定的应用价值。
| [1] |
Ferguson S J. Denitrification and its control[J]. Antonie van Leeuwenhoek, 1994, 66(1-3): 89-110. DOI:10.1007/BF00871634
(  0) 0) |
| [2] |
Frette L, Gejlsbjerg B, Westermann P. Aerobic denitrifiers isolated from an alternating activated sludge system[J]. FEMS Microbiology Ecology, 1997, 24(4): 363-370. DOI:10.1111/j.1574-6941.1997.tb00453.x
(  0) 0) |
| [3] |
王薇, 蔡祖聪, 钟文辉, 等. 好氧反硝化菌的研究进展[J]. 应用生态学报, 2008, 18(11): 2618-2625. Wang W, Cai Z C, Zhong W H, et al. Research advances in aerobic denitrifiers[J]. Chinese Journal of Applied Ecology, 2008, 18(11): 2618-2625. (  0) 0) |
| [4] |
Lukow T, Diekmann H. Aerobic denitrification by a newly isolated heterotrophic bacterium strain TL1[J]. Biotechnology Letters, 1997, 19(11): 1157-1159. DOI:10.1023/A:1018465232392
(  0) 0) |
| [5] |
Robertson L A, Kuenen J G. Aerobic denitrification: A controversy revived[J]. Archives of Microbiology, 1984, 139(4): 351-354. DOI:10.1007/BF00408378
(  0) 0) |
| [6] |
Chen F, Xia Q, Ju L K. Aerobic denitrification of Pseudomonas aeruginosa monitored by online NAD (P) H fluorescence[J]. Applied and Environmental Microbiology, 2003, 69(11): 6715-6722. DOI:10.1128/AEM.69.11.6715-6722.2003
(  0) 0) |
| [7] |
Kim M, Jeong S Y, Yoon S J, et al. Aerobic denitrification of Pseudomonas putida AD-21 at different C/N ratios[J]. Journal of Bioscience and Bioengineering, 2008, 106(5): 498-502. DOI:10.1263/jbb.106.498
(  0) 0) |
| [8] |
Wang P, Yuan Y, Li Q, et al. Isolation and immobilization of new aerobic denitrifying bacteria[J]. International Biodeterioration and Biodegradation, 2013, 76: 12-17. DOI:10.1016/j.ibiod.2012.06.008
(  0) 0) |
| [9] |
Ji B, Wang H, Yang K. Nitrate and COD removal in an upflow biofilter under an aerobic atmosphere[J]. Bioresource Technology, 2014, 158: 156-160. DOI:10.1016/j.biortech.2014.02.025
(  0) 0) |
| [10] |
Huang H K, Tseng S K. Nitrate reduction by Citrobacter diversus under aerobic environment[J]. Applied Microbiology and Biotechnology, 2001, 55(1): 90-94. DOI:10.1007/s002530000363
(  0) 0) |
| [11] |
Chen F, Xia Q, Ju L K. Competition between oxygen and nitrate respirations in continuous culture of Pseudomonas aeruginosa performing aerobic denitrification[J]. Biotechnology and Bioengineering, 2006, 93(6): 1069-1078. DOI:10.1002/(ISSN)1097-0290
(  0) 0) |
| [12] |
郭焱, 张召基, 陈少华. 好氧反硝化微生物学机理与应用研究进展[J]. 微生物学通报, 2016, 43(11): 2480-2487. Guo Y, Zhang Z, Chen S. Microbiology and potential application of aerobic denitrification: A review[J]. Microbiology China, 2016, 43(11): 2480-2487. (  0) 0) |
| [13] |
Liu Y, Gan L, Chen Z, et al. Removal of nitrate using Paracoccus sp. YF1 immobilized on bamboo carbon[J]. Journal of Hazardous Materials, 2012, 229: 419-425.
(  0) 0) |
| [14] |
马放, 任南琪, 杨基先. 污染控制微生物学实验[M]. 哈尔滨: 哈尔滨工业大学出版社, 2002. Ma F, Ren N Q, Yang J X. Microbiology Experiment of Pollution Control[M]. Harbin: Harbin Institute of Technology Press, 2002. (  0) 0) |
| [15] |
Takaya N, Catalan-Sakairi M A B, Sakaguchi Y, et al. Aerobic denitrifying bacteria that produce low levels of nitrous oxide[J]. Applied and Environmental Microbiology, 2003, 69(6): 3152-3157. DOI:10.1128/AEM.69.6.3152-3157.2003
(  0) 0) |
| [16] |
Zheng H Y, Liu Y, Gao X Y, et al. Characterization of a marine origin aerobic nitrifying-denitrifying bacterium[J]. Journal of Bioscience and Bioengineering, 2012, 114(1): 33-37. DOI:10.1016/j.jbiosc.2012.02.025
(  0) 0) |
| [17] |
马放, 王弘宇, 周丹丹. 活性污泥体系中好氧反硝化菌的选择与富集[J]. 湖南科技大学学报(自然科学版), 2005, 20(2): 80-83. Ma F, Wang H Y, Zhou D D. Selection and enrichment of aerobic denitrifier in activated sludge system[J]. Journal of Hunan University of Science and Technology (Natural Science Edition), 2005, 20(2): 80-83. (  0) 0) |
| [18] |
Meiberg J B M, Bruinenberg P M, Harder W. Effect of dissolved oxygen tension on the metabolism of methylated amines in Hyphomicrobium X in the absence and presence of nitrate: Evidence for 'aerobic' denitrification[J]. Journal of General Microbiology, 1980, 120(2): 453-463.
(  0) 0) |
| [19] |
Kong Q X, Li J W, Wang X W, et al. A new screening method for aerobic denitrification bacteria and isolation of a novel strain[J]. Chin J Appl Environ Biol, 2005, 11(2): 222-225.
(  0) 0) |
| [20] |
Chalkiadakis E, Dufourcq R, Schmitt S, et al. Partial characterization of an exopolysaccharide secreted by a marine bacterium, Vibrio neocaledonicus sp. nov., from New Caledonia[J]. Journal of Applied Microbiology, 2013, 114(6): 1702-1712. DOI:10.1111/jam.2013.114.issue-6
(  0) 0) |
| [21] |
Yoshizawa S, Wada M, Kita-Tsukamoto K, et al. Vibrio azureus sp. nov., a luminous marine bacterium isolated from seawater[J]. International Journal of Systematic and Evolutionary Microbiology, 2009, 59(7): 1645-1649. DOI:10.1099/ijs.0.004283-0
(  0) 0) |
| [22] |
Kucera I, Matyasek R. Aerobic adaptation of Paracoccus denitrificans: Sequential formation of denitrification pathway and changes in continuous culture of Pseudomonas stutter[J]. Appl Environ Microbiol, 1989, 55: 1670-1676.
(  0) 0) |
| [23] |
Körner H, Zumft W G. Expression of denitrification enzymes in response to the dissolved oxygen level and respiratory substrate in continuous culture of Pseudomonas stutzeri[J]. Applied and Environmental Microbiology, 1989, 55(7): 1670-1676.
(  0) 0) |
| [24] |
付昆明, 曹相生, 孟雪征, 等. 污水反硝化过程中亚硝酸盐的积累规律[J]. 环境科学, 2011, 32(6): 1660-1664. Fu M, Cao X, Meng X, et al. Characteristics of nitrite accumulation during wastewater denitrification[J]. Environmental Science, 2011, 32(6): 1660-1664. (  0) 0) |
| [25] |
Simon J. Enzymology and bioenergetics of respiratory nitrite ammonification[J]. FEMS Microbiology Reviews, 2002, 26(3): 285-309. DOI:10.1111/j.1574-6976.2002.tb00616.x
(  0) 0) |
| [26] |
Bonin P, Omnes P, Chalamet A. Simultaneous occurrence of denitrification and nitrate ammonification in sediments of the French Mediterranean Coast[J]. Hydrobiologia, 1998, 389(1-3): 169-182.
(  0) 0) |
| [27] |
Kelso B, Smith R V, Laughlin R J, et al. Dissimilatory nitrate reduction in anaerobic sediments leading to river nitrite accumulation[J]. Applied and Environmental Microbiology, 1997, 63(12): 4679-4685.
(  0) 0) |
| [28] |
Yin S X, Chen D, Chen L M, et al. Dissimilatory nitrate reduction to ammonium and responsible microorganisms in two Chinese and Australian paddy soils[J]. Soil Biology and Biochemistry, 2002, 34(8): 1131-1137. DOI:10.1016/S0038-0717(02)00049-4
(  0) 0) |
| [29] |
Fazzolari é, Nicolardot B, Germon J C. Simultaneous effects of increasing levels of glucose and oxygen partial pressures on denitrification and dissimilatory nitrate reduction to ammonium in repacked soil cores[J]. European Journal of Soil Biology, 1998, 34(1): 47-52. DOI:10.1016/S1164-5563(99)80006-5
(  0) 0) |
| [30] |
Polcyn W, Luciński R. Aerobic and anaerobic nitrate and nitrite reduction in free-living cells of Bradyrhizobium sp. (Lupinus)[J]. FEMS Microbiology Letters, 2003, 226(2): 331-337. DOI:10.1016/S0378-1097(03)00620-7
(  0) 0) |
| [31] |
殷士学. 淹水土壤中硝态氮异化还原成铵过程的研究[D]. 南京: 南京农业大学, 2000. Yin S. Dissimilatory Nitrate Reduction to Ammonium in Submerged Soils[D]. Nanjing: Nanjing Agricultural University, 2000. http://cdmd.cnki.com.cn/Article/CDMD-10307-2000005070.htm (  0) 0) |
| [32] |
陈丽敏. 淹水土壤中反硝化菌和硝酸还原菌数量、生理类群及其还原特点的研究[D]. 江苏: 扬州大学, 2001. Chen L. Study on the Pulation, Physiological Groups and Reduction Characteristics of Denitrification Bacteria and Nitrate Reducing Bacteria in Submerged Soil[D]. Jiangsu: Yangzhou University, 2001. http://cdmd.cnki.com.cn/Article/CDMD-11117-2001005276.htm (  0) 0) |
| [33] |
杨杉, 吴胜军, 蔡延江, 等. 硝态氮异化还原机制及其主导因素研究进展[J]. 生态学报, 2016, 36(5): 1224-1232. Yang S, Wu S, Cai Y, et al. The synergetic and competitive mechanism and the dominant factors of dissimilatory nitrate reduction processes: A review[J]. Acta Ecologica Sinica, 2016, 36(5): 1224-1232. (  0) 0) |
| [34] |
韦宗敏, 黄少斌, 蒋然. 碳源对微生物硝酸盐异化还原成铵过程的影响[J]. 工业安全与环保, 2013, 38(9): 4-7. Wei Z M, Huang S B, Jiang R. Effect of carbon on dissimilatory nitrate reduction to ammonium process[J]. Industrial Safety and Environmental Protection, 2013, 38(9): 4-7. (  0) 0) |
| [35] |
Dalsgaard T, Bak F. Nitrate reduction in a sulfate-reducing bacterium, Desulfovibrio desulfuricans, isolated from rice paddy soil: Sulfide inhibition, kinetics, and regulation[J]. Applied and Environmental Microbiology, 1994, 60(1): 291-297.
(  0) 0) |
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China
 2018, Vol. 48
2018, Vol. 48


