岩藻黄素是一种脂溶性类胡萝卜素,为海洋藻类所特有,以大型褐藻和海洋硅藻为主[1]。因其功效显著,应用价值高受到广泛的关注[2]。研究表明,岩藻黄素具有降血糖、抗氧化、抗炎等多种功能[3-5],其在海洋药物方面利用价值较高[6]。目前,岩藻黄素主要从大型褐藻如裙带菜、海带中获得[7],因为在大型褐藻中岩藻黄素仅存在于表皮的表层细胞,所以其在大型褐藻中含量低[2],一般为0.1~1.0 mg/g,且大型藻类细胞壁厚,藻胶含量丰富,导致岩藻黄素提取困难[7]。与大型藻类相比,海洋硅藻具有光合作用效率高、生长周期短、岩藻黄素含量高(其岩藻黄素含量是大型藻类的4倍以上[8-10])以及提取方便等优点。因此,海洋硅藻在岩藻黄素大规模开发利用方面具有很大的潜力。
目前,有关通过优化培养条件提高硅藻岩藻黄素含量的报道较多:臧正蓉等[2]研究结果表明,25 ℃、红光条件下可使三角褐指藻(Phaeodactylum tricornu-tum)岩藻黄素含量显著提高,但对藻细胞的光合活性有一定的抑制作用。宋培钦等[11]研究结果表明,盐度20、pH 8.0、以碳铵为氮源更有利于促进藻细胞中岩藻黄素的积累。徐润洁等[1]研究结果表明,紫光条件处理后三角褐指藻细胞岩藻黄素含量能极显著提高,但会加速藻细胞的衰老。以上研究结果为优化微藻培养条件、提高岩藻黄素产量奠定了理论基础,但岩藻黄素产量的提高往往伴随着藻细胞光合活性及生长指标的下降。因此,在提高硅藻岩藻黄素产量的同时又能促进藻细胞的生长、提高其光合活性的新方法成为研究热点之一。
常压室温等离子体(Atmospheric and room temperature plasma, ARTP)诱变作为一种新型的诱变育种技术具有操作简单、安全高效、不污染环境、得到的突变株具有较高的遗传稳定性等优点,应用前景广阔[12]。目前该技术已经在微生物领域得到了广泛应用[13-15]。但在微藻育种方面研究较少,主要应用在寇氏隐甲藻(Crypthecodinium cohnii)[16]、雨生红球藻(Haematococcus pluvialis)[17]、钝顶螺旋藻(Spirulina platensis)[18]、蛋白核小球藻(Chlorella pyrenoi-dosa)[19]、栅藻(Desmodesmus sp.)[20]等育种研究中,用该技术获得了具有高生物量、高油脂产量以及高多糖、高氨基酸、高虾青素含量等优良性状的突变株,该技术的应用前景十分广阔。
小新月菱形藻(Nitzschia closterium f. minutissima)俗称“小硅藻”,富含油脂、蛋白质、二十碳五烯酸(EPA)多不饱和脂肪酸,是多种水产经济动物的优良生物饵料[21]。在海洋硅藻中,小新月菱形藻作为岩藻黄素、EPA、金藻昆布糖等活性物质的潜在生产者而得到广泛研究,到目前为止,还没有发现利用ARTP诱变技术获取高产岩藻黄素小新月菱形藻的报道。
硫酸铈铵是一种稀土诱导子,朱帅旗等[22]通过研究不同浓度硫酸铈铵对三角褐指藻生长和岩藻黄素含量的影响发现,较低浓度的硫酸铈铵能显著促进藻细胞岩藻黄素的积累,但会抑制藻细胞的生长。由此可见,较低浓度的硫酸铈铵对于岩藻黄素来说起诱导作用,但对于生长起胁迫作用,可将其作为生长的筛选压力,选择在添加了硫酸铈铵的培养液中生长指标仍较好的突变株作为优良突变株,从而使突变株的生长、光合作用、岩藻黄素含量同步提升。本文以小新月菱形藻B248为研究对象,通过ARTP技术对其进行诱变,获得大量突变株,筛选出生长、光合活性及岩藻黄素含量均高于出发株的优良突变株,为高产岩藻黄素小新月菱形藻株系开发提供了技术路线和优良株系。
1 材料与方法 1.1 藻种及实验设计本实验所用藻种小新月菱形藻(编号为MACC/B248)来源于中国海洋大学微藻种质库。藻种培养条件为f/2培养基[23]、温度(20±1) ℃,盐度31,光照周期12L∶12D,光照强度60 μmol·m-2·s-1。
待藻液达到指数生长期后进行ARTP诱变,通过计算小新月菱形藻B248的致死率确定最佳诱变时间。之后按照最佳诱变时间对B248再次进行诱变,将诱变后的藻液均匀涂布在f/2固体培养基中,暗处理24 h后置于光照培养箱中培养。然后分别进行固体平板第一轮筛选、96孔板第二轮筛选、20 mL试管第三轮筛选、100 mL锥形瓶第四轮筛选。培养条件同藻种培养条件。
1.2 ARTP诱变方法用f/2培养基将处于指数生长期的小新月菱形藻B248藻液密度稀释至1×106个/mL左右,事先灼烧金属载片30 s,冷却后,取10 μL稀释好的藻液在金属载片上进行均匀涂布,再将涂有藻液的金属载片置于ARTP-IIS常压室温等离子体诱变育种仪(无锡源清天木生物科技有限公司)操作室中,设置输出功率为120 W,有效处理距离为2 mm,控制气量为10 L/min,诱变时间分别设置为0、4、8、12、16、20、24和28 s,每个时间梯度设3个平行。ARTP诱变处理后,金属载片自动落入预先加入1 mL f/2培养基的EP管内,用涡旋震荡器适当震荡EP管将金属载片上的藻细胞洗脱至培养液中。取适量已经稀释为原浓度1/10的藻液在固体平板上(其培养基是将1.5%的琼脂加入f/2液体培养基中)进行均匀涂布,每个固体平板藻落数控制在50~100。黑暗培养24 h计算致死率(L),其计算公式为:
| $ L=\left(N-N_{t}\right) / N \times 100 \% 。$ |
式中:N为ARTP诱变处理0 s时藻落数; Nt为ARTP分别诱变处理4、8、12、16、20、24和28 s时藻落数。
1.3 突变株的筛选将进行黑暗处理的固体平板上的小新月菱形藻B248藻细胞放入光照培养箱中培养。第一轮筛选在固体平板中进行,本轮筛选以藻落的颜色、形状、大小等为指标,从固体平板中挑选圆润、藻落生长较好且颜色较深的单藻落接种于96孔板中。第二轮筛选在96孔板中进行培养,本轮筛选以OD680值为指标,筛选出OD680值高于出发株的优良突变株接种于20 mL试管中。第三轮筛选在20 mL试管中进行,当藻液长出颜色时向培养液添加硫酸铈铵(终浓度为0.6 mg/L,现配现用)诱导藻细胞积累岩藻黄素,本轮筛选以藻液OD680值、叶绿素荧光参数(Fv/Fm和rETR值)为指标,筛选出上述参数均高于出发株的优良突变株,然后接种于100 mL锥形瓶中。第四轮筛选在100 mL锥形瓶中进行,培养至藻液长出颜色,再用0.6 mg/L的硫酸铈铵胁迫筛选,本轮筛选以OD680值、叶绿素荧光参数(Fv/Fm和rETR值)及岩藻黄素含量为指标,筛选出上述参数均高于出发株的优良突变株。将经过四轮筛选所获得的突变株与出发株藻液分别接种于500 mL三角烧瓶中,培养液中不添加硫酸铈铵,培养结束后测定其叶绿素荧光参数(Fv/Fm、rETR)、单位体积干质量及岩藻黄素含量。
1.4 遗传稳定性研究将经过四轮筛选得到的突变株接种于1 000 mL三角烧瓶中传代培养,传至5代,对Fv/Fm、rETR、单位体积干质量和岩藻黄素含量进行测定,确定其遗传稳定性。
1.5 各项参数的测定用全自动酶标仪(Bio Tek Synergy HTX)测定96孔板中藻细胞的OD680值; 用紫外可见分光光度计(KXB-20W-IB)测定试管和锥形瓶中藻细胞的OD680值; 采用Liang等[24]的方法,用Water-PAM水样叶绿素荧光仪测定叶绿素荧光参数rETR(相对电子传递速率)和Fv/Fm(PSⅡ最大光能转化效率); 按照Wang等[10]的方法测定岩藻黄素含量。
1.6 数据处理用Origin8.5软件绘制图形,用SPSS19.0软件对数据进行单因子方差分析和多重比较,P < 0.05表示差异显著。
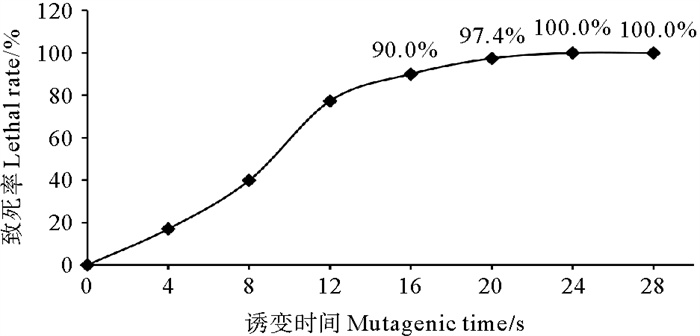
2 结果与分析 2.1 小新月菱形藻B248诱变致死率图 1表示小新月菱形藻B248诱变致死率。由图 1可知,B248致死率随着诱变时间的增加而升高。突变体改变更多生理功能的关键因素是致死率[19]。在实验条件下,等离子体诱变时间达到16和20 s后,B248藻细胞致死率分别为90.0%和97.4%;之后,随着诱变时间的增加,B248死亡率高达100%。因此,在实验条件下,确定小新月菱形藻B248产生有利突变株的最佳处理时间为16和20 s。
|
图 1 小新月菱形藻B248诱变致死率 Fig. 1 Mutagenic lethal rate of Nitzschia closterium f. minutissima B248 |
分别将ARTP诱变处理16和20 s后的小新月菱形藻B248藻细胞均匀涂布于f/2固体培养基平板上,15 d后获得大量突变株单克隆,从中选出圆润、藻落生长较好且颜色较深的单藻落接种于96孔板中继续培养。本轮从大量小新月菱形藻突变株中筛选出220株优良突变株。
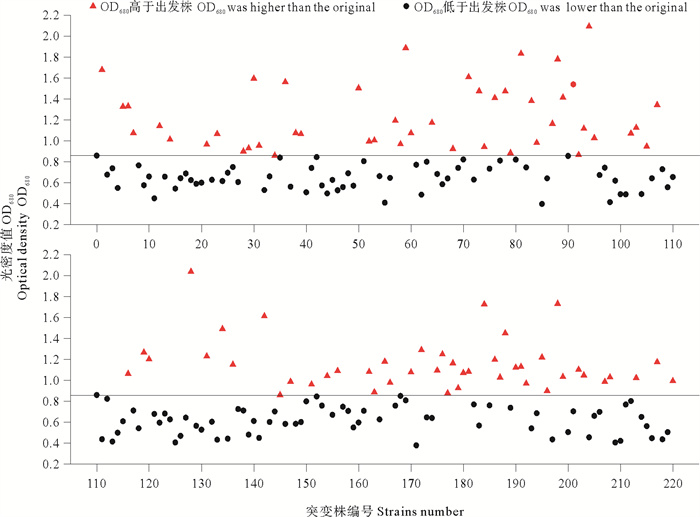
2.2.2 96孔板第二轮筛选结果将平板初筛获得的小新月菱形藻B248优良突变株接种于96孔板中进行培养,待藻液长出颜色(10 d后),测定OD680值。图 2表示B248出发株与220株突变株的OD680值。编号0表示出发株,以出发株的OD680值为基准添加辅助线,筛选出OD680值高于出发株的藻株作为优良突变株进行扩大培养。由图 2可知,经过ARTP诱变,虽有不少B248突变株的OD680值低于出发株,但仍有90株突变株的OD680值高于出发株。这可能是由于ARTP诱变损伤了大部分藻细胞的生长基因,藻细胞在短期内无法修复,从而降低其生长速度; 而一些自身修复能力较强的藻细胞会在修复的过程中产生正向突变,提高自身的生长、繁殖能力[18, 25-26]。本轮从220株小新月菱形藻突变株中筛选出90株OD680值高于出发株的优良突变株。
|
图 2 小新月菱形藻B248第二轮筛选过程中出发株与220株突变株的OD680值 Fig. 2 The OD680 value of the original strain and 220 mutant strains of Nitzschia closterium f. minutissima B248 in the second screening |
第三轮筛选使用硫酸铈铵对小新月菱形藻B248突变株进行胁迫筛选。第二轮筛选获得的优良突变株接种于20 mL试管中进行培养,待藻液出现颜色(5 d后),向培养液中添加硫酸铈铵(浓度为0.6 mg/L)培养5 d后,测定藻液OD680值和叶绿素荧光参数(Fv/Fm和rETR值),筛选出上述参数均高于出发株的突变株进行扩大培养。
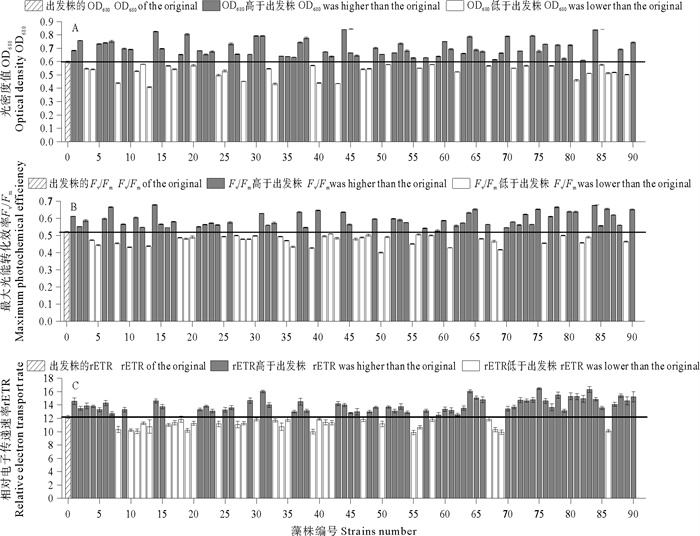
图 3表示小新月菱形藻B248出发株与90株突变株的OD680、Fv/Fm和rETR值,编号0表示出发株,以出发株的OD680值为基准添加辅助线,高度超过辅助线代表突变株的OD680值高于出发株,反之则代表突变株的该参数低于出发株。由图 3A可知,90株B248突变株有33株OD680值低于出发株,这与第二轮筛选所得90株突变株OD680值全部高于出发株结果不一致,其原因可能是本轮筛选所用硫酸铈铵诱导藻细胞产生岩藻黄素的同时也在一定程度上抑制了藻细胞的生长,从而降低了藻细胞的OD680值。由图 3B和3C可知,在硫酸铈铵胁迫的情况下,部分B248突变株的Fv/Fm和rETR值虽有不同程度的降低,但大部分突变株能应对不良环境,表现出较强的光合活性,从图 3中可以看出,有53株小新月菱形藻突变株的Fv/Fm值高于出发株,60株的rETR值高于出发株。由图 3可知,共有35株突变株的OD680、Fv/Fm和rETR值均高于出发株,经过本轮硫酸铈铵胁迫筛选,共从90株小新月菱形藻突变株中获得35株生长和光合活性均高于出发株的优良突变株。
|
图 3 小新月菱形藻B248第三轮筛选过程中出发株与90株突变株的OD680、Fv/Fm和rETR值 Fig. 3 The OD680, Fv/Fm and rETR value of original strain and 90 mutant strains of Nitzschia closterium f. minutissima B248 in the third screening |
将第三轮筛选得到的35株突变株接种于100 mL锥形瓶扩大培养,待藻液长出颜色(5 d后),向培养液中添加硫酸铈铵(浓度为0.6 mg/L),培养5 d后,测定藻液OD680值、叶绿素荧光参数(Fv/Fm和rETR值)以及岩藻黄素含量,筛选出上述参数均高于出发株的突变株进行扩大培养。
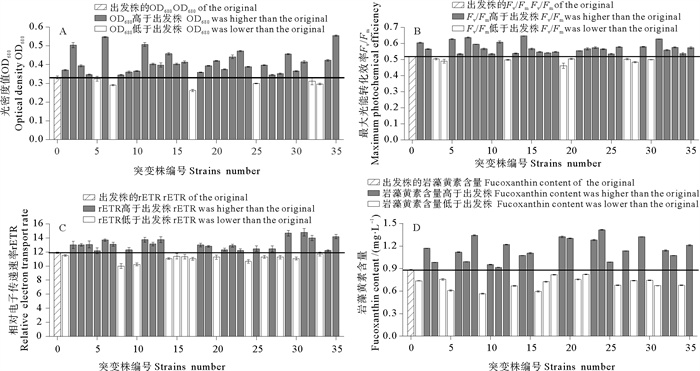
第四轮筛选过程中小新月菱形藻B248出发株与35株突变株的OD680、Fv/Fm、rETR值和岩藻黄素含量如图 4所示,编号0表示B248的出发株,以出发株的OD680值为基准添加辅助线,高度超过辅助线代表突变株的OD680值高于出发株,反之则代表突变株的该参数低于出发株。由图 4A可知,35株突变株中仅6株突变株的OD680值低于出发株。这说明,经过第三轮硫酸铈铵胁迫筛选,大部分突变株对硫酸铈铵产生了耐受能力,也说明经过ARTP诱变处理得到的优良突变株具有稳定的环境适应能力,因此它们的OD680值高于出发株。由图 4B和4C可知,有8株突变株Fv/Fm低于出发株,13株突变株的rETR低于出发株,而第三轮筛选中选择的突变株其Fv/Fm、rETR均高于出发株,可能是因为第三、四轮使用的硫酸铈铵的累积作用降低了它们的光合活性。由图 4D可知,35株小新月菱形藻突变株中有20株突变株岩藻黄素含量比出发株高,由此证明,硫酸铈铵胁迫筛选小新月菱形藻突变株获得高产岩藻黄素藻株切实可行。
|
图 4 小新月菱形藻B248第四轮筛选过程中出发株与突变株的OD680、Fv/Fm、rETR值和岩藻黄素含量 Fig. 4 The OD680, Fv/Fm, rETR value and fucoxanthin content of original strain and mutant strains of Nitzschia closterium f. minutissima B248 in the fourth screening |
由图 4可知,共有6株突变株的OD680、Fv/Fm、rETR值和岩藻黄素含量均高于出发株。经过本轮筛选,从35株小新月菱形藻突变株中筛选出6株生长、光合活性和岩藻黄素含量均高于出发株的优良突变株,将其编号为Z-A1、Z-A2、Z-A3、Z-A4、Z-A5、Z-A6。
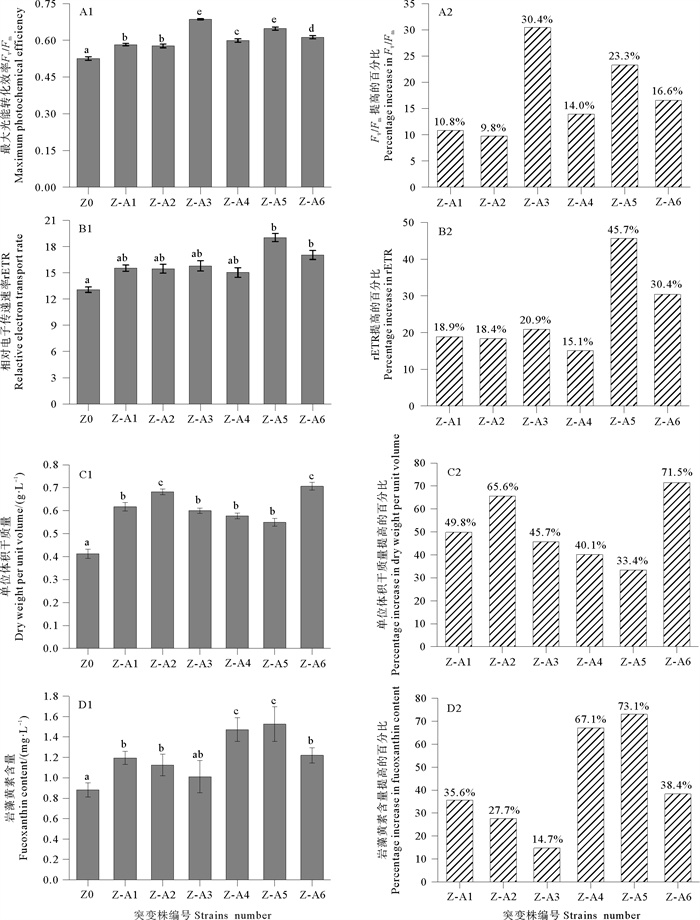
2.2.5 去除筛选剂后小新月菱形藻B248突变株与出发株的比较将筛选得到的6株小新月菱形藻B248优良突变株和出发株于f/2培养基中继续培养(培养基内无硫酸铈铵),7 d后测定藻株的Fv/Fm、rETR、单位体积干质量及岩藻黄素含量。去除筛选剂后B248出发株与突变株Fv/Fm、rETR、单位体积干质量和岩藻黄素含量的比较如图 5所示。图 5A1~D1表示出发株与突变株的Fv/Fm、rETR、单位体积干质量和岩藻黄素含量的具体数值,图 5A2~D2表示突变株各参数与出发株相比提高的百分比,Z0代表出发株,从图 5中可以看出,6株小新月菱形藻突变株的Fv/Fm、rETR、单位体积干质量及岩藻黄素含量均比出发株高,各突变株的测定参数之间也有差异。6株突变株的Fv/Fm、rETR、单位体积干质量和岩藻黄素含量分别为0.577~0.686、15.0~19.0、0.55~0.71 g/L和1.01~1.53 mg/L,与出发株相比,分别增加了9.8%~30.4%、15.1%~45.7%、33.4%~71.5%和14.7%~73.1%。
|
(左图中abcde表示方差分析差异程度,相同字母表明处理组间差异不显著,不同字母表明处理组间差异显著(P < 0.05)。右图纵坐标表示,与出发株相比,突变株各参数提高的百分比。In the left figure abcde indicate variance analysis in the difference degree, the same letters are no significantly diffe-rent from each other; the different letters are significantly different from each other (P < 0.05). The ordinate in the right figure shows the percentage increase in various parameters of the mutant compared with the original. ) 图 5 去除筛选剂后小新月菱形藻B248出发株与突变株Fv/Fm、rETR、单位体积干质量和岩藻黄素含量的比较 Fig. 5 The comparison of Fv/Fm、rETR、dry weight per unit volume and fucoxanthin content of original strain and mutant strains of Nitzschia closterium f. minutissima B248 after removing the screening agent |
将筛选获得的6株突变株按照10%的接种量接种于1 000 mL锥形瓶中传代培养。7 d后再次按照10%的接种量接种于1 000 mL锥形瓶再次培养,经过5次传代后,对其Fv/Fm、rETR、单位体积干质量及岩藻黄素含量进行测定。
小新月菱形藻B248突变株第1代和第5代的叶绿素荧光参数(Fv/Fm、rETR)、单位体积干质量及岩藻黄素含量见表 1。从表 1中可以得出,与第1代相比,第5代叶绿素荧光参数(Fv/Fm、rETR)下降在2%以内,所以6株优良突变株的光合活性传代较稳定; 与第1代相比,第5代Z-A2突变株的单位体积干质量降低了10.3%,Z-A3和Z-A5突变株的岩藻黄素分别降低了12.9%和14.1%,而Z-A1、Z-A4和Z-A6的单位体积干质量和岩藻黄素含量下降均不超过3%。因此,筛选得到的6株突变株中有3株遗传稳定性较高,分别是Z-A1、Z-A4和Z-A6。
|
|
表 1 小新月菱形藻B248突变株的遗传稳定性 Table 1 Genetic stability of the mutant strains of Nitzschia closterium f. minutissima B248 |
岩藻黄素作为海洋藻类特有的脂溶性类胡萝卜素,具有抗肿瘤、抗氧化、减肥、降脂、降糖等生理功能[3-5],发展前景广阔。提高岩藻黄素含量除了利用传统方法外,还可采用诱变育种方法。ARTP诱变育种作为一种新型诱变育种技术具有操作简单、不污染环境、突变率高等优点,在细菌、真菌及微藻育种等方面应用广泛且诱变效果显著[15-16, 18, 20-21]。在ARTP诱变研究中,为了得到大量有效的突变株,首先应该考虑获取ARTP诱变的最佳条件。大量研究表明,不同的诱变条件对生物体的致死率不同,相同的诱变条件对不同的生物体致死率也不同。本实验结果显示,在ARTP输入功率为120 W、处理距离为2 mm、气流速度为10 L/min条件下,小新月菱形藻B248产生有利突变的最佳处理时间为16和20 s,其致死率大于90%;而Cao等[20]研究发现,有利于蛋白核小球藻油脂积累的ARTP最佳诱变条件为输入功率120 W、处理距离2 mm、气体流速10 SLM、诱变时间为40、50和60 s,其致死率高达95%以上; Fang等[27]的结果表明,有利于提高钝顶螺旋藻生长速度和碳水化合物含量的最佳诱变条件为输入功率100 W、处理距离2 mm、处理时间为5、10、40和60 s,其致死率超过90%;Liu等[16]的研究结果表明,促进寇氏隐甲藻胞外多糖积累的ARTP最佳诱变条件为输入功率150 W、处理距离2 mm、气体流速10 SLM、处理时间为70 s,其致死率超过90%。以上实验结果表明,不同种类的微藻进行ARTP诱变的最佳条件是有差异的,这与微藻的自身修复机制有关,即当等离子体破坏微藻细胞壁、细胞膜及蛋白质时,不同种类的微藻进行基因修复的能力不同,从而表现出对ARTP诱变的敏感性不同[18]。
在微藻育种过程中,通过ARTP诱变技术得到的突变株存在正向突变和负向突变,获得优质目标突变株的关键是要建立一套简单便捷、行之有效的高通量筛选方法,节省筛选时间,提高筛选效率。目前有较多优良突变株高通量筛选方法的报道,Fang等[27]利用ARTP诱变技术对钝项螺旋进行诱变,采用96孔板和酶标仪高通量筛选出2株优良突变株,与出发株相比,2株突变株的碳水化合物分别增加了40.3%和78.0%。李青等[28]以若夫小球藻(Chlorella zofingensis)为研究对象,将其紫外诱变后通过流式细胞仪高通量筛选得到1株总脂产量比野生株高出50%的突变株。魏婷婷[29]在96孔板中加入藻液和尼罗红染液,利用酶标仪对5 000株蛋白核小球藻突变株进行荧光强度的高通量筛选,最终获得4株高含油脂的突变株。陈建楠等[30]采用尼罗红染色法高通量筛选出富含油脂的球等鞭金藻(Isochrysis galbana)突变株。在本实验中,将小新月菱形藻B248进行ARTP诱变后,依次进行固体平板第一轮筛选、96孔板OD680值第二轮筛选、20 mL试管OD680值、Fv/Fm和rETR值第三轮筛选、100 mL三角烧瓶OD680值、Fv/Fm、rETR值和岩藻黄素含量第四轮筛选,最终获得了生长快、光合活性强、高产岩藻黄素、遗传稳定性强的优良突变株。本实验在筛选过程中使用全自动酶标仪检测突变株的OD680值,大大节省了筛选时间,提高了筛选效率。使用快速、灵敏、对细胞无损伤的Water-PAM水样叶绿素荧光仪检测突变株的叶绿素荧光参数,实现了对各突变株光合活性的快速判断。实验结果表明,本文建立的方法是一套简单便捷、行之有效的高通量筛选方法。
ARTP产生的浓度较高的中性高浓度活性粒子能够改变细胞膜的通透性,从而进一步损伤DNA分子,从而使基因发生突变[31]。由于藻细胞内存在DNA修复机制,所以在基因受到损伤时,藻细胞自身的修复系统会不同程度的自行修复,一些修复能力较差的藻细胞在短期内无法修复至正常状态,表现为藻细胞的生长速度会不同程度地降低,本实验在第二轮筛选中有130株突变株的OD680值低于出发株证明了这一观点; 而一些修复能力较强的藻细胞不仅能修复至正常状态且会在修复的过程中产生正向突变,这种突变可抵御不良环境,从而表现出较高的生长繁殖能力和光合活性[18, 25-26],所以在第三轮硫酸铈铵胁迫筛选中能够从90株突变株中筛选出35株OD680值和叶绿素荧光参数(Fv/Fm、rETR)均高于出发株的优良突变株。有研究表明,当筛选剂去除后,突变株合成活性物质的含量往往会有所提高[32],本实验结果表明,去除筛选剂后,突变株的Fv/Fm、rETR、单位体积干质量及岩藻黄素含量均有所提高,这与江胜滔[32]的研究结论一致。ARTP诱变后的突变株经过四轮筛选获得6株突变株,其Fv/Fm、rETR、单位体积干质量及岩藻黄素含量分别比出发株增加了9.8%~30.4%、15.1%~45.7%、33.4%~71.5%和14.7%~73.1%,其中3株突变株(编号分别为Z-A1、Z-A4和Z-A6)具有较高的遗传稳定性,这说明ARTP诱变不仅能够提高藻细胞的光合活性和生长繁殖能力,而且也能获得高产岩藻黄素藻株,这一研究结果为高产岩藻黄素小新月菱形藻株系开发提供了技术路线和优良株系。
4 结语本文使用ARTP诱变技术对小新月菱形藻B248进行诱变,以0.6 mg/L的硫酸铈铵作为筛选剂,成功筛选出6株优良突变株,其Fv/Fm、rETR、单位体积干质量和岩藻黄素含量分别为0.577~0.686、15.0~19.0、0.55~0.71 g/L和1.01~1.53 mg/L,与出发株相比,分别增加了9.8%~30.4%、15.1%~45.7%、33.4%~71.5%和14.7%~73.1%;遗传稳定性研究表明,6株优良突变株中有3株遗传稳定性较高,编号分别为Z-A1、Z-A4和Z-A6。
| [1] |
徐润洁, 龚一富, 陈文婷, 等. 不同发光二极管单色光质对三角褐指藻中岩藻黄素含量及相关基因表达的影响[J]. 光学学报, 2019, 39(9): 299-307. Xu R J, Gong Y F, Chen W T, et al. Effects of LED monochromatic light quality of different colors on fucoxanthin content and expression levels of related genes in Phaeodactylum tricornutum[J]. Acta Optica Sinica, 2019, 39(9): 299-307. (  0) 0) |
| [2] |
臧正蓉, 解修俊, 赵佩佩, 等. 温度和光照对三角褐指藻的生长及岩藻黄素含量的影响[J]. 海洋科学, 2015, 39(7): 1-6. Zang Z R, Xie X J, Zhao P P, et al. Effect of different temperatures and light conditions on the growth and fucoxanthin content of Phaeodactylum tricornutum[J]. Marine Sciences, 2015, 39(7): 1-6. (  0) 0) |
| [3] |
Kong Z L, Sudirman S, Hsu Y C, et al. Fucoxanthin-Rich brown algae extract improves male reproductive function on streptozotocin-nicotinamide-induced diabetic rat model[J]. International Journal of Molecular Sciences, 2019, 20(18): 4485. DOI:10.3390/ijms20184485 (  0) 0) |
| [4] |
Bae M, Kim M B, Park Y K, et al. Health benefits of fucoxanthin in the prevention of chronic diseases[J]. Biochimica et Biophysica Acta-Molecular and Cell Biology of Lipids, 2020, 1865(11): 158618. DOI:10.1016/j.bbalip.2020.158618 (  0) 0) |
| [5] |
Lin H V, Tsou Y C, Chen Y T, et al. Effects of low-molecular-weight fucoidan and high stability fucoxanthin on glucose homeostasis, lipid metabolism, and liver fucoxanthin in a mouse model of type Ⅱ diabetes[J]. Marine Drugs, 2017, 15(4): 113. DOI:10.3390/md15040113 (  0) 0) |
| [6] |
隋吉槺, 汪辉, 刘天中. 硅藻岩藻黄素特性与其生物合成的研究进展[J]. 海洋科学, 2019, 43(12): 130-138. Sui J K, Wang H, Liu T Z. Research progress of the characteristics and biosynthesis of diatom fucoxanthin[J]. Marine Sciences, 2019, 43(12): 130-138. DOI:10.11759/hykx20190509001 (  0) 0) |
| [7] |
诸德斐, 杨润青, 宋培钦, 等. 光及补料条件对室内管道光反应器中三角褐指藻生长和岩藻黄素积累的影响[J]. 广东海洋大学学报, 2021, 41(2): 18-26. Zhu D F, Yang R Q, Song P Q, et al. Effect of light and fed-batch operation on growth of Phaeodactylum tricornutum and its fucoxa-nthin accumulation in indoor tubular photobioreactor[J]. Journal of Guangdong Ocean University, 2021, 41(2): 18-26. DOI:10.3969/j.issn.1673-9159.2021.02.003 (  0) 0) |
| [8] |
Kim S M, Kang S W, Kwon O, et al. Fucoxanthin as a major carotenoid in Isochrysis aff. galbana: Characterization of extraction for commercial application[J]. Journal of the Korean Society for Applied Biological Chemistry, 2012, 55(4): 477-483. DOI:10.1007/s13765-012-2108-3 (  0) 0) |
| [9] |
Xia S, Wang K, Wan L, et al. Production, characterization, and antioxidant activity of fucoxanthin from the marine diatom Odontella aurita[J]. Marine Drugs, 2013, 11(7): 2667-2681. DOI:10.3390/md11072667 (  0) 0) |
| [10] |
Wang L J, Fan Y, Parsons R L, et al. A rapid method for the determination of fucoxanthin in diatom[J]. Marine Drugs, 2018, 16(1): 33. DOI:10.3390/md16010033 (  0) 0) |
| [11] |
宋培钦, 刘鹭, 魏东. 三角褐指藻跑道池规模化培养及岩藻黄素积累条件的优化[J]. 现代食品科技, 2018, 34(4): 150-158, 241. Song P Q, Liu L, Wei D. Scaling-up cultivation of Phaeodactylum tricornutum in open raceway pond and optimization of the culture conditions for fucoxanthin accumulation[J]. Modern Food Science and Technology, 2018, 34(4): 150-158, 241. (  0) 0) |
| [12] |
梁英, 闫译允, 赖秋璇, 等. 微藻诱变育种研究进展[J]. 中国海洋大学学报(自然科学版), 2020, 50(6): 19-32. Liang Y, Yan Y Y, Lai Q X, et al. Researching advances in microalgal mutation breeding[J]. Periodical of Ocean University of China, 2020, 50(6): 19-32. (  0) 0) |
| [13] |
Ottenheim C, Nawrath M, Wu J C. Microbial mutagenesis by atmospheric and room-temperature plasma (ARTP): The latest development[J]. Bioresources and Bioprocessing, 2018, 5(1): 1-14. DOI:10.1186/s40643-017-0187-z (  0) 0) |
| [14] |
Zhang C, Qin J, Dai Y, et al. Atmospheric and room temperature plasma(ARTP)mutagenesis enables xylitol over-production with yeast Candida tropicalis[J]. Journal of Biotechnology, 2019, 296: 7-13. DOI:10.1016/j.jbiotec.2019.01.026 (  0) 0) |
| [15] |
Zhang C Z, Li Y, Zhang T S, et al. Increasing chitosanase production in Bacillus cereus by a novel mutagenesis and screen method[J]. Bioengineered, 2021, 12(1): 266-277. DOI:10.1080/21655979.2020.1869438 (  0) 0) |
| [16] |
Liu B, Sun Z, Ma X, et al. Mutation breeding of extracellular polysaccharide-producing microalga Crypthecodinium cohnii by a novel mutagenesis with atmospheric and room temperature plasma[J]. International Journal of Molecular Sciences, 2015, 16(4): 8201-8212. (  0) 0) |
| [17] |
吴晓英, 柳泽深, 姜悦. 雨生红球藻等离子诱变及高产藻株的筛选[J]. 食品安全质量检测学报, 2016, 7(9): 3781-3787. Wu X Y, Liu Z S, Jiang Y, et al. Mutation breeding of Haematococcus pluvialis by atmospheric and room temperature plasma and isolation of high-producing mutants[J]. Journal of Food Safety and Quality, 2016, 7(9): 3781-3787. (  0) 0) |
| [18] |
An J, Gao F L, Ma Q Y, et al. Screening for enhanced astaxanthin accumulation among Spirulina platensis mutants generated by atmospheric and room temperature plasmas[J]. Algal Research, 2017, 25: 464-472. DOI:10.1016/j.algal.2017.06.006 (  0) 0) |
| [19] |
Cao S, Zhou X, Jin W, et al. Improving of lipid productivity of the oleaginous microalgae Chlorella pyrenoidosa via atmospheric and room temperature plasma (ARTP)[J]. Bioresource Technology, 2017, 244: 1400-1406. DOI:10.1016/j.biortech.2017.05.039 (  0) 0) |
| [20] |
Sun X, Li P, Liu X, et al. Strategies for enhanced lipid production of Desmodesmus sp. mutated by atmospheric and room temperature plasma with a new efficient screening method[J]. Journal of Cleaner Production,, 2020, 250: 119509. DOI:10.1016/j.jclepro.2019.119509 (  0) 0) |
| [21] |
王青岩, 陈书秀. 小新月菱形藻培养基优化研究[J]. 科学养鱼, 2018(9): 27-28. Wang Q Y, Chen S X. Optimization of culture medium for Nitzschia parvum[J]. Scientific Fish Farming, 2018(9): 27-28. (  0) 0) |
| [22] |
朱帅旗, 龚一富, 刘浩, 等. 硫酸铈铵对三角褐指藻岩藻黄素含量的影响及转录差异研究[J]. 中国稀土学报, 2014, 32(6): 750-757. Zhu S Q, Gong Y F, Liu H, et al. Effects of ammonium cerous sulfate on fucoxanthin content in Phaeodactylum tricornutum and research of transcriptional differences[J]. Journal of the Chinese Society of Rare Earths, 2014, 32(6): 750-757. (  0) 0) |
| [23] |
Guillard R R L, Ryther J H. Studies of marine planktonic diatoms: I. Cyclotella nana (Hustedt) and Detonula confervacea (Cleve) Gran[J]. Canadian Journal of Microbiology, 1962, 8(2): 229-239. DOI:10.1139/m62-029 (  0) 0) |
| [24] |
Liang Y, Sun M, Tian C, et al. Effects of salinity stress on the growth and chlorophyll fluorescence of Phaeodactylum tricornutum and Chaetoceros gracilis (Bacillariophyceae)[J]. Botanica Marina, 2014, 57(6): 469-476. DOI:10.1515/bot-2014-0037 (  0) 0) |
| [25] |
张雪, 张晓菲, 王立言, 等. 常压室温等离子体生物诱变育种及其应用研究进展[J]. 化工学报, 2014, 65(7): 2676-2684. Zhang X, Zhang X F, Wang L Y, et al. Recent progress on atmospheric and room temperature plasma mutation breeding technology and its applications[J]. CIESC, 2014, 65(7): 2676-2684. DOI:10.3969/j.issn.0438-1157.2014.07.027 (  0) 0) |
| [26] |
艾江宁, 姚长洪, 孟迎迎, 等. 生长速度快且油脂产率高的湛江等鞭金藻诱变株的筛选[J]. 微生物学通报, 2015, 42(1): 142-147. Ai J N, Yao C H, Meng Y Y, et al. Screening of fast growth and high oil productivity mutants of Isochrysis zhangjiangensis[J]. Microbiology China, 2015, 42(1): 142-147. (  0) 0) |
| [27] |
Fang M, Jin L, Zhang C, et al. Rapid mutation of Spirulina platensis by a new mutagenesis system of atmospheric and room temperature plasmas (ARTP) and generation of a mutant library with diverse phenotypes[J]. PLoS One, 2013, 8(10): e77046. DOI:10.1371/journal.pone.0077046 (  0) 0) |
| [28] |
李青, 吴洪, 蔡忠贞, 等. 利用流式细胞仪筛选紫外诱变高含油小球藻[J]. 中国油脂, 2018, 43(5): 110-112,122. Li Q, Wu H, Cai Z Z, et al. Screening of UV-mutated Chlorella zofingensis with high lipid content using flow cytometry[J]. China Oils and Fats, 2018, 43(5): 110-112,122. DOI:10.3969/j.issn.1003-7969.2018.05.025 (  0) 0) |
| [29] |
魏婷婷. 高产油蛋白核小球藻60Co-γ射线诱变育种的初步研究[D]. 上海: 华东理工大学, 2018. Wei T T. Preliminary Studies on Mutation Breeding of Chlorella pyrenoidosa for High Lipid Productivity by 60Co-γ Irradiation[D]. Shanghai: East China University of Science and Technology, 2018. (  0) 0) |
| [30] |
陈建楠, 陈由强, 薛婷. 利用UV和ARTP诱变筛选优良性状的球等鞭金藻[J]. 福建农业科技, 2020(2): 9-16. Chen J N, Chen Y Q, Xue T. Mutation screening of Isochrysis galbana with excellent characters by using UV and ARTP treatments[J]. Fujian Agricultural Science and Technology, 2020(2): 9-16. (  0) 0) |
| [31] |
Wang X, Lu M, Wang S, et al. The atmospheric and room-temperature plasma (ARTP) method on the dextranase activity and structure[J]. International Journal of Biological Macromolecules, 2014, 70: 284-291. DOI:10.1016/j.ijbiomac.2014.07.006 (  0) 0) |
| [32] |
江胜滔. 虾青素产生菌的筛选鉴定及其转化子的研究[D]. 福州: 福建师范大学, 2005. Jiang S T. Screening and Identification of the Epiphyte Producing Astaxanthin and Study on Its Transformant[D]. Fuzhou: Fujian Normal University, 2005. (  0) 0) |
 2022, Vol. 52
2022, Vol. 52

