2. 烟台海益苗业有限公司, 山东 烟台 265600;
3. 青岛海洋科学与技术国家实验室, 海洋生物学与生物技术功能实验室, 山东 青岛 266071
贝类产业是中国海水养殖产业的重要组成部分, 养殖产量超过海水养殖总产量的72%[1]。据2015年《中国水产》统计, 中国共引进贝类10余种[2], 如海湾扇贝(Argopecten irradias)[3]、虾夷扇贝(Patinopecten yessoensis)[4]、紫扇贝(A. purpuratus)[5]和大扇贝(Pecten maximus)[6]等。自从1980年代引进国外优质扇贝种质以来, 中国扇贝养殖产量/产值实现跳跃式增长, 扇贝养殖总产量从1984年的0.38万t增加到2016年的178.53万t; 扇贝养殖总产值从1984年的0.06亿美元增长至2016的25.00亿美元[7]; 中国海水养殖业构建了新的养殖模式, 海湾扇贝与海带轮养能降低产业成本, 提高利润率[8]。可见, 优质扇贝种质的引进在促进中国水产养殖业迅速发展的同时, 创造了巨大的产业价值和经济价值。
风信标扇贝(Patinopecten caurinus)隶属于软体动物门(Mollusca), 瓣鳃纲(Lamellibranchia), 异柱目(Anisomyaria), 扇贝科(Pectinidae), 盘扇贝属(Patinopecten), 原产于美国北部旧金山(37°N)至阿拉斯加湾(60°N), 自然栖息于深度10~300 m内的白令海和阿米莉亚群岛(53°N, 174°W)等海域[9-10]。作为商业养殖贝类个体最大的种类之一, 风信标扇贝最大个体壳高可达250 mm[11], 同时因其肉质鲜美、营养价值高, 备受北美消费者青睐。自1967年以来, 风信标扇贝在阿拉斯加海湾逐渐形成商业化捕捞, 至2012年产出贝肉净重约为190 t, 为当地创造出约450万美元经济价值[11]。重要的是, 风信标扇贝与虾夷扇贝的生物学地位相近, 同属于盘扇贝属(Patinopecten), 并且生活习性相似, 均属于冷水性贝类, 适宜生长水温为5~20 ℃, 分布于底质坚硬、淤沙少的海底等[11], 这使中国引进风信标扇贝并形成大规模商业化养殖成为可能。2013—2015年, 中国海洋大学与海益水产苗业有限公司等单位合作, 从加拿大(54.32 °N, 131.40 °W)引种了风信标扇贝。新的扇贝物种引进将有助于其基因组学研究、重要经济性状遗传基础和调控机理的解析以及遗传育种等相关工作的开展。
标准化的人工育苗是实现扇贝大规模商业化养殖的前提条件, 而亲贝培育又是贝类人工育苗的重要技术环节, 直接影响着雌贝的产卵量、卵子的受精率、受精卵的孵化率以及幼虫的变态率[12]等。目前, 关于香港巨牡蛎(Crassostrea hongkongensis)[13]、斧文蛤(Meretrix lamarkii Deshayes)[14]、海湾扇贝(A. irradias)[15]、栉孔扇贝(Chlamys farreri)[16]、虾夷扇贝(P. yessoensis)[17]等性腺发育与繁殖周期规律的研究国内外已有报道, 但风信标扇贝在中国的的相关研究仍为空白。为此, 本课题组于2015年从加拿大引进了风信标扇贝并对其性腺发育和繁殖周期规律进行研究, 为贝类遗传育种研究和人工育苗工作提供重要的理论参考和科学依据。
1 材料和方法 1.1 材料用于组织切片观察和性腺指数测定的风信标扇贝样本, 为2016年1月—2016年12月采自蓬莱海头村浮筏养殖区(37.72°N, 121.02°E)3~5 m水深的3龄贝(2013—2015年由中国海洋大学与海益水产苗业有限公司等单位合作从加拿大引进), 除1、2月份外(分别为4、2次)每月采样3次(上旬、中旬、下旬), 每次采集样本雌雄各6只并进行编号记录。
1.2 方法 1.2.1 水温测量在2016年周年采样期间, 除1、2月份外(分别为4、2次)每月使用海水水温表(WQG-17)3次定期测量蓬莱浮筏养殖海区风信标扇贝养殖水层3~5 m的水温。
1.2.2 样本测量使用游标卡尺(0~150 mm、0.02 mm、Ⅱ型)分别测量样本壳长、壳高、壳宽(精确到0.01 mm)。用电子天平(PS200A)称取样本鲜重、软体部重和性腺重(精确到0.01 g), 观察其性腺发育程度、性别、颜色, 并计算性腺指数:
1.2.3 组织切片的制作与观察首先, 根据肉眼观察性腺颜色(雌性为橘黄色、雄性为乳白色)区分扇贝性别并做好标记; 其次, 将风信标扇贝性腺组织切成每块大小5 mm×5 mm, 波恩氏(Bouins)液固定24 h, 75%乙醇脱水, 以石蜡为介质将其进行包埋成块, 德国SLEE石蜡切片机(CUT6062)切片, 切片厚度为4~7 μm, 苏木素伊红HE染色, 树胶封片保存, 二甲苯透洗切片, 尼康生物荧光显微镜(Nikon ECLIPS E600)下对染色的性腺组织切片进行观察并通过高分辨率显微镜相机(Nikon DS-Ri1)拍照。
1.2.4 分析方法对试验数据采用Excel软件进行处理, 利用SPSS 23.0软件(IBM Corp, Armonk, USA)Pearson相关分析法(双侧T检验)对风信标扇贝性腺指数与海水温度两个变量的相关性进行分析。
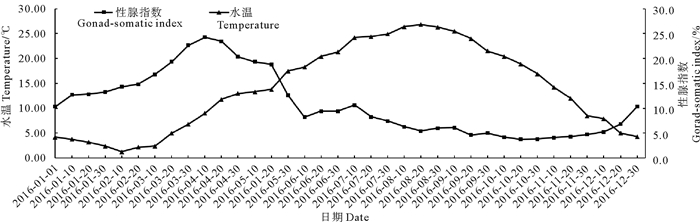
2 结果 2.1 风信标扇贝性腺指数与海区水温的关系由2016年1月1日—2016年12月31日为期一周年的浮筏养殖风信标扇贝性腺指数变化的连续观测可见(见图 1), 2月上旬至8月中旬海水温度呈上升趋势, 而8月下旬至12月下旬海水温度则平稳回落。1—4月上旬风信标扇贝的性腺指数呈现稳定连续增长趋势, 4月中旬到12月中旬则呈现逐渐下降趋势:1月初性腺指数逐渐上升, 至4月上旬达到最大值(24.25), 与之对应的海水温度变化趋势则显现为“V”型, 由1月初的4.2 ℃下降至2月上旬的1.3 ℃(为全年最低水温); 2月中旬至4月上旬海水温度从2.2 ℃逐渐上升至9.0 ℃; 4月中旬到12月中旬性腺指数呈现平稳下降趋势, 并在10月中旬出现全年最小值(3.80), 与之对应的海水温度变化趋势则呈现倒“V”型, 期间水温从4月中旬的11.8 ℃升至8月中旬的26.8 ℃, 之后逐渐回落。周年统计期间, 蓬莱海头村海水温度的波动与风信标扇贝性腺指数的变化呈现显著负相关(r =-0.483, P < 0.05), 说明海水温度变化显著影响风信标扇贝的性腺发育和繁殖周期。
|
图 1 风信标扇贝性腺指数与海区水温的变化 Fig. 1 Monthly change curves of the gonad-somatic index in Weathervane scallop and water temperature |
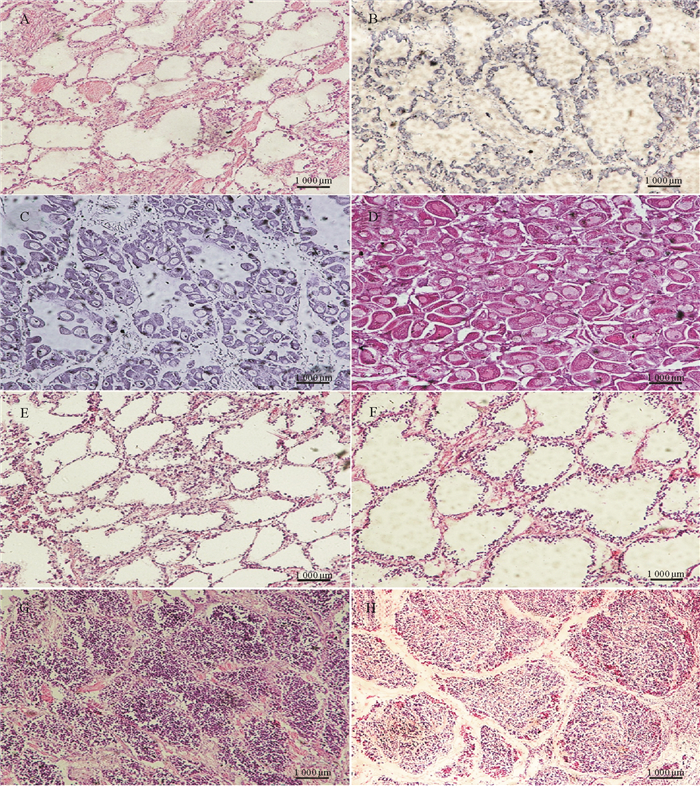
基于生殖细胞自身发育规律以及不同发育阶段生殖细胞在滤泡中所占的比例, 对2016年1月—2016年12月收集到的样品性腺组织切片进行观察, 将风信标扇贝的性腺发育划分为4个时期, 分别为增殖期、生长期、成熟期、休止期。
增殖期(12—次年1月):该时期的滤泡腔多为空腔, 并有原始生殖细胞在生殖腺的滤泡壁上堆积(见图 2B、F)。
|
(A、E休止期(♀、♂)resting stage(♀、♂), ×100;B、F增殖期(♀、♂)proliferative stage(♀、♂), ×100;C、G生长期(♀、♂)growing stage(♀、♂), ×100;D、H成熟期(♀、♂)maturation stage(♀、♂), ×100;标尺:100 μm Scale bar: 100 μm.) 图 2 风信标扇贝性腺不同发育时期的组织切片观察 Fig. 2 Histological observation of different gonadal development stages in Weathervane scallop |
生长期(2—3月):雄贝滤泡腔内出现不同发育阶段的生殖细胞(见图 2G), 雌贝滤泡中存在游离的卵母细胞, 滤泡壁内充满成熟的长柄状或不规则椭圆型卵母细胞, 此时期的卵母细胞较上一时期体积更大(见图 2C)。
成熟期(4—6月):雌雄性腺颜色差异较大, 雌性为橘黄色, 而雄性为乳白色。滤泡此时期最为发达, 滤泡之间的空隙已基本消失, 整个滤泡腔内充满生殖细胞。雌性滤泡内成熟卵占65%~5%, 成熟卵细胞和处于生长后期的卵母细胞游离在滤泡腔中, 卵母细胞在泡腔内相互挤压, 形状各异(见图 2D)。雄性滤泡内充满密集排列的精细胞, 呈现辐射状(见图 2H)。
休止期(7—11月):处于该时期的性腺发育程度最低, 滤泡腔为空腔且性腺体积很小, 但滤泡壁内可见及少量精细胞或卵细胞(见图 2A、E);
2.3 风信标扇贝繁殖规律根据人工繁育试验和性腺组织切片的周年观察结果, 笔者发现风信标扇贝的繁殖周期为一年。性腺发育程度与浮筏养殖海区水温变化密切相关, 并且处于不同发育时期的性腺, 在其形体特征上存在差异。
12月—次年1月, 蓬莱浮筏养殖区海水温度逐渐降低, 从7.9 ℃平稳下降至2.4 ℃, 此时期风信标扇贝性腺体积逐渐增大, 腺体内有少量内含物, 性腺指数从5.24快速上升至10.32, 性腺发育处于增殖期。
2—3月, 蓬莱浮筏养殖区海水温度从全年最低的1.3 ℃缓慢上升至6.8 ℃, 此时期风信标扇贝性腺体积接近其最大值, 腺体内内含物逐渐增多, 滤泡内生殖细胞逐渐增多。肉眼可区分性别, 雄贝性腺为乳白色, 雌贝性腺则呈现杏黄色。性腺指数从2月上旬的14.31陡然上升至3月底的22.63, 性腺发育处于生长期。
4—6月, 蓬莱浮筏养殖区海水温度从9.0 ℃逐渐上升至21.3 ℃, 此时期风信标扇贝性腺中的滤泡腔充满了生殖细胞, 滤泡间几乎没有空隙。因此性腺状态饱满圆润, 而且体积相比其它器官大。4月性腺发育进入成熟期, 平均性腺指数22.70为全年最高, 风信标扇贝进入繁殖盛期。
7—11月, 蓬莱浮筏养殖区海水温度稳定在20.0 ℃左右, 此时期风信标扇贝性腺体积相比其它器官相对较小, 且呈现萎缩、透明、退化状态。这5个月平均性腺指数约为5.10, 性腺发育处于休止期。
总体而言, 水温较低时, 低温使冷水贝类的性腺快速发育, 此时性腺指数相对较高; 反之, 水温较高时, 性腺发育受到温度协迫, 性腺指数较低。
此外, 课题组进行的风信标扇贝的人工繁育工作也取得了阶段性进展。2016年2月, 选择体型健壮的、性腺发育处于生长期的风信标扇贝入池, 进行人工促熟。在性腺发育的繁殖期, 挑选性腺发育较好的雌贝和雄贝(性腺体积大, 形态圆润饱满)阴干刺激45~60 min。之后, 雌贝和雄贝先后(时间间隔30 min)放入5~12 ℃的新鲜海水中(变温刺激, 持续45~60 min), 直至风信标扇贝产卵/精。在该温度下进行人工授精、孵化, 选优后幼虫培育水温逐渐升高至13 ℃, 恒温培育直到稚贝出库。
3 讨论 3.1 年度水温和性腺指数变化趋势在双壳贝类的生长过程中, 温度是诸多水生环境因子中最重要的发育调控因素[18-19]。在适温范围内, 贝类的新陈代谢旺盛, 这对其摄食、生长、性腺发育、繁殖等生理活动产生积极的作用[20]。风信标扇贝属于冷水性贝类, 在水温较低的冬季, 性腺发育迅速[10]。蓬莱浮筏养殖海区1—3月海水温度均低于7.0 ℃, 月均性腺指数上升2.44;4月风信标扇贝在水温达到9.0℃时性腺发育开始进入成熟期, 并在4月上旬出现全年性腺指数峰值(24.25);4月下旬—6月上旬为该扇贝繁殖盛期, 期间平均水温为14.1 ℃; 这与大连塔河湾海区和黄海北部虾夷扇贝相关研究结论有所差异:黄海北部海区全年最低海水温度出现在2月份(该月平均水温为1.3 ℃), 此时期的性腺发育速度快; 繁殖期为3月中旬—5月中旬, 其中3月份的平均性腺指数25.89为全年最高, 繁殖期水温为8.6 ℃左右[21]; 大连塔河湾海区虾夷扇贝的繁殖期为4—5月, 其性腺指数峰值(17.27)出现在3月上旬, 繁殖期水温为5.0~6.8 ℃[16]。可见, 低水温有助于风信标扇贝和虾夷扇贝的性腺发育。虽然蓬莱浮筏养殖区风信标扇贝的繁殖期与中国不同养殖海区虾夷扇贝的繁殖时期接近, 但繁殖期的水温存在一定差异, 这可能是养殖区地理位置以及水文条件的差异造成的。海水温度和性腺指数在3个不同海区的变化趋势, 均呈现相对明显的负相关。
3.2 风信标扇贝的性腺发育分期鉴定动物性腺发育的分期, 有助于笔者掌握其性腺发育规律和生殖周期的特征。正确划分扇贝性腺发育时期是进行人工繁殖的理论基础与实践指导。但是目前, 关于双壳类贝类性腺发育的分期标准尚未形成统一认识, 多为观察光学显微镜下拍摄的性腺组织切片结果而进行分期。如吴洪流等[22]将波纹巴非蛤(Paphia undulata)性腺发育分为6个时期, 分别为休止期、增殖期、生长期、成熟期、排放期和滞留退化期; 於锋[12]将广西茅尾海香港巨牡蛎(C. hongkongensis)性腺发育分期为5个时期, 未分化期、分化期、成熟排放期和休止期; 高悦勉[16]等将大连塔河湾海区虾夷扇贝(P. yessoensis)性腺发育划分为休止期、增殖期、生长期、成熟期、排放期。本实验结合性腺组织切片分析和肉眼观察的结果将蓬莱海头村浮筏养殖区风信标扇贝的性腺发育分为4个时期, 分别为增殖期(12月—次年1月)、生长期(2—3月)、成熟期(4—6月)、休止期(7—11月)。Hennick[23]通过肉眼观察原产于阿拉斯加湾的风信标扇贝性腺发育特征, 将其分为5个阶段, 第一阶段为性腺排空期, 体积缩小, 消化管可见, 干瘪透明状, 雌雄贝性腺几乎为无色; 第二阶段为性腺恢复初期, 性腺体积增大, 充满1/4~1/2内含物, 消化管隐约可见, 雄贝性腺中含生殖细胞的部分为乳白色, 余下腺体为透明状, 雌贝性腺呈淡粉色或浅橙色; 第三阶段为性腺生长期, 性腺体积接近最大, 充满3/4内含物, 雌贝性腺为浅橙黄色, 雄贝性腺为苍白色; 第四阶段为性腺成熟期, 性腺体积较其它器官大, 形态圆润, 雄贝性腺为乳白色, 雌贝性腺为橘黄色; 第五阶段为性腺发育早期或未成熟期, 性腺体积较其它器官小, 平滑透明无色。通过观察, 笔者发现阿拉斯加湾风信标扇贝与蓬莱浮筏养殖海区风信标扇贝性腺发育特征相似。例如, 雄贝性腺成熟时颜色均为乳白色, 雌贝性腺成熟时颜色均为橘黄色、性腺体积大、形态圆润等, 而且两种扇贝在生产后, 雌雄贝的性腺均逐渐变为瘪平透明状[23]。此后, 扇贝性腺进入恢复初期, 随着营养物质的吸收, 性腺内含物的积累, 其体积逐渐增大。但是由于不同地理环境(水温等)、取材个体差异, 目前引进到中国的风信标扇贝在性腺发育过程出现了不同于原产地个体的新特征, 不同地区扇贝在生长阶段的性腺内含物比例有所不同, 阿拉斯加湾风信标扇贝的性腺充满3/4内含物, 而引进中国的风信标扇贝的性腺充满约1/2内含物等; 蓬莱浮筏养殖海区风信标扇贝的繁殖盛期在为4月下旬—6月上旬(春末夏初), 而阿拉斯加湾风信标扇贝的繁殖期主要集中在夏季初, 为6月上旬—7月中旬[23]。
综上所述, 该实验课题组在引进风信标扇贝的基础上, 探究其性腺发育与繁殖周期变化规律。性腺发育分为4个时期, 根据本文所归纳性腺发育的特征可以对风信标扇贝的繁殖时间段进行预测。通过获得海水温度的实时变化, 研究者在一定程度上可以预估该扇贝群体性腺指数的变化趋势。研究结果不仅填补了其性腺发育研究方向上的空缺, 同时为风信标扇贝的人工繁育和商业养殖开发提供了重要的理论指导。
致谢 本文中风信标扇贝个体的取样和海水温度测量工作均在烟台海益苗业有限公司的大力协助下完成, 在此表示感谢。
| [1] |
农业部渔业渔政管理局. 2016中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2016. Bureau of Fisheries of the Ministry of Agriculture. China Fishery Statistical Yearbook 2016[M]. Beijing: China Agriculture Press, 2016. (  0) 0) |
| [2] |
张振东. 我国水产新品种研发基本情况与展望[J]. 中国水产, 2015(10): 39-42. Zhang Z D. Basic situation and prospects of developing new aquatic speices in China[J]. China Fisheries, 2015(10): 39-42. DOI:10.3969/j.issn.1002-6681.2015.10.018 (  0) 0) |
| [3] |
谢忠明. 我国引进美国海湾扇贝获得成功[J]. 海洋开发与管理, 1986(3): 70. Xie Z M. China successfully introduced bay scallop (Argioecten irradians) from America[J]. Ocean Development and Management, 1986(3): 70. (  0) 0) |
| [4] |
张福绥, 何义朝, 马江虎, 等. 虾夷扇贝的引种、育苗及试养[J]. 海洋科学, 1984, 5: 38-45. Zhang F S, He Y C, Ma J H, et al. Introduction and hatchery culture of Yesso scallop (Patinopecten yessoensis)[J]. Marine Science, 1984, 5: 38-45. (  0) 0) |
| [5] |
王春德. 紫扇贝引进和杂交新品种的培育[J]. 青岛农业大学学报(自然科学版), 2013(1): 73. Wang C D. Introduction of Purple scallop (Argopecten irradians) and development of new hybridization breed[J]. Journal of Qingdao Agricultural University, 2013(1): 73. (  0) 0) |
| [6] |
苏浩, 陈俅. 欧洲大扇贝人工繁育试验初报[J]. 河北渔业, 2013(6): 31-32. Su H, Chen Q. Preliminary report on hatchery culture of Great scallop (Pecten maximus)[J]. Hebei Fisheries, 2013(6): 31-32. DOI:10.3969/j.issn.1004-6755.2013.06.015 (  0) 0) |
| [7] |
张红智, 慕永通, 霍连才. 中国在世界扇贝产业中的地位-基于生产与贸易视角[J]. 安徽农业科学, 2016, 4: 268-274. Zhang H Z, Mu Y T, Huo L C. China's status in world scallop industry-based on Production and Trade[J]. Journal of Anhui Agricultural Sciences, 2016, 4: 268-274. (  0) 0) |
| [8] |
张福绥, 何义朝, 马江虎, 等. 海湾扇贝与海带轮养试验报告[J]. 海洋科学, 1987, 11(6): 1-6. Zhang F S, He Y Z, Ma J H, et al. A report on the experimental cultivation of bay scallop and kelp by turns[J]. Marine Sciences, 1987, 11(6): 1-6. (  0) 0) |
| [9] |
Bernard F R. Catalogue of the living Bivalvia of the eastern Pacific Ocean: Bering strait to cape horn[J]. Canadian Special Publication of Fisheries and Aquatic Sciences, 1983, 61: 1-102.
(  0) 0) |
| [10] |
Grau G. Pectinidae of the Eastern Pacific[M]. Los Angeles, California: University of Southern California Press, 1959.
(  0) 0) |
| [11] |
Shumway S E, Parsons G J. Scallops: Biology, ecology and aquaculture[J]. Developments in Aquaculture & Fisheriesence Elsevier, 2016, 40: 967-971.
(  0) 0) |
| [12] |
侯传宝. 虾夷扇贝亲贝培育中应注意的问题[J]. 当代水产, 2008, 36(12): 40-42. Hou C B. Issues in cultivation of Yesso scallop (Patinopecten yessoensis) that required attention[J]. Current Fisheries, 2008, 36(12): 40-42. DOI:10.3969/j.issn.1674-9049.2008.12.012 (  0) 0) |
| [13] |
於锋.广西茅尾海香港巨牡蛎(Crassostrea hongkongensis)遗传结构及其性腺发育研究[D].海南: 海南大学, 2016. Yu F. Studies on the Population Genetic Structure and Gonad Development of the Oyster (Crassostrea hongkongensis) in Maowei Sea, Guang xi, China[D]. Hainan: University of Hainan, 2016. (  0) 0) |
| [14] |
邵艳卿, 张炯明, 方军, 等. 人工蓄养斧文蛤的生殖周期及早期发育[J]. 中国水产科学, 2017, 24(1): 82-90. Shao Y Q, Zhang J M, Fang J, et al. Reproductive cycle and early development of Meretrix lamarkii (Veneroida: Veneridae) under artificial conditions[J]. Journal of Fisheries Sciences of China, 2017, 24(1): 82-90. (  0) 0) |
| [15] |
沈决奋, 杨爱国, 燕敬平. 海湾扇贝性腺发育的初步研究[J]. 海洋与湖沼, 1996, 27(6): 632-636. Shen J F, Yang A G, Yan J P. Preliminary study on gonad development of Bay scallop (Argioecten irradians)[J]. Oceanologia Et Limnologia Sinica, 1996, 27(6): 632-636. DOI:10.3321/j.issn:0029-814X.1996.06.010 (  0) 0) |
| [16] |
廖承义, 徐应馥, 王远隆. 栉孔扇贝的生殖周期[J]. 水产学报, 1983(1): 1-13. Liao C Y, Xu Y F, Wang Y L. Reproductive cycle of Chlamys farreri[J]. Journal of Fisheries of China, 1983(1): 1-13. (  0) 0) |
| [17] |
高悦勉, 田斌, 于永刚, 等. 大连塔河湾海区虾夷扇贝的性腺发育与繁殖规律[J]. 大连水产学院学报, 2007(5): 335-339. Gao Y M, Tian B, Yu Y G, et al. The gonadal development and reproductive cycle of Japanese scallop (Patinopecten yessoensis) in Tahe Bay in Dalian[J]. Journal of Dalian Fisheries University, 2007(5): 335-339. DOI:10.3969/j.issn.1000-9957.2007.05.004 (  0) 0) |
| [18] |
Sastry A N. Temperature effects in reproduction of the bay scallop, Aequipecten irradians Lamarck[J]. The Biological Bulletin, 1966, 130: 118-134. DOI:10.2307/1539958
(  0) 0) |
| [19] |
Loosanoff V L, Davis H C. Temperature requirements for maturation of gonads of Northern oyster[J]. Biology Bulletin, 1952, 103: 80-96. DOI:10.2307/1538408
(  0) 0) |
| [20] |
王如才. 海水贝类养殖学[M]. 青岛: 青岛海洋大学出版社, 1993. Wang R C. Science of Marine Shellfish Culture[M]. Qingdao: Qingdao Ocean University Press, 1993. (  0) 0) |
| [21] |
李文姬, 滕炜鸣, 王笑月, 等. 黄海北部虾夷扇贝性腺发育及繁殖规律研究[J]. 水产科学, 2012, 12: 703-707. Li W J, Teng W M, Wang X Y, et al. The gonadal development and life cycle in Japanese Scallop Patinopecten yessoensis in Northern Yellow Sea[J]. Fisheries Science, 2012, 12: 703-707. DOI:10.3969/j.issn.1003-1111.2012.12.002 (  0) 0) |
| [22] |
吴洪流, 王红勇, 王珺. 波纹巴非蛤性腺发育分期的研究[J]. 海南大学学报(自然科学版), 2002, 20(1): 41-47. Wu H L, Wang H Y, Wang J. Developmental stage of the gonad of the clam Paphia undulata[J]. Journal of Hainan University, 2002, 20(1): 41-47. DOI:10.3969/j.issn.1004-1729.2002.01.011 (  0) 0) |
| [23] |
Hennick D P. Reproductive cycle, size at maturity, and sexual composition of commercially harvested weathervane Scallops (Patinopecten caurinus) in Alaska[J]. Journal of the Fisheries Research Board of Canada, 2011, 27(11): 2112-2119.
(  0) 0) |
| [24] |
Shull G H. What is "Heterosis"?[J]. Genetics, 1948, 33(5): 439.
(  0) 0) |
| [25] |
Jr S K A, Gaffney P M, Scarpa J, et al. Inviable hybrids of Crassostrea virginica, (Gmelin) with C. rivularis, (Gould) and C. gigas, (Thunberg)[J]. Aquaculture, 1993, 113(4): 269-289. DOI:10.1016/0044-8486(93)90399-J
(  0) 0) |
| [26] |
王新成, 尤锋, 倪高田, 等. 石鲽与牙鲆人工杂交的研究[J]. 海洋科学, 2003, 27(1): 1-4. Wang C X, You F, Ni G T, et al. Hybridization between stone flounder (Kareius bicoloratus) and olive flounder (Paralichthys olivaceus)[J]. Marine Sciences, 2003, 27(1): 1-4. (  0) 0) |
| [27] |
沈钦龙. 绿鲍与皱纹盘鲍杂交育苗技术[J]. 齐鲁渔业, 2016, 3: 25-26. Shen Q L. Breeding technique in hybridization between Haliotis fulgens and H. discus hannai[J]. Shandong Fisheries, 2016, 3: 25-26. (  0) 0) |
| [28] |
王春德, 刘保忠, 李继强, 等. 紫扇贝与海湾扇贝种间杂交的研究[J]. 海洋科学, 2009, 33(10): 84. Wang C D, Liu B Z, Li J Q, et al. Inter specific hybridization between Purple scallop (Argopecten purpuratus) and bay scallop (Argioecten irradians)[J]. Marine Sciences, 2009, 33(10): 84. (  0) 0) |
| [29] |
于瑞海, 包振民, 王昭萍, 等. 栉孔扇贝×虾夷扇贝的杂交技术[J]. 中国海洋大学学报(自然科学版), 2006(1): 85-144. Yu R H, Bao Z M, Wang Z P, et al. A Study on hybridization between scallops Chlamys farreri and Patinopecten yessoensis[J]. Periodical of Ocean University of China, 2006(1): 85-144. (  0) 0) |
| [30] |
Bower S M, Blackbourn J, Meyer G R, et al. Effect of Perkinsus qugwadi on various species and strains of scallops[J]. Diseases of Aquatic Organisms, 1999, 36(2): 143-151.
(  0) 0) |
2. Yantai Marine Seeds Co., Ltd, Yantai 265600, China;
3. Laboratory for Marine Biology and Biotechnology, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China
 2019, Vol. 49
2019, Vol. 49


