2. 中国海洋大学海洋生物遗传学与育种教育部重点实验室,山东 青岛 266003;
3. 烟台丰泓海洋苗业有限公司, 山东 烟台 265617
海带(Saccharina japonica)属于冷温性藻类,在北半球5~15 ℃低温的冬季和早春生长旺盛[1]。海带幼苗的规模化繁育是海带养殖产业发展的基础。中国作为最大的海带养殖生产国,2019年用于养殖生产的海带幼苗为370亿株[2]。当前,海带“夏苗”是海带苗种生产的主要形式。在中国北方地区(主要是山东和辽宁沿海),使用夏苗技术生产海带种苗,要求种海带必须在8月中上旬前形成成熟的孢子囊群。目前生产上使用的海带品种,经过多年的人工选择成熟较早的个体作为种菜采孢子,并通过人工控制条件来调控其繁殖时间,在不断累代选择中逐渐形成了每年6月份开始出现孢子囊的规律。这与自然生海带形成孢子囊的规律不同,在太平洋北部自然生长的海带一般可跨3个年度,形成二年生海带,在生长过程中先后在孢子体发生后的次年早春和晚秋形成孢子囊群。杂交育种是海带种质改良的重要方法,通过不同遗传背景地理群体间的杂交,甚至不同近缘种之间的杂交,可以获得生产性状优良的海带养殖新品种。然而,生产实践表明,海带杂交新品种形成孢子囊群的特点,相对更接近其野生的亲本,而不同于常规养殖品种的亲本,也就是说杂种海带相比常规海带品种较晚成熟,其形成孢子囊的时间大大延迟,甚至到9月份才开始出现孢子囊[3]。因此,在中国北方8月中上旬的夏苗生产中,晚熟的杂交海带往往因尚未形成孢子囊,而无法作为采孢子的种菜,也就无法进行大规模的推广应用。虽然有利用海带配子体克隆采苗实现晚熟杂交海带产业化育苗的试验和实践[4-6],但基于配子体克隆育苗的方法在规模化生产中依然存在一些问题与不足,生产企业大多倾向于采用种海带释放游孢子采苗的传统方法[5]。因此,探索晚熟杂交海带良种的孢子囊适时诱导成熟,具有重要的应用价值。
对于孢子囊形成的条件、规律及人工诱导,在海带及其近缘种中已有一些研究报道。有研究表明通过提前采苗时间不能促进海带提前产生孢子囊[7]。光照是影响孢子囊形成的重要因素,但光周期的影响却有不同的结果,不同研究认为短日照[8-9]、长日照[10-12]培养条件下均能形成孢子囊,Boderskov等[13]首次通过黑暗诱导糖海带(Saccharina latissima)孢子囊的发生,Okamura[14]发现野生海带在背光面较大程度地形成孢子囊。另外,海带孢子体不同部位形成孢子囊的能力不同[9, 15],并有学者提出海带分生组织产生的某些抑制剂能抑制孢子囊的产生[16],通过对孢子体横切[15]和分离叶片组织[17]均能促进孢子囊的形成。除此之外,海带孢子体的成熟度(碳氮比值)[18]、培养温度[19]、脱落酸[20-21]和氮(N)磷(P)[22-23]浓度也影响海带孢子囊的发育。
这些研究多以野生的自然海带群体为对象,关于杂交海带孢子囊形成的研究较少。另外,对于铁(Fe3+)、种海带正反面不同向光摆放方式对海带孢子囊形成的影响少有报道,更缺乏关于同一实验材料的多因素条件的协同影响的研究。为此,本研究选取晚熟的杂交海带作为试验材料,比较不同温度、光照强度、脱落酸浓度、Fe3+浓度、营养盐浓度、孢子体横切以及海带凹凸面向光摆放方式等培养条件与方式对海带孢子囊形成的影响,探究影响孢子囊形成的主要环境因素,优化海带孢子囊形成的最适条件,以期实现缩短孢子囊促熟时间,节约室内养殖成本,为晚熟海带杂交品种孢子囊促熟提供技术参考,进而推动杂交海带的规模化示范与应用。
1 材料与方法 1.1 实验材料以“玉带1号”[24]海带杂交品系为实验材料。该品系的父母本分别是中国养殖海带品种海带黄官1号和母本野生海带,双亲杂交后代经过选育而成。该品系藻体具有颜色较浓褐、柔韧性较强、中带部较宽厚、边缘部较窄较厚、假根较发达、抓握力强、较耐高温、生长期长等特征,但该杂交品系较晚熟,在生产中一般在8月底9月初才自然形成孢子囊。
1.2 实验方法 1.2.1 材料预处理2020年7月从大连海带栽培区选取的种海带“玉带1号”。于光照强度60 μmol·m-2·s-1,水温15 ℃暂养一周后随机选取8株(长3.5~4 m,宽50~55 cm),在距离柄部1/4、边缘15~20 cm、靠近中带部位置, 从每株海带各取15个直径为2 cm的圆片状海带样品(单个圆片平均质量约1.09 g,平均厚度约3.56 mm)。控制水温13 ℃、光照强度60 μmol·m-2·s-1、光周期8∶16 (L∶D)条件,分别置于1 L容器中培养24 h,以最大程度去除因伤口产生的黏液,从8株海带中分别随机选出一个样品培养在2 L容器中(8个/瓶),每个容器中单个圆片作为1平行,共8个平行,每4天更换一次培养液并观察海带的变化。
1.2.2 诱导海带孢子囊形成的培养条件设置(1)光照强度:控制光照周期8∶16(L∶D)、营养盐N: 5 mg/L、P: 0.5 mg/L,分别设置光照强度为20、60和100 μmol·m-2·s-1 3个实验组(光照强度范围±5 μmol·m-2·s-1)。
(2) 营养盐:控制光照周期8∶16(L∶D)、光照强度60 μmol·m-2·s-1,分别设置氮、磷营养盐为:N: 0 mg/L、P: 0 mg/L,N: 2 mg/L、P: 0.2 mg/L,N: 5 mg/L、P: 0.5 mg/L(与(1)光照强度中60 μmol·m-2·s-1组为同一处理组),N: 0.5 mg/L、P: 5 mg/L,共4个实验组。
(3) Fe3+浓度:控制光照周期8∶16(L∶D)、营养盐N: 5 mg/L、P: 0.5 mg/L、光照强度60 μmol·m-2·s-1,分别设置Fe3+浓度为0(与(1)光照强度中60 μmol·m-2·s-1组为同一处理组)、0.05、0.10和0.20 mg/L 4个实验组。
(4) 脱落酸:控制光照周期8∶16(L∶D)、营养盐N: 5 mg/L、P: 0.5 mg/L、光照强度60 μmol·m-2·s-1,分别设置脱落酸浓度为0(与(1)光照强度中60 μmol·m-2·s-1组为同一处理组)、1×10-6、1×10-5和1×10-4 mol/L 4个实验组。
(5) 温度:控制光照周期8∶16(L∶D)、营养盐N: 5 mg/L、P: 0.5 mg/L、光照强度60 μmol·m-2·s-1,分别设置温度为8、13和17 ℃ 3个实验组。
(6) 横切:于海带育苗车间,设置横切组A:距离基部40 cm处横切孢子体叶片,横切宽度超过中带部,叶片上下部未完全分离;非横切组B:孢子体叶片不横切。每组各5株海带孢子体。光照强度40~100 μmol·m-2·s-1,海水水温16~18 ℃,光照时长8∶16(L∶D),记录孢子囊产生、破皮时间及位置。
(7) 培养方式:于海带育苗车间培养,设置A、B两组:A组为海带海上养殖时受光面与室内培养时的受光面一致(原受光面即孢子体凹面朝上),B组为海带海上养殖时受光面与室内培养时受光面相反(原受光面即孢子体凹面朝下),每组各5株海带孢子体。光照强度40~100 μmol·m-2·s-1,海水水温16~18 ℃,光照时长8∶16(L∶D),记录孢子囊产生、破皮时间及位置。
培养第一阶段除温度组(8和17 ℃)外,其他实验组均在13 ℃条件下培养,在实验过程中发现,17 ℃实验组大面积产生孢子囊,而13 ℃所有实验组均未产生孢子囊(21 d);第二阶段,第一阶段培养21 d后,将除8和13 ℃之外的实验组温度同步提升至17 ℃,其他培养条件不变,培养至实验结束。其中培养条件(6)横切和(7)培养方式组在育苗车间完成实验,温度始终维持原培养条件不变。记录孢子囊形成时间和数量,以及培养结束时形成的孢子囊面积。
1.3 孢子囊形成指标的测定在无影灯照射下使用相机拍摄海带孢子体表面变化并记录孢子囊形成过程。对培养结束时形成的孢子囊面积使用Image-Pro Plus 5.1软件进行统计,将一个圆片的两面形成的孢子囊面积合并统计作为一个平行。其中,培养条件(7)中同一个体的两面孢子囊面积分别统计。采用垂直背影平面面积分别计算孢子体总面积和孢子囊面积。另外,当孢子囊成熟后,其表层透明薄膜脱落,我们称之为“破皮”,破皮的数量也作为孢子囊发育程度的一个指标。
1.4 数据处理使用Excel软件统计海带圆片样品上形成的孢子囊面积,使用IBM SPSS Statistics 19.0对形成孢子囊面积的比值进行单因素方差分析、Duncan多重比较(P < 0.05)。
2 实验结果 2.1 光照强度对孢子囊形成的影响不同光照强度下形成的孢子囊情况如表 1所示。不同光照强度在孢子囊形成早期时存在显著影响,其中20 μmol·m-2·s-1光照更利于孢子囊的形成,在培养28 d后观察到2个圆片样品形成孢子囊,而60 μmol·m-2·s-1处理组只有1个圆片样品形成孢子囊,100 μmol·m-2·s-1处理组没有孢子囊形成;随着培养时间的延长,光照强度对孢子囊形成的影响减弱,不同光照强度下,不同处理组间孢子囊形成的数量逐渐趋于相同。孢子囊“破皮”是孢子囊发育程度的一个指标,由此可见,培养44~52 d左右,60~100 μmol·m-2·s-1处理组孢子囊破皮的数量更多,这说明孢子囊发育更快,且孢子囊的面积更大。综合来看,光照强度60~100 μmol·m-2·s-1更适合孢子囊的形成与发育。
|
|
表 1 不同光照强度下孢子囊形成与发育情况 Table 1 Sorus formation and development under different light intensities |
不同N、P营养盐浓度对孢子囊形成的影响如表 2所示,尽管培养44 d后,几乎所有的海带圆片样品都形成了孢子囊,但随着氮磷营养盐升高,无论是孢子囊形成的数量还是孢子囊的面积百分比都是增加的,这说明充足的N、P营养盐更有利于孢子囊的形成与发育。其中当N、P营养盐分别为5和0.5 mg/L时,孢子囊的形成速度最快,且最终的孢子囊面积最大,说明该N、P营养盐浓度最适合海带孢子囊的形成与发育。
|
|
表 2 不同比例N∶P浓度下孢子囊形成情况 Table 2 Sorus formation at different ratios of N and P concentrations |
添加不同浓度Fe3+对孢子囊形成的影响如表 3所示,添加浓度为0.20 mg/L的Fe3+培养到36 d时,首次观察到孢子囊形成,相比于未添加Fe3+对照组,0.2 mg/L处理组的孢子囊形成时间延后了8 d。Fe3+浓度越高,首次观察到孢子囊的时间越晚。在培养44 d后,所有海带圆片均形成了孢子囊,未添加Fe3+对照组在培养40 d时已全部形成孢子囊。在进入到孢子囊破皮阶段,未添加Fe3+组培养48 d后海带孢子囊全部破皮,而添加不同浓度Fe3+的处理组破皮数量都相对较少。在不同浓度Fe3+条件下孢子囊形成面积无显著差异(P>0.05),但都低于未添加Fe3+组。该结果说明自然海水中额外添加Fe3+不利于孢子囊的形成与发育。
|
|
表 3 不同浓度Fe3+条件下孢子囊形成情况 Table 3 Sorus formation at different concentrations of Fe3+ |
脱落酸对孢子囊形成的影响如表 4所示,孢子囊形成阶段,未添加外源脱落酸组优先观察到孢子囊形成,添加1×10-6 mol/L脱落酸在36 d全部形成孢子囊,添加更高浓度外源脱落酸与未添加脱落酸处理时均在44 d全部形成孢子囊。从孢子囊破皮情况来看,添加浓度1×10-4 mol/L处理组与不加脱落酸组的孢子囊破皮数量一致,1×10-6 mol/L处理组与1×10-5 mol/L处理组孢子囊破皮的速度更快,说明适量浓度的脱落酸能促进孢子囊的形成和破皮。添加不同浓度脱落酸与未添加脱落酸对形成孢子囊面积无显著差异(P>0.05)。
|
|
表 4 不同浓度脱落酸下孢子囊形成情况 Table 4 Sorus formation at different concentrations of abscisic acid |
温度对孢子囊形成的影响如表 5所示,17 ℃处理组最先观察到孢子囊,在培养24 d后全部样品都出现孢子囊,且在28 d全部开始破皮,早于其他温度处理组;13 ℃处理组在32 d时首次观察到孢子囊,在40 d时3个海带圆片样品形成孢子囊,培养至52 d时无新增孢子囊,且无孢子囊进入到破皮阶段;8 ℃处理组在20 d开始出现孢子囊,明显晚于17 ℃处理组,培养至52 d仅7个样品形成孢子囊。对孢子囊面积统计分析显示,3个温度处理组的孢子囊面积之间存在显著差异(P < 0.05),13 ℃处理组的孢子囊面积百分比最小,17 ℃处理组的孢子囊面积百分比最大。
|
|
表 5 不同温度条件下孢子囊形成情况 Table 5 Effect of sorus formation at different temperatures |
海带孢子体横切对孢子囊形成的影响如表 6所示。横切组(A)与未横切组(B)分别在培养15和24 d后全部开始形成孢子囊,且横切组(A)在培养27 d后全部开始出现孢子囊破皮,第5个孢子体在形成孢子囊前出现较大程度的腐烂,为避免其他藻体受到影响,在实验过程中剔除了该样本。未横切组(B)在培养33 d有4个出现破皮,第5个孢子体始终未出现破皮。对形成的孢子囊面积使用独立t检验发现,横切组孢子囊面积高于未横切组孢子囊面积,但二者无显著差异(p>0.05)。
|
|
表 6 横切对孢子囊形成的影响 Table 6 Effect on sorus formation when cross cutting |
如表 7所示,当海带在室内培养时,无论其受光面与海带在海上养殖时是否相同,都是在背光面首先形成孢子囊,且A(室内培养与海上养殖的受光面一致)、B(室内培养与海上养殖的受光面相反)两组背光面形成孢子囊的数量相似;而向光面较晚形成孢子囊,在实验结束时A组和B组分别尚有2株和3株未形成孢子囊。孢子囊破皮的数量也存在类似的规律。不同表面受光对形成的孢子囊面积的影响如图 1所示,室内培养受光面与在海上养殖的受光面是否一致对形成的孢子囊面积无显著影响,但孢子囊面积在背光一侧显著高于向光一侧(P < 0.05)。
|
|
表 7 不同表面受光对孢子囊形成数量的影响(n=5) Table 7 Effects of sorus formation when light on different surfaces (n=5) |
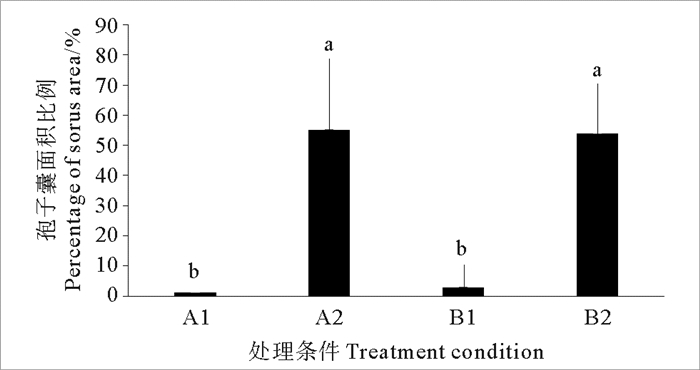
|
(A: 凹面向上,B: 凸面向上;1:向光面,2:背光面。不同字母代表不同处理组间有显著差异(p < 0.05)。A: Concave surface up, B: Convex surface up; 1: Facing light surface, 2: Back light surface. Different letters mean significant difference among different treatment groups(p < 0.05). ) 图 1 不同表面受光对形成孢子囊面积的影响 Fig. 1 Effects of the area of sorus formation when light on different surfaces |
海带孢子囊的形成受到光照强度、温度和营养盐等环境因素的影响[25]。野生二年生海带在次年早春的孢子体顶端出现少量孢子囊,并随着秋天出现水温下降、日照时间减少的情况,在海带表面开始大面积出现孢子囊。以往的研究表明,短日照和光照强度大于30 μmol·m-2·s-1的光强条件有利于糖海带和海带孢子囊的形成[15, 17, 26]。本研究结果显示,20 μmol·m-2·s-1充气培养时优先观察到孢子囊出现,培养到36 d时在不同光照强度下孢子囊形成数量基本相同,培养40 d时全部出现孢子囊。本研究发现孢子囊面积随着光照强度的增加而增大,且在60和100 μmol·m-2·s-1时孢子囊面积显著大于20 μmol·m-2·s-1时孢子囊面积(P < 0.05),适当增大光照强度能增加孢子囊面积。因此,在室内海带孢子囊促熟生产中,可通过控制光照强度在60~100 μmol·m-2·s-1范围内来促进孢子囊的形成与发育。另外,本研究发现海带在室内培养的受光面与海上养殖的受光面是否一致对孢子囊形成无显著影响,均表现为背光一侧孢子囊形成快于向光一侧,且背光面的孢子囊面积显著高于向光面。这与Okamura[14]发现野生海带和S. cichorioides总是在背光面形成更大面积的孢子囊的结果相一致。
N和P元素是控制海藻生长的必需元素[27-29],N、P元素影响到海带生长发育的多个方面,孢子囊的形成也受到N和P营养盐的影响[22-23]。Nimura等[30]提出不同海带需达到一定临界浓度N含量才能启动繁殖,高营养浓度有利于形成孢子囊[17]。另外,当叶片组织中的碳氮(C/N) 比值较低时会形成孢子囊[18]。本研究发现,添加N 5 mg/L和P 0.5 mg/L组孢子囊形成的面积显著高于其他组(P < 0.05),推测培养液中较高浓度的N和P能促进海带孢子囊的形成。
黄振华等[31]和Bartsch等[32]认为铁对藻类吸收氮、磷具有极大的促进作用,并有利于藻类发育增殖。本研究表明,添加与未添加Fe3+形成孢子囊的面积无显著差异(P>0.05),但未添加Fe3+时优先出现孢子囊,并在培养40 d时相比于其他添加Fe3+处理组提前全部形成孢子囊,可见添加Fe3+延缓了孢子囊的形成。海带往往在营养生长缓慢阶段出现孢子囊[32-36],而Kuwabara等[37]认为铁浓度为0.34 μmol/L时能促进Durvillaea Potatorum的营养生长,王潇等[38]发现Fe3+对海带配子体克隆营养生长具有促进作用,雷玉新等[39]研究发现在缺铁条件下藻类基本不生长。因此,我们推测Fe3+可能促进氮、磷吸收和海带生长,进而延缓孢子囊形成的相关繁殖活动。另外我们还发现,添加Fe3+培养的海带容易出现不同程度的腐烂,其原因有待进一步研究。
Schaffelke等[20]认为脱落酸可能作为极北海带(L. hyperborea)营养生长的抑制剂,在添加1×10-6~1×10-5 mol/L外源脱落酸时能够降低极北海带孢子体的伸长率,生长缓慢的孢子体具有较高浓度的脱落酸。本研究发现未添加外源脱落酸组优先(28 d)观察到孢子囊形成,添加脱落酸组在32 d后才观察到孢子囊形成,添加1×10-6 mol/L脱落酸时最早(36 d)全部形成孢子囊,添加更高浓度外源脱落酸的处理组与未添加脱落酸的处理组全部形成孢子囊的时间一致,且形成孢子囊面积百分比无显著差异,但添加1×10-5 mol/L脱落酸时孢子囊破皮较快。可见,添加1×10-6~1×10-5 mol/L外源脱落酸能促进海带孢子囊的形成与发育,这可能与孢子囊发生在生长缓慢的时期,而脱落酸能够抑制其生长有关,且内源性脱落酸季节性的增加与生殖组织的发育有关[21]。
研究表明,通过去除孢子体的分生组织并将孢子体保持在10 ℃左右的短日照条件下,可人工诱导海带孢子体在夏季育苗时形成孢子囊[15, 26]。在水温持续升高条件下,种海带大量形成孢子囊,温度有时须提高至16 ℃才能促进孢子囊释放游孢子[40]。但也有研究认为相对17 ℃而言,12 ℃培养条件下产生的孢子囊数量更多[41]。本研究发现,8 ℃培养的海带产生孢子囊的时间早于13 ℃,且8 ℃培养的海带产生的孢子囊面积更大。相比于8和13 ℃,17 ℃组优先形成孢子囊,且17 ℃组的孢子囊面积显著高于其他两组(P < 0.05)。值得提出的是,Lüning[9]发现在短日照条件下,相比于5~10 ℃,15 ℃更易于孢子体产生孢子囊,Li等[19]在18 ℃条件下培养的海带样品最先产生孢子囊,野生海带孢子体在20 ℃短日照的条件下可以形成孢子囊[42],这些研究报道都与本研究的结果相似,都表明稍高的温度(如17 ℃)对孢子囊形成具有明显促进作用。Mizuta等[43]研究发现孢子囊部分的ROS高于非孢子囊部分,较高温度条件下可能通过引起ROS的增加从而触发孢子囊的形成。
Buchholz等[16]研究发现相同条件培养时,远离分生组织的孢子体部位形成孢子囊,分生组织及附近部位不形成孢子囊。Stratmann等人较早地检测到抑制孢子囊形成的物质,并认为产生抑制剂的部位是海带叶片的基部和孢子体生长活跃的部分,这些抑制剂从叶片基部向远端方向移动,并在快速生长季节抑制幼孢子体孢子囊形成[16, 44]。Mizuta等[17]发现分离培养的孢子体组织更早地形成了孢子囊。本研究发现横切影响孢子体形成孢子囊,横切的孢子体早于未横切孢子体形成孢子囊。这与Pang等[15]研究发现足够宽度的横切能够更早产生孢子囊结果一致,但本研究发现横切对于形成孢子囊的最终面积无显著影响。在海带育苗场跟踪调查发现,在种海带促熟培养时由于场地和人员限制,导致大量受损伤和有切口的种海带腐烂。鉴于横切不能使孢子囊的面积显著增加,为减少种海带损失,不建议将横切作为批量促进海带孢子囊形成的手段。
4 结语海带孢子囊的形成受到多种环境因素的影响,包括温度、光照、营养盐、激素和藻体横切等,其中温度是最重要的因素之一,在短日照条件下,适当的高温可显著促进孢子囊的形成。综合考虑相关因素,本研究认为海带孢子囊促熟的适宜条件为:温度17 ℃、光照周期8∶16(L∶D)、光照强度60~100 μmol·m-2·s-1、营养盐浓度N 5 mg/L+P 0.5 mg/L、脱落酸浓度1×10-6~1×10-5 mol/L。
| [1] |
Tseng C K. Algal biotechnology industries and research activities in China[J]. Journal of Applied Phycology, 2001, 13(4): 375-380. DOI:10.1023/A:1017972812576 (  0) 0) |
| [2] |
农业农村部渔业渔政管理局. 中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2020. Fisheries and Fisheries Administration, The Ministry of Agriculture and Rural Affairs. China Fishery Statistical Yearbook[M]. Beijing: China Agriculture Press, 2020. (  0) 0) |
| [3] |
苏丽, 逄少军, 高素芹. 杂交海带新品系b013孢子囊形成规律初探[J]. 中国农业科技导报, 2017, 19(2): 119-123. Su L, Pang S J, Gao S Q. Investigation of sorus formation in the new Saccharina japonica hybrid cultivar b013[J]. Journal of Agricultural Science and Technology, 2017, 19(2): 119-123. DOI:10.13304/j.nykjdb.2015.735 (  0) 0) |
| [4] |
Pere`z R, Kaas R, Campelle F, et al. La culture de l'algue Undaria pinnatifida(Harvey) Suringar[C]// La Culture des Algues Marines Dans le Monde. France: Service de la Documentation et des Publications Ifremer, 1992.
(  0) 0) |
| [5] |
West J, Ohno M, Critchley A T. Seaweed cultivation and marine ranching[J]. Taxon, 1994, 43(1): 151. (  0) 0) |
| [6] |
Pang S J, Hu X Y, Wu C Y, et al. Intraspecific crossings of Undaria pinnatifida (Harv.) Sur.—a possible time-saving way of strain selection[J]. Chinese Journal of Oceanology&Limnology, 1997, 15(3): 227-235. (  0) 0) |
| [7] |
苏丽. 与海带品种培育相关的繁殖与栽培问题的研究[D]. 青岛: 中国科学院大学(中国科学院海洋研究所), 2018. Su L. The Study on Reproduction and Cultivation Problems Releated to Variety Breeding of the Economic Seaweed Saccharina japonica[D]. Qingdao: The University of Chinese Academy of Sciences (Institute of Oceanology, Chinese Academy of Sciences), 2018. (  0) 0) |
| [8] |
Gomez I, Lüning K. Constant short-day treatment of outdoor-cultivated Laminaria digitata prevents summer drop in growth rate[J]. British Phycological Bulletin, 2001, 36(4): 391-395. DOI:10.1080/09670260110001735548 (  0) 0) |
| [9] |
Lüning K. Photoperiodic control of sorus formation in the brown alga Laminaria saccharina[J]. Marine Ecology Progress Series, 1988, 45(1-2): 137-144. (  0) 0) |
| [10] |
Hoopen A T, Bos S, Breeman A M. Photoperiodic response in the formation of gametangia of the long-day plant Sphacelariarigidula (Phaeophyceae)[J]. Marine Ecology Progress, 1983, 13(2-3): 285-289. (  0) 0) |
| [11] |
Maggs C A. A long-day photoperiodic response in atractophora (Rhodophyta)[J]. British Phycological Journal, 1987, 22(3): 307-308. (  0) 0) |
| [12] |
Pang S J, Lüning K. Tank cultivation of the red alga Palmaria palmata: Year-round induction of tetrasporangia, tetraspore release in darkness and mass cultivation of vegetative thalli[J]. Aquaculture, 2006, 252(1): 20-30. DOI:10.1016/j.aquaculture.2005.11.046 (  0) 0) |
| [13] |
Boderskov T, Rasmussen M B, Bruhn A. Obtaining spores for the production of Saccharina latissima: Seasonal limitations in nature, and induction of sporogenesis in darkness[J]. Journal of Applied Phycology, 2021, 33: 1035-1046. DOI:10.1007/s10811-020-02357-0 (  0) 0) |
| [14] |
Okamura K. Icones of Japanese Algae[M]. Tokyo: Kazamashobo, 1927: 85-146.
(  0) 0) |
| [15] |
Shao J P, Lüning K. Breaking seasonal limitation: Year-round sporogenesis in the brown alga Laminaria saccharina by blocking the transport of putative sporulation inhibitors[J]. Aquaculture, 2004, 240(1-4): 531-541. DOI:10.1016/j.aquaculture.2004.06.034 (  0) 0) |
| [16] |
Buchholz C, Lüning K. Isolated, distal blade discs of the brown alga Laminaria digitata form sorus, but not discs, near to the meristematic transition zone[J]. Journal of Applied Phycology, 1999, 11(6): 579-584. DOI:10.1023/A:1008116828263 (  0) 0) |
| [17] |
Mizuta H, Nimura K, Yamamoto H, et al. Inducible conditions for sorus formation of the sporophyte discs of Laminaria japonica Areschoug (Phaeophyceae)[J]. Fisheries Science, 1999, 65(1): 104-108. DOI:10.2331/fishsci.65.104 (  0) 0) |
| [18] |
Harries R. An investigation by cultural methods of some of the factors influencing the development of the gametophytes and the early stages of the sporophytes of Laminaria digitata, L. saccharina, and L. clonstoni[J]. Annals of Botany, 1932, 46(184): 893-928. (  0) 0) |
| [19] |
Su L, Shan T F, Li J, et al. Aquaculture of the hybrid cultivars of Saccharina japonica: Removing the obstacle of sori production by photoperiodic control[J]. Aquaculture, 2020, 519: 734917. DOI:10.1016/j.aquaculture.2019.734917 (  0) 0) |
| [20] |
Schaffelke B. Abscisic acid in sporophytes of three Laminaria species (Phaeophyta)[J]. Journal of Plant Physiology, 1995, 146(4): 453-458. DOI:10.1016/S0176-1617(11)82008-0 (  0) 0) |
| [21] |
Nimura K, Mizuta H. Inducible effects of abscisic acid on sporophyte discs from Laminaria japonica Areschoug (Laminariales, Phaeophyceae)[J]. Journal of Applied Phycology, 2002, 14(3): 159-163. DOI:10.1023/A:1019929712633 (  0) 0) |
| [22] |
Mizuta H, Hayasaki J, Yamamoto H. Relationship between nitrogen content and sorus formation in the brown alga Laminaria japonica cultivated in southern Hokkaido, Japan[J]. Fisheries Science, 1998, 64(6): 909-913. DOI:10.2331/fishsci.64.909 (  0) 0) |
| [23] |
Kumura T, Yasui H, Mizuta H. Nutrient requirement for zoospore formation in two alariaceous plants Undaria pinnatifida (Harvey) Suringar and Alaria crassifolia Kjellman (Phaeophyceae: Laminariales)[J]. Fisheries Science, 2010, 72(4): 860-869. (  0) 0) |
| [24] |
刘义. 海带孢子囊形成的条件优化、生物学过程及调控机制研究[D]. 上海: 上海海洋大学, 2022: 14. Liu Y. Sorus Formation of Saccharina japonica: Optimization of Conditions, Biological Process and Regulatory Mechanism[D]. Shanghai: Shanghai Ocean University, 2022: 14. (  0) 0) |
| [25] |
Mizuta H, Nimura K, Yamamoto H. Sorus development on median and marginal parts of the sporophyte of Laminaria japonica Areschoug (Phaeophyceae)[J]. Journal of Applied Phycology, 1999, 11(6): 585-591. DOI:10.1023/A:1008163412333 (  0) 0) |
| [26] |
Forbord S, Skjermo J, Arff J, et al. Development of Saccharina latissima (Phaeophyceae) kelp hatcheries with year-round production of zoospores and juvenile sporophytes on culture ropes for kelp aquaculture[J]. Journal of Applied Phycology, 2012, 24(3): 393-399. DOI:10.1007/s10811-011-9784-y (  0) 0) |
| [27] |
Chapman A, Craigie J S. Seasonal growth in Laminaria longicruris: Relations with dissolved inorganic nutrients and internal reserves of nitrogen[J]. Marine Biology, 1977, 40(3): 197-205. DOI:10.1007/BF00390875 (  0) 0) |
| [28] |
Chapman A, Markham J W, Lüning K. Effects of nitrate concentration on the growth and physiology of Laminaria saccharina (Phaeophyta) in culture1, 2[J]. Journal of Phycology, 1978, 14(2): 195-198. DOI:10.1111/j.1529-8817.1978.tb02448.x (  0) 0) |
| [29] |
Manley S L, North W J. Phosphorus and the growth of juvenile Macrocystis pyrifera (Phaeophyta) sporophytes1[J]. Journal of Phycology, 1984, 20(3): 389-393. DOI:10.1111/j.0022-3646.1984.00389.x (  0) 0) |
| [30] |
Nimura K, Mizuta H, Yamamoto H. Critical contents of nitrogen and phosphorus for sorus formation in four laminaria species[J]. Botanica Marina, 2002, 45(2): 184-188. (  0) 0) |
| [31] |
黄振芳, 刘昌明, 刘波, 等. 铁锰微量元素对淡水藻类的生长影响研究[J]. 北京师范大学学报(自然科学版), 2009, 45(Z1): 607-611. Huang Z F, Liu C M, Liu B. Impact of trace elements iron and manganese on algae growth[J]. Journal of Beijing Normal University (Natural Science), 2009, 45(Z1): 607-611. (  0) 0) |
| [32] |
Bartsch I, Wiencke C, Bischof K, et al. The genus Laminaria sensulato: Recent insights and developments[J]. European Journal of Phycology, 2008, 43(1): 1-86. (  0) 0) |
| [33] |
Markham J W. Observations on the ecology of Laminaria sinclairii on three northern oregon beaches1, 2[J]. Journal of Phycology, 1973, 9: 336-341. (  0) 0) |
| [34] |
Patten M, Yarish C. Allocation of blade surface to reproduction in Laminaria longicruris of Long Island Sound (USA)[J]. Hydrobiologia, 1993, 260-261(1): 173-181. (  0) 0) |
| [35] |
Chapman A. Reproduction, recruitment and mortality in two species of Laminaria in southwest Nova Scotia[J]. Journal of Experimental Marine Biology and Ecology, 1984, 78(1-2): 99-109. (  0) 0) |
| [36] |
Kain J M, Jones N S. The biology of Laminaria hyperborea Ⅶ. Reproduction of the sporophyte[J]. Journal of the Marine Biological Association of the United Kingdom, 1975, 55(3): 567-582. (  0) 0) |
| [37] |
Kuwabara J S. Gametophytic growth by macrocystis pyrifera (Phaeophyta) in response to various iron and zinc concentrations[J]. Journal of Phycology, 1981, 17(4): 417-419. (  0) 0) |
| [38] |
王潇, 刘福利, 梁洲瑞, 等. 铁离子对海带配子体克隆系生长发育的影响[J]. 中国水产科学, 2020, 27(9): 52-61. Wang X, Liu F L, Liang Z R, et al. Effects of iron on the growth and development of gametophyte clones in Saccharina japonica[J]. Journal of Fishery Sciences of China, 2020, 27(9): 52-61. (  0) 0) |
| [39] |
雷玉新, 刘耀兴, 席银, 等. 水体中铁离子和氮磷比对藻类生长影响研究[J]. 生态科学, 2016, 35(1): 75-78. Lei Y X, Liu Y X, Xi Y, et al. Study on effects of iron ion and nitrogen-phosphorus ratio on the growth of algae[J]. Ecological Science, 2016, 35(1): 75-78. (  0) 0) |
| [40] |
Flavin K, Flavin N, Flahive B. Kelp Farming Manual: A Guide to the Processes, Techniques, and Equipment for Farming Kelp in New England Waters[R]. New England: Ocean Approved, 2013.
(  0) 0) |
| [41] |
Demes K W, Graham M H. Abiotic regulation of investment in sexual versus vegetative reproduction in the clonal kelp Laminaria sinclairii (Laminariales, Phaeophyceae)[J]. Journal of Phycology, 2011, 47(3): 463-470. (  0) 0) |
| [42] |
Tokuda H, Ohno M, Ogawa H. The Resources and Cultivation of Seaweeds[M]. Tokyo: Midori Shobo, 1987: 116-132.
(  0) 0) |
| [43] |
Mizuta H, Yasui H. Significance of radical oxygen production in sorus development and zoospore germination in Saccharina japonica (Phaeophyceae)[J]. Botanica Marina, 2010, 53(5): 409-416. (  0) 0) |
| [44] |
Lüning K, Wagner A, Buchholz C. Evidence for inhibitors of sporangium formation in Laminaria digitata (Phaeophyceae) during the season of rapid growth[J]. Journal of Phycology, 2000, 36(6): 1129-1134. (  0) 0) |
2. Key Laboratory of Marine Genetics and Breeding of Ministry of Education, Ocean University of China, Qingdao 266003, China;
3. Yantai Fenghong Marine Seeds Company Limited, Yantai 265617, China
 2023, Vol. 53
2023, Vol. 53


