GATA家族是一类含有保守锌指结构并能识别和结合靶基因启动子上特定基序[T/A(GATA)A/G]的转录因子。该家族除了参与器官形态的发生和细胞的增殖外,也在性别的分化中发挥着重要的作用。比如:小鼠GATA4可通过调节苗勒管(Mullerian duct)的退化和雄激素的产生来促成雄性生殖腺的发育[1-2];尼罗罗非鱼gata4能上调雄性通路相关基因amh的表达,抑制雌性通路相关基因cyp19a1a的表达[3-4],表明GATA4为启动雄性通路的重要基因。新近,使用生物信息学方法,研究者发现了一种新的锌指蛋白,称为GATA-like protein-1 (ZGLP-1)[3-4]。在小鼠中,Zglp-1的锌指结构与GATA家族的锌指结构高度同源,编码Zglp-1的基因也被称为Zglp-1(Zinc finger,GATA-like protein-1)[5-7]。
有研究发现, 小鼠zglp-1基因除了在成体卵巢的颗粒细胞和睾丸的支持细胞中表达外,也在胚胎期的生殖细胞中表达[5-7]。敲除纯合突变zglp-1基因可导致雌性小鼠的卵巢发育严重萎缩,卵泡不能形成,在出生的雌性卵巢中检测到极缺乏卵母细胞[5-7];而敲除纯合突变zglp-1基因对雄性小鼠性腺发育的影响要小一些,虽然大部分成年个体精子的形成有严重的缺陷,但仍能发现有生育功能的精子存在[5-7]。还有研究表明,在小鼠中,Zglp-1能够抑制转录因子GATA6的转录活性,而GATA6是性腺分化及发育过程中一种重要的转录因子[4],这表明Zglp-1可能是转录抑制型GATA转录因子[8]。
文昌鱼属于海洋原索动物,介于无脊椎动物和脊椎动物之间,在进化上占有极其重要的地位,是研究发育与进化的理想模式动物[9-10]。文昌鱼雌雄异体,野生群体文昌鱼的雌、雄比例接近1∶1[11-12]。另外,文昌鱼身体构造简单,皮肤透明,肉眼即可观察到性腺等内部器官的发育情况;同时文昌鱼性腺中的精、卵细胞发育比较同步。因此,文昌鱼不仅是研究脊椎动物起源进化和发育生物学的理想模型,也是研究性腺发育、性别分化的理想材料。目前,对文昌鱼性腺发育与调控的研究还比较零散。Shi等[13]通过性染色体连锁基因nodal突变体繁育后代的性别比例分析得出,佛罗里达文昌鱼的性染色体属于ZW型。Mizuta和Kubokawa[14]克隆到文昌鱼细胞色素P450基因CYP11A、CYP17和CYP19。Barker[15]发现细胞色素P450基因编码的蛋白质分别参与催化由胆固醇合成孕激素、雄激素和雌激素的关键反应。Wang等[16-18]研究揭示文昌鱼已经出现类似脊椎动物的垂体-生殖腺调控轴,而且文昌鱼的哈氏窝与脊椎动物的垂体同源。但是,迄今鲜有对文昌鱼性腺发育与性别分化调控的分子机制的研究。本研究通过分析雌、雄文昌鱼转录组测序数据,获得了在雌、雄文昌鱼中显著差异表达的基因,为文昌鱼性别相关基因的研究提供了重要的基础信息[19]。在这些雌、雄文昌鱼差异表达基因中,zglp-1基因在雌性文昌鱼中的表达显著高于在雄性文昌鱼中的表达[19]。本文进一步对青岛文昌鱼zglp-1的进化和组织表达进行了研究,以期为其在雌、雄性腺发育及分化中的作用提供参考。
1 材料与方法 1.1 实验动物青岛文昌鱼(Branchiostoma japonicum,曾用名B. belcheri tsingtauense)取自山东省青岛市崂山区沙子口附近海区。取5月初采集的文昌鱼,此时期的文昌鱼大部分有明显的性腺,在实验室每天以单细胞藻类喂食2次。在实验开始前,将其在消过毒的过滤海水中进行2 d的绝食,以去除肠道内的所有食物。
1.2 实验方法 1.2.1 cDNA模板的制备使用RNA提取试剂盒(Total RNA Kit Ⅰ, OMEGA)对青岛文昌鱼总RNA进行提取,通过Nanodrop仪检测RNA的浓度,并用琼脂糖凝胶电泳检测RNA的完整性。使用PrimescriptTM RT reagent Kit with gDNA Eraser (Perfect Real Time)试剂盒将提取的RNA反转录为cDNA,以青岛文昌鱼的持家基因ef1α作为检测对象,对cDNA进行质检,以确定该模板是否可用。ef1α基因上、下游引物序列为:F1:5’-TGCTGATTGTGGCTGCTGGTACTG-3’和R1:5’-GGTGTAGGCCAGCAGGGCG TG-3’。
1.2.2 文昌鱼zglp-1基因片段的克隆通过MegAlign软件将青岛文昌鱼转录组测序结果中筛选出的zglp-1基因序列与佛罗里达文昌鱼zglp-1基因序列按照Clustal W方法进行比对,然后将两者保守区域部分的序列利用Primer Premier 5软件设计引物,以1.2.1所述合成的cDNA模板进行zglp-1基因片段的克隆,所用引物序列为:F2:5’-ACTCGGTCCTGGACCACAATTA-3’和R2:5’-GGATGCTGAAGTAGGAGCGAAT-3’。PCR反应条件为:94 ℃ 5 min;94 ℃ 30 s、55 ℃ 30 s、72 ℃ 50 s,35个循环;72 ℃ 7 min;4 ℃长期保存。PCR扩增产物测序,将测序结果与两者锌指结构域序列进行对比分析。
1.2.3 RACE技术克隆文昌鱼zglp-1 cDNA序列通过RACE技术(SMART 5’RACE和3’RACE,Clontech)克隆青岛文昌鱼zglp-1 cDNA序列,用卵巢组织cDNA作为5’RACE的模板设计一轮引物,并设计二轮引物进行巢氏PCR。一轮引物序列为:F3:5’-ACGTGCCAACAGCGGGTACATCGGA-3’和R3:5’-CTAATACGACTCACTATAGGGCAAGCAGTG GTATCAA CGCAGAGT-3’。PCR反应条件为:94 ℃ 10 min;94 ℃ 30 s、60 ℃ 30 s、72 ℃ 90 s,35个循环;72 ℃ 10 min;4 ℃长期保存。二轮引物序列为:F4:5’-GCAGGACTCTTGGTGGGTTTGGCG-3’和R4:5’-CTAATACGACTCACTATAGGGC-3’。PCR反应条件为:94 ℃ 10 min;94 ℃ 30 s、60 ℃ 30 s、72 ℃ 90 s,35个循环;72 ℃ 10 min;4 ℃长期保存。PCR扩增产物测序。再根据拼接后的序列设计引物克隆文昌鱼zglp-1 cDNA序列。引物序列为:F5:5’-ATGTATCCACCGTTTGCATTTTGCG-3’和R5:5’-TTAAATACTGTATCGGCGAAAGATGGAGA-3’。PCR反应条件为:94 ℃ 5 min;94 ℃ 30 s、55 ℃ 30 s、72 ℃ 50 s,35个循环;72 ℃ 7 min;4 ℃长期保存。PCR扩增产物,并通过测序进行确认。
1.2.4 文昌鱼zglp-1基因生物信息学及进化分析 1.2.4.1 文昌鱼zglp-1基因进化分析在NCBI数据库中查找不同物种间zglp-1基因的核苷酸序列及氨基酸序列,利用DNASTAR软件(Lasergene)的Megalign程序通过Clustal W方法进行多序列比对。使用MEGA 6.0软件依据所选基因的氨基酸序列选用邻接法(Neighbour-Joining)建立关于该蛋白的系统进化树。用Sequence Viewer(http://www.ncbi.nlm.nih.gov/projects/sviewer/)和Ensembl Genome Browser(http://www.ensembl.org)对代表物种的zglp-1基因在染色体上的位置进行比较。
1.2.4.2 文昌鱼zglp-1基因序列及结构分析在SeqBuider(Lasergene)软件中导入文昌鱼zglp-1基因完整开放阅读框(ORF)序列,分析其编码的氨基酸序列和分子量大小等参数。通过SMART网站(http://smart.embl.de/)对该序列进行结构域预测,并通过SWISS MODEL网站(http://swissmodel.expasy.org/)对zglp-1基因ORF编码的蛋白的三维结构进行预测。
1.2.5 半定量RT-PCR和实时定量PCR利用半定量RT-PCR和实时定量PCR(Real-time PCR)检测青岛文昌鱼zglp-1基因在各组织中的表达情况。半定量RT-PCR实验中,根据青岛文昌鱼zglp-1基因序列设计特异性引物,引物序列为:F6:5’-CCTCATCCCAAACCTTCCCTC-3’和R6:5’-TTGTACCTGATTCCACATGCGTTA-3’。以ef1α为内参基因,cDNA为模板进行PCR扩增。PCR反应条件为:94 ℃ 5 min;94 ℃ 30 s、60 ℃30 s、72 ℃ 30 s、72 ℃ 10 min,28个循环。琼脂糖凝胶电泳检测。实时定量PCR实验中,内参基因为ef1α基因,所用引物对也为F6和R6。PCR反应条件为:95 ℃ 15 s;95 ℃ 5 s、60 ℃ 15 s、72℃ 35 s,40个循环。各样孔的CT值和溶解曲线通过计算机软件ABI 7500 SDS PCR系统进行分析,利用Graph Pad Prism5软件绘制柱状图。实验重复3次。
1.2.6 原位杂交根据扩增得到的青岛文昌鱼zglp-1基因序列设计探针,所用引物对为F2和R2。SP6和T7启动子序列分别加在正向引物和反向引物的5’端。以青岛文昌鱼cDNA为模板,用合成探针时所用的引物进行PCR扩增。PCR产物测序后,以测序正确的质粒为模板,使用Roche公司DIG RNA Labeling kit试剂盒体外转录获得DIG标记的RNA正义和反义探针。使用Nanodrop仪检测探针的浓度,并通过琼脂糖凝胶电泳检测探针的完整性。使用眼科剪将文昌鱼剪成2段,分别放入4%PFA中,在4 ℃条件下固定过夜。将文昌鱼组织从多聚甲醛溶液(PFA)中取出后,将组织块经过梯度脱水、透明、浸蜡等一系列处理后,滴加石蜡浸润整个组织块,进行石蜡包埋,固定于石蜡切片机进行切片,厚度为8 μm。在DEPC水中展片,将切片贴于载玻片,置于原位杂交炉中烘片。然后脱蜡复水,用Proteinase K消化蛋白,4%PFA固定组织,稀盐酸溶液处理组织,在三乙醇胺/乙酸酐混合液中进行孵育。然后进行预杂交、杂交,封闭液封闭组织,滴加染色液显色。最后在显微镜下观察并拍照保存。
2 结果 2.1 青岛文昌鱼zglp-1基因的克隆为对zglp-1基因进行进一步研究,我们克隆了该基因在青岛文昌鱼中的同源基因。以青岛文昌鱼卵巢组织cDNA为模板,首先运用引物对F2和R2扩增了文昌鱼zglp-1基因序列片段534 bp(见图 1(a))。接着利用RACE技术克隆得到的青岛文昌鱼zglp-1 cDNA为1 383 bp,其中ORF序列长1 170 bp,编码389个氨基酸(见图 1(b))。比对青岛文昌鱼和佛罗里达文昌鱼zglp-1基因核苷酸和氨基酸序列,发现青岛文昌鱼和佛罗里达文昌鱼zglp-1基因核苷酸序列同源性为87.7%,Zglp-1蛋白氨基酸序列同源性为87.5%。

|
((a)青岛文昌鱼zglp-1基因片段PCR扩增结果。M为Marker,1为克隆到的青岛文昌鱼zglp-1基因序列片段。(b)克隆到的青岛文昌鱼zglp-1 cDNA、ORF碱基序列及其对应的氨基酸序列。(a) PCR amplification of Qingdao amphioxus zglp-1 gene fragment. The M lane is Marker, and 1 shows PCR products of the Qingdao amphioxus zglp-1 gene fragment.(b) The zglp-1 cDNA、ORF base sequence and deduced amino acid sequence of the zglp-1 gene in Qingdao amphioxus. ) 图 1 青岛文昌鱼zglp-1基因的克隆 Fig. 1 The cloning of zglp-1 gene in Qingdao amphioxus |
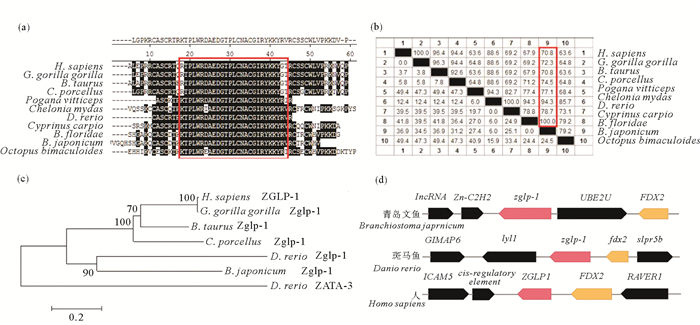
比对各物种Zglp-1的锌指结构域序列,发现该结构域序列在进化上较为保守(见图 2(a)),青岛文昌鱼与佛罗里达文昌鱼(B. floridae)Zglp-1锌指结构域序列完全一致,而文昌鱼Zglp-1与脊椎动物Zglp-1锌指结构域序列相似性为70.8%~94.3%(见图 2(b)),其中文昌鱼Zglp-1与斑马鱼Zglp-1蛋白锌指结构域部分相似性最高。基于不同物种Zglp-1蛋白的氨基酸序列(见表 1),利用邻接法构建了系统进化树,结果显示文昌鱼Zglp-1与斑马鱼Zglp-1首先聚在一起,它们共同处于哺乳动物Zglp-1进化的基部(见图 2(c))。
|
((a)不同物种Zglp-1蛋白的锌指结构域氨基酸序列比对,红色方框表示保守性较高的区域。(b)不同物种Zglp-1蛋白的锌指结构域氨基酸序列相似性分析。(c)文昌鱼与其他物种Zglp-1的系统进化分析。通过MEGA 6.0软件对不同物种的Zglp-1氨基酸序列用邻接法建立系统进化树。以斑马鱼GATA-3序列作为外类群。所用序列来源参见表 1。(d)用Sequence Viewer和Ensembl Genome Browser对青岛文昌鱼、斑马鱼及人Zglp-1的同源基因在染色体上的位置进行比较。方框代表基因,箭头代表转录方向。(a)Alignment of the amino acid sequences of the zinc finger domain of Zglp-1 proteins from different species. Red squares indicate areas of the highly conserved sequence. (b)Similarity analysis of amino acid sequences between the zinc finger domain of Zglp-1 proteins from different species. (c)Phylogenetic analysis of Zglp-1 in amphioxus and other species. The amino acid sequences of the Zglp-1 from different species are used to construct the tree with the maximum likelihood method in MEGA 6.0 software. The GATA-3 sequence in D. rerio is used as the outgroup in the tree. See table 1 for sequence sources.(d)Sequence Viewer and Ensembl Genome Browser are used to compare the locations of homologous genes in zglp-1 of B. japonicum, D. rerio and H. sapiens on chromosomes. The boxes represent genes and the arrows represent transcription directions. ) 图 2 Zglp-1的系统进化分析 Fig. 2 Phylogenetic analysis of Zglp-1 |
|
|
表 1 本文涉及到的基因序列来源 Table 1 The source of the gene sequence involved in this paper |
对斑马鱼和人染色体上zglp-1基因位点周围基因的分析发现,zglp-1基因与FDX2基因紧密连锁,且顺序、方向一致(见图 2(d)),表明在脊椎动物的进化过程中,zglp-1基因在染色体上表现出了很好的同线性。类似地,本研究还发现,青岛文昌鱼zglp-1基因也与FDX2基因连锁,但两者之间插入了1个UBE2U基因。上述结果说明,文昌鱼zglp-1基因为斑马鱼和人zglp-1基因的同源基因。相对于文昌鱼基因组,斑马鱼和人的基因组分别经历了2轮和3轮倍增,但它们基因组中尚未发现zglp-1的其他同源基因。
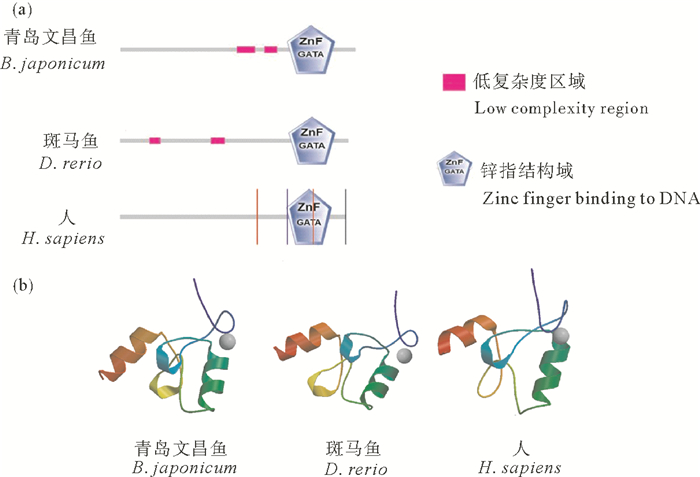
2.3 Zglp-1蛋白结构的进化分析选取青岛文昌鱼、斑马鱼及人的Zglp-1作为代表,利用SMART程序对其二级结构进行预测分析,发现从无脊椎动物文昌鱼到脊椎动物斑马鱼和人Zglp-1蛋白的二级结构具有较高的相似性,均具有保守的锌指结构域(见图 3(a))。
|
((a)SMART分析青岛文昌鱼、斑马鱼及人Zglp-1蛋白的二级结构。(b)Swiss-Model在线软件对青岛文昌鱼、斑马鱼及人Zglp-1蛋白三维结构的预测和比较。(a)SMART analysis of secondary structure of Zglp-1 protein in B. japonicum, D. rerio and H. sapiens. (b)Three-dimensional structural comparison of predicted Zglp-1 proteins in B. japonicum, D. rerio and H. sapiens. The 3D structure of Zglp-1 protein is predicted by Swiss-Model online software. ) 图 3 青岛文昌鱼、斑马鱼及人Zglp-1蛋白的二级结构及三维结构比较 Fig. 3 The comparison of the secondary structure or the three-dimensional structure of Zglp-1 proteins in B. japonicum, D. rerio and H. sapiens |
利用Swiss-Model在线软件对青岛文昌鱼、斑马鱼及人Zglp-1蛋白的三维结构进行预测,发现人的ZGLP-1包含2个α螺旋、1个β折叠片层以及一个锌离子结合区;斑马鱼及青岛文昌鱼的Zglp-1的α螺旋和β折叠的数目均相同,分别包含2个α螺旋和2个β折叠片层,外加一个锌离子结合区(见图 3(b)),显示该蛋白的三维结构在从原索动物到脊椎动物的进化上也表现出较好的保守性。
2.4 青岛文昌鱼zglp-1基因组织分布的PCR检测利用半定量RT-PCR检测zglp-1在青岛文昌鱼各个组织中的表达情况,结果显示文昌鱼zglp-1基因主要在性腺组织(精巢和卵巢)中特异性表达(见图 4(a))。运用实时定量PCR(Real-time PCR)技术的检测结果类似,zglp-1基因高表达于卵巢和精巢中,其中在卵巢中的表达量高于精巢;在其他组织中也有表达,但是表达水平很低(见图 4(b))。

|
((a)为半定量RT-PCR检测zglp-1基因在青岛文昌鱼不同组织中的表达。Mu:肌肉;Nc:脊索;Gi:鳃;Hc:肝盲囊;Hg:后肠;Te:精巢;Ov:卵巢。(b)为实时定量PCR(Real-time PCR)技术检测zglp-1基因在青岛文昌鱼不同组织中的表达。(a) The expression of zglp-1 gene in different tissues of Qingdao amphioxus by semiquantitative RT-PCR. Mu: Muscle; Nc: Notochord; Gi: Gill; Hc: Hepatic caecum; Hg: Hindgut; Te: Testis; Ov: Ovary. Figure (b) The expression of zglp-1 gene in different tissues of Qingdao amphioxus by Real-time PCR. ) 图 4 青岛文昌鱼zglp-1基因组织表达的PCR检测 Fig. 4 Expression of zglp-1 gene in various tissues of Qingdao amphioxus by PCR |
对文昌鱼zglp-1基因进行切片原位杂交,检测文昌鱼zglp-1基因在各个组织中的表达。结果显示,在肌肉及脑泡(a)、脊索及后肠(b)组织中未检测到阳性信号,在肝盲囊及鳃(c、d)组织中出现了阳性信号,在卵巢(c)和精巢(d)中有明显的阳性信号,特别是在卵巢中信号最强;而用正义探针杂交的阴性对照组(e)~(h)均无杂交信号出现(见图 5)。

|
((a)~(d)为反义探针杂交后的结果(实验组);(e)~(h)为正义探针杂交后的结果(阴性对照)。Cv:脑泡;H:哈氏窝;Gi:鳃;Hc:肝盲囊;Hg:后肠;Mu:肌肉;No:脊索;Ov:卵巢;Te:精巢。标尺线:50 μm。Figure (a)~(d) are the results of hybridization using antisense probes (experimental group); Figure (e)~(h) are the results of hybridization using sense probes. Cv: Cerebral vesicle; H: Hastel's nest; Gi: Gill; Hc: Hepatic caecum; Hg: Hindgut; Mu: Muscle; No: Notochord; Ov: Ovary; Te: Testis. Bar: 50 μm. ) 图 5 青岛文昌鱼zglp-1基因切片原位杂交 Fig. 5 Section in situ hybridization of zglp-1 gene in Qingdao amphioxus |
研究发现,具有GATA样锌指结构的转录因子Zglp-1(Zinc finger, GATA-like protein 1)决定小鼠卵子发生的细胞命运,为雌性小鼠正常繁育所需要[2-4]。本研究通过转录组测序分析性腺发育成熟的雌雄青岛文昌鱼差异表达显著基因时,也发现zglp-1基因在雌性文昌鱼中表达量显著高于其在雄性文昌鱼中的表达[19]。文昌鱼处于无脊椎动物进化至脊椎动物的过渡类型,因此,对文昌鱼zglp-1基因进行研究对于揭示其进化具有重要意义。本文首先通过生物信息学方法对zglp-1基因的进化进行了分析,发现其全长序列在各物种中相似性不高,但Zglp-1蛋白的二级及三维结构具有很高的保守性,特别是其锌指结构域十分相似。同线性分析表明,文昌鱼zglp-1基因为斑马鱼和人zglp-1基因的同源基因,这是首次在原索动物文昌鱼中鉴定出zglp-1基因。系统进化分析显示,文昌鱼Zglp-1处于脊椎动物Zglp-1进化的基部,可能代表了脊椎动物Zglp-1进化的原始形式。
小鼠zglp-1基因主要表达于卵巢[2]。本文发现,青岛文昌鱼zglp-1基因在卵巢组织中的表达最高,但其在精巢中也有较高表达,暗示文昌鱼zglp-1基因虽然也主要在卵巢发育中发挥作用,但与其在哺乳动物中的功能可能还有差异,可能不仅仅决定卵子发生的细胞命运。文昌鱼zglp-1基因可能在文昌鱼卵巢和精巢发育中都发挥着重要的作用,下一步可利用CRISPR/Cas9技术对文昌鱼中zglp-1进行基因敲除,研究文昌鱼zglp-1在性腺发育乃至性别决定与分化中的功能。总之,关于文昌鱼zglp-1基因的功能及作用机制还有待于进一步的研究。
| [1] |
Anttonen M. FOG-2 and GATA-4 Are Coexpressed in the mouse ovary and can modulate mullerian-inhibiting substance expression[J]. Biology of Reproduction, 2002, 68(4): 1333-1340. (  0) 0) |
| [2] |
Tevosian S G, Albrecht K H, Crispino J D, et al. Gonadal differentiation, sex determination and normal sry expression in mice require direct interaction between transcription partners GATA4 and FOG2[J]. Development, 2002, 129(19): 4627-4634. DOI:10.1242/dev.129.19.4627 (  0) 0) |
| [3] |
Li J, Chen W, Wang D, et al. GATA4 is involved in the gonadal development and maturation of the teleost fish tilapia, Oreochromis niloticus[J]. Journal of Reproduction and Development, 2012, 58(2): 237-242. DOI:10.1262/jrd.11-131S (  0) 0) |
| [4] |
叶凯. 尼罗罗非鱼GATA因子表达及其功能的初步研究[D]. 重庆: 西南大学, 2012. Ye K. Preliminary Studies on Expression Patterns and Functional Analysis of GATA Factors in Nile Tilapia[D]. Chongqing: Xinan University, 2012. (  0) 0) |
| [5] |
Strauss T J, Castrillon D H, Hammes S R. GATA-like protein-1 (GLP-1) is required for normal germ cell development during embryonic oogenesis[J]. Reproduction, 2011, 141: 173-181. DOI:10.1530/REP-10-0376 (  0) 0) |
| [6] |
Li S, Lu M M, Zhou D, et al. GLP-1: A novel zinc finger protein required in somatic cells of the gonad for germ cell development[J]. Develomental Biology, 2007, 301: 106-116. DOI:10.1016/j.ydbio.2006.07.048 (  0) 0) |
| [7] |
Nagaoka S I, Nakaki F, Miyauchi H, et al. ZGLP1 is a determinant for the oogenic fate in mice[J]. Science, 2020, 367(6482): eaaw4115. DOI:10.1126/science.aaw4115 (  0) 0) |
| [8] |
Raymond C S, Shamu C E, Shen M M, et al. Evidence for evolutionary conservation of sex determining genes[J]. Nature, 1998, 391(6668): 691-695. DOI:10.1038/35618 (  0) 0) |
| [9] |
Holland L Z, Laudet V, Schubert M. The chordate amphioxus: An emerging model organism for developmental biology[J]. Cellular and Molecular Life Sciences, 2004, 61(18): 2290-2308. (  0) 0) |
| [10] |
Ren Z M, Liu Z H. Receptor, signal transduction and evolution of sweet, umami and bitter taste[J]. Marine Life Science & Technology, 2020, 2(1): 6-15. (  0) 0) |
| [11] |
Yamaguchi T, Henmi Y. Biology of the amphioxus, Branchiostoma belcheri in the Ariake Sea, Japan Ⅱ. Reproduction[J]. Zoological Science, 2003, 20(7): 907-918. DOI:10.2108/zsj.20.907 (  0) 0) |
| [12] |
Kubokawa K, Mizuta T, Morisawa M, et al. Gonadal state of wild amphioxus populations and spawning success in captive conditions during the breeding period in Japan[J]. Zoological Science, 2003, 20(7): 889-895. DOI:10.2108/zsj.20.889 (  0) 0) |
| [13] |
Shi C, Wu X, Su L, et al. A ZZ/ZW sex chromosome system in cephalochordate amphioxus[J]. Genetics, 2020, 214(3): 617-622. DOI:10.1534/genetics.120.303051 (  0) 0) |
| [14] |
Mizuta T, Kubokawa K. Presence of sex steroids and cytochrome P450 genes in amphioxus[J]. Endocrinology, 2007, 148(8): 3554-3565. DOI:10.1210/en.2007-0109 (  0) 0) |
| [15] |
Baker M E. Co-evolution of steroidogenic and steroid-inactivating enzymes and adrenal and sex steroid receptors[J]. Molecular and Cellular Endocrinology, 2004, 215(1-2): 55-62. DOI:10.1016/j.mce.2003.11.007 (  0) 0) |
| [16] |
Wang P, Zhang L, Li H, et al. Characterization of GRP as a functional neuropeptide in basal chordate amphioxus[J]. International Journal of Biological Macromolecwes, 2020, 142: 384-394. DOI:10.1016/j.ijbiomac.2019.09.109 (  0) 0) |
| [17] |
Wang P, Wang M, Zhang L, et al. Functional characterization of an orexin neuropeptide in amphioxus reveals an ancient origin of orexin/orexin receptor system in chordate[J]. Science China Life Sciences, 2019, 62(12): 1655-1669. DOI:10.1007/s11427-018-9421-1 (  0) 0) |
| [18] |
Wang P, Wang M, Ji G, et al. Demonstration of a functional kisspeptin/kisspeptin receptor system in amphioxus with implications for origin of neuroendocrine regulation[J]. Endocrinology, 2017, 158(5): 1461-1473. DOI:10.1210/en.2016-1848 (  0) 0) |
| [19] |
李浩毅, 徐高倩, 刘振辉. 雌雄文昌鱼差异表达基因的转录组分析[J]. 中国海洋大学学报(自然科学版), 2021, 51(11): 40-48. Li H Y, Xu G Q, Liu Z H. Transcriptome analysis of the differential expression genes between male and female amphioxus[J]. Periodical of Ocean University of China, 2021, 51(11): 40-48. (  0) 0) |
 2023, Vol. 53
2023, Vol. 53


