2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室,山东 青岛 266237;
3. 中国海洋大学海洋生物多样性与进化研究所,山东 青岛 266003
弧菌(Vibrio)属于变形菌门(Proteobacteria)γ变形菌纲(Gammaproteobacteria),是一种典型的海洋异养细菌,一般条件下占海洋总细菌的1%左右[1]。以往的研究显示,弧菌是一种机会主义细菌,当环境条件适宜时,会出现暴发性的增殖[2],当营养缺乏或生存环境不适时,又能进入活的非可培养(Viable but nonculturable,VBNC)状态,增强自身对不利环境条件的抗性,从而等待适合其生存的环境条件[3-4]。Rubio-Portillo等[5]的研究显示,在地中海区域不同地理位置,附着于石珊瑚表面的弧菌群落结构也是不同的。可培养弧菌群落与珊瑚的健康状况有关,健康珊瑚表面的弧菌丰度是不健康珊瑚的5倍多。Thickman等[6]发现浮游植物来源的溶解有机物(Dissolved organic matter,DOM)显著地增加了总副溶血弧菌(Vibrio parahaemolyticus)和致病性V. parahaemolyticus的丰度。Armada等[4]在长期实验中检测到了弧菌具有呼吸作用,证明弧菌可以在资源有限的条件下存活。弧菌可以在营养条件充足时暴发性增殖又能在环境条件不利时增强自身抗性的生存策略,使它们能够适应各种各样的海洋环境。研究这种独特的生存策略对了解海洋生物地球化学循环具有重要的意义。
2007年至今,中国黄海沿岸地区每年夏季都会暴发浒苔(Ulva prolifera)绿潮,给当地的生态环境造成了影响,甚至演变成一种自然灾害[7]。作为黄海沿岸北部城市的青岛,每年夏季也会受到浒苔暴发的影响。浒苔暴发对海洋水质的影响是巨大的。浒苔暴发初期会大量吸收海水中的营养物质,例如氮、磷等营养盐[8]。浒苔消退时,会大量沉入海底进行有氧分解,消耗大量的氧气,释放出大量的营养物质等,导致水中的溶解氧含量下降,对需氧生物尤其是异养微生物的呼吸产生严重的影响[9]。因此,藻类暴发影响了海洋中相关区域DOM的含量和种类,而异养细菌又可以利用和转化相应的DOM,使其成分和生物活性等方面发生变化。浒苔等浮游植物与海洋微生物之间的这种相互作用,影响了海洋的生物地球化学循环。
关于浒苔等浮游植物与微生物群落之间关系的研究已有报道。例如Liang等[10]在进行实验室模拟培养时发现浒苔来源的DOM促进总细菌和弧菌丰度在24 h达到峰值,群落出现明显的演替规律。Wang等[11]发现有浒苔生长的海水池塘中黄杆菌丰度较高,弧菌丰度较低。Zhang等[12]的研究表明在有浒苔生长的海水中脱硫弧菌(Desulfovibrio)等细菌占主导地位。然而目前并没有针对浒苔暴发整个过程中海洋细菌群落结构动态变化的研究,尤其是缺乏对浒苔分解物响应最快的弧菌的研究。本研究拟在自然条件下对浒苔暴发前、中、后期弧菌群落进行研究。结合传统培养方法和分子生物学技术,对弧菌的丰度和群落组成进行研究,确定弧菌在此过程中的丰度变化趋势及其群落演替规律。另外,本研究还将对影响弧菌群落的环境因子进行分析。
1 材料与方法 1.1 样品采集根据历年青岛近岸浒苔暴发的情况,选取三个典型的浒苔暴发地点(见图 1,栈桥ZQ、鲁迅公园LX、第二海水浴场EY),于2017年4—8月进行了14次海水取样。其中EY站点为广阔沙滩,没有大型岩石和草木的覆盖,较易受到人类影响;ZQ站点受到人为设计的景点阻隔,兼有沙滩和岩石等;LX站点多为大型岩石和草木,受到人为影响较小。三个站点生态环境不同,在一定程度上可以作为青岛近岸的代表,且均无城市废水排放管道等明显的非自然因素影响。取样时间涵盖本次浒苔暴发的全过程,可分为暴发前、中、后三个时间段。在采水现场使用200 μm孔径的筛绢预过滤海水,以除去颗粒较大的杂质。将滤过的海水通过漏斗转入5 L预先酸处理过的聚碳酸酯桶(Thermo Fisher Scientific,USA)中。用YSI多参数水质仪(YSI 556 MPS,美国)在现场测量海水的温度、盐度、电导率、总溶解性固体(TDS)、pH、溶解氧(DO)等理化指标。
|
( ZQ:栈桥;LX:鲁迅公园;EY:第二海水浴场。ZQ: Zhanqiao; LX: Luxun Park; EY: The Second Bathing Beach. ) 图 1 采样地点站位图(Ocean Date View绘制) Fig. 1 The map of sampling stations(Drawn by Ocean Date View) |
样本用采样地点+采样月份+采样次数进行编号。其中:采样地点用其名称的前两个汉字首字母进行样品的命名;第一个数字表示采样的月份;第二个数字表示采样的次数。例如:LX41表示在鲁迅公园4月份的第一次采样。
根据本次浒苔来临和最后消退的时间,将样品分为三组:浒苔暴发前(Before,样品41、42、51、52、53、54、61),浒苔暴发中(During,样品62、63、64、65、66、71、72),浒苔消退后(After,样品73、74)。
1.2 样品预处理DNA样品预处理:将1 L海水用3 μm孔径的聚碳酸酯膜(Millipore Corporation,Billerica,MA,直径47 mm;PC膜)过滤,再将过滤后的海水用0.22 μm孔径的PC膜过滤。使用后的滤膜均放入2 mL无菌冻存管,然后立刻放入液氮中速冻并转入-80 ℃冰箱保存。具体方法参照Liang等[10]的方法。
溶解有机碳(Dissolved organic carbon, DOC)样品预处理:将100 mL水样用预处理(酸洗,550 ℃灼烧6 h)过的专用过滤器过滤至玻璃纤维膜(Whatman,0.7 μm,5 mm)上。取过滤后水样大约40 mL至棕色玻璃瓶,为防止微生物干扰加一滴饱和HgCl2溶液。迅速放于-20 ℃保存。具体方法参照Zhang等[34]的方法。
叶绿素样品预处理:样品处理须在黑暗中进行,必须在2 h内完成。将500 mL水样于黑暗中用3 μm聚碳酸酯膜进行过滤,过滤后的水样再用0.22 μm膜进行过滤。将滤膜放入锡箔纸包裹的2 mL冻存管并放入液氮速冻,然后转入-80 ℃保存。具体方法参照《中华人民共和国国家标准》GB17378.4—1998。
1.3 环境因子的测定营养盐:营养盐(亚硝酸盐NO2-、硝酸盐NO3-、铵盐NH4+、硅酸盐SiO32-和磷酸盐PO43-)的测定采用分光光度法和比色法,具体方法参照Dai等[13-14]的研究。
溶解有机碳(DOC):溶解有机碳的测定由中国海洋大学海洋化学理论与工程技术教育部重点实验室王旭晨教授课题组协助。采用高温催化氧化法通过岛津TOC-V全有机碳分析仪(日本京都岛津公司)测定[15]。
叶绿素:测定标准参照《中华人民共和国国家标准》GB17378.4—1998。过滤完海水的3和0.22 μm的聚碳酸酯膜分别加入80%的丙酮(10 mL),混匀后在4 ℃放置14~24 h。使用荧光分光光度计测量酸化前后的荧光值。Chl a的浓度计算参考以下公式:
| $ \rho_1=F_{\mathrm{D}} \frac{R}{R-1}\left(R_{\mathrm{b}}-R_{\mathrm{a}}\right) \frac{v}{V} 。$ |
式中:FD为换算因子;R为酸化因子;Rb为酸化前荧光值;Ra为酸化后荧光值;v为丙酮体积(mL);V为海水体积(L)。
1.4 可培养弧菌丰度的测定将海水样品梯度稀释后,涂布于TCBS培养基(Thiosulfate citrate bile salts sucrose agar culture medium)上,每个梯度设3个平行,于28 ℃培养48 h后进行计数。
1.5 DNA的提取样品DNA的提取采用酚/氯仿/异戊醇法。具体方法:将滤膜放于冰上融化,剪碎后放入2 mL样品管中。加入600 μL sodium chlorideTris-EDTA(STE)溶液并用均质破碎仪震荡(6 m/s,60 s,3次),加速裂解。加入10 μL的10 mg/mL溶菌酶并37 ℃水浴0.5 h,加入60 μL 10%的SDS溶液混匀,再加入6 μL 10 mg/mL蛋白酶并65 ℃水浴20 min。加入等体积的酚/氯仿/异戊醇(25∶24∶1)离心(12 000 r/min,10 min),再吸取上清加入等体积的氯仿/异戊醇(24∶1)离心(12 000 r/min,10 min)并重复2次。上清用0.6倍体积异丙醇在-20 ℃沉降2 h或过夜,再次离心(14 000 r/min,4 ℃,10 min)。用70%乙醇冲洗离心管内壁后晾干。用无菌蒸馏水或Tris-EDTA(TE)溶解DNA,-20 ℃保存。
1.6 弧菌和细菌16SrRNA基因丰度的测定样品中的弧菌和细菌16S rRNA基因丰度的定量,采用实时荧光定量PCR(Real-time quantitative PCR detecting system,qPCR)技术。所用引物序列见表 1。
|
|
表 1 本研究所用的PCR引物序列 Table 1 PCR primer sequence and reaction system used in this study |
反应参数、反应体系和标准品的制备参考Liang等的方法[19]。将标准菌接入含有Ampicillin抗性的LB培养基(Luria-Bertani培养基),37 ℃恒温培养12 h。用质粒提取试剂盒Plasmid Mini Kit Ⅰ(Takara)提取含有目的基因的质粒。用限制性内切酶XbaⅠ对质粒进行酶切,切胶回收后获得qPCR标准品。用NanoDrop 2000 Spectrophotometer (Thermo Scientific,USA)测标准品浓度。
样品(包括标准品)设置3个平行,以无菌去离子水为模板设置三个空白对照。实验操作系统StepOne Real-time PCR System,分析软件StepOne(version2.2)。
1.7 弧菌16S rRNA基因高通量测序DNA样品送往上海美吉生物医药科技有限公司进行高通量测序,对弧菌16S rRNA基因的V2~V4高变区扩增。测序平台Illumina MiSeq,扩增引物为169F和680R。所用引物序列见表 1,反应参数、反应体系参考Liang等[19]的方法。
1.8 数据分析将原始数据按最小样品序列数进行抽平,保留序列数总和≥3的物种。运用QIIME1软件过滤低质量序列和去除嵌合体,获得有效序列,使用UPARSE(v7.1)对序列进行OTU聚类,相似度为97%。通过RDP分类器算法对16S rRNA基因序列进行分类学分析,阈值为70%。对抽平后的样本重新命名,以便进行后续分析。进行Pan/Core物种分析,根据生成的曲线是否平缓,评估测序量是否足够。所有样品根据实验目的分组,设计分组方案。
按照浒苔暴发的不同时期进行分组。用非参数Mann-Whitney检验对环境因子进行显著性差异分析。通过Spearman秩和检验分析弧菌和细菌与环境因子的相关性。通过α多样性分析反映浒苔暴发过程中弧菌的多样性和丰富度。α多样性分析包括Phylogenetic distance、Chao 1、Shannon、Equitability四个指数,按照浒苔暴发的不同站点和暴发时期进行分组。利用非度量多维尺度(Non-metric multidimensional scaling,NMDS)分析来探索组间群落组成的相似性或差异性。进行群落组成分析,通过Bar图可视化样本的物种丰度。通过Kruskal-Wallis秩和检验分析优势弧菌的丰度与环境因子的相关性。最后进行冗余分析研究弧菌群落与主控环境变量之间的关系。
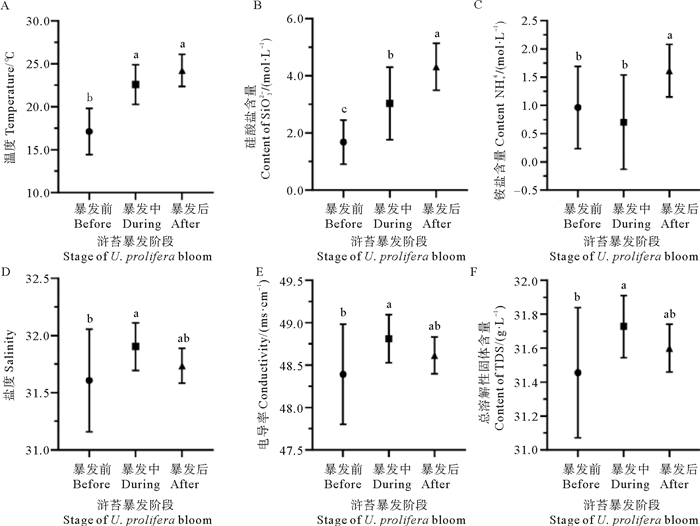
2 结果 2.1 浒苔暴发和消亡期间的环境参数变化对浒苔暴发整个过程的环境因子进行显著性差异分析(Mann-Whitney U test,P<0.05),发现6种环境因子(温度、盐度、电导率、总溶解性固体、SiO32-和NH4+)在浒苔暴发不同时期具有显著性差异(Mann-Whitney U test,P<0.05,见图 2)。在浒苔暴发期间及消退后,水温逐渐升高;SiO32-浓度随浒苔暴发不断增加,浒苔消退后仍呈现上升的趋势(t检验,P<0.05,见图 2A、B);NH4+浓度在浒苔暴发时稍有下降,但浒苔消退后显著增加(见图 2C,P<0.05)。盐度、电导率和总溶解性固体在暴发时稍有增加,但浒苔消退后显著降低(见图 2D、E和F,P<0.05)。其他环境因子(DO、NO2-、NO3-、PO43-和DOC)的差异不显著,其中DO为6.32~11.74 mg/L;NO2-浓度为0.05~0.55 μmol/L;NO3-浓度为0~12.74 μmol/L;PO43-浓度为0~0.06 μmol/L;DOC浓度为155.87~569.67 μmol/L。
|
( 小写字母表示显著性差异分析,相同字母代表两者没有显著性差异,不同的字母代表有显著性差异。Lowercase letters represent significant difference analysis. The same letters represent no significant difference between the two, and different letters represent significant differences. ) 图 2 浒苔暴发过程中关键环境因子的变化动态 Fig. 2 Dynamics of significant environmental factors during Ulva proliferabloom |
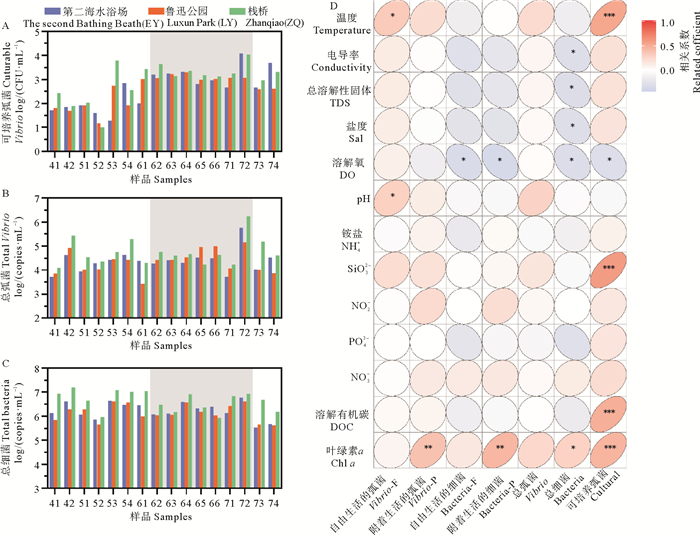
可培养弧菌与总弧菌的丰度随采样时间呈现逐渐增加的趋势,在7月的第二次采样(采样点72)时间点附近达到峰值,浒苔消退后略有下降(见图 3A、B)。可培养弧菌丰度在浒苔暴发前先短暂下降,之后迅速上升,其平均值为76.17 CFU/mL,而在整个暴发过程中趋于稳定,约2 131.32 CFU/mL。总弧菌的丰度在浒苔暴发过程中变化趋势明显(2.65×103~1.71×106 copies/mL),在浒苔暴发前先短暂上升,再迅速下降,暴发前丰度为4.19×104 copies/mL。在71采样时间点附近出现短暂的丰度减小(1.12×104 copies/mL),后迅速上升到最高值(8.09×105 copies/mL)。因此,浒苔暴发对总弧菌群落的影响主要发生在暴发末期。可能是由于浒苔裂解导致营养物质迅速释放,为弧菌生长提供了营养条件。
|
( A:可培养弧菌;B:总弧菌;C:总细菌;D:丰度与环境因子的关系。Spearman秩和检验。Vibrio-F、Vibrio-P分别为自由生活和附着生活的弧菌;Bacteria-F、Bacteria-P分别为自由生活和附着生活的细菌;Cultural为可培养弧菌。*:P<0.05; **:P<0.01;***:P<0.001。椭圆向左为负相关,向右为正相关。A: Culturable Vibrio; B: Total Vibrio; C: Total bacteria; D: Relationship between abundance and environmental factors.Spearman's rank correlation test."Vibrio-F" and "Vibrio-P" are free-living and particle-associated Vibrio respectively, "Bacteria-F" and "Bacteria-P" are free-living and particle-associated Bacteria respectively, and "Cultural" is culturable Vibrio. *: P < 0.05; **: P < 0.01; ***: P < 0.001.The ellipse has a negative correlation to the left and a positive correlation to the right. ) 图 3 浒苔暴发过程中细菌丰度的变化及其与环境因子的关系 Fig. 3 Changes of bacterial abundance during Ulva prolifera outbreak and its relationship with environmental factors |
总细菌的丰度在浒苔暴发过程中变化趋势较为稳定,呈现缓慢下降的趋势(见图 3C),并介于3.38×105和1.58×107 copies/mL之间。浒苔消退后,总细菌的丰度达到最低值1.32×106 copies/mL。在总弧菌丰度显著上升的情况下,总细菌丰度却无明显变化,这使弧菌在细菌中的占比从小于1%上升至20.54%,表明浒苔暴发的确影响了弧菌群落的丰度,造成了细菌群落的演替,弧菌代替其他类群成为了重要组成。浒苔消退后,弧菌的丰度又恢复到暴发前水平,表明群落演替再次发生。
对三个采样点的可培养弧菌、总弧菌、总细菌比较分析发现,在大多数的采样时间点,ZQ的丰度总是最高的。EY和LX在弧菌与细菌的丰度上无显著性差异。在弧菌丰度达到峰值时(72采样点),EY与ZQ的丰度高于LX,两者差别很小。
为探究各种环境因子对弧菌及总细菌的影响,本研究将自由生活的弧菌和细菌、附着生活的弧菌和细菌、可培养弧菌、总弧菌和总细菌与环境因子作Spearman检验(见图 3D)。结果表明,决定总细菌丰度的环境因子最多,其中电导率(r=-0.307, P<0.05)、总溶解性固体(r=-0.306, P<0.05)、盐度(r=-0.302, P<0.05)和溶解氧(r=-0.312, P<0.05)与总细菌丰度呈现明显的负相关,Chl a(r=0.287, P<0.05)与总细菌丰度呈现正相关。可培养弧菌的丰度也受到很多环境因子的影响,温度(r=0.532, P<0.001),SiO32-(r=0.586, P<0.001),溶解有机碳(r=0.488, P<0.001),Chl a(r=0.457, P<0.01)与其呈现显著正相关关系,而溶解氧(r=-0.300, P<0.05)与其负相关。自由生活的弧菌随温度的升高而增加(r=0.329, P<0.05);附着生活的弧菌随Chl a的升高而增加(r=0.379, P<0.01);自由生活的细菌随溶解氧的升高而减小(r=-0.335, P<0.05);附着生活的细菌随Chl a的升高而增加(r=0.443, P<0.01),随溶解氧的升高而减小(r=-0.357, P<0.05)。各种环境因子与其影响的丰度的变化与浒苔暴发过程相关,例如附着生活的弧菌,附着生活的细菌与Chl a呈现显著正相关,推测藻类暴发伴随大量的Chl a产生,而藻类暴发又为附着生活的菌群提供了适合生活的生态位。
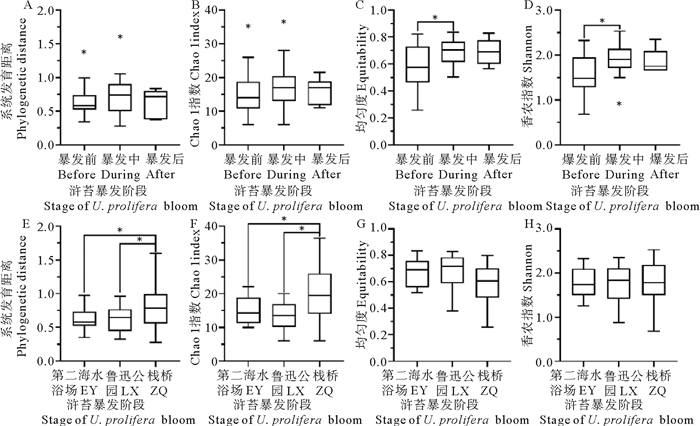
2.3 弧菌群落结构的变化及其影响因素分析 2.3.1 弧菌的多样性和丰富度48个样品共获得1 836 819条序列,抽平后每个样品获得21 781条序列。样品的coverage均在99.9%以上,可以确定这些序列能够代表所有样品中的弧菌。将样品按照浒苔暴发的时间和采样站位进行分组,可看出浒苔暴发与弧菌丰富度无显著相关性(见图 4A、B),但是暴发前后的均匀度与多样性指数有显著差异(t检验,P<0.05,见图 4C、D、G和H)。从站位方面看,ZQ站点的丰富度和系统发育距离明显高于其余两个站点(P<0.05,见图 4E、F)。
|
图 4 浒苔暴发过程中弧菌的多样性和丰富度指数变化 Fig. 4 Variation of Vibrio diversity and abundance index during Ulva prolifera bloom |
基于OTU水平进行NMDS分析,弧菌按照浒苔暴发前、暴发时、消退后沿第一轴进行聚类(见图 5,Stress=0.148),根据采样站点没有明显的聚类。表明浒苔暴发极大地影响了弧菌的群落组成,造成群落间显著差异(ANOSIM,R2=0.43,P<0.001)。
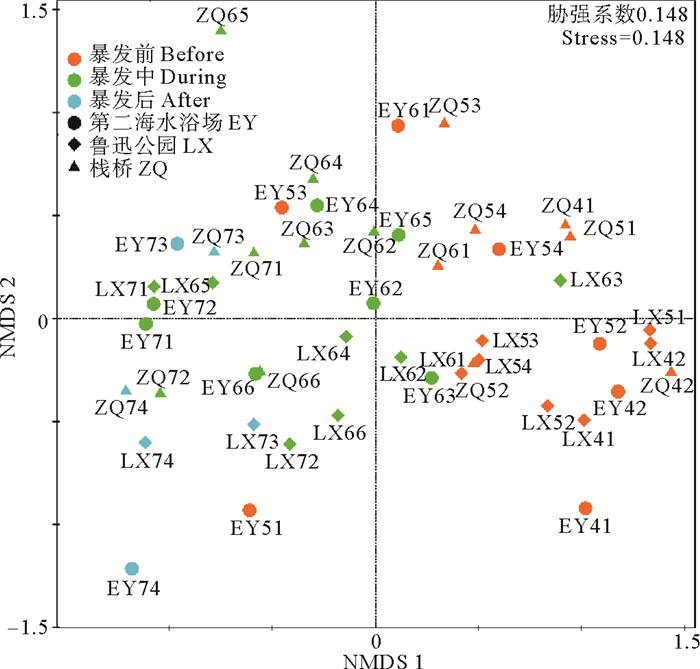
|
( 用不同的颜色区分浒苔暴发时期,用不同的形状区分不同样品地点。Samples of different periods of Ulva prolifera bloom are color-coded and samples of different sampling sites are distinguished by shapes. ) 图 5 OTU水平上弧菌群落的NMDS分析 Fig. 5 NMDS analysis of Vibrio community at OTU level |
浒苔暴发过程中弧菌群落组成发生显著变化(见图 6、7A)。对弧菌群落中优势种分析结果显示,V. splendidus(P<0.001)、V. gigantis(P<0.001)和V. pectenicida(P<0.05)随采样时间延长呈现降低趋势,浒苔暴发前、后的占比存在显著差异。其中V. splendidus是弧菌群落中丰度最高的种,浒苔暴发前丰度为76.40%。V. campbellii(P<0.001)、V. caribbeanicus(P<0.01)和V. maritimus(P<0.01)随采样时间延长丰度不断升高。其中V. campbellii在浒苔消退后在弧菌群落中占比最高。V. comitans(P<0.01)、Photobacterium rosenbergii(P<0.05)和V. pelagius (P<0.001)在浒苔暴发时占比最高,消退后略有下降。
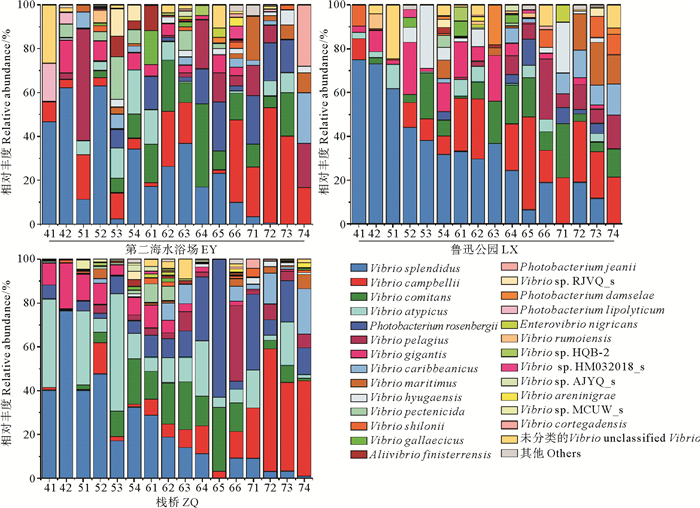
|
图 6 浒苔暴发过程中的弧菌群落组成 Fig. 6 Composition of Vibrio community during Ulva prolifera bloom |
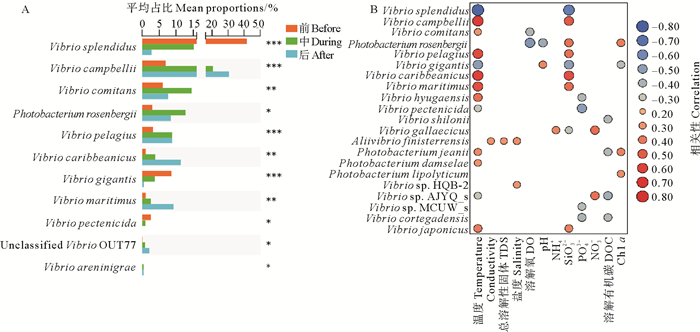
|
( A:部分优势弧菌类群在不同阶段的占比,图中只展示有显著性差异的物种,Kruskal-Wallis秩和检验,*:P<0.05; **:P<0.01;***:P<0.001。B:弧菌丰度与环境因子的关系。A: Proportion of some dominant Vibrio groups in different stages, only species with significant differences are shown, Kruskal Wallis rank sum test, *: P < 0.05; **: P < 0.01; ***: P < 0.001.B: Relationship between Vibrio abundance and environmental factors. ) 图 7 浒苔暴发过程中的部分优势弧菌类群及其丰度与环境因子的关系 Fig. 7 Some dominant Vibrio groups in the outbreak of Ulva prolifera and the relationship between their abundance and environmental factors |
对弧菌群落中主要优势种丰度与环境因子进行分析,发现温度和SiO32-是影响弧菌丰度的主要环境因子(见图 7B,P<0.05)。温度与V. campbellii、V. comitans和V. pelagius等9种弧菌呈现显著正相关,与V. splendidus、V. gigantis和V. pectenicida等4种弧菌呈现显著负相关。SiO32-与V. campbellii、Photobacterium rosenbergii和V. pelagius等6种弧菌呈现显著正相关,与V. splendidus、V. gigantis和V. gallaecicus 3种弧菌呈现显著负相关。PO43-、DOC和Chl a是仅次于温度和SiO32-的影响最大的环境因子,他们分别与4种弧菌有显著相关性。Photobacterium rosenbergii、V. gigantis分别受4种环境因子的影响,是受到最多环境因子影响的弧菌类群。不同的环境因子对不同的弧菌类群影响不同,推测可能与弧菌自身的生活方式相关(见图 7B)。
对所有样品与环境因子进行冗余分析(Redundancy analysis,RDA,见图 8)。Monte permutation检验得出,对弧菌群落影响最大的环境因子主要是温度(F=4.5,P<0.001)、SiO32-(F=4.0,P<0.001)、Chl a(F=3.8,P<0.01)和PO43-(F=2.4,P<0.05)。
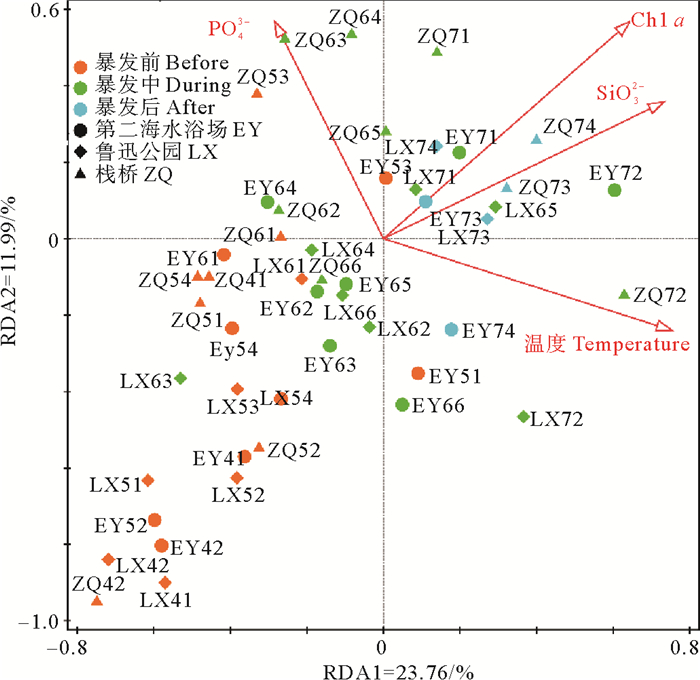
|
图 8 冗余分析说明弧菌群落与主控环境变量之间的关系 Fig. 8 Redundancy analysis showed the relationship between Vibrio community and main environmental variables |
先前的研究表明,弧菌是一种典型的机会主义细菌,当环境条件适宜时,会发生暴发性的增殖[20]。尤其一些浮游动植物的暴发会紧跟着弧菌的暴发增殖。例如,Thickman等[6]发现浮游植物来源的DOM显著地增加了总V. parahaemolyticus和致病性V. parahaemolyticus的丰度。Sison-Mangus等[21]发现随着拟菱形藻暴发进入峰值,弧菌的丰度从6%增加到65%,且其丰度与浮游植物生物量呈现正相关。Main等[22]发现附着生活的弧菌同赤潮异弯藻、甲藻的丰度显著正相关。同样的在本次研究中,浒苔暴发期总弧菌与可培养弧菌丰度均出现显著性升高。尤其是在浒苔暴发末期(71~72),弧菌丰度从1.12×104 copies/mL迅速增加至8.09×105 copies/mL,总弧菌对细菌的占比也从不到1%增加到11.3%左右。以往的研究可知,弧菌具有较短的代时,例如需钠弧菌(V. natriegens)的代时低于10 min[23],这可能与弧菌有较高的核糖体基因拷贝数有关,能够较快地进行增殖[24]。另外,弧菌能够在营养物质匮乏的情况下生存,这与它们对有机碳化合物代谢谱广有关。它们可以通过分泌一系列的胞外酶而去利用很多大分子的有机物例如褐藻胶等,还可以直接利用很多小分子物质[25]。同时,弧菌通过自身的趋化作用寻找营养物质,一旦其生长的某种限制因子得到补充,又可以暴发性增殖[26-27]。
在浒苔暴发整个过程中,相比于暴发前期弧菌丰度的略微升高,暴发末期,丰度显著性升高,推测这与暴发末期浒苔大量裂解而导致的营养物质大量释放有关。Liu等[28]的研究表明,浒苔上附着生活着很多细菌,其中弧菌是优势类群之一。因此,浒苔暴发过程中,由于其丰度的迅速增加,为附着生活的弧菌提供了足够多的生态位。暴发末期,浒苔大量裂解[12],释放出大量的营养物质如氮、磷等营养盐,同时释放出大量的DOM。这些DOM大多由浒苔多糖和蛋白质组成,其中小分子DOM被细菌直接利用,大分子DOM在细菌分泌的胞外酶作用下降解为小分子再被利用。因此附着生活的弧菌转变为自由生活状态,利用这些营养物质迅速增殖。以往的研究证实了这样的结果,Liu等[28]在对青岛胶州湾浒苔暴发所引起的细菌群落改变的研究中发现,藻类暴发末期甚至开始消退时弧菌目对总细菌相对占比达到最大。Teeling等[29]关于海洋中浮游植物繁殖对浮游细菌的群落演替的研究中发现,直到浮游植物暴发的消退期,γ变形菌纲的细菌如弧菌的丰度才开始迅猛增加。因此可以得出结论:浒苔等藻类对弧菌丰度的影响主要集中在暴发的末期,也可能是由于暴发末期是浮游植物死亡释放大量营养物质的时期。
对浒苔暴发过程中的环境因子分析发现,温度是对弧菌丰度影响最大的环境因子,在丰度占比最高的10种弧菌中,温度对9种弧菌具有显著相关性。以往的研究也证实了这一观点。Vezzulli等[30]在对地中海底栖无脊椎动物大规模死亡的研究中发现,弧菌在季节性尺度上与温度相关,当温度降至18 ℃以下时,在特定介质上的弧菌很少,当温度不低于22 ℃时弧菌丰度急剧增加。同样,Vezzulli等[31]对全球海面温度对弧菌影响的研究中也发现,全球海面温度升高对弧菌在生物学和生态学上产生了重要的影响,包括生长速率、可培养性、致病性等。在本研究中,温度主要对自由生活的弧菌和可培养弧菌产生影响,对附着生活的弧菌无明显影响。SiO32-对弧菌丰度的影响仅次于温度,在丰度占比最高的10种弧菌中,SiO32-浓度与7种弧菌的丰度具有显著相关性。Sun等[36]通过围隔实验发现,SiO32-浓度的增加能够促进硅藻及其他藻类生长,进而促进其同蓝细菌和绿藻的营养竞争,提升水生生态系统的多样性水平。而浒苔属于典型的绿藻类群,浒苔的暴发直接导致弧菌种群的暴发。因此推测SiO32-通过影响生态系统中藻类多样性水平,进而影响了弧菌群落结构和丰度。Paranjpye等[35]在对美国太平洋西北部V. parahaemolyticus季节性分布的研究显示,V. parahaemolyticus的丰度与SiO32-含量呈现显著负相关,且与温度相比,SiO32-水平的降低更有可能引起V. parahaemolyticus浓度的增加。在本研究中,SiO32-对不同种类弧菌的丰度显示出不同的相关性,其原因有待进一步探讨。而Chl a对附着生活的弧菌和细菌均有显著影响,这可能与浒苔为附着生活的细菌提供了充足的生态位有关。
3.2 浒苔暴发对弧菌群落的影响浒苔暴发过程中弧菌群落组成发生了显著变化。通过α多样性分析,本研究作者发现浒苔暴发时弧菌的多样性和均匀度与暴发前有显著性差异。Zhang等[8, 32]发现在浒苔暴发前,水体维持了一种相对稳定的状态。浒苔暴发时从水中大量吸收营养物质(如无机营养盐以及很多小分子物质),同时不断向水中释放营养物质,而吸收与释放的成分和数量不同,造成营养成分不平衡[8]。对于弧菌这种机会主义细菌来说,海水中营养物质的不平衡意味着某种限制因子的增多,极大地影响了弧菌群落的多样性。从采样站点看,ZQ位点的系统发育距离和丰富度明显高于其他2个采样地点,可能是ZQ位点与其他两个位点相比有较大的环境差异。在本次研究中,温度、SiO32-是影响较大的环境因子。而ZQ温度跨度为14.8 ℃,SiO32-跨度4.53 μmol/L,均显著的超过了其他2个站点。另外,ZQ站点的Chl a跨度为3.29 mg/L,而EY和LX均超过了5.5 mg/L,这可能也是ZQ站点弧菌群落与其他2个位点有显著性差异的原因之一。
Diner等[33]在美国南加州圣迭戈长达一年的时间里每月对霍乱弧菌(V. cholerae),V. parahaemolyticus,创伤弧菌(V. vulnificus)进行监测,发现它们的丰度都很高,但是特定物种分布对应于特定的温度和盐度。本次研究也能得出多种弧菌与温度呈现显著相关性。例如,夏季海水温度升高了15 ℃,随着浒苔暴发,弧菌群落的优势种发生很大的变化。浒苔暴发前期,占比最大的是V. splendidus,其相对丰度高达76.40%。随着采样时间的增加,温度逐渐变高,V. splendidus却呈现一种减小的趋势。而V. campbellii相反,随着温度的升高而增加,并成为暴发后期的主要类群。同样的,V. gigantis随水温升高而降低,V. caribbeanicus随水温升高而增加。Liang等[19]在之前的研究中发现,中国北部边缘海的V. campbellii和V. caribbeanicus在夏季的丰度大于水温较低的冬季,本研究结果同该结论一致,即在浒苔暴发过程中以V. campbellii和V. caribbeanicus为代表的温水物种逐渐成为弧菌群落的优势类群。
3.3 关于DOM与弧菌群落的关系Liang等[10]的研究表明,DOM能够促使弧菌在短时间内快速增殖,且DOM含量越高,弧菌的丰度越高。同样的,本次研究中DOC表征的DOM与可培养弧菌丰度存在显著的正相关关系。然而,DOC与V. shilonii、Photobacterium jeanii、Vibrio sp. AJYQ_s和V. cortegadensis等4种弧菌丰度显著负相关。造成这种结果的原因可能是从长时间范围尺度而言,温度等其他环境因子对特定弧菌群落的影响比DOM的影响大。本研究的分析结果显示,对弧菌群落影响较大的环境因子是温度,SiO32-、Chl a、PO43-,是DOM次之。另外,采样前期(采样点41、42、51、52、53、54)DOM含量低于检测线而造成有效数据缺失对于整体的数据分析可能存在一定的影响。对于这一部分问题有待进一步研究。
4 结语先前已有关于细菌群落结构与浒苔暴发之间关系的研究,但是尚缺乏对浒苔暴发整个过程中微生物(尤其是海洋弧菌)群落结构变化的研究。本研究通过数月的实地连续采样,发现浒苔暴发可以引起弧菌丰度的显著变化,且弧菌丰度的迅猛增长出现在浒苔暴发的末期;浒苔暴发过程中营养物质吸收与释放影响了弧菌群落结构;同时,温度、SiO32-、Chl a等环境因子在此过程中起到了决定性的作用。此外,采样地点的选择、采样时的天气变化和潮汐变化,都会影响浒苔的覆盖或堆积,从而对实验结果产生一定的影响。将来有必要进行更加精细化的实验设计,从而减少各种环境因素的影响。然而,这些选择并不影响在宏观尺度上得出较为准确的结论。
| [1] |
Zhang X H, Lin H Y, Wang X L, et al. Significance of Vibrio species in the marine organic carbon cycle—a review[J]. Science China(Earth Sciences), 2018, 61(10): 1357-1368. DOI:10.1007/s11430-017-9229-x (  0) 0) |
| [2] |
Thompson J R, Randa M A, Marcelino LA, et al. Diversity and dynamics of anorth Atlantic coastal Vibrio community[J]. Applied and Environmental Microbiology, 2004, 70(7): 4103-4110. DOI:10.1128/AEM.70.7.4103-4110.2004 (  0) 0) |
| [3] |
Xu H S, Roberts N, Singleton F L, et al. Survival and viability of nonculturable Escherichia coli and Vibrio cholerae in the estuarine and marine environment[J]. Microbial Ecology, 1982, 8(4): 313-323. DOI:10.1007/BF02010671 (  0) 0) |
| [4] |
Armada S P, Farto R, Pérez M J, et al. Effect of temperature, salinity and nutrient content on the survival responses of Vibrio splendidus biotype Ⅰ[J]. Microbiology (Reading), 2003, 149(2): 369-375. DOI:10.1099/mic.0.25574-0 (  0) 0) |
| [5] |
Rubio-Portillo E, Gago J F, Martínez-García M, et al. Vibrio communities in scleractinian corals differ according to health status and geographic location in the Mediterranean Sea[J]. Systematic and Applied Microbiology, 2018, 41(2): 131-138. DOI:10.1016/j.syapm.2017.11.007 (  0) 0) |
| [6] |
Thickman J D, Gobler C J. The ability of algal organic matter and surface runoff to promote the abundance of pathogenic and non-pathogenic strains of Vibrio parahaemolyticus in Long Island Sound, USA[J]. PLoS One, 2017, 12(10): e0185994. DOI:10.1371/journal.pone.0185994 (  0) 0) |
| [7] |
蒋雪蕾, 周晓见, 林佳宁, 等. 黄海浒苔绿潮生态效应研究进展[J]. 海洋环境科学, 2021, 40(4): 647-652. Jiang X L, Zhou X J, Lin J N, et al. Research progress on the ecological effects of Enteromorpha green tide in the Yellow Sea[J]. Marine Environmental Science, 2021, 40(4): 647-652. DOI:10.13634/j.cnki.mes.2021.04.023 (  0) 0) |
| [8] |
Zhang Y Y, He P M, Li H M, et al. Ulva prolifera green-tide outbreaks and their environmental impact in the Yellow Sea, China[J]. National Science Review, 2019, 6(4): 825-838. DOI:10.1093/nsr/nwz026 (  0) 0) |
| [9] |
Ogawa T, Ohki K, Kamiya M. High heterozygosity and phenotypic variation of zoids in apomictic Ulva prolifera (Ulvophyceae) from brackish environments[J]. Aquatic Botany, 2015, 120: 185-192. DOI:10.1016/j.aquabot.2014.05.015 (  0) 0) |
| [10] |
Liang J C, Liu J W, Zhan Y C, et al. Succession of marine bacteria in response to Ulva prolifera—derived dissolved organic matter[J]. Environment International, 2021, 155: 106687. DOI:10.1016/j.envint.2021.106687 (  0) 0) |
| [11] |
王春忠, 孙富林, 侯代云, 等. 基于浒苔暴发海水池塘的微生物生态特征研究[J]. 海洋学报, 2017, 39(4): 107-116. Wang C Z, Sun F L, Hou D Y, et al. Study on the microbial characteristics of in seawater ponds based on Enteromorpha bloom[J]. Haiyang Xuebao, 2017, 39(4): 107-116. DOI:10.3969/j.issn.0253-4193.2017.04.011 (  0) 0) |
| [12] |
Zhang X L, Song Y J, Liu D Y, et al. Macroalgal blooms favor heterotrophic diazotrophic bacteria in nitrogen-rich and phosphorus-limited coastal surfacewaters in the Yellow Sea[J]. Estuarine, Coastal and Shelf Science, 2015, 163: 75-81. DOI:10.1016/j.ecss.2014.12.015 (  0) 0) |
| [13] |
Dai M H, Guo X H, Zhai W D, et al. Oxygen depletion in the upper reach of the Pearl River estuary during a winter drought[J]. Marine Chemistry, 2006, 102(1-2): 159-169. DOI:10.1016/j.marchem.2005.09.020 (  0) 0) |
| [14] |
Han A Q, Dai M H, Kao S J, et al. Nutrient dynamics and biological consumption in a large continental shelf system under the influence of both a river plume and coastal upwelling[J]. Limnology and Oceanography, 2012, 57(2): 486-502. DOI:10.4319/lo.2012.57.2.0486 (  0) 0) |
| [15] |
徐彩丽, 罗春乐, 薛跃君, 等. 山东省降雨和降雪中溶解有机碳、溶解无机碳和总氮的浓度变化及来源分析[J]. 环境科学学报, 2016, 36(2): 658-666. Xu C L, Luo C L, Xue Y J, et al. Concentration changes and source analysis of dissolved organic carbon, dissolved inorganic carbon and total nitrogen in rainfall and snowfall in Shandong Province[J]. Acta Scientiae Circumstantiae, 2016, 36(2): 658-666. DOI:10.13671/j.hjkxxb.2015.0540 (  0) 0) |
| [16] |
Thompson J R, Randa M A, Marcelino L A, et al. Diversity and dynamics of a north Atlantic coastal Vibrio community[J]. Applied and Environmental Microbiology, 2004, 70(7): 4103-4110. DOI:10.1128/AEM.70.7.4103-4110.2004 (  0) 0) |
| [17] |
Sogin M L, Morrison H G, Huber J A, et al. Microbial diversity in the deep sea and the underexplored "rare biosphere"[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(32): 12115-12120. DOI:10.1073/pnas.0605127103 (  0) 0) |
| [18] |
Liu Y, Yang G P, Wang H L, et al. Design of Vibrio 16S rRNA gene specific primers and their application in the analysis of seawater Vibrio community[J]. Journal of Ocean University of China, 2006, 5(2): 157-164. DOI:10.1007/BF02919216 (  0) 0) |
| [19] |
Liang J C, Liu J W, Wang X L, et al. Spatiotemporal dynamics of free-living and particle-associated Vibrio communities in the northern Chinese marginal seas[J]. Applied and Environmental Microbiology, 2019, 85(9): e00217-19. (  0) 0) |
| [20] |
Westrich J R, Ebling A M, Landing W M, et al. Saharan dust nutrients promote Vibrio bloom formation in marine surface waters[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(21): 5964-5969. DOI:10.1073/pnas.1518080113 (  0) 0) |
| [21] |
Sison-Mangus M P, Jiang S, Kudela R M, et al. Phytoplankton-associated bacterial community composition and succession during toxic Diatom bloom and non-bloom events[J]. Frontiers in Microbiology, 2016, 7: 1433. (  0) 0) |
| [22] |
Main C R, Salvitti L R, Whereat E B, et al. Community-level and species-specific associations between phytoplankton and particle-associated Vibrio Species in Delaware's Inland Bays[J]. Applied and Environmental Microbiology, 2015, 81(17): 5703-5713. DOI:10.1128/AEM.00580-15 (  0) 0) |
| [23] |
Aiyar S E, Gaal T, Gourse R L. rRNA promoter activity in the fast-growing bacterium Vibrio natriegens[J]. Journal of Bacteriology, 2002, 184(5): 1349-1358. DOI:10.1128/JB.184.5.1349-1358.2002 (  0) 0) |
| [24] |
Lin H Y, Yu M, Wang X L, et al. Comparative genomic analysis reveals the evolution and environmental adaptation strategies of Vibrios[J]. BMC Genomics, 2018, 19(1): 135. DOI:10.1186/s12864-018-4531-2 (  0) 0) |
| [25] |
Li B, Liu J W, Zhou S, et al. Vertical variation in Vibrio community composition in Sansha Yongle Blue Hole and its ability to degrade macromolecules[J]. Marine Life Science & Technology, 2020, 2(1): 60-72. (  0) 0) |
| [26] |
Takemura A F, Chien D M, Polz M F. Associations and dynamics of Vibrionaceae in the environment, from the genus to the population level[J]. Frontiers in Microbiology, 2014, 5: 38. (  0) 0) |
| [27] |
Smriga S, Fernandez V I, Mitchell J G, et al. Chemotaxis toward phytoplankton drives organic matter partitioning among marine bacteria[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(6): 1576-1581. DOI:10.1073/pnas.1512307113 (  0) 0) |
| [28] |
Liu M, Dong Y, Zhao Y, et al. Structures of bacterial communities on the surface of Ulva prolifera and in seawaters in an Ulva blooming region in Jiaozhou Bay, China[J]. World Journal of Microbiology and Biotechnology, 2011, 27(7): 1703-1712. DOI:10.1007/s11274-010-0627-9 (  0) 0) |
| [29] |
Teeling H, Fuchs B M, Becher D, et al. Substrate-controlled succession of marine bacterioplankton populations induced by a phytoplankton bloom[J]. Science, 2012, 336(6081): 608-611. DOI:10.1126/science.1218344 (  0) 0) |
| [30] |
Vezzulli L, Previati M, Pruzzo C, et al. Vibrio infections triggering mass mortality events in a warming Mediterranean Sea[J]. Environmental Microbiology, 2010, 12(7): 2007-2019. DOI:10.1111/j.1462-2920.2010.02209.x (  0) 0) |
| [31] |
Vezzulli L, Pezzati E, Brettar I, et al. Effects of global warming on Vibrio ecology[J]. Microbiology Spectrum, 2015, 3(3): 1-9. (  0) 0) |
| [32] |
Li H M, Zhang Y Y, Han X R, et al. Growth responses of Ulva prolifera to inorganic and organic nutrients: Implications for macroalgal blooms in the southern Yellow Sea, China[J]. Scientific Reports, 2016, 6(1): 1423-1432. (  0) 0) |
| [33] |
Diner R E, Kaul D, Rabines A, et al. Pathogenic Vibrio species are associated with distinct environmental niches and planktonic taxa in Southern California (USA) Aquatic Microbiomes[J]. mSystems, 2021, 6(4): e0057121. DOI:10.1128/mSystems.00571-21 (  0) 0) |
| [34] |
Zhang T, Wang X C. Release and microbial degradation of dissolved organic matter (DOM) from the macroalgae Ulva prolifera[J]. Marine Pollution Bulletin, 2017, 125(1-2): 192-198. (  0) 0) |
| [35] |
Paranjpye R N, Nilsson W B, Liermann M, et al. Environmental influences on the seasonal distribution of Vibrio parahaemolyticus in the Pacific Northwest of the USA[J]. FEMS Microbiology Ecology, 2015, 91(12): fiv121. (  0) 0) |
| [36] |
孙凌, 金相灿, 杨威, 等. 硅酸盐影响浮游藻类群落结构的围隔试验研究[J]. 环境科学, 2007, 28(10): 2174-2179. Sun L, Jin X C, Yang W, Xu M, et al. Effects of silicate on the community structure of phytoplankton in enclosures[J]. Chinese Journal of Environmental Science, 2007, 28(10): 2174-2179. (  0) 0) |
2. Laboratory for Marine Ecology and Environmental Sciecne, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China;
3. Institute of Evolution & Marine Biodiversity, Ocean University of China, Qingdao 266003, China
 2023, Vol. 53
2023, Vol. 53


