2. 海洋化学理论与工程教育部重点实验室,山东 青岛 266100;
3. 威海普益船舶环保科技有限公司,山东 威海 264200
随着海运行业规模持续扩大,船舶带来的废气污染不容忽视。据统计,全球每年由舰船排放的SOx量可占全世界SOx的7%以上[1],其中船舶废气中的SO2主要来源于燃料中有机硫化物的燃烧,因此柴油机燃用低硫柴油可从根本上解决硫排放超标的问题,但低硫柴油显而易见的弊端是燃油费用和发动机改造费用的大幅增加,并且炼油厂利用催化加氢脱硫技术降低燃油含硫量的过程伴随着大量能源的消耗,又因舰船不携带大型储能设备,柴油机在运行过程中产生的电量除供给舰船本身使用外,剩余电量基本浪费,综合成本、操作性方面考虑,并不是最优解决方案。传统的海水脱硫脱硝方法[2-3]具有效率高成本低的特征,可适用于舰船烟气净化,然而由于舰船体积和重量的影响,制约了海水脱硫脱硝系统的能力,致使净化效率低,并且吸收后的废液还需经过曝气工序,使亚稳态SO32-转化为稳态的SO42-后方可排放入大海,将占用舰船上有限的空间资源。光催化氧化[4-7]、紫外辐射氧化[8-9]等高级氧化技术,具有高效、无污染的特点,是环境治理方面的研究热点。本课题组孙圣楠的研究表明[10],Fe掺杂TiO2在紫外光照射下表现出较高的NO脱除能力; 张静伟[2]利用海水脱硫的效率在设计操作条件下可达95%。
基于本课题组和已报道的研究结果[11-13],本文提出光催化/VUV协同海水吸收技术用于舰船烟气脱硫脱硝,该净化系统在船舶应用上空间占用少、效率高,将为舰船烟气净化提供一种新的解决方案。为验证该技术的可行性,本实验室自制相应的小试装置,为后续工业化的应用推广提供先期的验证和数据积累。本文主要工作就是利用小试装置模拟舰船烟气脱除污染物的过程,研究了不同工况下系统的脱硫脱硝率,并分析揭示光催化/VUV协同海水吸收脱除机理。
1 实验部分 1.1 实验装置如图 1所示,该系统是本实验室自行设计的实验装置,可模拟光催化/VUV协同海水吸收舰船烟气中的SO2和NO等污染物。该系统主要由进气部分、海水喷淋部分、保温预热部分、主反应器、尾气处理及检测部分组成。其中核心部件9#为真空紫外灯,10#为负载Fe-TiO2光催化剂的陶瓷填料,海水作为吸收液由顶部喷淋进入填料层和烟气逆流接触。真空紫外灯功率为150 W,可辐射紫外线用以激发产生自由基和空穴-电子对,进而产生·OH等自由基氧化污染物分子。因此,本研究利用负载Fe-TiO2光催化剂的陶瓷作为反应器中的填料,一方面可增加气液接触的面积,另一方面可与紫外辐射产生光催化作用提供自由基等。因此本实验装置将光催化氧化和VUV辐照、海水吸收三效耦合为一体化脱硫脱硝技术(以下称为光催化/VUV协同海水吸收技术),去除烟气中SO2和NO。
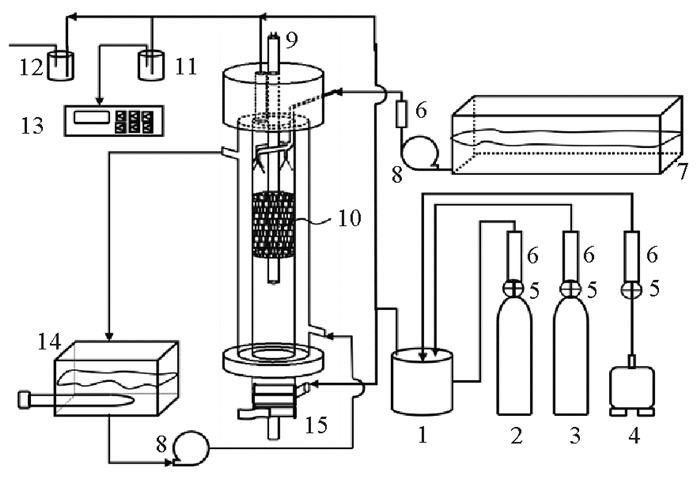
|
( 1.气体缓冲罐;2.SO2气瓶;3.NO气瓶;4.空气泵;5. 稳压阀;6. 转子流量计;7. 海水储槽;8. 水泵;9. 真空紫外灯;10. 负载型陶瓷填料层;11. 干燥器;12. 尾气吸收瓶;13. 烟气分析仪;14. 恒温水浴;15. 加热带。1.Gas buffer tank; 2. SO2 source; 3. NO source; 4. Air pump; 5. Pressure maintaining value; 6.Flowmeter; 7.Seawater tank; 8.Water pump; 9.VUV; 10.Packing with Fe-TiO2; 11.Dryer; 12.Exhaust gas absorption; 13. Flue gas analyzer; 14.Thermostat water bath; 15.Heater band. ) 图 1 反应系统 Fig. 1 The experimental device |
通过调节6#转子流量计,将2#SO2气源和3#NO气源及4#电磁式空气泵的气体混合于1#缓冲罐内,充分混合后得到模拟烟气,该烟气浓度通过13#烟气分析仪获得。模拟烟气由主反应器底部烟气入口进入反应室,穿过10#负载型陶瓷填料床层,从顶部的尾气出口离开反应器。
系统可通过调节海水喷淋部分的6#转子流量计来控制天然海水喷淋量,以此考察液气比对系统脱硫脱硝性能的影响。通过调节14#恒温水浴和15#加热带对负载型陶瓷填料床层和烟气温度进行控制,以此考察温度对系统脱硫脱硝性能的影响。通过调节进气部分的流量评测空速及不同SO2、NO浓度对系统脱除效率的影响。因考虑到该技术在实际应用中会遇到船舶驶入淡水区的情况,此时存在脱硫脱硝效率下降的可能,因此考察了喷淋自来水情况下的脱除率。
SO2和NO反应前后的浓度可由13#烟气分析仪读取。SO2和NO的脱除率可通过公式(1)计算:
| $ \eta=\frac{C_{0}-C_{t}}{C_{0}} 。$ | (1) |
其中:η为脱除效率;C0为SO2或NO的初始浓度;Ct为SO2和NO在t时刻的浓度值。
2 结果与讨论 2.1 光催化/VUV协同海水吸收SO2和NO机理通过对比分析光催化/VUV协同海水吸收系统和纯海水吸收系统在不同液气比下的脱除率,从图 2的实验结果中可以看出,随着系统液气比不断升高,海水系统脱硫率从0.88 L·m-3时的65%增大到5.0 L·m-3时的100%,这是因为海水呈弱碱性,酸性气体SO2在海水中溶解度较高,而光催化/VUV协同海水吸收系统从0.88 L·m-3开始就一直保持90%以上脱硫率,当增大至3.5 L·m-3,此时脱硫率达到100%,较海水系统脱硫率为100%时液气比减少1.5 L·m-3,说明光催化/VUV增强了海水脱硫能力,这是因为VUV一方面将气相中O2和H2O氧化成氧化性极强的O3和H2O2,可将极性弱的SO2氧化为强极性的SO3,另一方面紫外辐射填料表层负载的光催化剂产生·OH等自由基,氧化性极强,与SO2快速反应,提高了脱硫效率。海水吸收系统脱硝率基本保持14%左右,不随液气比增加而变化,这是因为NO在海水中溶解度低,很难将其在海水中转化和吸收,而光催化/VUV协同海水吸收系统液气比在5.0 L·m-3以内,可保持90%以上的脱硝率,而继续增加至7.0 L·m-3时,脱硝率下降为85%,这是因为过量的海水吸收紫外光,减少了光催化/VUV作用产生的·OH自由基的数量,NO脱除率有所下降。因此,光催化/VUV协同海水吸收系统较纯海水吸收系统增加了O3氧化和·OH自由基氧化等反应,提高了脱硫脱硝率。反应过程如下:
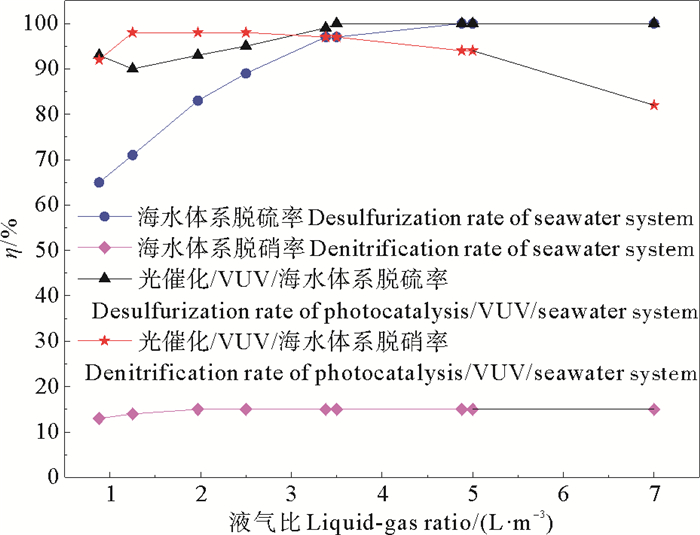
|
图 2 不同体系的脱硫脱硝率 Fig. 2 The efficiency of desulfurization and denitrification under different system |
紫外辐射的紫外线在气相中发生反应(2)和(3),增加了系统中·OH等自由基的量[14-15]:
| $ \mathrm{O}_{2} \stackrel{\mathrm{hv}}{\longrightarrow} \mathrm{O}_{3} \stackrel{\mathrm{hv}}{\longrightarrow} \mathrm{O}_{2}+\mathrm{O}, $ | (2) |
| $ \mathrm{H}_{2} \mathrm{O}+\mathrm{O} \longrightarrow 2 \cdot \mathrm{OH} 。$ | (3) |
填料层表面负载的Fe-TiO2在紫外辐射的照射下发生光催化作用,生成电子-空穴对[16-17],如反应(4):
| $ \mathrm{Fe}-\mathrm{TiO}_{2} \stackrel{\mathrm{hv}}{\longrightarrow} \mathrm{TiO}_{2}+\mathrm{e}^{-}+\mathrm{h}^{+} 。$ | (4) |
电子可与O2等作用产生·O2-,空穴可氧化H2O分子生成·OH[18],增加液相中·OH含量[19-20],反应如下(5)和(6):
| $ \mathrm{O}_{2}+\mathrm{e}^{-} \longrightarrow \cdot \mathrm{O}_{2}^{-} , $ | (5) |
| $ \mathrm{H}_{2} \mathrm{O}+\mathrm{h}^{+} \longrightarrow \mathrm{OH}+\mathrm{H}^{+} 。$ | (6) |
系统中SO2和NO被·OH、·O2-、O等自由基氧化生成极性强的SO3和NO2,与H2O反应生成稳定的H2SO4、HNO3,而纯海水吸收SO2、NO后主要以不稳定的H2SO3、HNO2等形式存在,还需进行曝气工序,占用空间、设备、时间等,不适用于舰船烟气脱硫脱硝。
2.2 不同工况下光催化/VUV协同海水吸收系统的脱硫脱硝率为探究不同工况下光催化/VUV协同海水吸收系统的脱硫脱硝率,本文分别考察了液气比、空速、温度、SO2初始浓度、NO初始浓度以及淡水为吸收剂等工况下的脱除率。
2.2.1 液气比的影响液气比影响吸收过程的气液传质,液气比过低达不到吸收效果,液气比过高时会导致动力(主要是海水泵)消耗高,设备重和占地面积大等一系列问题。由图 3可知,在模拟舰船烟气流量1.0 m3·h-1,SO2初始浓度2 567 mg·m-3,NO浓度510 mg·m-3,填料床层高600 mm,反应体系温度60 ℃,开启真空紫外灯的条件下,以海水为吸收剂,液气比为0.5 L·m-3时,NO脱除率达到100%、SO2脱除率达到95%,增大液气比至4.8 ~6.5 L·m-3时,SO2脱除率也可达到100%,这是因为一方面吸收液喷淋量增大可提供更多的气液接触面积,有利于SO2、NO的传质过程,使得脱硫脱硝率增加,另一方面光催化作用和紫外辐射能够使液相和气相中产生大量的·OH、O等自由基,自由基基元反应具有高效快速的特点,将SO2和NO氧化为SO3和NO2,易与H2O反应吸收。当液气比增大到8.0 L·m-3时,NO脱除率降低至70%,这是因为海水对紫外辐照有一定的吸收作用,过量的海水减少了紫外辐射和光催化作用产生氧化性自由基的数量。因此为保证光催化/VUV协同海水吸收系统最佳的液气比不应超过6.0 L·m-3。
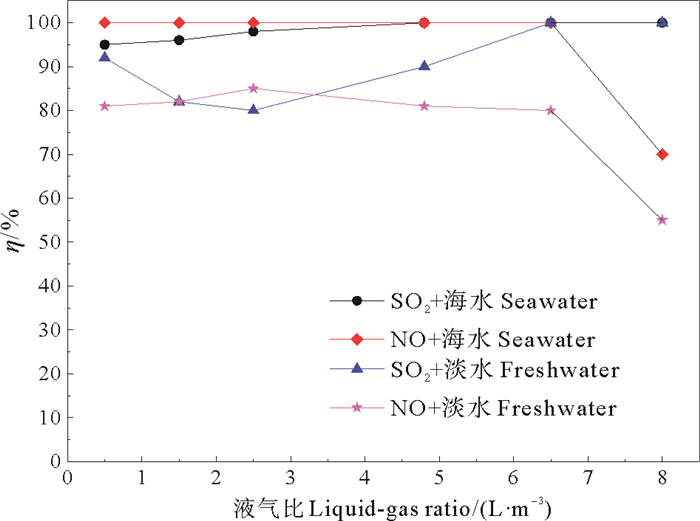
|
图 3 不同液气比下的脱硫脱硝率 Fig. 3 The efficiency of desulfurization and denitrification under different ratio of liquid-gas |
在以淡水为吸收剂的实验中,同样发现液气比超过6.5 L·m-3后,脱硝效率从80%降低为55%,而在液气比<6.5 L·m-3的条件下,脱硝率比海水吸收低20%,这是因为海水呈弱碱性,对酸性气体的吸收效果优于pH为中性的淡水。烟气比0.5~2.5 L·m-3范围真空紫外辐照氧化作用占主导,随着液气比继续增大,系统中水汽量增加,由于水汽对紫外辐射有一定的吸收作用以及UV灯管表面水膜厚度增加,导致活性自由基产生数量降低,SO2脱除率反而下降。液气比从2.5 L·m-3增加至6.5 L·m-3,脱硫率从78%升高至100%,此时水对SO2吸收的贡献度占据主导,液气比增加,脱硫率随之增加,当在液气比为6.5~8.5 L·m-3范围内时脱硫率达到100%不再变化。
2.2.2 空速的影响系统的空速同样影响吸收过程的气液传质,空速高,则烟气停留时间短,气液接触不充分,脱硫转化率低,但空速低,也可能使外扩散影响明显,光催化的效率没有充分发挥。调节模拟烟气流量为0.6~2.0 m3·h-1, SO2初始浓度2 700 mg·m-3, NO初始浓度500 mg·m-3,液气比4 L·m-3,反应体系温度60℃,填料床层高600 mm,从图 4结果可以看出,在海水为吸收剂的条件下,当空速从300 h-1增至1 100 h-1,SO2和NO脱除率均随空速从100%下降为76%和62%。其中NO脱除率随空速的增大下降迅速,这是因为NO的脱除更多来自于气相反应,空速的增加降低了烟气中SO2和NO的反应停留时间,SO2和NO脱除率降低。
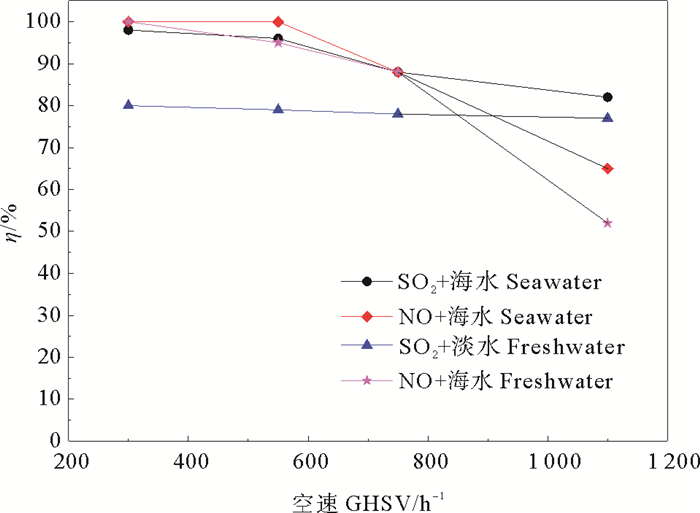
|
图 4 不同空速下的脱硫脱硝率 Fig. 4 The efficiency of desulfurization and denitrification under different GHSV |
以淡水为吸收剂的条件下,空速为300 h-1时脱硫率为80%,脱硫率随空速增加降低比较平缓,1 100 h-1时脱硫效率为77%,变化率不足3%,脱硫性能稳定,仍低于海水下的100%脱硫率。当空速从300 h-1增至1 100 h-1,脱硝率由100%降到52%,较海水低10%,这是因为淡水pH值为中性,溶解度小于呈弱碱性的海水。
2.2.3 温度的影响通过控制夹套循环水实现对负载型填料床层温度的调控,采用模拟烟气流量1.0 m3·h-1,SO2初始浓度2 700 mg·m-3,NO浓度590 mg·m-3,液气比4.0 L·m-3,填料层总高600 mm,考察不同温度下的系统脱硫脱硝率(见图 5)。使用海水和淡水喷淋条件下,SO2脱除率随温度升高下降迅速,由30 ℃时的94%下降为70 ℃时的75%,这是因为SO2的溶解度与温度负相关,海水和淡水系统的脱除效果随温度的响应变化趋势基本一致,且海水吸收系统较淡水吸收系统脱出效率高。,海水条件下,从30 ℃的72%提高至70 ℃的97%,淡水条件下,从30 ℃的67%升高至70 ℃的75%,这是因为温度升高后,气相中水汽含量升高,通过光催化/紫外辐射后系统中·OH的数量增加,利用自由基的强氧化性,将NO氧化成NO2后脱除,且海水呈弱碱性,吸收效果强于淡水,因此系统温度高于60 ℃后,脱硝能力增强。
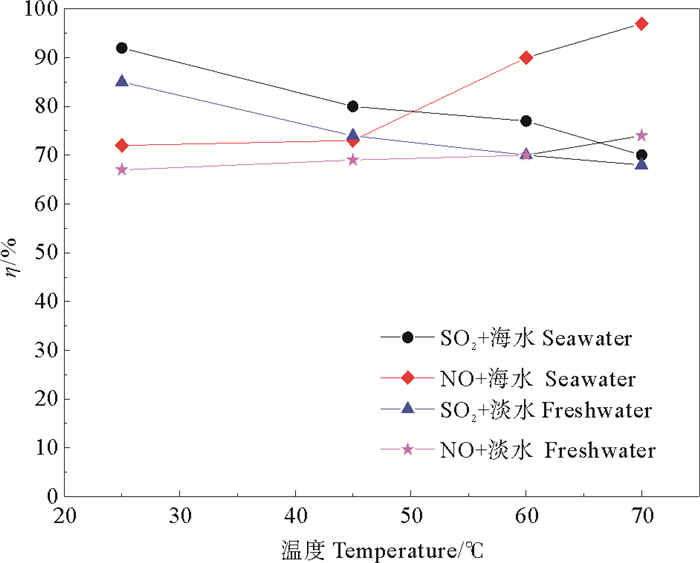
|
图 5 不同温度下的脱硫脱硝率 Fig. 5 The efficiency of desulfurization and denitrification under different temperature |
在模拟烟气流量1.0 m3·h-1,液气比2.5 L·m-3,NO初始浓度540 mg·m-3,反应体系温度60 ℃,填料层高度570 mm的实验条件下,考察了SO2初始浓度对NO脱除效率的影响,结果如图 6所示:NO脱除率随SO2初始浓度的增加呈现先减少后持平的趋势,在SO2浓度为1 600 mg·m-3下,97%的脱硝率降低到SO2浓度为3 800 mg·m-3时的88%,脱硝率下降约9%,随SO2浓度继续增至10 000 mg·m-3时,NO脱除率基本保持88%左右,同时SO2的脱除率从1 600 mg·m-3浓度下的100%降低为10 000 mg·m-3浓度下的70%,烟气流中存在大量未反应的SO2。这是因为在SO2初始浓度<3 800 mg·m-3时,SO2在气相反应和填料层吸附中与NO存在竞争关系,NO转化率随SO2浓度升高而下降,在SO2浓度超过3 800 mg·m-3后,由于NO浓度低,气相反应生成的SO3会与NO进行如下反应:SO3+NO→SO2+NO2,使得高浓度SO2对NO脱除率基本无影响。
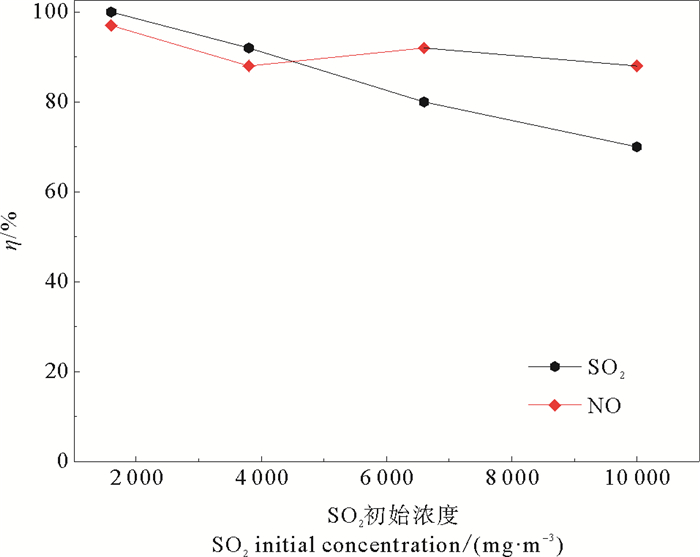
|
图 6 不同SO2初始浓度的NO脱除率 Fig. 6 The efficiency of denitrification under different SO2 initial concentration |
在实验条件为模拟烟气流量1.0 m3·h-1 ,液气比2.5L·m-3,SO2初始浓度2 500 mg·m-3,反应体系温度60 ℃,填料层高度570 mm,考察模拟烟气中初始NO浓度对SO2的脱除率的影响,实验结果如图 7,随着NO初始浓度由210 mg·m-3增至680 mg·m-3时,SO2脱除率保持在97%以上,表明NO初始浓度对SO2的吸收基本无明显的扰动。而NO的脱除率从浓度为210 mg·m-3浓度下的96%降低为浓度在550 mg·m-3浓度下的91%,下降趋势缓慢,随着NO浓度继续升高,从浓度为520 mg·m-3时,92%的NO脱除率快速下降至680 mg·m-3浓度下的60%,这是因为此时NO浓度超过520 mg·m-3后,因光催化填料比表面积一定,只有部分NO可在光催化剂表面的吸附反应,剩余NO不能参与氧化吸收反应,而且因H2O存在时,SO2键能较NO小,SO2较NO更容易被光催化剂捕获,因此NO随浓度升高率下降。
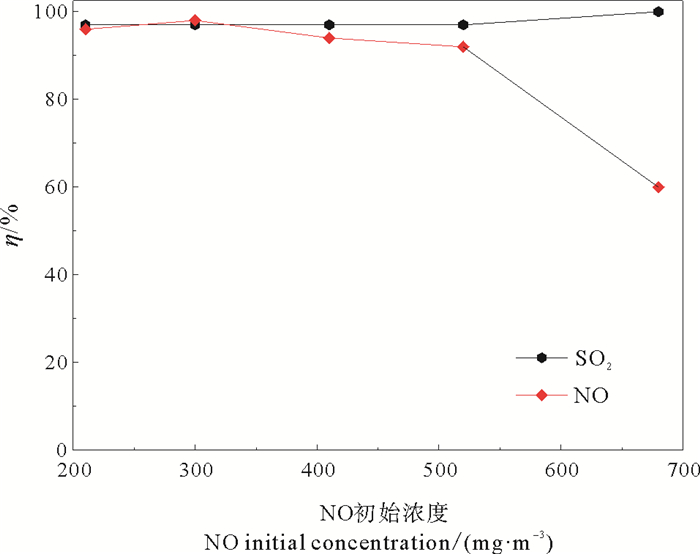
|
图 7 不同NO初始浓度的SO2脱除率 Fig. 7 The efficiency of desulfurization under different NO initial concentration |
(1) 纯海水吸收系统中,当液气比≥3.0 L·m-3以上时,脱硫率可超过90%,因NO在海水中溶解度低,纯海水吸收系统对NO脱除率约15%左右,而通过光催化/紫外辐射协同可增强海水对SO2和NO的吸收转化率,达到相同脱硫率100%以上时,液气比较纯海水吸收系统减少1.5 L·m-3,此可大大减少反应器液相负荷,并且对NO脱除率由15%升高到90%,实现同时脱硫脱硝的目的,更加适用于舰船烟气脱硫脱硝。
(2) 通过探究光催化/VUV协同海水吸收系统在不同工况下的脱硫脱硝率发现,该系统最佳的液气比不应超过6.5 L·m-3,过量海水对紫外辐照有一定的吸收作用,可减少紫外辐射和光催化作用产生氧化性自由基的数量,使得系统对SO2和NO的脱除率降低;该系统最佳空速为680 h-1;温度升高,系统脱硫效率降低,而,系统脱硝能力在温度高于60 ℃后增强;在淡水条件下,较海水条件下脱硫脱硝率有所下降,仍满足模拟舰船在淡水区脱硫脱硝的目的。
(3) 考察发现SO2初始浓度在一定范围内影响NO脱除率,NO脱除率随SO2初始浓度从1 600 mg·m-3增至3 800 mg·m-3时而减小,当SO2初始浓度超过3 800 mg·m-3后对NO脱除率几乎无影响;而NO初始浓度对SO2脱除率无明显影响。
综上讨论,光催化/VUV协同海水吸收技术在舰船烟气净化领域将是值得深入研究的技术之一。
| [1] |
张清凤, 陈晓平, 余帆. 海水脱硫技术在船舶废气处理上的研究进展[J]. 化工进展, 2016, 35(1): 277-284. Zhang F Q, Chen X P, Yu F. A review of seawater desulphurization technology on ship exhaust treatment[J]. Chemical Industry and Engineering Progress, 2016, 35(1): 277-284. (  0) 0) |
| [2] |
张静伟. 海水烟气脱硫填料吸收塔效率的研究[D]. 青岛: 中国海洋大学, 2010. Zhang J W. The Study of Desulphurization Efficiency by Seawater in Pack Absorption Tower[D]. Qingdao: Ocean University of China, 2010. (  0) 0) |
| [3] |
盖国盛. 船舶动力装置海水脱硫系统仿真及试验研究[D]. 哈尔滨: 哈尔滨工程大学, 2012. Gai G S. Numerical Simulation and Experiment Research About Seawater Desulphurization of Ship[D]. Harbin: Harbin Engineering University, 2012. (  0) 0) |
| [4] |
Li B L, Song H Y, Han F Q, et al. Photocatalytic oxidative desulfurization and denitrogenation for fuels in ambient air over Ti3C2/g-C3N4 composites under visible light irradiation[J]. Elsevier B V. DOI:10.1016/j.apcatb.2020.118845
(  0) 0) |
| [5] |
Zhang X B, Song H Y, Sun C Y, et al. Photocatalytic oxidative desulfurization and denitrogenation of fuels over sodium doped graphitic carbon nitride nanosheets under visible light irradiation[J]. Elsevier B V, 2019, 226: 34-43.
(  0) 0) |
| [6] |
商宇桐, 杨丽娜, 管景国, 等. 光催化氧化脱硫催化剂研究进展[J]. 石油化工高等学校学报, 2020, 33(2): 17-22. Shang Y T, Yang L N, Guan J G, et al. Progress in photocatalytic oxidation desulfurization catalysts[J]. Journal of Petrochemical Universities, 2020, 33(2): 17-22. DOI:10.3969/j.issn.1006-396X.2020.02.004 (  0) 0) |
| [7] |
Ding X H, Li C H, Wang L, et al. Fabrication of hierarchical g-C3N4/MXene-AgNPs nanocomposites with enhanced photocatalytic performances[J]. Materials Letters, 2019, 247: 174-177. DOI:10.1016/j.matlet.2019.02.125
(  0) 0) |
| [8] |
张明慧, 马强, 徐超群, 等. 臭氧氧化结合湿法喷淋对玻璃窑炉烟气同时脱硫脱硝实验研究[J]. 燃料化学学报, 2015, 43(1): 88-93. Zhang M H, Ma Q, Xu C G, et al. Simultaneous removal of NOx and SO2 from glass furnace flue gas by ozone oxidation and spray tower[J]. Journal of Fuel Chemistry and Technology, 2015, 43(1): 88-93. DOI:10.3969/j.issn.0253-2409.2015.01.014 (  0) 0) |
| [9] |
周杨, 李彩婷, 喻明娥, 等. 臭氧应用于烟气净化的研究进展[J]. 环境化学, 2015, 34(6): 1116-1126. Zhou Y, Li C T, Yu M E, et al. Research progress of ozone application in flue gas purification[J]. Environmental Chemistry, 2015, 34(6): 1116-1126. (  0) 0) |
| [10] |
孙圣楠, 李春虎, 闫欣, 等. 活化半焦负载Fe掺杂TiO2光催化烟气脱硝的研究[J]. 中国海洋大学学报(自然科学版), 2015, 45(11): 63-68. Sun S N, Li C H, Yan X, et al. Investigation of photocatalytic removal of NO from flue gas by Fe-TiO2 loaded on activated semi-coke[J]. Periodical of Ocean University of China, 2015, 45(11): 63-68. (  0) 0) |
| [11] |
Ding X H, Li Y C, Li C H, et al. 2D visible-light-driven TiO2@Ti3C2/g-C3N4 ternary heterostructure for high photocatalytic activity[J]. Journal of Materials Science, 2019, 54(13): 9385-9396. DOI:10.1007/s10853-018-03289-4
(  0) 0) |
| [12] |
Zheng R, Li C H, Zhang C Z, et al. Photo-reduction of NO by g-C3N4@foamed ceramic[J]. Chinese Journal of Chemical Engineering, 2020, 28(7): 1840-1846. DOI:10.1016/j.cjche.2020.02.020
(  0) 0) |
| [13] |
Huang K L, Li C H, Zhang X L, et al. TiO2 nanorod arrays decorated by nitrogen-doped carbon and g-C3N4 with enhanced photoelectrocatalytic activity[J]. Applied Surface Science, 2020, 518: 146-219.
(  0) 0) |
| [14] |
马双忱, 马京香, 赵毅, 等. 紫外/过氧化氢法同时脱硫脱硝的研究[J]. 热能动力工程, 2009, 24(6): 792-795. Ma S C, Ma J X, Zhao Y, et al. Research of ultraviolet/hydrogen-peroxide method for simultaneous desulfurization and denitrification[J]. Journal of Engineering for Thermal Energy and Power, 2009, 24(6): 792-795. (  0) 0) |
| [15] |
Liu Y Q, Wang H Y, Zhao J C, et al. Ultra-deep desulfurization by reactive adsorption desulfurization on copper-based catalysts[J]. Journal of Energy Chemistry, 2019, 29(2): 8-16.
(  0) 0) |
| [16] |
孙圣楠. 金属与非金属改性TiO2/ASC光催化剂的制备与NO氧化表面光电子行为研究[D]. 青岛: 中国海洋大学, 2015. Sun S N. Preparation of Photocatalysts TiO2/ASC Modified by Metal and Non·-metal and Investigation of Photo-·electron Behavior for NO Oxidation[D]. Qingdao: Ocean University of China, 2015. (  0) 0) |
| [17] |
Adapa S, Gaur V, Vema N. Catalytic oxidation of NO by activated carbon fiber(ACF)[J]. Chemical Engineering Journal, 2006, 1(116): 25-37.
(  0) 0) |
| [18] |
韩静, 赵毅. 不同光源下TiO2/ACF同时脱硫脱硝实验研究[J]. 环境科学, 2009, 30(4): 997-1002. Han J, Zhao Y. Simultaneous desulfurization and denitrification by TiO2/ACF under different irradiation[J]. Environmental Science, 2009, 30(4): 997-1002. DOI:10.3321/j.issn:0250-3301.2009.04.010 (  0) 0) |
| [19] |
Dalton J S, Janes P A, Jones N G. Photocatalytic oxidation of NOx gases using TiO2: A surface spectroscopic approach[J]. Environmental Pollution, 2002, 2(120): 415-422.
(  0) 0) |
| [20] |
Zhao J, Yang X. Photocatalytic oxidation for indoor air purification: A literature review[J]. Building and Environment, 2003, 5(38): 645-654.
(  0) 0) |
2. The Key Laboratory of Marine Chemistry Theory and Technology, Ministry of Education, Qingdao 266100, China;
3. Weihai Puyi Marine Environmental Technology Co. Ltd., Weihai 264200, China
 2021, Vol. 51
2021, Vol. 51


