2. 山东省友发水产有限公司,山东 滨州 251900
斑节对虾(Penaeus monodon)(非洲群体)又名金刚虾、黑虎虾,原产于莫桑比克,具有个体大、肉质鲜美、营养丰富、生长速度快、抗逆性强、经济价值高等优点[1-2],夏秋季节工厂化养殖金刚虾成本低、价格高、养殖周期短,能有效地利用闲置的工厂化养殖车间,因此金刚虾具有广泛的推广价值。
夏季工厂化车间水温高、密度高、投饵料量大,高含氮排泄物和残饵在养殖环境中积累,超过水体微生态系统的自净能力,使水体中的亚硝态氮含量升高[3]。养殖过程中,对虾长时间受到亚硝态氮胁迫,摄食量减弱,造成空肠、空胃,严重时对虾停止摄食,游动活力减弱,最终导致死亡。有研究发现,亚硝态氮进入对虾血淋巴后,与血蓝蛋白结合,使血淋巴对氧的亲和性降低,最终造成了对虾的中毒或死亡[4-5];且长时间的胁迫会损坏对虾的组织器官[6-7],致使机体抗氧化系统和非特异性免疫系统功能下降,生理代谢紊乱,从而降低对虾的存活率和免疫功能[8-9]。金刚虾工厂化养殖模式发展的初步阶段,对养殖的基础理论知识研究较少,充分了解养殖水质对金刚虾生理特性的影响,是工厂化养殖发展的保障。本实验通过模拟实际养殖生产中水中NO2-N的变化,研究其对对虾行为、消化和非特异性免疫系统的影响,为实际养殖生产提供参考。
1 材料与方法 1.1 实验材料及管理实验于2020年10月在山东省友发水产有限公司工厂化养殖车间进行。金刚虾体质量为(6.06±0.76) g,实验桶为圆柱形(有效水体积为1 m3/桶),中心排污。试验期间所用水为经过漂白粉消毒暴晒后的海水,盐度35,pH=8.0±0.5,水温(28±0.5) ℃,24 h不间断曝气,溶氧量约(7.0±0.5) mg/L。金刚虾养殖过程中每天投喂4次(6:00、11:00、16:00、21:00),投喂量以2 h摄食完毕为标准;每天换水一次,第1~8天换水量为总养殖水量的20%,第9天后,根据养殖水质的变化每天增加5%换水量,直至60%。NO2-N浓度采用亚硝酸钠(分析纯)调置,购买于国药集团化学试剂有限公司。
1.2 实验设计金刚虾的放养密度为500尾/m3。模拟实际工厂化养殖中水体NO2-N逐渐升高的趋势,以每天0.5 mg/L的浓度逐渐提高水体中的NO2-N,对照组不做NO2-N处理,其他实验条件与对照组相同。分别在NO2-N浓度为2 mg/L(实验第4天)、4 mg/L(实验第8天)、6 mg/L(实验第12天)、8 mg/L(实验第16天)、10 mg/L(实验第20天)、12 mg/L(实验第24天)、14 mg/L(实验第28天)时,进行取样,并记录金刚虾的活力状态、摄食及死亡情况,如有死亡个体及时清理。实验期间,为了保证NO2-N的浓度,每天换水后0.5和12 h时用盐酸萘乙二胺检测法测定养殖水体中NO2-N含量,根据测定的数值及时调整水体的NO2-N浓度。
1.3 样品制备在NO2-N浓度为2、4、6、8、10、12、14 mg/L时,每桶随机取20尾金刚虾,用1 mL无菌注射器从金刚虾围心腔中抽取血液,并加入到抗凝剂中,抗凝剂(肝素钠溶液0.1%,125 U/mL)与血液的体积比为1∶1。混合均匀后,立即在4 ℃下8 500 r/min离心5 min,取上清液转移至-80 ℃冷冻保存、待测。另将金刚虾的肝胰腺,收集放入已灭菌50 mL的无菌管内,按照样品∶生理盐水=1∶9比例,加入生理盐水,在冰水浴中进行超声波破碎(匀浆3 s,间歇8 s,3~4次),匀浆液4 ℃,8 000 r/min离心5 min后,取上清液-80 ℃保存,待测。
1.4 指标检测 1.4.1 金刚虾行为观察在投喂前和投喂2 h后观察金刚虾分布状态(水底U、水中M、水面Su)及游动活力(迅速Q、缓慢S);投喂后,以2 h为标准观察金刚虾的摄食速度,超过2 h未摄食完的以每15 min为间隔观察金刚虾是否摄食完毕;摄食后金刚虾肠道呈清晰饱满状态(清晰C、饱满F,模糊V、不饱满N,空肠J、空胃E);记录实验过程中死亡个数。
1.4.2 消化酶活性测定采用南京建成生物工程研究所的试剂盒测定金刚虾肝胰腺组织样品中脂肪酶(Lipase)、胰蛋白酶(Trypsin)活性。脂肪酶活力定义为37 ℃条件下每毫克组织蛋白每分钟水解生成1 μmol脂肪酸为一个活力单位。胰蛋白酶活力定义为37 ℃条件下每毫克组织蛋白每分钟水解生成1 μg氨基酸为一个酶活力单位。
1.4.3 非特异性免疫酶活性测定采用南京建成生物工程研究所试剂盒测定金刚虾血淋巴样品中谷胱甘肽(GSH)含量,谷草转氨酶(GOT)、谷丙转氨酶(GPT)、酸性磷酸酶(ACP)等非特异性免疫酶活性。GSH含量定义为测定组织液或体液中总谷胱甘肽减去2倍的氧化性GSSG的量;GOT酶活力定为在25 ℃条件下1 mL体液,1 min内所生成的丙酮酸,使NADH氧化成NAD+而引起吸光度每下降0.001为一个单位;GPT酶活力定为在25 ℃条件下1 mL体液,1 min内所生成的丙酮酸,使NADH氧化成NAD+而引起吸光度每下降0.001为一个单位;ACP酶活力定义为100 mL血清中在37 ℃与基质作用30 min产生1 mg酚为1个金氏单位。
1.5 数据处理实验数据利用SPSS 16.0进行单因素方差分析(one-way ANOVA,Excel 2010软件作图,结果均表示为平均值±标准差(Mean±SD),P < 0.05为差异显著。
2 结果与分析 2.1 NO2-N慢性胁迫对金刚虾行为的影响如表 1所示,实验开始后,在NO2-N≤6 mg/L(第12天)时实验组与对照组(NO2-N≤(0.020±0.008) mg/L)金刚虾的生活状态无明显差异,金刚虾栖于养殖桶中、底部,除喂料时很难看到其游到水面,摄食正常,摄食后胃肠清晰饱满。在6 mg/L(第12天)≤NO2-N≤8 mg/L(第16天)时,实验组金刚虾摄食能力逐渐减缓,需要2 h 5 min才能将饵料摄食完,在水中的分布状态、游动活力及胃肠饱满清晰与对照组((0.020±0.008) mg/L≤NO2-N≤(0.03±0.01) mg/L)未见明显差异;8 mg/L(第16天)≤NO2-N≤10 mg/L(第20天)时,金刚虾需要2 h 30 min才能将饵料摄食完,相较于对照组((0.03±0.01)mg/L≤NO2-N≤(0.10±0.03)mg/L),摄食速度下降明显,胃肠道稍有模糊,不饱满,实验组水面会偶见上游的金刚虾;NO2-N≥10 mg/L(第20天)时,金刚虾需要3 h才能将食物摄食完,有的金刚虾胃肠道模糊,有的出现空肠现象,粪便空絮状;NO2-N达到14 mg/L(第28天)时,金刚虾停止摄食,水面、桶壁可见金刚虾缓慢游动并碰触桶壁,并出现死亡个体(见表 1)。
|
|
表 1 NO2-N慢性胁迫对金刚虾行为的影响 Table 1 Effects of chronic nitrite stress on behavior of an African population of Penaeus monodon |
如图 1A所示,当NO2-N升高至2 mg/L(第4天)时,Trypsin活性值高于对照组(NO2-N=0.0 mg/L),但无显著差异(P>0.05);当NO2-N升高至6 mg/L(第12天)时,实验组活性升高至最大值,显著高于对照组;之后逐渐下降,当10 mg/L(第20天)≤NO2-N≤14 mg/L(第28天)时,Trypsin活性均显著低于对照组((0.1±0.03)mg/L≤NO2-N≤(0.18±0.08)mg/L)(P < 0.05)。
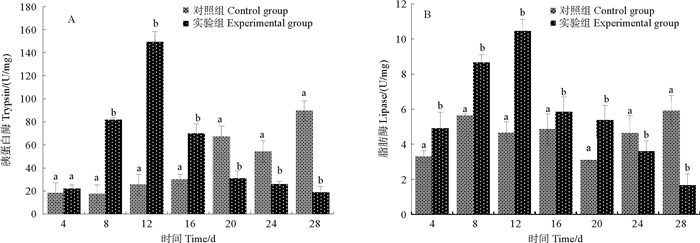
|
(图中不同小写字母表示同一时间各组之间存在显著性差异(P < 0.05)。Different small letter superscripts in the figures are significantly different (P < 0.05). ) 图 1 NO2-N慢性胁迫对金刚虾消化酶活性的影响 Fig. 1 Effects of chronic nitrite stress on the activities of digestive enzymes of an African population of Penaeus monodon |
如图 1B所示,Lipase活性变化趋势与Trypsin相似。当2 mg/L(第4天)≤NO2-N≤6 mg/L(第12天)时,Lipase活性显著升高,当NO2-N升高至6 mg/L(第12天)时,Lipase活性达到最大值,当8 mg/L(第16天)≤NO2-N≤10 mg/L(第20天)时,Lipase活性下降,但均显著高于对照组(P < 0.05);当NO2-N≥12 mg/L(第24天)时,Lipase活力下降且显著低于对照组(P < 0.05)。
2.3 NO2-N慢性胁迫对金刚虾血淋巴中非特异性免疫酶活性的影响如图 2A所示,当NO2-N升高至4 mg/L(第8天)时,ACP活性显著升高,当NO2-N升高至6 mg/L(第12天)时,酶活性达到最高峰值,显著高于对照组(P < 0.05),之后随着NO2-N缓慢升高,ACP活性逐渐下降,当8 mg/L(第16天)≤NO2-N≤10 mg/L(第20天)时,实验组活性仍明显高于对照组,当12 mg/L(第24天)≤NO2-N≤14 mg/L(第28天)时,ACP活性值均显著低于对照组(P < 0.05)。
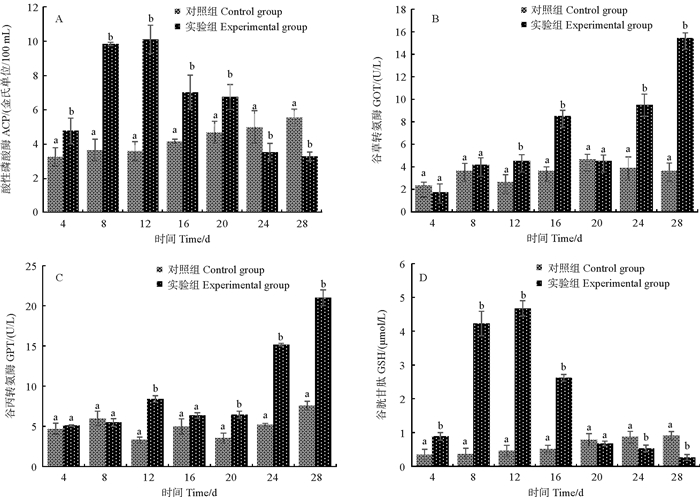
|
(图中不同小写字母表示同一时间各组之间存在显著性差异(P < 0.05)。Different small letter superscripts in the figures are significantly different (P < 0.05). ) 图 2 NO2-N慢性胁迫对金刚虾血淋巴中非特异性免疫性酶活性的影响 Fig. 2 Effects of chronic nitrite stress on the activity of nonspecific immune enzymes in serum of an African population of Penaeus monodon |
如图 2B所示,当NO2-N≤8 mg/L(第16天)时,实验组的GOT酶活性一直是上升的状态,且明显高于对照组(P < 0.05);当NO2-N升高至10 mg/L时(第20天),GOT活性开始下降,略低于对照组(P>0.05);当NO2-N升高至12 mg/L(第24天)时,GOT活性开始升高,至实验结束时,持续升高,明显高于对照组(P < 0.05)。
如图 2C所示,当NO2-N升高至2 mg/L(第4天)时,GPT活性略高于对照组(P>0.05),当NO2-N升高至4 mg/L(第8天)时,实验组GPT活性略有升高,但低于对照组(P>0.05),当NO2-N升高至6 mg/L(第12天)时,GPT酶活性上升,显著高于对照组(P < 0.05);当8 mg/L(第16天)≤NO2-N≤10mg/L(第20天)时,GPT酶活性下降,但均高于对照组(P>0.05);当NO2-N≥12 mg/L(第24天)时,GPT酶活性不断升高,显著高于对照组(P < 0.05)。
如图 2D所示,当NO2-N升高至6 mg/L(第12天)时,实验组GSH含量达到最大值,显著高于对照组(P < 0.05);当NO2-N升高至8 mg/L(第16天)时,GSH含量开始下降,显著高于对照组(P < 0.05),当NO2-N≥10 mg/L(第20天)时,GSH含量下降,当NO2-N升高至14 mg/L(第28天)时,GSH含量最低,显著低于对照组(P < 0.05)。
3 讨论 3.1 NO2-N慢性胁迫对金刚虾活力和摄食行为的影响NO2-N是对虾工厂化养殖的主要胁迫因子之一,对对虾的生长、繁殖、行为、代谢和免疫等有重要影响,严重制约了对虾高密度养殖产业的发展。行为是动物适应内外环境变化所产生的反应[10],研究表明,养殖水体中NO2-N浓度的升高会影响对虾血蓝蛋白的形成,引起组织缺氧,严重影响对虾的呼吸代谢,对养殖生物的行为产生影响,如摄食频率下降、游泳异常缓慢,严重的可直接造成对虾死亡[11-12]。本实验中,金刚虾在NO2-N慢性胁迫中也表现出相似的行为。在低浓度时(≤6 mg/L),金刚虾摄食频率、活力和游动并无异常;随着NO2-N浓度升高(≥8 mg/L),金刚虾摄食速度明显下降,胃肠道模糊、不饱满;金刚虾分布于中上层,游动异常,根据日本对虾(Penaeus japonicus)[13]、日本沼虾(Macrobrachium nipponensis)[14]为躲避低氧区域,趋向于浅水区或碰触水槽来接触空气,以增加自身的摄氧量,推测NO2-N慢性胁迫引起金刚虾组织缺氧,致使金刚虾异常游动到水上层甚至水面。因此,在实际工厂化养殖过程中,将养殖水体中NO2-N浓度控制在6 mg/L以下,将不会影响金刚虾的活力及摄食。
3.2 NO2-N慢性胁迫对金刚虾肝胰腺消化酶活性的影响肝胰腺是对虾合成和分泌消化酶、消化吸收并贮存营养物质的器官,通过组织切片和超微观察发现,NO2-N能够破坏器官组织,影响对虾的消化吸收[12, 15]。消化酶活性是反应个体摄食活性的最直接的证据[16-18]。NO2-N胁迫会导致水生生物的食欲下降,降低对虾的摄食率和饲料转化率,从而引起水生生物生长速率下降。实验中的脂肪酶和胰蛋白酶均在NO2-N浓度为6 mg/L时上升至最大值,随着NO2-N浓度升高表现出了“诱导-抑制”的变化趋势。研究表明,随着养殖水体NO2-N浓度逐渐升高,导致血液携氧量下降,组织缺氧[19],打破了机体的代谢平衡,为了维持机体代谢平衡,需要消耗大量的糖类、脂肪、蛋白质来提供能量[12, 20-21],从而在短时间内提高了消化酶活力[18]。本实验证明, 在NO2-N浓度升高过程中,通过脂肪和蛋白质的大量消耗来为机体提供能量,当NO2-N浓度继续升高后,降低了脂肪酶和胰蛋白酶的活性,导致金刚虾摄食减少,机体供能减少,其表现为游动缓慢、摄食速度下降,这一情形与上述3.1结果相呼应。
3.3 NO2-N慢性胁迫对金刚虾血淋巴中免疫酶活性的影响ACP是溶酶体酶的一种,其活性的高低直接反映生物体的生长状况、免疫功能及应对外界环境变化的能力[22]。在本实验中,ACP随着NO2-N浓度表现出“先升高后下降”的趋势,说明NO2-N慢性胁迫对金刚虾血淋巴中ACP产生了诱导,活性值升高,机体的生长及反应能力不受影响;之后ACP活性下降,推测NO2-N浓度抑制ACP产生,使机体免疫及反应能力下降。GOT、GPT是肝脏重要的转氨酶,在正常状态下,活性稳定;当肝细胞受到外界刺激导致损伤或者病变时,细胞膜通透性增强,将肝细胞中的这两种酶释放到血液中,致使血淋巴中两种酶活性升高[23],因此GOT、GPT是反应肝细胞是否受损的重要指标,可以评价NO2-N胁迫对养殖生物的毒副作用[24]。本实验研究中,金刚虾血淋巴中GOT、GPT活性随着NO2-N浓度的升高,表现出“先升高后下降再升高”的趋势。说明NO2-N慢性胁迫对金刚虾肝胰腺产生了一定的损伤;之后GOT、GPT活性下降,推测金刚虾开始出现一定自身修复功能,随着NO2-N浓度的持续升高,超越了自身修复能力,从而对肝胰腺产生了负担甚至损伤。这与已有的研究“毒性兴奋效应”现象相似,在一定的浓度范围内,经过外界物质的刺激,促使机体为快速清除胁迫而产生活性氧,以增强抵抗力;超越浓度范围则会对机体产生严重损伤[25]。
氧化应激反应是对虾体内一种危害机制,会导致对虾体内产生大量自由基(ROS),从而对重要器官造成损伤[26],使对虾组织产生病理变化,其中对肝胰腺的影响最为严重[27]。GHS是体内重要的抗氧化剂,它可通过参与非酶类抗氧化反应和作为GSH-Px的底物来清除ROS[28]。本实验结果显示,随着NO2-N浓度的升高GSH活性逐渐升高,在NO2-N浓度小于等于6 mg/L时达到峰值,表明GHS受到NO2-N胁迫后迅速清除金刚虾体内的ROS,提高其免疫能力,以应对外界环境的变化。随着NO2-N浓度升高,酶活力转而下降,直至显著低于对照组,推测可能由于金刚虾体内的自由基增多超出了清除能力,致使金刚虾重要器官受到损伤,甚至出现死亡。
4 结语当养殖水体中NO2-N浓度小于6 mg/L时,NO2-N对金刚虾的摄食、活力行为影响不显著,对相关消化酶和免疫酶产生了诱导作用。当NO2-N浓度大于10 mg/L时,NO2-N对金刚虾的摄食及活力影响显著,且显著影响着相关消化酶和免疫酶的活性。因此,水体中NO2-N浓度控制在6 mg/L以下不会影响金刚虾的生长。
| [1] |
陈书畅, 徐晔, 吴龙华, 等. 南非斑节对虾和中国明对虾肌肉营养成分分析比较[J]. 水产科技情报, 2019, 46(5): 283-286. Chen S C, Xu Y, Wu L H, et al. Comparative analysis of muscle nutrients between Penaeus monodom and Penaeus chinensis[J]. Aquatic Science and Technology Information, 2019, 46(5): 283-286. (  0) 0) |
| [2] |
王晓璐, 李乐, 王友红, 等. 南非斑节对虾肠道组织结构及菌群特征、代谢活性研究[J]. 广西科学院学报, 2019, 35(4): 325-331. Wang X L, Li L, Wang Y H, et al. Research on organization structure, miro-flora characteristics and metabolic activity of Penaeus monodom[J]. Journal of Guangxi Academy of Sciences, 2019, 35(4): 325-331. (  0) 0) |
| [3] |
高明辉, 马立保, 葛立安, 等. 亚硝酸盐在水生动物体内的吸收机制及蓄积的影响因素[J]. 南方水产, 2008, 4(4): 73-79. Gao M H, Ma L B, Ge L A, et al. Nitrite uptake mechanism and the influencing factors of accumulation in aquatic animals[J]. South China Fisheries Science, 2008, 4(4): 73-79. DOI:10.3969/j.issn.2095-0780.2008.04.014 (  0) 0) |
| [4] |
Cheng S Y, Chen J C. Haemocyanin oxygen affinity and the fractionation of oxyhemocyanin and deoxyhemocyanin for Penaeus monodom exposed to elevated nitrite[J]. Aquatic Toxicology, 1999, 45: 35-46. DOI:10.1016/S0166-445X(98)00090-3 (  0) 0) |
| [5] |
陈亭君, 刘建勇, 申玉春, 等. 亚硝酸盐氮对日本囊对虾幼虾的急性毒性研究[J]. 渔业现代化, 2019, 46(3): 35-40. Chen T J, Liu J Y, Shen Y C, et al. Study on acute toxicity of nitrite to juvenile shrimp Marsupenaeus japonicus[J]. Fishery Modernization, 2019, 46(3): 35-40. DOI:10.3969/j.issn.1007-9580.2019.03.006 (  0) 0) |
| [6] |
Duan Y F, Liu Q S, Wang Y, et al. Impairment of the intestine barrier function in Litopenaeus vannamei exposed to ammonia and nitrite stress[J]. Fish and Shellfish Immunology, 2018(78): 279-288. (  0) 0) |
| [7] |
Duan Y F, Zhang J S, Wang Y, et al. Nitrite stress disrupts the structural integrity and induces oxidative stress response in the intestines of Pacific white shrimp Litopenaeus vannamei[J]. Experimental Zoology Part A, Ecolgical and Zntegrative Physiology, 2018, 329(1): 43-50. DOI:10.1002/jez.2162 (  0) 0) |
| [8] |
Cheng S Y, Shi L W, Chen J C. Changes in hemolymph oxyhemocyanin, acid-base balance, and electrolytes in Marsupenaeus japonicus under combined ammonia and nitrite stress[J]. Aquatic Toxicology, 2013(130): 131-138. (  0) 0) |
| [9] |
Guo H, Ye C X, Wang A L, et al. Trascriptome analysis of the Pacific white shrimp Litopenaeus vannamei exposed to nitrite by RNA-seq[J]. Fish&Shellfish Immunology, 2013, 35(6): 2008-2016. (  0) 0) |
| [10] |
刘莎, 黄小丽, 李良玉, 等. 氨氮、亚硝酸盐胁迫对小龙虾的影响[J]. 水产养殖, 2021, 42(1): 56-57. Liu S, Huang X L, Li L Y, et al. Effects of ammonia nitrogen and nitrite stress on Procambarus clarkii[J]. Aquaculture, 2021, 42(1): 56-57. DOI:10.3969/j.issn.1004-2091.2021.01.017 (  0) 0) |
| [11] |
李波. 氨氮和亚硝酸盐对黄颡鱼的毒性研究[D]. 武汉: 华中农业大学, 2010. Li B. Effects of Ammonia and Nitrite Toxicity on Yellow Catfish Pelteobagrus fulvidraco[D]. Wuhan: Huazhong Agricultural University, 2010. (  0) 0) |
| [12] |
刘海侠, 孙海涛, 刘晓强, 等. 亚硝酸盐中毒鲤的血液和组织病理学研究[J]. 淡水渔业, 2010, 40(3): 67-71. Liu H X, Sun H T, Liu X Q, et al. Study on hematology and histopathology of acute toxicity test of nitrite in Cyprinus carpio[J]. Freshwater Fisheries, 2010, 40(3): 67-71. DOI:10.3969/j.issn.1000-6907.2010.03.012 (  0) 0) |
| [13] |
Egusa S, Yamamoto T. Studies on the respiration of the "Kumura" prawn Penaeus japonicus bate. I. Burrowing behavior with special reference to its relation to environmental oxygen concentration[J]. Bulletin of the Japanese Society Scientific Fisheries, 1961, 27: 22-27. DOI:10.2331/suisan.27.22 (  0) 0) |
| [14] |
Kang J C, Matsuda O, Imamura N. Avoidance and behavior of prawn Macrobrachium nipponense by oxygen depletion and hydrogen sulfide[J]. Nippon Suisan Gakkaishi, 1995, 61(1): 827-831. (  0) 0) |
| [15] |
胡静, 周胜杰, 杨蕊, 等. 亚硝酸盐胁迫对尖吻鲈稚鱼消化酶活性的影响[J]. 暨南大学学报, 2020, 42(1): 31-38. Hu J, Zhou S J, Yang R, et al. Effect of acute nitrite on digestive enzymes in juvenile Lates calcarifer[J]. Journal of Jinan University, 2020, 42(1): 31-38. (  0) 0) |
| [16] |
柳琪, 区又君. 鱼类早期发育阶段摄食行为的研究现状[J]. 南方水产, 2006, 2(1): 71-75. Liu Q, Qu Y J. Present status on feeding behavior studies in early development of fishes[J]. South China Fisheries Science, 2006, 2(1): 71-75. DOI:10.3969/j.issn.2095-0780.2006.01.015 (  0) 0) |
| [17] |
胡炜, 赵斌, 李成林, 等. 慢性氨氮胁迫对刺参摄食与消化酶活性的影响[J]. 中国水产科学, 2018, 25(1): 137-146. Hu W, Zhao B, Li C L, et al. Effects of chronic ammonia nitrogen stress on the feeding and digestive enzyme activities of sea cucumber(Apostichopus japonicas Selenka)[J]. Journal of Fishery Sciences of China, 2018, 25(1): 137-146. (  0) 0) |
| [18] |
Egnew N, Renukdas N, Ramena Y, et al. Physiological insights into largemouth bass (Micropterus salmoides) survival during long-term exposure to high environmental ammonia[J]. Aquatic Toxicology, 2019, 207: 72-82. (  0) 0) |
| [19] |
Jensen F B. Nitrite disrupts multiple physiological functions in aquatic animal[J]. Comparative Biochemistry and Physiology-Part A: Molecula & Integrative Physiology, 2003, 135(1): 9-24. (  0) 0) |
| [20] |
强俊, 杨弘, 马昕羽, 等. 基于响应曲面法研究亚硝酸盐与养殖密度对吉富罗非鱼幼鱼生长与肝脏抗氧化能力的影响[J]. 海洋与湖沼, 2015, 46(5): 1166-1174. Qiang J, Yang H, Ma X Y, et al. Using response surface methodol ogy to determine effects of chronic nitrite exposure and stocking density on growth of gift tilapla Oreochromis niloticus juveniles[J]. Oceanologia Et Limnologia Sinica, 2015, 46(5): 1166-1174. (  0) 0) |
| [21] |
Mallasen M, Valenti W C. Effect of nitrite on laval development of giant river prawn Macrobrachium rosenbergii[J]. Aquaculture, 2006, 261(4): 1292-1298. (  0) 0) |
| [22] |
叶海斌, 樊英, 严芳, 等. 益生菌制剂对虹鳟血清生化指标和免疫功能的影响[J]. 华南师范大学学报(自然科学版), 2018, 50(3): 41-49. Ye H B, Fan Y, Yan F, et al. Effects of dietary probiotics on serum biochemistry and immunity of rainbow trout, Oncorhynchus mykiss[J]. Journal of South China Normal University(Natural Science Edition), 2018, 50(3): 41-49. (  0) 0) |
| [23] |
孙怡晴. 拥挤胁迫和亚硝酸盐胁迫对草鱼应激相关基因和泛素-蛋白酶体系统的影响[D]. 武汉: 华中农业大学, 2018. Sun Y Q. The Effect of Crowding Stress and Nitrite Stress on Stress-Related Genes and Ubiquitin-Proteasome System in Grass Carp Ctenopharyngodon idella[D]. Wuhan: Huzhong Agricultural University, 2018. (  0) 0) |
| [24] |
樊英, 叶海斌, 王晓璐, 等. 丁酸梭菌和凝结芽孢杆菌对虹鳟生长性能、肝功能及肠道菌群的影响[J]. 大连海洋大学学报, 2019, 34(2): 198-203. Fan Y, Ye H B, Wang X L, et al. Effects of Clostridium butyricum and Bacillus coagulans on growth performance, hepatic function and intestinal microbiotain rainbow trout Oncorhynchus mykiss[J]. Journal of Dalian Ocean University, 2019, 34(2): 198-203. (  0) 0) |
| [25] |
赵艳飞, 宋志飞, 王贤丰, 等. 亚硝酸盐急性胁迫对拟穴青蟹相关免疫指标的影响[J]. 广西科学, 2017, 24(4): 382-388. Zhao Y F, Song Z F, Wang X F, et al. Effects of acute nitrite exposure on immnity indicators in Scylla paramamosain[J]. Guangxi Sciences, 2017, 24(4): 382-388. (  0) 0) |
| [26] |
Camargo J A, Alonso Á. Ecological and toxicological effects of inorganic nitrogen pollution in aquatic ecosystems: A global assessment[J]. Evironment International, 2006, 32(6): 831-849. (  0) 0) |
| [27] |
余苗苗, 江敏, 吴昊, 等. 亚硝酸盐和氨对日本沼虾肝胰腺代谢的影响[J]. 生态毒理学报, 2019, 14(3): 99-111. Yu M M, Jiang M, Wu H, et al. Effects of nitrite and ammonia on the hepatopancreas metabolism of Macrobrachium nipponensis[J]. Asian Journal of Ecotoxicology, 2019, 14(3): 99-111. (  0) 0) |
| [28] |
Barata C, Varo I, Navarro J C, et al. Antioxidant enzyme activities and lipid peroxidation in the freshwater cladoceran Daphnia magna exposed to redox cycling compounds[J]. Comparative Biochemistry and Physiology C Toxicology and Pharmacology, 2005, 140: 175-186. (  0) 0) |
2. Shandong Youfa Aquaculture Company Limited, Binzhou 251900, China
 2023, Vol. 53
2023, Vol. 53


