2. 中国海洋大学海洋环境与生态教育部重点实验室,山东 青岛 266100
浮游植物是海洋初级生产力的主要贡献者,它能够进行光合作用将无机物转化成有机物,通过食物链和食物网传递物质和能量,是生态系统的基本环节。浮游植物在海洋生态系统中的作用具有多样性。首先,浮游植物会直接或间接地影响到浮游动物和经济鱼虾类的生长状态,甚至在很大程度上会影响渔业资源的数量,所以浮游植物是渔业资源调查的重要内容[1];其次,浮游植物个体小、生命周期短[2],能够对环境变化做出迅速响应[3],因而在指示水体环境变化方面具有重要作用;另外,浮游植物群落结构的改变会对海洋云反照率[4]、碳通量[5]和海水光通量与热通量[6]产生影响,进而影响全球气候。因此,浮游植物的群落结构的研究对掌握海洋生物资源现状、水环境监控乃至全球变化都具有重要意义。
陆架边缘海是面积小、生产力高[7]的海域,在海洋生态系统中扮演着重要角色。渤海和黄海作为典型的半封闭型陆架边缘海[8],成为了研究生物资源状况和环境变化的热点海区。渤海的辽东湾、渤海湾和莱州湾入海河流较多;北黄海有黄海暖流、冷水团存在和鸭绿江等径流的输入[9];南黄海中部区域有来自东海低营养盐海流的输入[10];沿海城市的陆源输入较多。渤海和黄海受人类活动和陆源输入的影响很大[2],各种因素的累加使得其生态环境较为复杂。研究渤海和黄海浮游植物群落结构的动态以掌握海洋生态系统的状况尤为重要。自上1930年代开始,中国就已对渤、黄海的浮游植物群落展开了调查[11]。康元德[12]、孙军[13-15]、王俊[16-17]和刘述锡[9, 18]等都对渤、黄海浮游植物群落进行了分析,积累了丰富的资料和数据。在全球变化的大背景下,人们对黄渤海浮游植物群落结构变化特征的认识还有不足,为了深入和全面地了解该海域海洋生态系统的变化还需要不断地进行观测和数据积累。
本研究利用2013年秋季的观测数据,分析了渤、黄海的叶绿素a浓度、浮游植物种类组成、细胞丰度、优势种和群落多样性等生态特征,并探讨了浮游植物与环境因子的相关关系。本研究可为更好地了解渤、黄海浮游植物生态特征的现状与变化特征,评估其对黄渤海生态系统的影响提供基础性资料。
1 材料与方法 1.1 调查海区和站位设置本研究于2013年11月6日~23日在黄、渤海海域(118.88°E~124.81°E,31.19°N~39.85°N)采集浮游植物以及叶绿素样品。共设置16条断面,62个站位,其中南黄海7条断面,北黄海5条断面,渤海4条断面。调查海区及采样站位见图 1。海水温度、盐度等数据由CTD(SeaBird 911)现场测得。
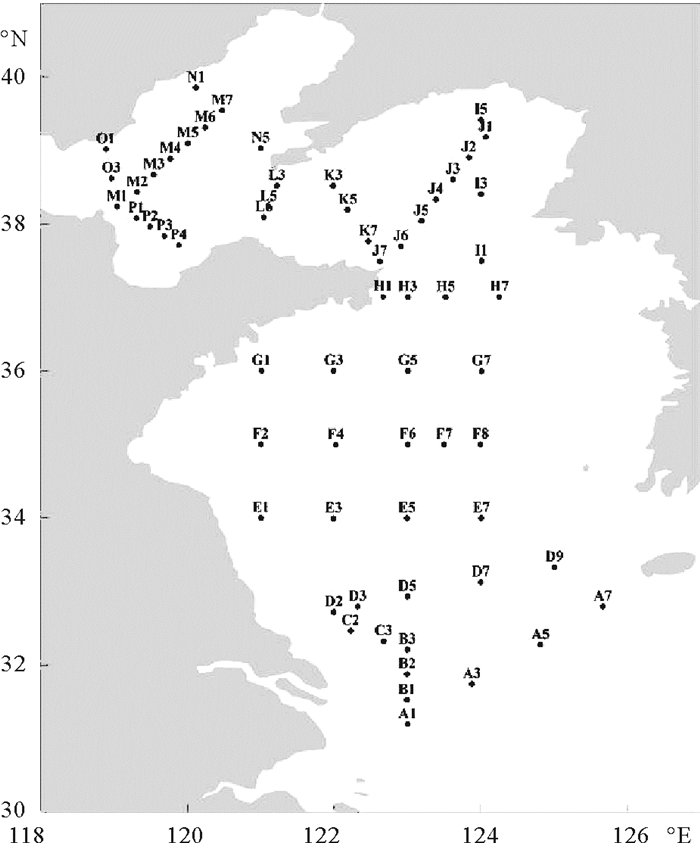
|
图 1 渤、黄海调查区域及站位图 Fig. 1 Investigation area and sampling stations in the Bohai and the Huanghai |
不同站位分3~6层(采水层为3、10、20、30、50 m和底层,层次视各站位水深而定)采集浮游植物水样。采水体积为1 L,现场用终浓度2%的鲁哥氏液固定。实验室内自然沉降一周后,浓缩至10~50 mL,在双目生物显微镜(YS100, Nikon)下进行种类鉴定和计数。
叶绿素样品对应浮游植物水层,采集海水300~500 mL,加入3~5滴饱和MgCO3溶液后经GF/F滤膜(Whatman)过滤,用铝箔包裹,液氮保存。抽滤压力小于200 mmHg。实验室内在4 ℃的环境下用90%的丙酮溶液避光萃取24 h后用荧光分光光度计(F-4500,HITACHI,日本)测量叶绿素a浓度(μg/L)。海上采样、样品处理和室内分析等均严格按照《海洋调查规范第6部分海洋生物调查》(GB/T 12763.6—2007)[19]执行。
丰度(Abundance)以单位水体细胞数(cells/L)表示,并根据各水层浮游植物的丰度,计算各站位浮游植物丰度水柱积分Ct,根据浮游植物丰度水柱积分,采用水柱平均丰度Cd表示各站位浮游植物的丰度[20]:
| $ \begin{array}{l} {C_t} = \sum\limits_{i = 1}^{n - 1} {\frac{{({C_i} + {C_{i + 1}})}}{2} \times ({D_{i + 1}} - {D_i})} (1 \le i \le n - 1)\\ \;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;{C_d} = \frac{{{C_t}}}{{{Z_{{\rm{max}}}}}}。\end{array} $ |
式中:Ct为水柱浮游植物丰度;Ci为第i层浮游植物丰度(cells/L);Ci+1为第i+1层浮游植物丰度(cells/L);Di为第i层采样水深(m);Di+1为第i+1层采样水深(m);n为采样层数;Cd为浮游植物丰度(cells/L);Zmax为最大采样深度(m)。
根据每个种的优势度值(Y)确定浮游植物的优势种[14]。
| $ Y = \frac{{{n_i}}}{N}\cdot{f_i}。$ |
式中:Y为优势度;ni为第i种的丰度;N为所有种类总丰度;fi为第i种出现频率。规定优势度>0.02为优势种[21]。
香农-威纳指数(H’)[22]的计算公式为:
| $ H' = {\rm{ - }}\sum\limits_{i = 1}^S {{P_i}{\rm{lo}}{{\rm{g}}_{\rm{2}}}{P_i}} 。$ |
式中:S为海域浮游植物种类数量;Pi为样品中第i种个体的比例,如样品总个体为N,第i种个体数为ni,则
调查区域站位图、温度盐度分布图、浮游植物细胞丰度及生物多样性指数分布图采用Surfer 8.0软件绘制。采用SPSS 11.5中的Correlate程序进行浮游植物丰度和叶绿素a浓度与环境参数的相关性分析(Pearson)。
2 结果 2.1 调查水域水文环境本次调查海域表层海水温度范围为9.6~21.5 ℃,平均值为(15.3±3.3)℃,最高值位于长江口北部的B2站,最低值出现在北黄海中部的J4站。渤海与北黄海的海水温度明显低于南黄海,表层水温整体呈现由北向南逐渐升高的趋势(见图 2a)。底层水温均值为(13.8±3.8)℃,最大值出现在长江口的A1站(21.6 ℃),最小值(8.5 ℃)位于山东半岛东部海域的H5站位,北黄海东南部与南黄海中部存在大面积的冷水区(见图 2b)。
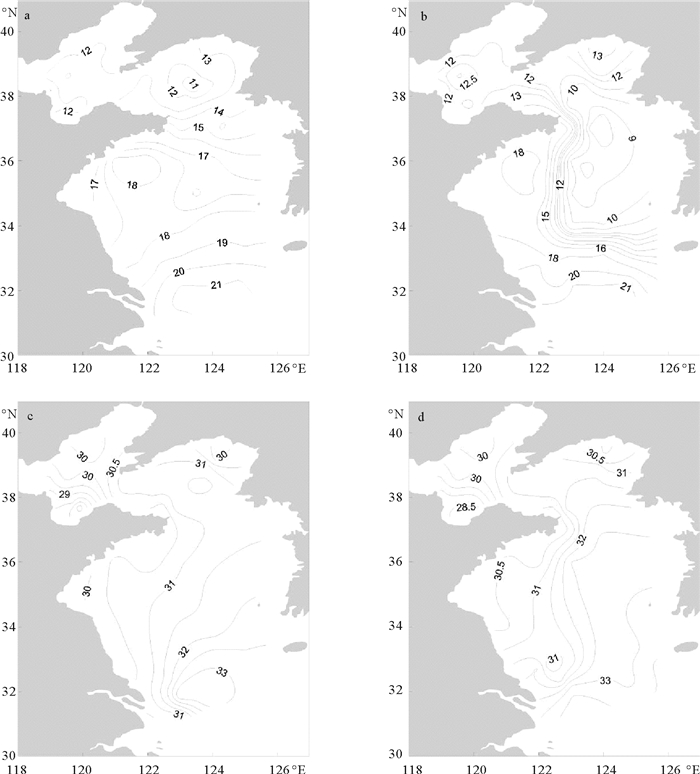
|
(a.表层温度;b.底层温度;c.表层盐度;d.底层盐度。a. Surface temperature; b. bottom temperature;c. Surface salinity; d. Bottom salinity.) 图 2 渤、黄海海水温度和盐度的水平分布 Fig. 2 Temperature and salinity in the Bohai and the Huanghai |
海水表层盐度均值为30.9±1.2,最高值位于长江口附近的B1站(33.9),最低值出现在渤海南部的P4站(27.3)。本次调查海域的表层盐度呈由近岸向外海逐渐增高的趋势。在渤海南部的莱州湾出现盐度低值区(见图 2c)。海水底层盐度均值为31.2±1.4,最大值位于长江口东部的A1站(33.8),最小值位于黄河口附近的P4站(27.8)。海域底层盐度分布趋势与表层基本一致(见图 2d)。
2.2 叶绿素a分布本次调查海域表层叶绿素a浓度均值为(0.85±0.70)μg/L,最高值位于北黄海西南部的K7站(3.51 μg/L),最低值位于北黄海中部的J3站(0.01 μg/L),渤海叶绿素a浓度均值为(0.89±0.70)μg/L,北黄海均值为(1.16±1.02)μg/L,南黄海均值为(0.59±0.25)μg/L。辽东半岛西南部周边海域叶绿素a浓度偏低,莱州湾、北黄海中部和山东半岛北岸存在叶绿素a浓度高值区,表层叶绿素a浓度在水平方向整体呈现近岸高于外海,由北向南递减的趋势。叶绿素a水柱浓度均值为(0.76±0.70)μg/L,最大值位于莱州湾的P4站(3.41 μg/L),最低值出现在南黄海中部的F8站(0.18 μg/L)。叶绿素a水柱浓度在水平方向上的分布和趋势与表层叶绿素a基本一致(见图 3)。
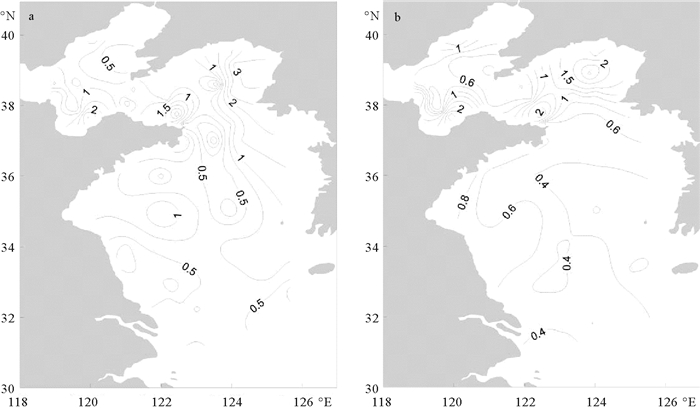
|
(a.表层;b.水柱。a. Surface; b. Water column.) 图 3 渤黄海叶绿素a浓度水平分布(μg/L) Fig. 3 Concentration distributions of chlorophyll a in Bohai and Yellow sea (μg/L) |
研究水域共记录浮游植物4门54属109种(包括变型和变种),其中,硅藻门共37属81种,占总种数的74.3%;甲藻门12属23种,占总种数的21.1%;隐藻门1种,金藻门4种。硅藻门和甲藻门在物种数中占主要地位。硅藻门中圆筛藻属(Coscinodiscus sp.)种数最多,有12种,占硅藻总种数的14.8%;甲藻门中原甲藻属(Prorocentrum sp.)种数最多,有6种,占甲藻总种数的26.1%。渤黄海属典型的温带气候,物种多为温带种和广布种,也有少数大洋种和暖水性物种出现,如微小原甲藻(Prorocentum minutum)、佛氏海线藻(Thalassionema frauenfeldii)和笔尖根管藻(Rhizosolenia styliformis)等。
2.3.2 丰度的水平分布表层浮游植物丰度均值为(4.5±6.3)×103 cells/L,最大值位于北黄海中部的J4站(30.7×103 cells/L)。渤海表层总丰度均值为6.1×103 cells/L,北黄海表层为6.4×103 cells/L,南黄海表层为2.0×103 cells/L(见图 4a)。表层硅藻丰度均值为(4.1±6.2)×103 cells/L,最大值位于北黄海中部的J4站,丰度为30.7×103 cells/L,渤海硅藻丰度均值为5.9×103 cells/L,北黄海硅藻丰度值为5.6×103 cells/L,南黄海为1.8×103 cells/L,南黄海中部海区硅藻丰度较低,表层海水中硅藻丰度的分布趋势与总浮游植物丰度相似(见图 4b)。表层甲藻平均丰度为(0.3±0.6)×103 cells/L,其中渤海丰度均值为0.2×103 cells/L,北黄海为0.7×103 cells/L,南黄海为0.2×103 cells/L,最大值在北黄海最北端近岸的I5站(3.3×103 cells/L)。渤海与北黄海丰度由近岸逐渐向外海降低,南黄海中部海水中甲藻丰度较高,其分布趋势与硅藻相反(见图 4c)。其他门类(金藻和隐藻)浮游植物的平均丰度为(0.1±0.3)×103 cells/L,其中渤海没有检出,北黄海丰度均值为0.1×103 cells/L,北黄海的东北部丰度较高。
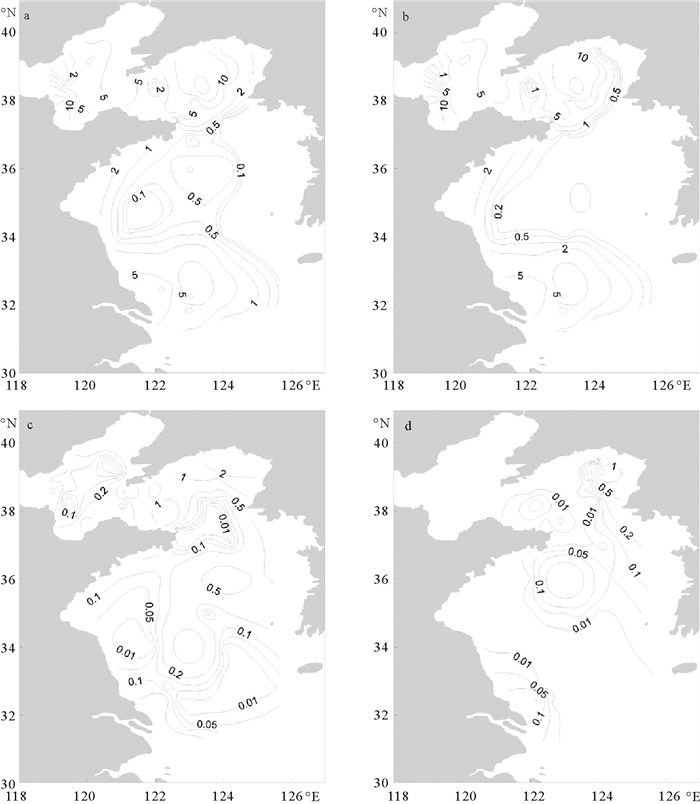
|
(a.浮游植物;b.硅藻;c.甲藻;d.其他。a. Phytoplankton; b. Diatom; c. Dinoflagellate; d. Others.) 图 4 渤、黄海表层浮游植物丰度水平分布(×103 cells/L) Fig. 4 Surface abundance distributions of phytoplankton in the Bohai and the Huanghai(×103 cells/L) |
浮游植物水柱丰度均值为(5.7±10.0)×103 cells/L,最大值位于北黄海中部的J3站(66.1×103 cells/L),并以其为中心形成丰度高值区,南黄海中部浮游植物丰度低于沿岸。硅藻水柱丰度均值为(5.2±9.9)×103 cells/L。甲藻水柱丰度平均值为(0.3±1.0)×103 cells/L,最高值位于L3站(6.4×103 cells/L)。该航次硅藻和甲藻水柱丰度趋势与表层丰度分布一致。其他门类浮游植物水柱丰度的均值为(0.1±0.3)×103 cells/L(见图 5)。
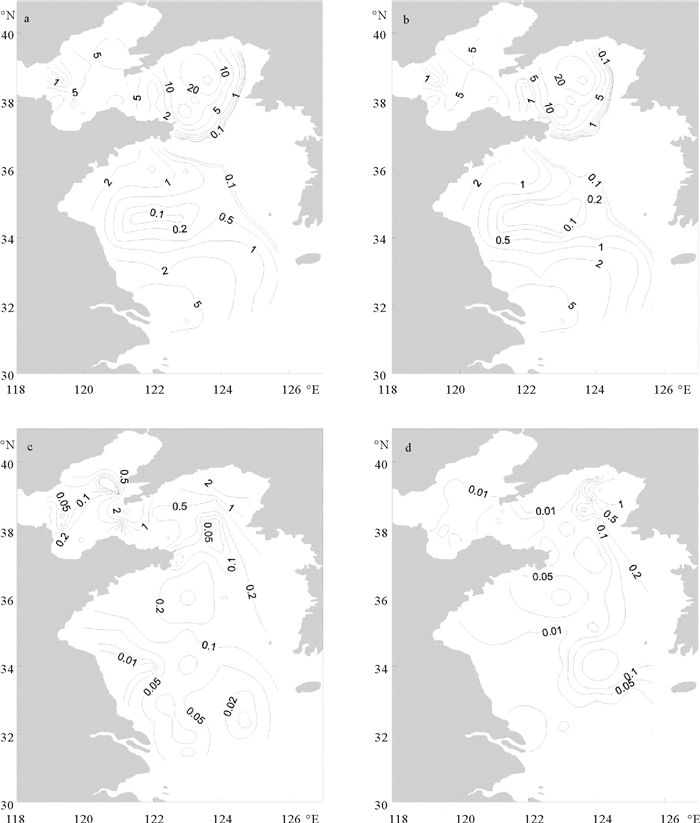
|
(a.浮游植物;b.硅藻;c.甲藻;d.其他。a. Phytoplankton; b. Diatom; c. Dinoflagellate; d. Others.) 图 5 渤、黄海浮游植物水柱丰度水平分布(×103 cells/L) Fig. 5 Water column abundance distributions of phytoplankton in the Bohai and Huanghai (×103 cells/L) |
渤海、北黄海和南黄海的浮游植物优势种存在差异,各海区浮游植物优势种及优势度见表 1。每个海区均有2个优势种,渤海海区为具槽帕拉藻(Paralia sulcata)和离心海链藻(Thalassiosira excentrica),北黄海海区为斯氏几内亚藻(Guinardia striata)和具槽帕拉藻,南黄海海区为具槽帕拉藻和菱形海线藻(Thalassionema nitzschioides)。具槽帕拉藻在三个海区中出现频率均较高,尤其是在渤海中出现频率(80.0%)最高;其在渤海和南黄海中均为主要优势种,优势度分别达到了0.459和0.248。具槽帕拉藻在渤海中的丰度均值为3.5×103 cells/L,最大值位于靠近黄河口的M1站,丰度为16.3×103 cells/L,并以其为中心形成高值区,在沿岸以及辽宁北岸西部也有较高丰度的具槽帕拉藻;在南黄海中,具槽帕拉藻在长江口东北部存在较高丰度(见图 6a)。渤海海区的第二优势种离心海链藻的优势度(0.048)相对较低,多集中分布于黄河口沿岸和秦皇岛附近水域(见图 6c)。斯氏几内亚藻虽然出现频率(35.0%)不如具槽帕拉藻的出现频率(50.0%)高,但是由于其在北黄海海域具有较高的平均丰度(3.7×103 cells/L),因而成为了北黄海的主要优势种,并且丰度比例达到了58.9%;斯氏几内亚藻在渤海和南黄海极少出现,最大值位于北黄海中部的J4站,以其为中心形成丰度高值区(见图 6b)。菱形海线藻是南黄海的另一个优势种,其最高值(4.3×103 cells/L)出现于南黄海南部的B3站位,并且菱形海线藻也大多分布在南黄海南部(见图 6d)。
|
|
表 1 渤、黄海浮游植物优势种及优势度 Table 1 Dominant species and their dominance in Bohai and Yellow sea |
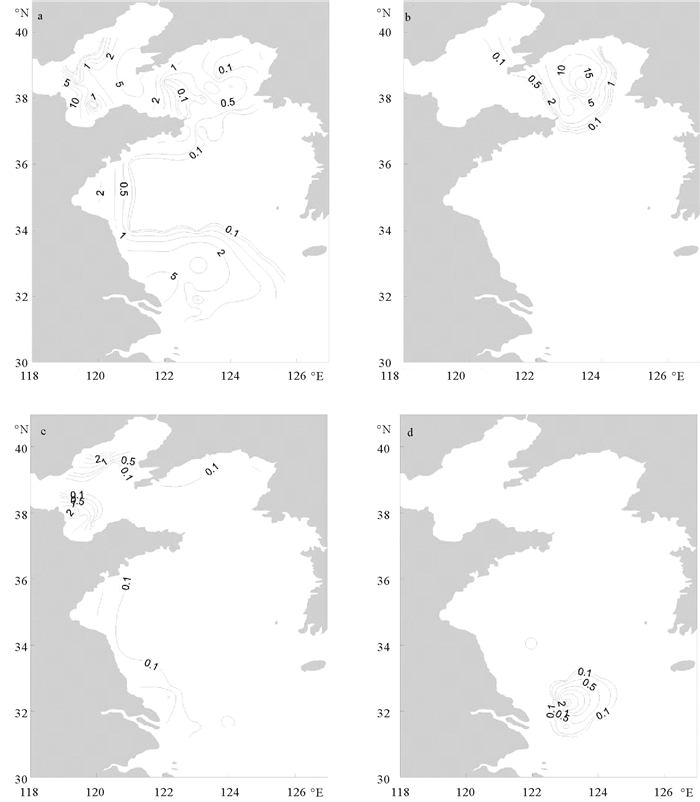
|
(a.具槽帕拉藻;b.斯氏几内亚藻;c.离心海链藻;d.菱形海线藻。a. Paralia sulcata; b. Guinardia striata; c. Thalassiosira excentrica; d. Thalassionema nitzschioides.) 图 6 黄、渤海浮游植物优势种的平面分布(×103 cells/L) Fig. 6 Abundance distributions of dominant species in Bohai and Yellow Sea(×103 cells/L) |
本次调查表层浮游植物香农-威纳指数平均值为1.58±0.92,最大值出现在北黄海东北部的J1站(3.43),最小值位于北黄海最南部的H7站。生物多样性指数较高的区域多集中分布在长江口附近海域、山东半岛南部周边海域、莱州湾以及北黄海东部海域,在北、南黄海中部以及山东半岛东部海域多样性指数较低(见图 7)。
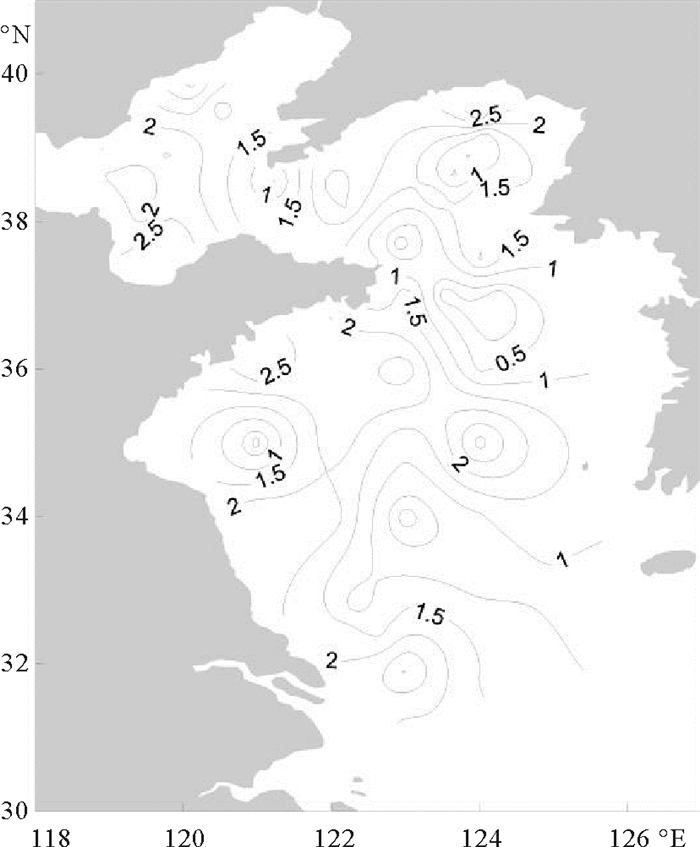
|
图 7 渤黄海浮游植物香农-威纳指数分布 Fig. 7 Shannon-Wiener index of phytoplankton in the Bohai and Huanghai |
浮游植物总丰度与硅藻丰度呈极显著正相关关系,两者与表层温度均呈极显著的负相关关系;甲藻丰度与叶绿素a浓度呈现极显著的正相关关系,与香农威纳指数呈显著正相关,与其他环境参数的相关性均不显著;叶绿素a浓度与表层温度和表底层盐度均呈现显著的负相关关系;香农威纳指数与环境参数均无显著相关性。表层温度与其他3个参数之间均呈极显著的正相关;底层温度与表层盐度呈极显著的正相关,与底层盐度呈显著正相关;表层盐度与底层盐度也呈极显著的正相关关系(见表 2)。
|
|
表 2 浮游植物丰度、多样性指数与环境因子间相关性分析 Table 2 Correlation analysis between abundance, diversity and environmental variables |
本次调查共记录浮游植物4门54属109种。2000年秋季渤海海域共发现浮游植物35属64种[15];郭术津等[20]在2011年秋季北黄海鉴定出浮游植物3门31属64种;2012年秋季在北黄海和渤海的调查结果显示,共有浮游植物3门38属98种[2]。本研究中浮游植物种数较以往调查数据更高是由于调查海域较广,研究水域包括了渤海、北黄海和南黄海。分布较广泛的广温广盐种,如具槽帕拉藻和梭角藻(Ceratium fusus),在以往调查研究中也经常出现。由于黄海秋季暖流的影响,出现了微小原甲藻(Prorocentum minutum)等暖水性物种。佛氏海线藻(Thalassionema frauenfeldii)和笔尖根管藻(Rhizosolenia styliformis)均属于外海种,可能是受东海外海水输入的影响。
本研究结果显示,表层浮游植物丰度北黄海>渤海>南黄海。综合1959年全国综合调查(1.5×103 cells/L)[23]、1982年调查(2.4×103 cells/L)[24]和2011年郭术津等关于北黄海浮游植物群落的研究结果(4.2×103 cells/L)[20],北黄海的浮游植物丰度呈现逐年升高的趋势。与同季节历史调查资料对比,本次调查北黄海浮游植物丰度(6.4×103 cells/L)较2011年也有所升高,与丰度逐年上升的趋势一致。表层浮游植物丰度呈近岸高外海低的趋势,长江口附近海域、莱州湾和辽东半岛东南部海域有浮游植物丰度高值区。沿岸河流入海营养盐通量的增大、富营养化程度的加重[25],可能是加速沿岸海域浮游植物繁殖,导致浮游植物的丰度显著升高的原因之一。
硅藻丰度与浮游植物总丰度分布趋势一致,两者呈极显著的正相关关系。历史数据也显示,硅藻一直都在黄渤海浮游植物群落中占绝对的主导地位[2, 14-16, 20, 26-27]。甲藻分布的高值区集中出现在北黄海北部,与1998年的结果相似[28]。叶绿素a可以反映浮游植物的分布情况。本研究叶绿素a浓度与浮游植物总丰度和硅藻丰度相关性不显著,但与甲藻丰度呈极显著的正相关。这可能是由于同体积的硅藻体内叶绿素a的含量均低于甲藻[29],甲藻对叶绿素a浓度的贡献更大。
近年来,具槽帕拉藻一直作为渤黄海浮游植物的优势种出现,但由于调查海域和调查时间的差异,其优势度有所变化。2006年冬季北黄海的优势种中具槽帕拉藻作为第2优势种,其出现频度(0.94)却是最高的[26]。2011年秋季北黄海浮游植物群落结构调查结果显示[20],具槽帕拉藻的优势度(0.36)和出现频率(0.71)明显高于其他物种。在本研究中,具槽帕拉藻作为整个海区的主要优势种大多分布在渤黄海沿岸的表层和中下层,这与其既能浮游又能底栖的生态类型有关[30]。相比于渤海和北黄海,具槽帕拉藻在南黄海的丰度较低,这与1992年渤海种群动态的研究结果相似,具槽帕拉藻只有在低温下会大量出现[16]。作为本研究中第2优势种的斯氏几内亚藻,在2011年秋季的北黄海海域也成为优势种[20]。本研究中,斯氏几内亚藻主要集中分布在北黄海,南黄海几乎没有检出。在垂直方向上,斯氏几内亚藻多分布在中上层,这可能与该种倾向于光照和营养盐适宜的水层[31]有关。菱形海线藻是本研究南黄海的第2优势种,这在以往报道中也有记录[30, 32]。离心海链藻多分布于渤海的沿岸以及长江口的周边海域。有研究结果显示,离心海链藻曾在2005年冬季的长江口邻近水域被记录为优势种[33],但在渤海成为优势种尚未见报道。
生物群落的多样性指数越高,则表示该群落所属的生态系统处于越稳定的状态[34]。2006年冬季北黄海海域Shannon-Wiener多样性指数均值为1.80[26];2011年秋季北黄海调查的结果为1.65[20]。本次调查海域的生物多样性指数(1.58)与以上同季节历史数据相比稍微偏低,而与2012年渤海和北黄海调查的结果(1.49)[2]相比有所升高。北黄海中部浮游植物多样性指数较低,可能是与优势种斯氏几内亚藻丰度畸高,降低了群落的均匀度有关。
| [1] |
康元德. 渤海湾春季浮游植物的生态特点及其与渔业资源的关系[J]. 海洋渔业, 1984(2): 51-53. KANG Yuan-De. Ecological characteristics of phytoplankton in the Bohai bay and its relationship with fishery resources[J]. Marine Fisheries, 1984(2): 51-53. (  0) 0) |
| [2] |
苑明莉, 孙军, 翟惟东. 2012年秋季渤海和北黄海浮游植物群落[J]. 天津科技大学学报, 2014, 27(6): 56-64. YUAN Ming-Li, SUN Jun, ZHAI Wei-Dong. Phytoplankton community in Bohai Sea and the North Yellow Sea in autumn 2012[J]. Journal of Tianjin University of Science and Technology, 2014, 27(6): 56-64. (  0) 0) |
| [3] |
Brogueira M J, Oliveira M R, Cabeçadas G. Phytoplankton community structure defined by key environmental variables in Tagus estuary, Portugal[J]. Marine Environmental Research, 2007, 64(5): 616-628. DOI:10.1016/j.marenvres.2007.06.007
(  0) 0) |
| [4] |
Charlson R J, Lovelock J E, Andreae M O, et al. Oceanic phytoplankton, atmospheric sulphur, cloud albedo and climate[J]. Nature, 1987, 326(6114): 655-661. DOI:10.1038/326655a0
(  0) 0) |
| [5] |
Sarmiento J L, Toggweiler J R, Najjar R, et al. Ocean carbon-cycle dynamics and atmospheric pCO2[J]. Philosophical Transactions of the Royal Society of London A: Mathematical, Physical and Engineering Sciences, 1988, 325(1583): 3-21. DOI:10.1098/rsta.1988.0039
(  0) 0) |
| [6] |
Sathyendranath S, Gouveia A D, Shetye S R, et al. Biological control of surface temperature in the Arabian Sea[J]. Nature, 1991, 349: 54-56. DOI:10.1038/349054a0
(  0) 0) |
| [7] |
高嵩, 范士亮, 韩秀荣, 等. 浒苔绿潮与南黄海近岸海域水质的关系[J]. 中国环境科学, 2014, 34(1): 213-218. GAO Song, FAN Shi-Liang, HAN Xiu-Rong, et al. Relations of Enteromorpha prolifera blooms with temperature, salinity, dissolved oxygen and pH in the Southern Yellow Sea[J]. China Environmental Science, 2014, 34(1): 213-218. (  0) 0) |
| [8] |
曾呈奎, 鸿儒, 春林. 中国海洋志[M]. 郑州: 大象出版社, 2003. ZENG Cheng-Kui, HONG Ru, CHUN Lin. Oceanography of China[M]. Zhengzhou: Elephant Publishing House, 2003. (  0) 0) |
| [9] |
刘述锡, 隋伟娜, 孙淑艳, 等. 北黄海北部近岸海域网采浮游植物群落结构[J]. 海洋湖沼通报, 2015(2): 128-138. LIU Shu-Xi, SUI Wei-Na, SUN Shu-Yan, et al. The Community structure and seasonal distribution of phytoplankton in the coast of the North Yellow Sea[J]. Transactions of Oceanology and Limnology, 2015(2): 128-138. (  0) 0) |
| [10] |
Lin C, Ning X, Su J, et al. Environmental changes and the responses of the ecosystems of the Yellow Sea during 1976—2000[J]. Journal of Marine Systems, 2005, 55(3-4): 223-234. DOI:10.1016/j.jmarsys.2004.08.001
(  0) 0) |
| [11] |
Wang C C. Dinoflagellata of the gulf of Pe-Hai[J]. Sinensia, 1936, 7(2): 128-171.
(  0) 0) |
| [12] |
康元德. 渤海浮游植物的数量分布和季节变化[J]. 渔业科学进展, 1991(12): 31-54. KANG Yuan-De. Distribution and seasonal variation of phytoplankton in the Bohai Sea[J]. Marine Fisheries Research, 1991(12): 31-54. (  0) 0) |
| [13] |
孙军, 刘东艳, 杨世民, 等. 渤海中部和渤海海峡及邻近海域浮游植物群落结构的初步研究[J]. 海洋与湖沼, 2002, 33(5): 461-471. SUN Jun, LIU Dong-Yan, YANG Shi-Min, et al. The preliminary study on phytoplankton community structure in the central Bohai sea and the Bohai strait and its adjacent area[J]. Oceanologia Et Limnologia Sinica, 2002, 33(5): 461-471. DOI:10.3321/j.issn:0029-814X.2002.05.002 (  0) 0) |
| [14] |
孙军, 刘东艳, 柴心玉, 等. 1998—1999年春秋季渤海中部及其邻近海域叶绿素a浓度及初级生产力估算[J]. 生态学报, 2003, 23(3): 517-526. SUN Jun, LIU Dong-Yan, CHAI Xin-Yu, et al. The chlorophyll a concentration and estimating of primary productivity in the Bohai Sea in 1998—1999[J]. Acta Ecologica Sinica, 2003, 23(3): 517-526. DOI:10.3321/j.issn:1000-0933.2003.03.016 (  0) 0) |
| [15] |
孙军, 刘东艳. 2000年秋季渤海的网采浮游植物群落[J]. 海洋学报, 2005, 27(3): 124-132. SUN Jun, LIU Dong-Yan. Net-phytoplankton community of the Bohai Sea in the autumn of 2000[J]. Acta Oceanologica Sinica, 2005, 27(3): 124-132. DOI:10.3321/j.issn:0253-4193.2005.03.018 (  0) 0) |
| [16] |
王俊, 康元德. 渤海浮游植物种群动态的研究[J]. 渔业科学进展, 1998, 19(1): 43-52. WANG Jun, KANG Yuan-De. Study on population dynamics of phytoplankton in the Bohai Sea[J]. Marine Fisheries Research, 1998, 19(1): 43-52. (  0) 0) |
| [17] |
王俊. 黄海秋、冬季浮游植物的调查研究[J]. 渔业科学进展, 2003, 24(1): 15-23. WANG Jun. Study on phytoplankton in the Yellow Sea in autumn and winter[J]. Marine Fisheries Research, 2003, 24(1): 15-23. DOI:10.3969/j.issn.1000-7075.2003.01.004 (  0) 0) |
| [18] |
刘述锡, 樊景凤, 王真良. 北黄海浮游植物群落季节变化[J]. 生态环境学报, 2013, 22(7): 1173-1181. LIU Shu-Xi, FAN Jing-Feng, WANG Zhen-Liang. The seasonal changes of phytoplankton community in the North Yellow Sea, China[J]. Ecology and Environmental Sciences, 2013, 22(7): 1173-1181. DOI:10.3969/j.issn.1674-5906.2013.07.014 (  0) 0) |
| [19] |
国家海洋局. GB/T 12763.6-2007, 海洋调查规范海洋生物调查[S].北京: 中国标准出版社, 2008. State Oceanic Administration. GB/T 12763.6-2007, Specifications for Oceanographic Survey Marine Biological Survey[S]. Beijing: Standards Press of China, 2008. (  0) 0) |
| [20] |
郭术津, 孙军, 张辉, 等. 2011年秋季北黄海浮游植物群落[J]. 天津科技大学学报, 2013, 28(1): 22-29. GUO Shu-Jin, SUN Jun, ZHANG Hui, et al. Phytoplankton communities in the northern Yellow Sea in autumn 2011[J]. Journal of Tianjin University of Science & Technology, 2013, 28(1): 22-29. DOI:10.3969/j.issn.1672-6510.2013.01.008 (  0) 0) |
| [21] |
徐兆礼, 陈亚瞿. 东黄海秋季浮游动物优势种聚集强度与鲐鲹渔场的关系[J]. 生态学杂志, 1989(19): 13-15. XU Zhao-Li, CHEN Ya-Qu. Aggregated intensity of dominant species of zooplankton in autumn in the East China Sea and Yellow Sea[J]. Chinese Journal of Ecology, 1989(19): 13-15. (  0) 0) |
| [22] |
Shannon C E, Weaver W. The mathematical theory information[J]. Mathematical Gazette, 1949, 97(333): 170-180.
(  0) 0) |
| [23] |
中国科学院海洋研究所浮游生物组. 中国近海浮游生物的研究[M]. 北京: 海洋出版社, 1965: 34-46. Plankton Group, Institute of Oceanology, Chinese Academy of Sciences. The Plankton in the Coastal Seas of China[M]. Beijing: Ocean Publishing House, 1965: 34-46. (  0) 0) |
| [24] |
黄文祥, 沈亮夫, 朱琳. 黄海的浮游植物[J]. 海洋环境科学, 1984(3): 19-28. HUANG Wen-Xiang, SHEN Liang-Fu, ZHU Lin. The plankton in the Yellow Sea[J]. Marine Environmental Science, 1984(3): 19-28. (  0) 0) |
| [25] |
孙培艳.渤海富营养化变化特征及生态效应分析[D].青岛: 中国海洋大学, 2007. SUN Pei-Yan.Analysis of Ultrophication Variation Characteristic and Ecological Effect of Bohai Sea[D]. Qingdao: Ocean University of China, 2007. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1071668 (  0) 0) |
| [26] |
杜秀宁, 刘光兴. 2006年冬季北黄海网采浮游植物群落结构[J]. 海洋学报, 2009, 31(5): 132-147. DU Xiu-Ning, LIU Guang-Xing. Community structure of net-phytoplankton in the northern Huanghai Sea in the winter of 2006[J]. Acta Oceanologica Sinica, 2009, 31(5): 132-147. (  0) 0) |
| [27] |
张翠霞, 陈婷, 黄晓, 等. 2011年夏季北黄海浮游植物群落[J]. 海洋湖沼通报, 2014(1): 81-93. ZHANG Cui-Xia, CHEN Ting, HUANG Xiao, et al. Phytoplankton communities in the Northern Yellow Sea in Summer, 2011[J]. Transactions of Oceanology and Limnology, 2014(1): 81-93. (  0) 0) |
| [28] |
董婧, 刘海映, 毕远溥, 等. 黄海北部近岸的浮游甲藻生态[J]. 渔业科学进展, 2002, 23(4): 46-50. DONG Jing, LIU Hai-Ying, BI Yuan-Pei, et al. Ecological study on planktonic dinoflagellates in inshore of Northern Yellow Sea[J]. Marine Fisheries Reseach, 2002, 23(4): 46-50. DOI:10.3969/j.issn.1000-7075.2002.04.009 (  0) 0) |
| [29] |
Hitchcock G L. A comparative study of the size-dependent organic composition of marine diatoms and dinoflagellates[J]. Journal of Plankton Research, 1982, 4(2): 363-377. DOI:10.1093/plankt/4.2.363
(  0) 0) |
| [30] |
田伟, 孙军. 2009年晚春黄海南部浮游植物群落[J]. 海洋科学, 2011, 35(6): 19-24. TIAN Wei, SUN Jun. Later spring phytoplankton community in Southern Yellow Sea in 2009[J]. Marine Sciences, 2011, 35(6): 19-24. (  0) 0) |
| [31] |
Hanson C E, Pesant S, Waite A M, et al. Assessing the magnitude and significance of deep chlorophyll maxima of the coastal eastern Indian Ocean[J]. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 2007, 54(8): 884-901.
(  0) 0) |
| [32] |
张健, 李佳芮. 2013年夏季南黄海浮游植物群集[J]. 浙江海洋学院学报(自然科学版), 2014, 33(4): 332-336. ZHANG Jian, LI Jia-Rui. Phytoplankton community in the South Yellow Sea in the summer of 2013[J]. Journal of Zhejiang Ocean University, 2014, 33(4): 332-336. DOI:10.3969/j.issn.1008-830X.2014.04.007 (  0) 0) |
| [33] |
何青, 孙军, 栾青杉, 等. 长江口及其邻近水域冬季浮游植物群集[J]. 应用生态学报, 2007, 18(11): 2559-2566. HE Qing, SUN Jun, LUAN Qing-Shan, et al. Phytoplankton assemblage in Yangtze River estuary and its adjacent waters in winter time[J]. Chinese Journal of Applied Ecology, 2007, 18(11): 2559-2566. (  0) 0) |
| [34] |
孙军, 刘东艳. 多样性指数在海洋浮游植物研究中的应用[J]. 海洋学报, 2004, 26(1): 62-75. SUN Jun, LIU Dong-Yan. The application of diversity indices in marine phytoplankton studies[J]. Acta Oceanologica Sinica, 2004, 26(1): 62-75. DOI:10.3321/j.issn:0253-4193.2004.01.007 (  0) 0) |
2. Key Laboratory of Ministry of Education for Marine Environment and Ecology, Ocean University of China, Qingdao 266100, China
 2018, Vol. 48
2018, Vol. 48


