四溴双酚A (tetrabromobisphenol-A, TBBPA)是一种持久性有机污染物(Persistent Organic Pollutants, POPs),易于在生物体内富集,可在食物链和食物网中传递并产生毒性效应[1-2]。另外,作为市场需求量最大的新型溴代阻燃剂(Brominated Flame Retardants, BFRs)[3-4],TBBPA的污染问题日益严峻,有研究表明,在空气、水体、沉积物和土壤等介质以及水生生物甚至人体中都检测到了TBBPA的存在[5]。
桡足类是浮游动物中最重要的组成部分,因其对污染物敏感,常被用来检测海洋污染与评估风险[6-7]。日本虎斑猛水蚤(Tigriopus japonicus)是研究河口和海洋生态污染的模式物种,具有分布广、易培养、生态特征显著等特点。目前,桡足类已被广泛应用于毒性效应研究,徐东晖等、Ida Beathe等和巩文静等分别研究了多环芳烃、Hg和TBBPA对桡足类的毒性效应[10-12]。Kyun-Woo Lee等和Foley等分别指出污染物对日本虎斑猛水蚤的世代毒性和耐受力的影响[13-14]。另外,Shi等研究了HBCD在日本虎斑猛水蚤体内的急性积累与发育毒性[8]。
温度是影响桡足类生长和繁殖的重要因素[15]。温度变化对污染物毒性效应的影响已成为研究的焦点。Santhanam P等和Alexander K等分别研究不同的温盐度对桡足类的毒性效应[16-17]。李光福等和韩萃等分别研究了温度和盐度对指状伪镖水蚤(Pseudodiaptomidae inopinus)摄食和繁殖的影响以及温、盐度对拟长腹剑水蚤(Oithona similis)生长发育的影响[15, 18]。胡媛媛和Kaisa Figueiredo分别测量了不同物质在水生生物中的积累[19-20]。目前,关于环境因子作用下污染物在桡足类体内多世代积累方面的报道较少。因此,本研究在摄食、产粪的基础上系统探究了温度对日本虎斑猛水蚤多世代积累TBBPA的影响,为自然环境下TBBPA在水生生物体内的富集提供数据,有利于建立完善合理的TBBPA毒性评定标准。
1 材料与方法 1.1 日本虎斑猛水蚤的培养日本虎斑猛水蚤最初采集于山东省青岛市汇泉湾附近海域,已在实验室连续培养3年以上。日本虎斑猛水蚤的培养条件为温度(20±1) ℃、盐度30、光照周期12 h L:12 h D。喂养青岛大扁藻(Platymonas hellgolandica Kylin var Tsingtaoensis)、三角褐指藻(Phaeodactylum tricornutum )和活性干酵母溶液的混合饵料,投喂比例为5:1:2。
1.2 测试化学品TBBPA固体从J&K化学试剂有限公司购买。根据以往文献中的标准设计,用二甲亚砜(DMSO)配制浓度为10 g/L的溶液,随后用过滤海水稀释至50 mg/L并用于之后的实验。
1.3 实验方法 1.3.1 急性毒性测试实验设有空白对照组、溶剂对照组D(DMSO)、1.59、2.385、3.577、5.366、8.049和12.07 mg·L-1 TBBPA共八组。每组三个平行。每个平行组20只日本虎斑猛水蚤。实验条件同培养条件。每24 h记录水蚤死亡数并将死亡个体挑出。实验持续48 h并计算48 h-LC50[18, 24]。
1.3.2 摄食实验根据预实验,设定日本虎斑猛水蚤的实验温度为18、20、23 ℃,驯化一周后开始实验。实验开始前饥饿处理24 h。采用饵料浓度差法计算摄食率和滤水率[21]。
根据急性毒性测试结果,将实验的TBBPA浓度分别设定为48 h-LC50的1%、2.2%、5%、11%,并设置一个溶剂对照组、一个不加水蚤的藻液参照组,每组3个平行。实验时,取对数生长期的扁藻,稀释至105 ind/mL分别置于100 mL的塑料瓶中(完全密封),每瓶30只水蚤。黑暗环境下实验24 h。为避免藻细胞沉降,每2 h晃动一次。实验结束时,用鲁哥试剂固定并用血球计数板在显微镜下统计细胞个数。计算公式如下:
| $ F = \frac{V}{N} \cdot \frac{{\ln {c_t} - \ln {c_{{\rm{tf}}}}}}{t},\;\;\;\;G = F \cdot \frac{{{c_{{\rm{tf}}}} - {c_0}}}{{\ln {c_{{\rm{tf}}}} - \ln {c_0}}}。$ |
其中:F为滤水率(mL·ind-1·h-1);G为摄食率(cells·ind-1·h-1);V为实验溶液体积(mL);N为每个平行水蚤个数(ind);c0为起始饵料浓度(cells/mL);ct为对照组饵料终浓度(cells/mL);ctf为实验组饵料终浓度(cells/mL);t为实验周期(h)[12]。
1.3.3 产粪粒数实验日本虎斑猛水蚤的驯化、饥饿及TBBPA浓度如上。实验时,将日本虎斑猛水蚤挑至12孔板,每孔一只,每组24个成年桡足类个体,投喂青岛大扁藻(105 ind/mL),分别在18、20、23 ℃下实验24 h后用鲁哥试剂固定并在解剖镜下计产粪粒数[15]。
1.3.4 生物富集实验水蚤的驯化条件如上。实验分别在18、20和23 ℃下进行,并且根据48 h-LC50值,设置溶剂对照组、1/100 LC50组、5/100 LC50组。每组十二个平行,每个平行30只水蚤。挑选孵化时间<24 h的无节幼虫置于六孔板中,曝光条件如上,待发育至成体阶段。挑选约12只挂卵雌体至12孔板中待其孵化,将剩余成年桡足类收集,并保存于-80 ℃冰箱。待12孔板中的雌体孵化后,将F1代无节幼虫置于六孔板中,实验和曝光条件均与F0代一致。每24 h换水50%,记录并挑出死亡个体[12, 18, 32]。
1.4 TBBPA含量的测定 1.4.1 分析条件使用使用高效液相色谱仪(安捷伦1100)测定TBBPA含量。柱温30 ℃,检测波长209 nm,流动相为甲醇:去离子水=80:20(v/v),流速1 mL/min,进样体积20 μL[22-23]。
1.4.2 质量控制按照上述方法处理空白样品,测定结果对样品无影响,依次加入0.1、1、5、10、25和50 mg/L的标准溶液,每组溶液做3个平行,测定信噪比S/N>3时,方法检出限是0.01 μg/mL,平均回收率为89.52%,相对标准偏差为9.3%。
1.5 生物富集因子生物富集因子(Bioaccumulation Factor,BAF)的计算公式为:BAF=Corg/Cw,其中:Corg为生物体内TBBPA的湿重浓度(ng/kg),Cw为海水溶解态TBBPA的浓度(ng/L)。
1.6 数据分析运用Excel对数据进行初步统计处理。采用SPSS16.0对实验数据作统计分析。
2 结果 2.1 TBBPA对日本虎斑猛水蚤的48 h-LC50实验结果经SPSS16.0线性分析后,得出TBBPA对日本虎斑猛水蚤的48 h-LC50是4.423 mg/L。
2.2 不同温度下TBBPA对日本虎斑猛水蚤摄食率和滤水率的影响毒性暴露24 h后,比较TBBPA浓度对摄食率和滤水率的影响。18 ℃下(见图 1A),摄食率和滤水率随浓度升高而升高,97、221和487 μg/L均显著高于对照组(p<0.05)。20 ℃下(见图 1B),在一定浓度范围内,水蚤的摄食率和滤水率呈现先升高(p>0.05)后显著降低的变化趋势(p<0.05),在44 μg/L浓度下,摄食率和滤水率最高,分别为8 377.2 cells·ind-1·h-1和0.268 mL·ind-1·h-1;在97 μg/L的浓度下,摄食率最低,为7 583.9 cells·ind-1·h-1。23 ℃下(见图 1C),随着TBBPA浓度的升高,摄食率和滤水率呈现先降低(p>0.05)后增加再降低的趋势(p<0.05),在221 μg/L浓度下,摄食率和滤水率达到最大,分别是7 324.8 cells·ind-1·h-1和0.221 mL·ind-1·h-1(见图 1)。
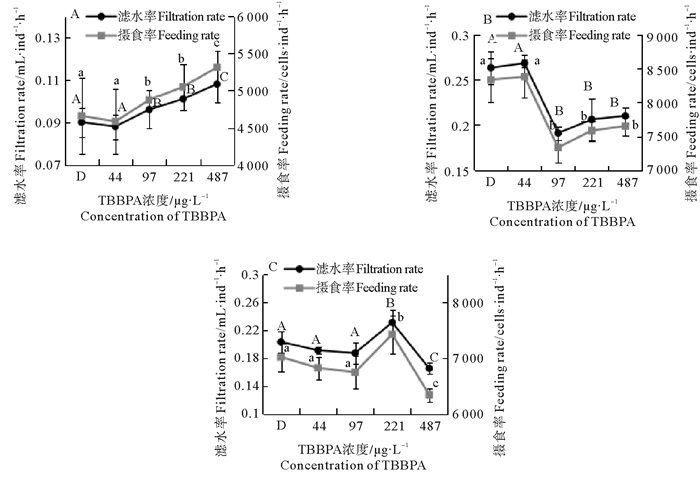
|
( A、B、C分别表示18、20、23 ℃;不同字母表示p<0.05,显著相关。相同字母表示p>0.05,不相关。A, B and C mean 18, 20 and 23 ℃, respectively. The different letter means p < 0.05, significant correlation; The same letter means p>0.05, uncorrelated. ) 图 1 不同TBBPA浓度下日本虎斑猛水蚤的摄食率和滤水率 Fig. 1 Feeding rate and filtration rate of Tigriopus japonicus under different concentration of TBBPA |
比较温度对摄食率和滤水率的影响。在20 ℃时,两者达到最高(除221 μg/L浓度组的滤水率外);18 ℃时最低,显著(p<0.05)低于20和23 ℃;487 μg/L浓度下各温度摄食组无显著差异(P>0.05)。20和23 ℃的摄食率和滤水率只在44 μg/L的浓度组中差异显著(P<0.05)(见图 2)。
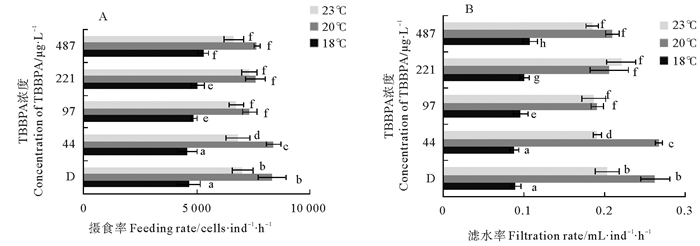
|
( A、B分别表示摄食率和滤水率;不同字母表示p<0.05,显著相关;相同字母表示p>0.05,不相关。A and B mean feeding rate and filtration rate, respectively.The different letter means p < 0.05, significant correlation; The same letter means p>0.05, uncorrelated. ) 图 2 不同温度下日本虎斑猛水蚤的摄食率和滤水率 Fig. 2 Feeding rate and filtration rate of T. japonicus under different temperature |
TBBPA暴露24 h后,不同温度下日本虎斑猛水蚤的产粪粒数如图 3。18 ℃下,产粪粒数只在高浓度组(487 μg/L)显著下降(p<0.05),为15.8粒。20 ℃下,在所有实验组中,产粪粒数呈现先增加后降低的趋势,在44 μg/L浓度下有最大值,为28.3粒。23 ℃下,44、97、487 μg/L浓度组均与对照组差异显著(p<0.05)。
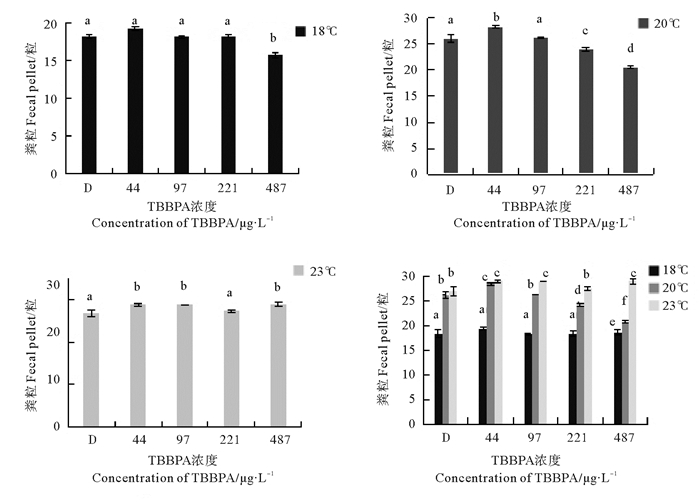
|
(不同字母表示p<0.05,显著相关;相同字母表示p>0.05,不相关。The different letter means p < 0.05, significant correlation; The same letter means p>0.05, uncorrelated. ) 图 3 不同温度和不同TBBPA浓度下日本虎斑猛水蚤的产粪粒数 Fig. 3 Feces production of T. japonicus under different temperature and concentration of TBBPA |
产粪粒数随温度的升高而升高。18 ℃组显著低于20、23 ℃组。44 μg/L浓度组在20和23 ℃之间无显著差异。97、221和487 μg/L浓度组中,23 ℃组显著高于20 ℃组(p<0.05)。
2.4 不同温度下TBBPA对日本虎斑猛水蚤两世代富集的影响 2.4.1 日本虎斑猛水蚤体内富集的TBBPA浓度TBBPA暴露两世代后,F0代和F1代桡足类体内的TBBPA浓度都随着溶液浓度的升高显著增加。由于23 ℃的低浓度组数据丢失,所以之后的实验未讨论。在F0代(见图 4A),44 μg/L的浓度下,20 ℃组水蚤体内TBBPA含量低于18 ℃组,仅为0.732 4 mg/g ww;220 μg/L浓度下,20 ℃组显著低于其他温度组,只有2.918 mg/g ww,23 ℃浓度值最大,为3.481 8 mg/g ww。在F1代(见图 4B),44 μg/L浓度组在各温度之间无显著差异,但是220 μg/L浓度组,各温度之间差异显著(p<0.05),在20 ℃最低,为3.027 mg/g ww;23 ℃最大,达到3.933 4 mg/g ww(见图 4)。
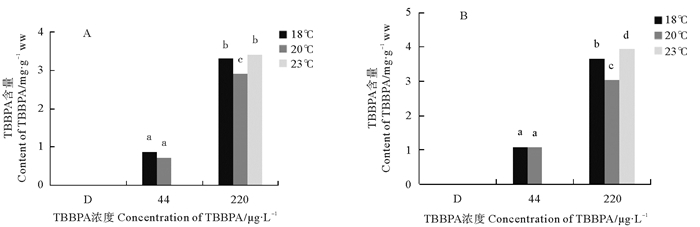
|
( A、B分别表示F0和F1代;不同字母表示p<0.05,显著相关;相同字母表示p>0.05,不相关。A and B mean F0 and F1, respectively; The different letter means p < 0.05, significant correlation; The same letter means p>0.05, uncorrelated. ) 图 4 暴露在不同温度和不同TBBPA浓度下日本虎斑猛水蚤体内富集的TBBPA浓度 Fig. 4 Concentration of TBBPA of T. japonicus expose to various concentrations of TBBPA under different temperature |
日本虎斑猛水蚤两世代共同积累TBBPA的浓度如图 5,与F0代相比,F1代均有不同程度的增加。在44 μg/L浓度组中,F1代水蚤体内的TBBPA含量显著高于F0代,18 ℃组和20 ℃组分别增加了20 %和40 %以上。在220 μg/L浓度组中,18 ℃和23 ℃组都增加了10 %以上。两世代共同积累的TBBPA含量相比,只有220 μg/L浓度组在各温度间差异显著(p<0.05),其中23 ℃下的220 μg/L浓度组最大,达到了7.414 4 mg/g ww。20 ℃下的44 μg/L浓度组最小为1.813 8 mg/g ww。
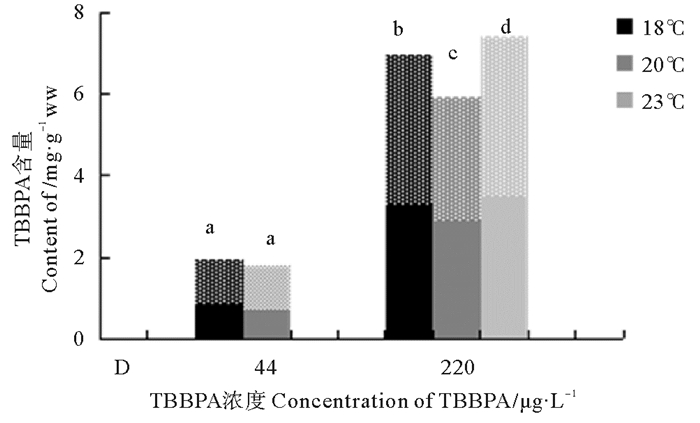
|
(纯色表示F0代;星点表示F1代。Pore color means F0; Star means F1. ) 图 5 暴露在不同温度和不同TBBPA浓度下日本虎斑猛水蚤体内两世代积累含量 Fig. 5 Two generations of TBBPA concentration of T. japonicus expose to various concentrations of TBBPA under different temperature |
毒性暴露两世代后,在F0代(见图 6A),44 μg/L浓度组中,18 ℃组的BAF最大,为19.89×103,20 ℃组较低;220 μg/L浓度组中,所有温度组的BAF均小于44 μg/L浓度组,其中20 ℃组最小,为13.26×103。在F1代(见图 6B),44 μg/L浓度组的BAF增加至持平,220 μg/L浓度组与F0代分布值一致(见图 6)。
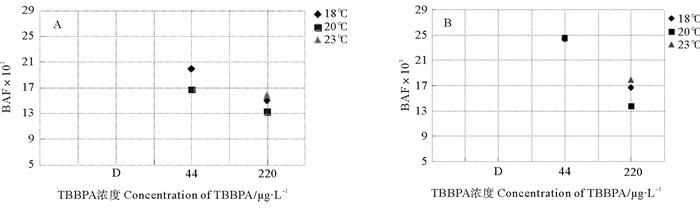
|
(A、B分别表示F0和F1代。A and B mean F0 and F1, respectively. ) 图 6 暴露在不同温度和不同TBBPA浓度下日本虎斑猛水蚤的生物富集因子 Fig. 6 BAF of T. japonicus expose to various concentrations of TBBPA under different temperature |
毒性暴露两世代后,F1代的BAF高于F0代,在44 μg/L浓度组中增加尤其显著。在44 μg/L浓度组中,20 ℃组的BAF增加较快,在F1代已经超过18 ℃组。而在220 μg/L浓度组中,F0和F1两个世代中均是23 ℃组的BAF最高,分别是15.83×103和17.88×103,20 ℃组最低,分别为13.26×103和13.76×103(见图 7)。

|
(A、B分别表示44和220μg/L。A and B mean 44 and 220μg/L, respectively. ) 图 7 暴露在不同温度和不同TBBPA浓度下日本虎斑猛水蚤的两世代富集因子 Fig. 7 Two generations BAF of T. japonicus expose to various concentrations of TBBPA under different temperature |
有报道称,桡足类体内富含脂肪酸,在一定的暴露途径中能够富集某些化合物,从而产生不利的影响,如摄食活动紊乱、新陈代谢变化等[12]。本研究中,不同温度下TBBPA对日本虎斑猛水蚤摄食率和滤水率的影响不同。常温下的结果与徐风风等的结果基本一致,呈现这种结果可能是由于低浓度下水蚤因代谢消耗能量而轻微增加摄食,而高浓度的TBBPA则完全影响了水蚤的正常活动,致使水蚤产生了躲避行为从而减少摄食[24]。高温条件下221 μg/L浓度组促进水蚤摄食,其他浓度组都不同程度的抑制了水蚤摄食,结合此浓度下的产粪粒数小而积累浓度却大,这样的结果正好与较大的摄食率和滤水率相对应。另外,刘丽华等发现PDBEs具有一定的神经毒性,而神经系统能够在一定程度上调控桡足类的摄食活动[25],所以TBBPA也可能会通过影响水蚤的神经系统而影响摄食和滤水。摄食率和滤水率在各温度之间比较结果显示,常温>高温>低温(除221 μg/L浓度组的滤水率外),本结果与薛泽等和李光福等的结果基本一致[15, 26]。温度是影响桡足类摄食的主要因素之一,随着温度的升高,桡足类代谢增强,所需能量增加,摄食率和滤水率也增加,但是当温度超过其最适值之后,代谢就会受到抑制,摄食率和滤水率也会下降[27]。Changling Li等也指出桡足类的摄食率和滤水率随着温度的升高而升高[28]。
3.2 日本虎斑猛水蚤的产粪粒数粪粒可以在一定程度上反应桡足类排出污染物的浓度。本研究中日本虎斑猛水蚤的24 h产粪粒数随着浓度的升高呈现先升高后降低的趋势,在各温度间则呈现逐渐升高的趋势,而李光福等的研究中随着温度增加,产粪颗粒先增加后减少[15],结果稍有不同,可能是本次研究温度设置范围较小的原因,没有包括水蚤的最适产粪粒温度。而在TBBPA影响下各浓度组表现出了不同的抑制或促进现象,在低浓度组(44 μg/L)中,日本虎斑猛水蚤的摄食率和滤水率更高,但是体内积累的TBBPA含量却少,我们猜测这样的结果是由于水蚤较高的产粪粒数造成的,而高浓度组(487 μg/L)相反的结果也能在一定程度上验证我们的猜测。产粪粒数的变化侧面反映了温度和TBBPA对水蚤摄食和消化代谢的影响,有助于分析水蚤对污染物的积累情况,更有利于水蚤的生长繁殖。
3.3 日本虎斑猛水蚤体内的TBBPA浓度TBBPA具有高亲脂性、低水溶性的特点,易于在沉积物、生物体中积累[29],浮游动物等小型水生生物极易受到影响,一旦它们在体内富集,污染物就会沿着食物链和食物网传递,对高营养级生物造成毒性效应[29-30]。本研究中,日本虎斑猛水蚤体内的TBBPA浓度随着溶液浓度的升高显著增加,这是因为水体中的TBBPA会通过桡足类摄食等途径进入体内[31]。江田田等也曾指出浮游动物体内TBBPA的浓度与海水浓度变化相一致。另外,生物体可以通过产卵等方式将污染物传递给后代[32],因此后代就具有相对较大的基数,当后代处于同样的环境中时,富集的污染物量势必高于亲代,这与本研究中的结论一致。在两个浓度组的两世代增加比例来看,低浓度的TBBPA在桡足类中具有更大的增加比率。巩文静等人的研究也表明,TBBPA在指状伪镖水蚤中具有传代积累毒性[12]。
TBBPA富集量在各温度之间的比较显示,高温(23℃)>低温(18℃)>常温(20℃),这可能是由于不同的吸收消化效率造成的[32]。结合摄食率、滤水率和产粪颗粒的结果,水蚤在常温下具有最高的摄食率和滤水率,而产粪颗粒却不是最高,富集量最小,这是因为水蚤的粪便是由饵料代谢产生的[24],本次研究投喂的饵料未染毒,通过滤水摄入体内的TBBPA有一部分随粪便排出,出现常温组富集量最小的现象。而一定范围内的低温和高温,都会增加TBBPA在水蚤体内积累的几率[15]。Siriporn等也曾指出温度会影响BPA在生物体内的积累[33]。
3.4 生物富集因子(BAF)生物富集因子(BAF)代表生物体对污染物的富集能力。江田田等人测定夏冬两季渤、黄海浮游动物对TBBPA的富集因子平均值分别为14.396×103和14.839×103,logBAF范围分别是3.26~4.80和3.07~4.59[32]。本研究结果在其范围内,表明日本虎斑猛水蚤对TBBPA具有较强的生物富集性(BAF>5 000)。随着世代的增加,BAF也增加,且低浓度组增幅较大。本研究还发现,随着日本虎斑猛水蚤体内TBBPA浓度的增加,BAF显著增加,但是当溶液中TBBPA浓度增加时,BAF却降低,这样的结论与江田田和李学鹏的结论一致。李学鹏等还指出影响BAF的因素主要包括温度等环境因素和生物量等生物因素[34],本次研究结果也证明了这一观点。
综上所述,在温度的作用下,TBBPA对日本虎斑猛水蚤的摄食、产粪以及富集都有不同程度的影响。低浓度的TBBPA能够促进摄食与产粪,并且随温度升高而增加。在日本虎斑猛水蚤富集TBBPA方面,BAF偏高,水蚤体内的富集量随溶液浓度的升高而增加,并且具有明显的世代效应;当改变温度时,富集量和BAF也发生一定程度的变化。因此在水体污染日渐严重和气温逐渐增加的当前环境中,研究以日本虎斑猛水蚤为代表的桡足类的富集情况,可以为评估海洋生物富集能力提供依据,有利于水生生态系统的健康发展。
| [1] |
Yang S, Wang S, Liu H, et al. Tetrabromobisphenol A:tissue distribution in fish, and seasonal variation in water and sediment of Chaohu Lake, China[J]. Environ Sci Pollut Res, 2012, 19: 4090-4096. DOI:10.1007/s11356-012-1023-9
(  0) 0) |
| [2] |
Shi Z X, Wu Y N, Li J G, et al. Dietary exposure assessment of Chinese adults and nursing infants to tetrabromobisphenol-A and hexabromocyclododecanes:Occurrence measurements in foods and human milk[J]. Environmental Science & Technology, 2009, 43: 4314-4319.
(  0) 0) |
| [3] |
Alaee M, Arias P, SjÖdin A, et al. An overview of commercially used brominated flame retardants, their applications, their use patterns in different cuntries/regions and possible modes of release[J]. Environment International, 2003, 29(6): 683-689. DOI:10.1016/S0160-4120(03)00121-1
(  0) 0) |
| [4] |
Liu K, Li J, Yan S J, et al. A review of status of tetrabromobisphenol A (TBBPA) in China[J]. Chemosphere, 2016, 148(2016): 8-20.
(  0) 0) |
| [5] |
Abdallah M A E, Harrad S, Covaci A. Hexabromocyclododecanes and tetrabromobisphenol-A in indoor air and dust in Birmingham, UK:Implications for human exposure[J]. Environmental Science & Technology, 2008, 42: 6855-6861.
(  0) 0) |
| [6] |
李超伦, 王克. 植食性浮游桡足类摄食生态学研究进展[J]. 生态学报, 2002, 22(4): 593-596. Li C L, Wang K. Feeding ecology progress of the herbivorous copepod[J]. Acta Ecologica Sinica, 2002, 22(4): 593-596. DOI:10.3321/j.issn:1000-0933.2002.04.022 (  0) 0) |
| [7] |
Lee K W, Raisuddin S, Hwang D S, et al. Two-generation toxicity study on the copepod model species Tigriopus japonicus[J]. Chemosphere, 2008, 72: 1359-1365. DOI:10.1016/j.chemosphere.2008.04.023
(  0) 0) |
| [8] |
Shi D L, Lv D M, Liu W X, et al. Accumulation and developmental toxicity of hexabromocyclododecanes (HBCDs) on the marine copepod Tigriopus japonicus[J]. Chemosphere, 2017, 167: 155-162. DOI:10.1016/j.chemosphere.2016.09.160
(  0) 0) |
| [9] |
Vivien W W, Ba oa, Kenneth M Y, et al. Acute and chronic toxicities of Irgarol alone and in combination with copper to the marine copepod Tigriopus japonicus[J]. Chemosphere, 2013, 90: 1140-1148. DOI:10.1016/j.chemosphere.2012.09.022
(  0) 0) |
| [10] |
徐东晖, 刘光兴. 多环芳烃(萘)对火腿许水蚤(Schmackeria poplesia)急性和慢性毒性效应的研究[J]. 生态毒理学报, 2010, 5(4): 543-548. Xu D H, Liu G X. A study on the acute and chronic effects of NAPH on Schmackeria poplesia[J]. Asian Journal of Ecotoxicology, 2010, 5(4): 543-548. (  0) 0) |
| [11] |
Ida Beathe, Dag Altinb, Torunn Bergc, et al. Acute and sub-lethal response to mercury in arctic and borealcalanoid copepods[J]. Aquatic Toxicology, 2014, 155: 160-165. DOI:10.1016/j.aquatox.2014.06.019
(  0) 0) |
| [12] |
巩文静.四溴双酚A (TBBPA)对近海常见桡足类的毒性效应及其在中国北方海域的污染分布[D].青岛: 中国海洋大学, 2016: 73-78. Gong W J.The Toxic Effects of Tetrabromobisphenol A (TBBPA) to Estuarine Common Copepods and Its Environmental Distribution in the North China Sea[D].Qingdao: Ocean University of China, 2016: 73-78. (  0) 0) |
| [13] |
Kyun-Woo Lee, Sheikh Raisuddin, Dae-Sik Hwang, et al. Two-generation toxicity study on the copepod model species Tigriopus japonicus[J]. Chemosphere, 2008, 72: 1359-1365. DOI:10.1016/j.chemosphere.2008.04.023
(  0) 0) |
| [14] |
Patrick Y Sun, Helen B.Foley, Vivien W W Bao, et al. Variation in tolerance to common marine.pollutantsamong different populations in two species of the marine copepod Tigriopus[J]. Environ Sci Pollut Res, 2015, 22(20): 16143-16152. DOI:10.1007/s11356-015-4846-3
(  0) 0) |
| [15] |
李光福, 朱丽岩, 王晓敏, 等. 温度和盐度对指状伪镖水蚤孵化及产粪的影响[J]. 中国海洋大学学报(自然科学版), 2015, 45(11): 36-42. Li G F, Zhu L Y, Wang X M, et al. Effects of temperature and salinity on the hatching and fecal production of Pseudodiaptomidae inopinus[J]. Periodical of Ocean University of China, 2015, 45(11): 36-42. (  0) 0) |
| [16] |
Santhanam P, Perumal P. Effect of temperature, salinity and algal food concentration on population density, growth and survival of marine copepod Oithona rigida Giesbrecht[J]. Indian Journal of Geo-Marine Sciences, 2012, 41(4): 369-376.
(  0) 0) |
| [17] |
Alexander K, Brazenor, Kate S. Hutson.Effect of temperature and salinity on egg hatching and description of the life cycle of Lernanthropus latis (Copepoda:Lernanthropidae) infecting barramundi, Lates calcarifer[J]. Parasitology International, 2013, 62: 437-447. DOI:10.1016/j.parint.2013.05.005
(  0) 0) |
| [18] |
韩萃.不同温度盐度条件下TBBPA对拟长腹剑水蚤的毒性效应[D].青岛: 中国海洋大学, 2017. Han C.The effect of TBBPA on Copepod (Oithona similis) Under Different Salinity and Temperature[D].Qingdao: Ocean University of China, 2017. (  0) 0) |
| [19] |
胡媛媛.典型内分泌干扰物的鱼类生物蓄积[D].上海: 华东师范大学, 2015 Hu Y Y.Bioaccumulation of Typical Endocrine Disrupters in Fish[D].Shanghai: East China Normal University, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10269-1015339283.htm (  0) 0) |
| [20] |
Kaisa Figueiredo, Kimmo, Merja Lyytikfiinen, et al. Assessing the infiuence of confounding biological factors whenestimating bioaccumulation of PCBs with passive samplers inaquatic ecosystems[J]. Science of the Total Environment, 2017, 601-602: 340-345. DOI:10.1016/j.scitotenv.2017.05.140
(  0) 0) |
| [21] |
Frost B W. Effects of size and concent ratio of food particles on the feeding behavior of the marine planktonic copepod Calanus pacificus[J]. Limnology and Oceanography, 1972, 18: 805-815.
(  0) 0) |
| [22] |
曹洋, 李莉, 杨苏文, 等. 高效液相色谱法分析湖泊环境介质中的四溴双酚A[J]. 吉林广播电视大学学报, 2010, 4: 9-10. Cao Y, Li L, Yang S W, et al. High-performance liquid chromatography (HPLC) analysis of lake environment medium tetrabromobisphenol A[J]. Journal of Jilin Radio and TV University, 2010, 4: 9-10. (  0) 0) |
| [23] |
任海霞. 高效液相色谱法测定四溴双酚-A[J]. 城镇供水(水质分析与监测), 2012, 2: 42-44. Ren H X. HPLC determination of tetrabromo bisphenol-A[J]. Urban Water Supply (Water Quality Analysis and Monitoring), 2012, 2: 42-44. (  0) 0) |
| [24] |
徐风风, 朱丽岩, 巩文静, 等. 四溴联苯醚(BDE-47)对两种海洋桡足类动物的毒性效应[J]. 生态毒理学报, 2013, 8(3): 23-30. Xu F F, Zhu L Y, Gong W J, et al. Toxic effects of BDE-47 on two marine copepods[J]. Asian Journal of Ecotoxicology, 2013, 8(3): 23-30. (  0) 0) |
| [25] |
刘丽华.2, 2', 4, 4'-四溴联苯醚紫外光解及DNA损伤毒性研究[D].北京: 中央民族大学, 2010. Liu L H.2, 2', 4, 4'-Four Bromine Biphenyl Ether Ultraviolet Solutions and DNA Damage Toxicity Research[D].Beijing: Central University for Nationalities, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10052-2010261408.htm (  0) 0) |
| [26] |
薛泽.温度、盐度、pH和饵料对两种海洋桡足类摄食和代谢的影响[D].青岛: 中国海洋大学, 2013. Xue Z.Effect of Temperature, Salinity, pH and Algalspecies on the Ingestion and Metabolism of Two Marine Copepods[D].Qingdao: Ocean University of China, 2013. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=D327946 (  0) 0) |
| [27] |
高亚辉, 林波. 几种因素对太平洋纺键水圣摄食率的影响[J]. 厦门大学学报(自然科学版), 1999, 38(5): 751-757. Gao Y H, Lin B. Several factors influence on the Pacific spinning st feeding rate of key water[J]. Journal of Xiamen University (Natural Science Edition), 1999, 38(5): 751-757. DOI:10.3321/j.issn:0438-0479.1999.05.021 (  0) 0) |
| [28] |
Li C L, Luo X X, Huang X H, et al. Effects of temperature, salinity, pH, and light on filtering and grazing rates of a Calanoid Copepod (Schmackeria dubia)[J]. The Scientific World Journal, 2008, 8: 1219-1227. DOI:10.1100/tsw.2008.153
(  0) 0) |
| [29] |
WHO.Environmental Health Criteria 172: Tetrabromobisphenol A and Derivatives[D].Geneva, Switzerland: International Programme on Chemical Safety, 1995.
(  0) 0) |
| [30] |
Guvenius D M, Aronssona, E  0) 0) |
| [31] |
Battuello M, Mussat Sartor R, Brizio P, et al. The influence of feeding strategies on trace element bioaccumulationin copepods (Calanoida)[J]. Ecological Indicators, 2017, 74: 311-320. DOI:10.1016/j.ecolind.2016.11.041
(  0) 0) |
| [32] |
江田田.夏、冬季渤、黄海浮游动物对四溴双酚A (TBBPA)生物富集的研究[D].青岛: 中国海洋大学, 2017. Jiang T T.Study on Accumulation of Tetrabromobisphenol A (TBBPA) in Zooplankton of the Yellow Sea and Bohai Sea, in the Summer and Winter[D].Qingdao: Ocean University of China, 2017. (  0) 0) |
| [33] |
Siriporn Borrirukwisitsak, Helen E, Caroline Gauchotte, et al. Effects of salinity, pH and temperature on the octanol-water partition coefficient of bisphenol A[J]. International Journal of Environmental Science and Development, 2012, 3: 460-464.
(  0) 0) |
| [34] |
李学鹏.重金属在双壳贝类体内的生物富集动力学及净化技术的初步研究[D].浙江: 浙江工商大学, 2008: 54-55. Li X P.Heavy Metal Bioaccumulation in Bivalves Body Dynamics and the Preliminary Research on the Purification Technology[D].Zhejiang: Zhejiang Industry and Commerce University, 2008: 54-55. http://cdmd.cnki.com.cn/Article/CDMD-10353-2008172067.htm (  0) 0) |
 2019, Vol. 49
2019, Vol. 49


